Introducción
La cuenca del río Magdalena forma parte del suelo de conservación de la Ciudad de México y está clasificada como Parque Nacional; a pesar de ello, se producen cambios en el uso de suelo y existen áreas destinadas al pastoreo y a cultivos agrícolas (Jujnovsky et al., 2013), lo cual tiene efectos negativos en las propiedades físicas y químicas del suelo, mismos que modifican el funcionamiento del ecosistema (Tischer et al., 2014).
Las comunidades vegetales principales en la cuenca son los bosques de Pinus hartwegii Lindl., Abies religiosa (Kunth) Schltdl. & Cham. y Quercus rugosa Née, con distintas asociaciones de especies dentro de ellas. Estudios realizados en el área han puesto de manifiesto que el bosque de Abies religiosa tiene una alta productividad (10.78 ± 1.13 Mg ha-1 año-1) (Delgadillo, 2011); también registra la mayor tasa de descomposición, pues en un trabajo previo, Barajas (2014) concluyó que la velocidad de pérdida de peso de la fracción foliar de A. religiosa duplicó el valor de la de Q. rugosa y fue superior a la de P. hartwegii. Además, contiene mayor contenido de humedad en el suelo y una alta calidad de materia orgánica, lo que favorece la actividad de los organismos desintegradores (Barajas, 2014). Por ello, resulta interesante evaluar la liberación de CO2 en este bosque urbano en el contexto de la circulación del carbono, ya que existe muy poca información al respecto en la literatura, tanto para bosques de oyamel como para bosques urbanos, como es el caso de la cuenca del río Magdalena.
A escala global, la respiración del suelo genera de 68 a 77 x 1015 g C al año (Raich y Schlesinger, 1992); aproximadamente un tercio de este proviene de la respiración de las raíces y el resto corresponde a la actividad de los microorganismos durante el proceso de descomposición de la materia orgánica muerta (Luo y Zhou, 2006; Noh et al., 2016; Galicia et al. 2016), por lo que dicho proceso tiene un papel importante en el ciclo global del carbono y en la concentración de CO2 en la atmósfera. Por consiguiente, es de gran importancia por sus implicaciones en el cambio climático y las políticas ambientales (Latimer y Risk, 2016).
La producción de CO2 está influenciada por diversos factores bióticos y abióticos, así como por su interacción. Entre los componentes ambientales se cuentan la temperatura, la humedad, la concentración de O2, la disponibilidad de nutrientes, la textura del suelo y el pH (Wood et al., 2013; Zimmerman et al., 2015). La vegetación afecta la respiración edáfica, de manera indirecta, al modificar el microclima y la estructura del suelo, también por la cantidad y calidad de materiales orgánicos que aporta. La calidad está determinada por el contenido de compuestos lábiles y recalcitrantes de la hojarasca (relación C:N); la rápida descomposición indica una mayor concentración de componentes lábiles en relación a los recalcitrantes (C:N baja), lo que promueve la tasa de descomposición; por lo tanto, conduce a tasas altas de respiración, de manera directa, pues la respiración de las raíces es uno de los principales contribuyentes al aporte de CO2 (Hasset y Banwart, 1992; Raich y Tufekcioglu, 2000).
En virtud de que todos estos factores se modifican por el cambio de uso de suelo, resulta de interés evaluar su impacto en la respiración de la biota edáfica. Actualmente, se estima que entre 30 y 66 % del territorio nacional está bajo algún uso agrícola o ganadero (Dupuy et al., 2012) y la pérdida de los recursos forestales es del orden de 500 000 a 631 000 ha al año (Díaz-Gallegos et al., 2008).
Los estudios en campo que estiman la respiración en los suelos de México son escasos (García et al., 2001; Campos, 2004; Covaleda et al., 2009; Campos, 2014), lo mismo sucede con los de laboratorio (Álvarez y Anzueto, 2004; Ikkonen et al., 2004; Alcántara, 2009; Cruz et al., 2012; Cueva et al., 2016), y ninguno se ha llevado a cabo en las áreas verdes de la Ciudad de México.En ese contexto, se realizó el presente trabajo cuyo objetivo consistió en determinar y contrastar la actividad microbiana a través de la respiración, en zonas con diferente área basal en el bosque de Abies religiosa de la cuenca del río Magdalena.
Materiales y Métodos
Zona de estudio
El estudio se llevó a cabo en el bosque de Abies religiosa perteneciente a la cuenca del Río Magdalena (CRM). Es un bosque alto, perennifolio con zonas densas que alcanza 100 % de cobertura vegetal, en el que dominan los estratos arbóreo y arbustivo; aunque, también hay zonas abiertas debido a disturbios y al ganado. Se localiza sobre pendientes pronunciadas, a 2 750-3 500 msnm. En la Figura 1 aparecen en color blanco los sitios de muestreo a lo largo del bosque de A. religiosa y se indica el área basal que corresponde a cada sitio.

Fuente: Modificado de Santibáñez (2009).
Figura 1 Cuenca del río Magdalena en el suroeste de la Ciudad de México.
La precipitación mínima registrada es de 1 000 mm en la parte baja y la máxima de 1 500 mm, en las cumbres más altas. Se presentan dos tipos de climas, de 2 400 a 2 800 msnm un clima subhúmedo con una temperatura media anual entre 12 °C y 18 °C. De 2 800 a 3 800 msnm predomina un clima semifrío y una temperatura media anual entre 5 °C y 12 °C (García, 1988). En la Figura 2 se observan los datos de temperatura y precipitación correspondientes al periodo de estudio.

Fuente: Estación meteorológica Desviación Alta al Pedregal
Figura 2 Temperatura promedio y precipitación total por mes del periodo de estudio en la cuenca del río Magdalena en la Ciudad de México.
El suelo en el bosque de A. religiosa en la CRM es un Andosol húmico (FAO-UNESCO) con textura media limosa a franco arenosa (INEGI, 2006). El dosel alcanza de 20 a 30 m de altura, el estrato arbustivo es de 2 a 3 m de alto y existe un estrato herbáceo. Se han citado las siguientes asociaciones vegetales: A. religiosa - Roldana angulifolia (DC.) H. Rob. & Brettell y A. religiosa - Acaena elongata L. (Almeida-Leñero et al., 2007).
Selección de sitios
El estudio se realizó en septiembre de 2013 (estación de lluvias) y en mayo de 2014 (estación seca). Se eligieron seis sitios con diferente cobertura vegetal (Cuadro 1), donde se trazó un cuadro de 25 × 25 m por sitio, en los cuales se registró el número de especies y el perímetro a la altura del pecho (PAP) de los árboles de Abies religiosa para obtener el área basal.
Cuadro 1 Área basal de los árboles en pie, la riqueza vegetal y el nombre de la especie más abundante en cada uno de los sitios en el bosque de Abies religiosa (Kunth) Schltdl.& Cham. en la cuenca del río Magdalena en la Ciudad de México.
| Área basal (cm2) | 0 | 100 | 170 | 180 | 240 | 310 |
|---|---|---|---|---|---|---|
| Riqueza vegetal | 18 | 9 | 24 | 26 | 14 | 2 |
| Especie dominante | Bromus carinatus Hook. & Arn. | Acaena elongata L. | Salvia gesneriflora Lindl. & Paxton | Senecio angulifolius DC. | Senecio angulifolius DC. | Abies religiosa (Kunth) Schltdl. & Cham. |
En el sitio más perturbado no había ningún árbol, la riqueza de hierbas fue de 18 taxones y el más abundante fue Bromus carinatus Hook. & Arn., maleza nativa de México que se utiliza como forraje (Rzedowski y Rzedowski, 2001); en el otro extremo del gradiente de conservación, se localiza el sitio conservado con la presencia dominante de árboles de A. religiosa. Al sitio con la mayor riqueza (26 especies) le correspondió un área basal de 180 cm2 y el arbusto dominante fue Senecio angulifolius DC. (Cuadro 1), taxón característico de estadios sucesionales intermedios en bosques templados (Rzedowski y Rzedowski, 2001).
En la esquina y el centro de cada cuadro se recolectó una muestra de suelo a 10 cm de profundidad con ayuda de un nucleador Soilmoisture 200-A (10 cm de alto × 7 cm de diámetro). Se tuvieron cinco réplicas por sitio en cada una de las estaciones (lluviosa y seca). Las muestras fueron almacenadas en un refrigerador a 4 °C hasta su procesamiento. Al mismo tiempo, en cada punto se obtuvo una segunda muestra inalterada de suelo con un nucleador de 100 cm3.
Preparación y análisis
Las primeras cinco muestras se tamizaron con una malla de 2.38 mm de apertura para estimar la respiración bacteriana y fúngica, y el contenido gravimétrico de agua. En la muestra inalterada, se midió la densidad aparente, la concentración de carbono (C) y de nitrógeno (N) total, así como el pH.
Los análisis de C y N se realizaron en el Laboratorio de Fertilidad de Suelos del Colegio de Postgraduados (Colpos). El nitrógeno total se determinó por digestión ácida con ácido sulfúrico y análisis colorimétrico (Technicon Industrial Systems, 1977). El C total se determinó por el método de Walkley-Black modificado (Technicon Industrial Systems, 1977).
La densidad aparente se obtuvo a partir de la muestra inalterada de suelo, la cual se secó a 105 °C hasta alcanzar un peso constante (Siebe et al., 2006).
El pH se registró con un potenciómetro Conductronic PC18 (Hendershot et al., 2007).
El contenido gravimétrico de agua se determinó al pesar 50 g de suelo recolectado en campo y se colocó en un horno de secado Binder ED53-UL#02-30777 a 105 °C hasta alcanzar un peso constante (Jarrell et al., 1999).
Respiración microbiana
Se siguió la técnica de Isermeyer (Alef, 1995) para la medición de la liberación de CO2 por parte de la biomasa microbiana total del suelo, la cual consiste en colocar un peso conocido de suelo (no se humedeció) en un vaso de Precipitado de 100 mL dentro de frascos con tapa hermética, en los que se añadió una solución de NaOH al 0.05 M; enseguida se colocaron en una incubadora Percival GR41VL a 25 °C durante tres días. Al terminar este periodo, se agregaron 5 mL de solución de cloruro de bario (BaCl2) al 0.5 M y cuatro gotas de indicador (solución de fenolftaleína al 0.05 M) y las muestras se tornaron color rosa. Por último, la solución color rosa se tituló con ácido clorhídrico (HCl) a una concentración de 0.05 M, hasta que se tornó incolora. La cantidad de CO2 se determinó a partir del volumen de HCl utilizado (Alef, 1995).
Para la biomasa fúngica se usó la misma técnica, pero se le añadió ácido láctico (C3H6O3 al 85 %) para eliminar a las poblaciones bacterianas, y así, evaluar la liberación de CO2 por parte de los hongos (Van Netten et al., 1994; Dubal et al., 2004; Wolf et al., 2012). Para calcular la liberación del CO2 bacteriano, se restó al CO2 microbiano total el CO2 fúngico.
Los frascos control no tenían suelo, y con ellos se siguió el mismo procedimiento.
Análisis estadístico
Para el análisis de la liberación de CO2, se hizo un análisis de varianza (en cumplimiento con los supuestos de normalidad y homocedasticidad) de tres vías, en el que se consideraron como factores la fuente de CO2 (bacteriano, fúngico), el sitio (área basal) y estacionalidad de las lluvias; cuando hubo diferencias significativas se procedió a realizar la prueba de Tukey. También, se efectuaron regresiones lineales entre las variables edáficas y la liberación de CO2. Todos los análisis se llevaron a cabo con 95 % de confianza en el paquete estadístico STATISTICA 8.0 (StatSoft Inc., 2007).
Resultados
Se registraron diferencias significativas en la liberación de CO2 entre la biomasa bacteriana y la biomasa fúngica (F(1,96) = 138.34; P < 0.0001). La liberación potencial de CO2 de la biomasa fúngica fue superior a la bacteriana (Figura 3).

Las letras diferentes indican diferencias significativas (P < 0.0001).
Figura 3 Liberación potencial de CO2 de la biomasa bacteriana y fúngica en el bosque de Abies religiosa (Kunth) Schltdl. & Cham. en la cuenca del río Magdalena en la Ciudad de México.
La liberación de CO2 también evidenció diferencias significativas entre temporadas (F(1,96) = 279.55; P < 0.0001). Se registró 1.6 veces mayor respiración en la estación de lluvias en comparación con la temporada seca (Figura 4).

Las letras diferentes indican diferencias significativas (P < 0.0001).
Figura 4 Liberación potencial de CO2 en temporada de lluvias y secas en el bosque de Abies religiosa (Kunth) Schltdl. & Cham. en la cuenca del río Magdalena en la Ciudad de México.
La emisión de CO2 en los sitios tuvo diferencias significativas (F(5,96) = 32.4; P < 0.0001). El valor más alto se observó en el sitio con un área basal de 100 cm2 y el más bajo en aquel con 240 cm2; hubo una diferencia de 40 % entre ambos sitios (Cuadro 2). En el sitio con el área basal más alta (ausencia de sotobosque y estrato herbáceo) se verificó 13 % menos liberación de CO2, con respecto al valor más grande.
Cuadro 2 Liberación potencial de CO2 microbiano (promedio ± desviación estándar) de seis sitios con área basal diferente en el bosque de Abies religiosa (Kunth) Schltdl. & Cham. en la cuenca del río Magdalena en la Ciudad de México.
| Área Basal (cm2) | CO2 (mg CO2 g-1 día-1) Promedio |
|---|---|
| 0 | 0.106 (±0.055) CD |
| 100 | 0.155 (±0.072) A |
| 170 | 0.116 (±0.072) C |
| 180 | 0.108 (±0.033) CD |
| 240 | 0.094 (±0.040) E |
| 310 | 0.135 (±0.042) B |
Letras diferentes indican diferencias significativas (P < 0.0001).
La interacción entre la fuente de liberación de CO2 y la temporada fue significativa (F(1,96) = 90.42; P < 0.0001). El máximo valor correspondió a la combinación de biomasa fúngica en la temporada de lluvias, y la liberación de CO2 fue aproximadamente el doble de lo que se registró en la temporada de secas en cada uno de los grupos de microorganismos (Figura 5).
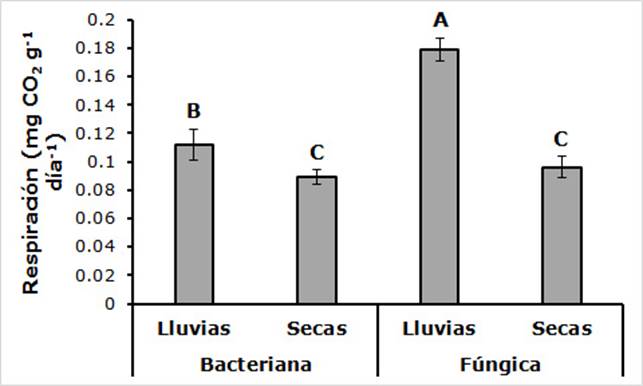
Las letras diferentes indican diferencias significativas (P < 0.001).
Figura 5 Liberación potencial de CO2 de la biomasa bacteriana y fúngica en temporada de lluvias y secas en la cuenca del río Magdalena en la Ciudad de México.
La interacción entre la fuente de liberación de CO2 y los sitios con diferente área basal, también fue significativa (F(5,96) = 34.94; P < 0.0001). Los valores más bajos correspondieron a la biomasa bacteriana en los sitios con 170 y 180 cm2 de área basal, y los más altos a los sitios de 170 y 310 cm2 en combinación con la biomasa fúngica.
Asimismo, la interacción entre temporada y sitios con diferente área basal resultó significativa (F(5,96) = 35.18; P < 0.0001). En la temporada de secas en el sitio con 240 cm2 de área basal se determinó el valor más bajo; mientras que el mayor fue para el sitio con área basal de 100 cm2, en la época lluviosa.
Finalmente, la interacción entre fuente de liberación de CO2, temporada y sitios con diferente área basal fue significativa (F(5,96) = 36.65; P < 0.0001); la biomasa bacteriana del sitio con 170 cm2 de área basal tuvo el menor promedio en la temporada de lluvias; y el más alto para la biomasa fúngica se estimó en el sitio de 100 cm2, en la misma época.
Si bien, se detectaron diferencias en la liberación de CO2 entre sitios, la relación entre el área basal y la respiración no fue significativa, pero sí se presentaron relaciones lineales con algunas de las variables del suelo. La liberación potencial de CO2 de la biomasa bacteriana se relacionó lineal y positivamente con el contenido gravimétrico de humedad en el suelo (R2 = 0.36, F(1,28) =15.54; P < 0.001) y con la densidad aparente (R2 = 0.52, F(1,28) =29.89; P < 0.0001) en la temporada de lluvias (Figura 6).
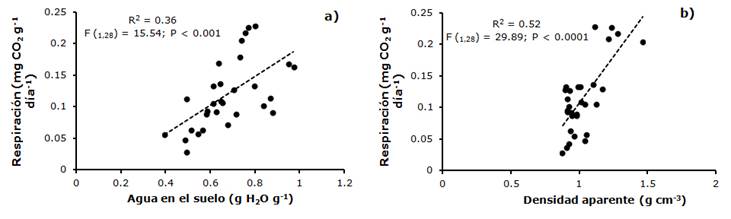
Figura 6 Relación entre la liberación potencial de CO2 de la biomasa bacteriana y el contenido gravimétrico de humedad (a) y entre la densidad aparente (b) en la temporada de lluvias, en la cuenca del río Magdalena en la Ciudad de México.
La liberación de CO2 por parte de la biomasa fúngica, también se relacionó de manera lineal y positiva con el contenido gravimétrico de humedad en el suelo durante la época de secas (R2 = 0.67, F(1,28) =33; P < 0.0001) y con la densidad aparente en lluvias (R2 = 0.55, F(1,28) =33; P < 0.0001) (Figura 7).

Figura 7 Relación entre la liberación potencial de CO2 de la biomasa fúngica y el contenido gravimétrico de humedad en la época de secas (a) y entre la densidad aparente en la temporada de lluvias (b), en la cuenca del río Magdalena en la Ciudad de México.
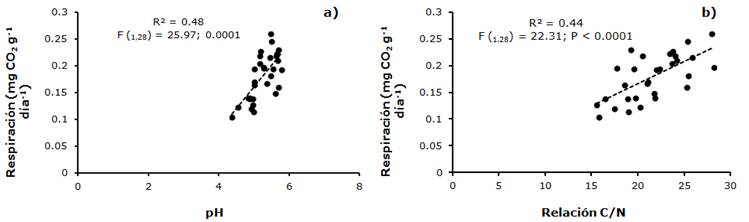
También, en la temporada de lluvias la liberación de CO2 por parte de la biomasa fúngica se relacionó lineal y positivamente con el pH (R2 = 0.48, F(1,28) =25; P < 0.0001) y la calidad de la materia orgánica del suelo (estimada a través del la relación C:N) (R2 = 0.44, F(1,28) =22; P < 0.0001). Los valores más bajos de respiración se observaron en un pH cercano a 4 y los más altos en valores próximos a 6; en tanto que la actividad de la biomasa fúngica aumentó a valores altos del cociente C/N (Figura 8).
Discusión
Los valores registrados de CO2 están dentro del intervalo citado para los bosques templados: 0.01 a 0.70 mg CO2 g-1 día-1 (Bailey et al., 2002; Ikkonen et al., 2004; Campos, 2014).
Aunque no se determinó una relación entre el área basal y la liberación potencial de CO2, el sitio donde se registró una riqueza de nueve especies vegetales, con la dominancia de Acaena elongata y cuya área basal fue de 100 cm2, registró los valores más altos de CO2, seguido por el sitio en el que solo había árboles (310 cm2) de A. religiosa, lo que sugiere, como en otros estudios, que las tasas de respiración heterotrófica se modifican de acuerdo a los cambios en la estructura de la vegetación durante la sucesión, lo cual se ha observado tanto en bosques templados, como en subtropicales (Yan et al., 2009; Susyan et al., 2011).
En en presente estudio, la liberación de CO2 por la biomasa microbiana (bacterias y hongos) fue diferente entre los sitios, pero no siguió un patrón ascendente en función del área basal o de la riqueza de especies (Cuadro 2). Así, el valor más alto de respiración además de registrarse en un sitio con pocas especies vegetales (9), coincidió con la dominancia de Acaena elongata, especie indicadora de disturbio, que presenta alta demanda de luz, que tiende a crecer en manchones y a dominar el estrato herbáceo (Rzedowski y Rzedowski, 2001), y que impide el establecimiento de otras especies.
En dos de los sitios con presencia importante de árboles (180 y 240 cm2 de área basal) Senecio angulifolius, taxón dominante que alcanza hasta 5 m de altura, favorece la entrada y establecimiento de otros taxa en el suelo (Rzedowski y Rzedowski, 2001), lo que significa que la sucesión está en un estadio intermedio; aquí se registraron valores bajos de liberación potencial de CO2. En cambio, Susyan et al. (2011) observaron que las tasas de respiración basal del suelo, así como la biomasa microbiana aumentan durante el proceso de sucesión posterior al abandono de las tierras de uso agrícola, lo cual atribuyen a un aumento en las entradas y acumulación de C orgánico en el suelo.
Por lo que respecta a la relación entre la liberación de CO2 y algunas características edáficas, era de esperarse una reducción de las tasas de respiración debido a una alteración de la estructura del suelo, consecuente a las actividades humanas dentro de la CRM; en general, estas tienden a resultar en una compactación del suelo, y una reducción del flujo de oxígeno y agua a lo largo del perfil (Tan, 2000), lo que limita la actividad microbiana; por ello, el grado de compactación se refleja en valores altos de densidad aparente. Al respecto, Torbert y Wood (1992) y Pengthamkeerati et al. (2005) consignaron una reducción de 60 a 65 % de los flujos de CO2 del suelo, con valores de densidad aparente de 1.4 - 1.8 g m-3. Adicionalmente, Li et al. (2002) observaron un decaimiento de 26 a 39 % en la abundancia de bacterias, hongos y actinomicetos en el suelo, en respuesta a un incremento de la densidad aparente. En este trabajo los valores de densidad estuvieron en el intervalo de 0.9 y 1.3 g cm-3, lo cual indica que el suelo no tiene problemas de compactación y que presenta una buena estructura, a pesar de los diferentes usos de suelo que existen en la CRM.
El pH ácido y un alto contenido de materiales recalcitrantes favorecen el establecimiento de las comunidades fúngicas (Joergensen y Wichern, 2008; Paul, 2015; Kamble y Bååth, 2016), de ahí que se haya registrado una relación lineal positiva y significativa entre la liberación de CO2 de la biomasa fúngica y esas dos variables. Los resultados son consistentes con los de Lou y Zhou (2006) y Zhang et al. (2016), quienes documentan que los hongos son más resistentes a pH ácidos que las bacterias en suelos forestales. No obstante, los datos del estudio en la CRM presentan un claro decremento de las tasas de respiración microbiana a valores de pH menores a 5. Sinsabaugh et al. (2008) consignan que los pH muy bajos limitan la actividad extracelular enzimática de los hongos, lo cual explicaría lo observado en este trabajo.
La relación C/N de la fracción foliar de la hojarasca de A. religiosa es de 50 (Barajas, 2014), lo que indica que es un sustrato de difícil degradación, en tanto que la relación C/N de la materia orgánica del suelo en la época de lluvias varió de 20 a 25 y en secas alcanzó solo valores de 15. La mayor liberación de CO2 se registró con una relación C/N de la materia orgánica del suelo de 25, lo cual se observó en la época de lluvias, de manera que una buena calidad, aunada al agua presente en el suelo, favorecen la actividad microbiana.
Diversos autores han observado una respuesta muy marcada de las tasas de respiración microbiana en relación a la estacionalidad, presentándose los valores más altos durante la temporada de lluvias, lo cual es resultado de una mayor disponibilidad de nutrientes y agua en el suelo y a la consecuente activación de la comunidad microbiana (Raich y Schlesinger, 1992; Yan et al., 2009; Wood et al., 2013). Por otro lado, en los periodos de sequía el acceso a los nutrientes se torna limitado conforme la capa de agua dentro del suelo se reduce (Lou y Zhou, 2006; Barnard et al., 2013), lo que resulta en tasas de descomposición más bajas y, por ende, de respiración. En la CRM se registró aproximadamente el doble de liberación de CO2 en la temporada de lluvias, con respecto a la de secas, hecho que concuerda con lo citado en estudios realizados en ecosistemas templados, tropicales húmedos y en ambientes transformados, como los cultivos y pastizales (Munson et al., 2010; Carbone et al., 2011; Thomey et al., 2011; Galicia et al. 2016).
El que se haya registrado una relación lineal positiva entre la liberación de CO2 y el contenido de humedad en el suelo durante la temporada de secas, podría deberse a que los hongos poseen mayor resistencia a la desecación asociada a su crecimiento micelial, que permite extender sus hifas a lo largo de los poros del suelo para la absorción nutrientes y agua (De Vries et al., 2012; Paul, 2015). Asimismo, los hongos como estrategas k de crecimiento producen mayor cantidad de enzimas para acceder al uso de más formas orgánicas de C acumuladas durante este periodo (Waldrop et al., 2006).
Conclusiones
Los resultados indican que los sitios en las primeras etapas de un proceso de sucesión y que tienen menos área basal en la CRM, generan una liberación potencial alta de CO2 en el suelo.
También, se corrobora la relación entre algunas características del suelo y la actividad microbiana; el contenido gravimétrico de humedad, el pH, la densidad aparente y la calidad de la materia orgánica modifican la liberación potencial de CO2. Por lo tanto, se trata de un proceso multifactorial.
Finalmente, se sugiere la recuperación de las áreas perturbadas para disminuir las emisiones de CO2 del suelo a la atmósfera de la Ciudad de México.











 texto en
texto en