Introducción
El hule o árbol del caucho [Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg.] pertenece a la familia Euphorbiaceae y es originario de las planicies del Amazonas en Latinoamérica (Compagnon, 1998; SIAPa, 2018). En México su cultivo se remonta a 1882, cuando compañías inglesas y holandesas establecieron las primeras plantaciones en los municipios Tezonapa, en el estado de Veracruz y en Tuxtepec, Ojitlán y Santa María Chimalapa, en Oaxaca (Picón et al., 1997).
El cultivo del hule representa un producto estratégico, pues es considerado una alternativa para el desarrollo de las regiones del trópico húmedo de México; desde el punto de vista socioeconómico ocupa una numerosa mano de obra durante todas sus fases de cultivo, desde el establecimiento de viveros hasta el establecimiento y mantenimiento de las plantaciones. En 2018, la producción total de hule en México fue de 75 922.65 t, procedente de los estados de Veracruz, Chiapas, Tabasco, Oaxaca y Puebla los que contribuyeron con la mayor aportación (Rojo et al., 2005; Izquierdo et al., 2008; SIAPb, 2018).
El árbol de hule es susceptible al ataque de enfermedades provocadas, principalmente, por hongos que afectan la raíz, el panel de pica, el tallo, ramas y hojas, los cuales son responsables cada año de pérdidas considerables en términos de producción de látex (Anacafé, 2004). Entre los patógenos de mayor importancia económica a nivel mundial destacan Microcyclus ulei (Henn.) Arx, Colletotrichum gloesporioides (Penz.) Penz. & Sacc., Drechslera heveae (Petch) M. B. Ellis y Corynespora cassicola C. T. Wei (Jaimes y Rojas, 2011). C. gloeosporioides es el agente causal de una diversidad de daños y síntomas en diferentes cultivos en México, pues afecta diversos órganos vegetales en distintas etapas fenológicas (Gutiérrez et al., 2001).
Oaxaca ocupa el cuarto lugar a nivel nacional con una producción de 6 457.82 t y una superficie sembrada de 4 021.50 ha (SIAPa, 2018). En el 2016 se registró una incidencia de la enfermedad de 6 % en San José Chiltepec y de 63 % en San Juan Bautista, Tuxtepec, Oaxaca (Gijón et al., 2017); se observaron pequeñas manchas necróticas de forma circular a irregular con bordes amarillos en hojas y tallos jóvenes. Los productores de la región lo asociaron con los daños provocados por Microcyclus ulei (Henn.) Arx, pero, al realizar las observaciones en microscopio estereoscopio, los signos concordaron con la enfermedad conocida como antracnosis. Por esta razón, se considera que las medidas de manejo implementadas en la zona productora no han sido eficientes para el control de la enfermedad. Ante la importancia socioeconómica del cultivo y por ser el municipio con la mayor superficie sembrada en la entidad (863 ha), es sustancial un diagnóstico correcto del patógeno, por lo que el objetivo de la presente investigación fue identificar el agente causal asociado a la antracnosis en el cultivo de hule.
Materiales y Métodos
Recolección de muestras
Se realizaron recorridos en jardines clonales de hule en octubre de 2016 en el municipio San Juan Bautista, Tuxtepec, Oaxaca. Se recolectaron 20 muestras foliares y 10 de tallos con síntomas de antracnosis, mismas que se procesaron en el Laboratorio de Sanidad Forestal del Cenid Comef.
Aislamiento y purificación de hongos
El material vegetal (hojas y tallos) con los síntomas de antracnosis se cortaron en cuadros de 1 cm² aproximadamente; se desinfestaron con hipoclorito de sodio al 1% durante 5 minutos, enseguida se lavaron tres veces con agua destilada estéril y se eliminó el exceso de humedad en papel filtro estéril. Por último, se colocaron en cámara húmeda y en medio de cultivo Papa Dextrosa Agar (PDA).
Las siembras de ambos métodos se incubaron a 28 ± 1 °C durante cinco días con fotoperiodo controlado 12:12 h. Cumplido el periodo, se observó el crecimiento fungoso y se realizó la purificación en PDA y cultivos monospóricos. Las cepas purificadas se conservaron en tubos con medio de cultivo PDA inclinados con aceite mineral.
Caracterización morfológica
A partir de cultivos monospóricos en PDA se observó la coloración de micelio y el crecimiento del hongo. Se hicieron preparaciones temporales y permanentes de los aislamientos, así como montajes de cortes de las estructuras obtenidas en cámara húmeda para su visualización en microscopía óptica con contraste de fases (AxiolabdrbKT, Zeiss) y microscopía electrónica de barrido (EVO MA15, Zeiss) mediante la técnica de criofractura, con el objetivo de obtener una imagen de mayor resolución que permitiera observar, con más detalle, las estructuras presentes en las preparaciones. Para determinar el género, se utilizaron claves generales (Humber, 1997; Barnett y Hunter, 1999).
Caracterización molecular
Para el estudio molecular, se seleccionaron dos cepas aisladas de tallo (M51 y M95) y tres de hojas (M39, M46 y M48). La extracción de ADN se llevó a cabo por el método AP (Alkaline Phosphatase) modificado (Sambrook y Russell, 2001) con cultivos monospóricos de cuatro días de crecimiento en PDA. La región ITS se amplificó con los cebadores ITS5 (5´GGAAGTAAAAGTCGTAACAAGG-3´) e ITS4 (5´-TCCTCCGCTTATTGATATGC-3´) (White et al., 1990), que se encuentran en las regiones conservadas de los genes 18S y 28S, respectivamente.
Las amplificaciones de PCR se realizaron con un termociclador T100 marca Biorad con el siguiente programa: un ciclo de desnaturalización inicial de 3 min a 94 °C, seguido de 34 ciclos, cada uno constó de tres pasos: desnaturalización de 30 s a 94 °C, anillamiento de 30 s a 58 °C y una de extensión de 1 min a 72 °C, finalmente una extensión de 1 min a 72 °C. La purificación de los productos de PCR fue con el Kit Wizard ® SV Gel and PCR Clean-Up System (Promega Corporation, 1999). La secuenciación se realizó en Macrogen Inc. en Seúl, Korea.
Las secuencias obtenidas se limpiaron, ensamblaron en Mega X y se llevó a cabo una búsqueda de secuencias de referencia de las especies del complejo Colletotrichum depositadas en la base de datos de GenBank (https://www.ncbi.nlm.nih.gov/).
Todas las secuencias se alinearon con el método muscle (Edgar, 2004) incluido en el software Mega X (Kumar et al., 2018). La reconstrucción filogenética se realizó por inferencia bayesiana mediante Markov Chains Monte Carlo (MCMC), implementado en el programa Mr Bayes v.3.2.1 (Ronquist y Huelsenbeck, 2003) con 1 000 000 de generaciones. De los árboles producidos, 25 % se descartaron con la opción ‘burn-in phase’ y la probabilidad posterior se determinó con los árboles restantes. Colletotrichum boninense JQ005162 se usó como fuera de grupo.
Resultados y Discusión
Caracterización de síntomas
Las muestras recolectadas de plantas de hule del clon IAN-710 presentaron síntomas de antracnosis (Figura 1A). En las hojas se observaron pequeñas manchas acuosas necróticas de forma circular a irregular, de color crema que posteriormente se tornan oscuras con bordes amarillos (Figura 1B); además, en los tallos se identificaron lesiones color negro, hendidas y muerte descendente de peciolos (Figura 1C).
Caracterización morfológica
Se obtuvieron 17 aislamientos monospóricos, siete de tallos y 10 de hojas, los cuales presentaron características morfológicas del género Colletotrichum. Se observó crecimiento micelial, blanco a gris claro, con pequeños puntos negros y con masas conidiales de color salmón en PDA (Figura 2A); conidios cilíndricos, con los extremos redondeados, hialinos, unicelulares y fusiformes (Figura 2B y 2C) que se ubican en una estructura reproductiva llamada acérvulo. Los conidióforos septados y ramificados se originan en la parte superior del pseudoparénquima.
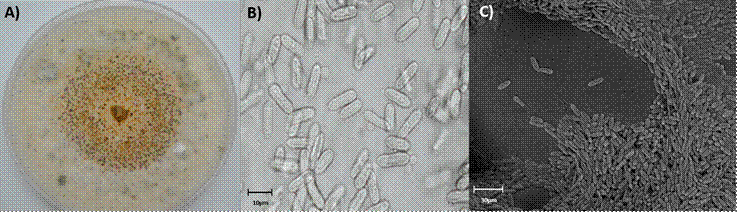
A) Desarrollo colonial en medio PDA; B) Conidios observados en microscopio compuesto (40x); C) Conidios vistos en microscopio electrónico de barrido (mag 358X).
Figura 2 Morfología de Colletotrichum, aislados de hojas de hule.
Li et al. (2012) describió a Colletotrichum gloeosporioides con conidios cilíndricos, obtusos en los extremos, hialinos, lisos. Las colonias en PDA con micelio blanco, gris, gris oscuro o gris oliva y esporulación de color naranja y marrón o verde oliva al reverso, lo que es similar a lo observado en el presente estudio.
La antracnosis en el cultivo de hule es causada por especies del género Colletotrichum, en particular por C. gloesporoides (Jaimes y Rojas, 2011).
La enfermedad provocada por este patógeno, se presenta, por lo general, en los sitios de producción de algunas especies vegetales del trópico. Colletotrichum gloeosporioides Penz. es el agente causal de una diversidad de daños y síntomas en diferentes cultivos en México, y afecta diversos órganos vegetales en distintas etapas fenológicas (Gutiérrez et al., 2001). En el hule se manifiesta en viveros, jardines clonales y plantas adultas, además limita la producción al ocasionar la muerte de los tejidos jóvenes afectados (Grupo Técnico Procaucho, 2012).
Caracterización molecular
La amplificación de los productos de PCR con los primers ITS4 e ITS5 del ADNr de los 17 aislados generó un fragmento de aproxímadamente 550 pb (Figura 3).
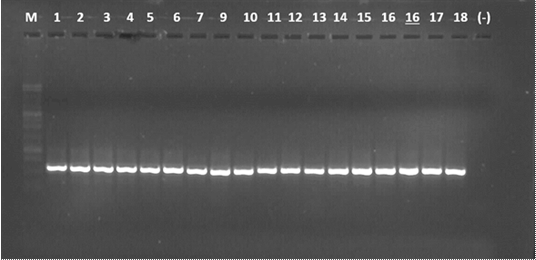
M = Marcador molecular 1kb, carril 1 a 7 cepas de hongos obtenidas de tallos, 8 a 17 cepas de hongos obtenidas de hojas; (+) = Control positivo (Colletotrichum sp. aislado de mango); (-) = Control negativo (Agua libre de nucleasas).
Figura 3 Amplificación del producto PCR de Colletotrichum sp. asociado a la antracnosis en hojas y tallos de hule.
Silva y Ávila (2011) obtuvieron fragmentos de aproximadamente 580 pb para especies de Colletotrichum aisladas de aguacate (Persea americana Mill.). Por otro lado, Domínguez-Guerrero et al. (2012) consignaron un fragmento de aproximadamente 600 pb para Colletotrichum gloeosporioides de la palma aceitera africana (Elaeis guineensis Jacq.) y Martínez et al. (2015), 580 pb para aislamientos de C. gloeosporioides en litchi (Litchi chinensis Sonn.).
Análisis filogenético
El árbol resultante se generó a partir de 1 000 000 de generaciones y una desviación estándar final de 0.008780. Se formaron dos clados bien definidos, en el primero se incluyeron las especies en estudio y en el segundo, seis especies correspondientes al complejo C. acutatum J. H. Simmonds, el soporte estadístico de ambos clados fue igual a 1 (Figura 4).
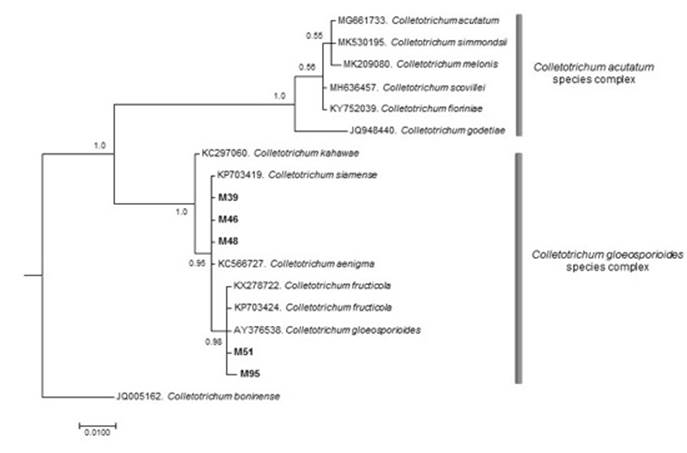
Figura 4 Árbol filogenético de consenso basado en inferencia bayesiana que ilustra la relación de los aislamientos de Colletotrichum asociados con la antracnosis en el cultivo de hule dentro de los complejos de especies Colletotrichum gloeosporioides (Penz.) Penz. & Sacc.
Las secuencias de los aislamientos M39, M46 y M48 se agruparon con secuencias correspondientes a C. siamense Prihast, L. Cai & K. D. Hyde y C. aenigma B. S. Weir & P. R. Johnst., así como M51 y M95 con C. fructicola Pihasti, L. Cai & H. D. Hyde; estas especies se han descrito recientemente dentro del complejo de C. gloeosporioides (Weir et al., 2012). La reconstrucción filogenética mostró que los aislamientos en estudio fueron diferentes a los taxones incluidos dentro del complejo C. acutatum (Damm et al., 2012a) y fuera del grupo C. boninense (Damm et al., 2012b).
Con base en la reconstrucción filogenética de la región ITS del ADNr, los aislamientos M39, M46 y M48 se ubicaron en el clado conformado por C. siamense y C. aenigma. Ambas especies están filogenéticamente relacionadas, aunque ninguna de ellas ha sido declarada como causante de afectaciones del hule en el país, por lo que representan secuencias ‘novel’ para posteriores estudios.
Con relación a los aislamientos M51 y M95, se identificaron como C. fructicola, junto con la accesión AY376538 designada como C. gloeosporioides, secuencia que ha sido reasignada en el subclado fructicola.
Conclusiones
Los síntomas de antracnosis observados en hojas y tallos de hule procedentes de San Juan Bautista Tuxtepec, Oaxaca son causados por Colletotrichum sp. Los análisis filogenéticos indican que los aislamientos en estudio forman parte del complejo Colletotrichum gloeosporioides que está integrado por más de 22 especies y dos subespecies. Este es el primer registro de la enfermedad con sustento científico para Colletotrichum en plantaciones de hule en México.











 texto en
texto en 



