Introducción
El cambio de uso de suelo y la fragmentación del paisaje ha provocado la eliminación y transformación de la vegetación primaria en más de 50 % de los ecosistemas terrestres; estos cambios se asocian al crecimiento de la población humana, la agricultura, ganadería y el incremento de la industria (Mendenhall et al., 2012).
En 2015, la FAO citó para México una tasa de cambio de vegetación primaria de -0.6 %, para el periodo 2000-2010; y de -0.7 % de 1990-2015 (FAO, 2015). El análisis realizado por Mas et al. (2009) muestra tasas de deforestación de -4.2 a -8.15 % para selva alta perennifolia y -10.1 % para bosque mesófilo de montaña.
Esta acelerada transformación ha propiciado que zonas como la porción norte y sureste del estado Puebla y la Sierra Mazateca de Oaxaca, originalmente cubiertas por selva alta perennifolia y bosque mesófilo de montaña, en la actualidad se localicen en fragmentos y en estado secundario, rodeadas de agricultura y pastizales inducidos para la ganadería (Guevara, 2011; Velasco et al., 2014).
Las modificaciones en el paisaje provocan cambios en la distribución espacial de las especies e incluso su eliminación, lo que ocasiona un efecto en cadena de pérdida de biodiversidad (Fischer y Lindenmayer, 2007). La desaparición de un depredador secundario, como Leopardus pardalis (Linnaeus, 1758), afecta el equilibrio ecológico de los ecosistemas (Terborgh et al., 2001).
El ocelote se distribuye en ambas planicies costeras de México y en la península de Yucatán, habita principalmente áreas con cobertura densa como: la selva alta perennifolia y el bosque mesófilo de montaña, bosques espinosos y el matorral xerófilo (Aranda, 2005). También, tolera ambientes fragmentados, pero en sitios aledaños a grandes macizos montañosos de áreas naturales protegidas (Torres-Romero, 2009; Michalski et al., 2010; Ramírez-Bravo et al., 2010; Cruz-Rodríguez et al., 2015). Debido a esto, es necesario, no solo estudiar la reducción neta de la superficie de su hábitat, sino la pérdida de conectividad de los parches de vegetación primaria en paisajes muy fragmentados fuera de áreas naturales protegidas.
El ocelote en México está catalogado en peligro de extinción (Semarnat, 2010), a nivel internacional La Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres lo lista en el Apéndice I (CITES, 2015). En cambio, la Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales solo lo clasifica como LC (least concern); es decir, en “preocupación menor” (IUCN, 2015). Las mayores amenazas para dicho mesodepredor son las actividades humanas, como la destrucción y fragmentación de su hábitat y la cacería (Caso et al., 2008). En ese contexto, el objetivo del presente estudio fue evaluar los efectos del cambio de uso de suelo y fragmentación del paisaje sobre la distribución espacial del ocelote en la Sierra Negra de Puebla y la Sierra Mazateca de Oaxaca.
Materiales y Métodos
Área de estudio
El estudio se desarrolló en dos sierras contiguas: la Sierra Negra de Puebla y la Sierra Mazateca de Oaxaca (Figura 1). En la región prevalece el clima cálido húmedo con lluvias todo el año, la temperatura oscila entre 16 y 26 °C; la precipitación varía de 3 000 y 4 500 mm (Inegi, 2009).
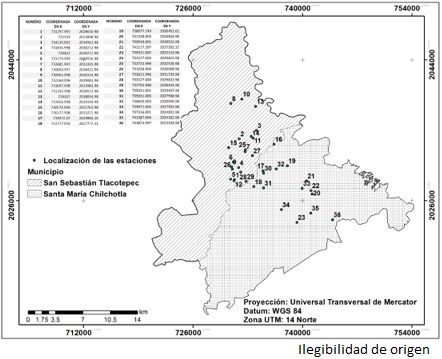
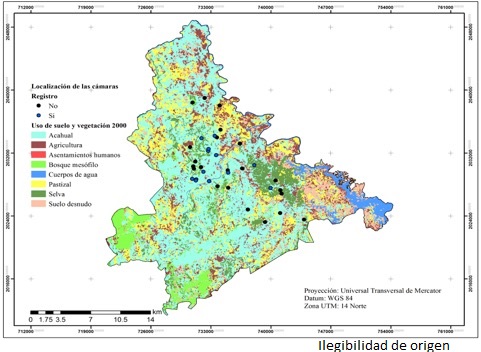
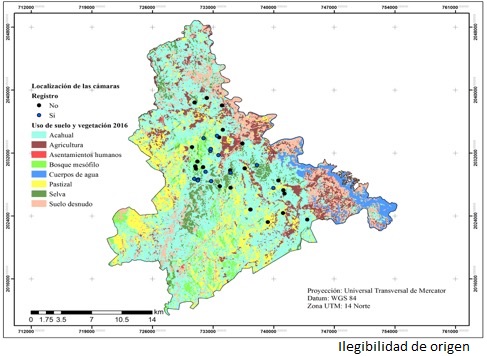
Figura 1 Ubicación del área de estudio y las estaciones de fototrampeo en San Sebastián Tlacotepec, Puebla y Santa María Chilchotla, Oaxaca.
En cada sierra se trabajó en un municipio: San Sebastián Tlacotepec (SST), ubicado al sureste de estado de Puebla, entre los paralelos 18°14’ y 18°32’ N y 96°43’ y 96°55’ O, con un intervalo altitudinal de 60 a 1 580 m (Inegi, 2010). SST tiene una población total de 13 534 habitantes distribuidos en 61 pueblos, con una densidad media de población de 56.99 habitantes km-² (CDI, 2010; Sedesol, 2013). Las actividades agropecuarias como el cultivo de maíz de temporal, caña de azúcar, café y la cría de ganado bovino y porcino se desarrollan en 40 % de su territorio (Inegi, 2010).
El otro municipio bajo estudio fue Santa María Chilchotla (SMCH), ubicado al norte del estado de Oaxaca, entre los paralelos 18°10’ y 18°24’ N y 96°35’ y 96°52’ O, con una altitud de 0 a 2 100 m (Inegi, 2010). Su población total es de 20 584 habitantes distribuidos en 110 localidades, con una densidad media de población de 72.36 habitantes km-2 (CDI, 2010; Sedesol, 2013). Las actividades agropecuarias ocupan 60 % de su territorio (INEGI, 2010). Dentro de la agricultura, el cultivo de café es el más importante, seguido del maíz y frijol. Respecto a la ganadería, la zona baja (tropical) está dedicada principalmente al ganado bovino, y en las zonas media (templada) y alta (fría) al caprino y ovino (García, 2008).
Uso de suelo y vegetación
La cartografía de uso de suelo y vegetación (USV) se generó para dos fechas: 2000 y 2016. Para el año 2000 se utilizó Landsat 7 (ETM+) del 13 de julio, y para el 2016 se usó Landsat 8 (OLI-TIRS) del 28 de abril, ambas del path 24/Row 47.
Los efectos de bruma y nubosidad se redujeron mediante la corrección atmosférica de las imágenes con el modelo COST (Chávez, 1996) incorporado al programa Idrisi Selva.
Debido a la intensidad de la fragmentación de la vegetación natural de las zonas, fue necesario mejorar la resolución espacial de las imágenes con la herramienta sharpening y el algoritmo Gram-Schmidt Spectral Sharpening de ENVI 4.7®, esto permitió incrementar la resolución de 30 a 15 m.
Con las imágenes de alta resolución, se llevó a cabo una clasificación supervisada con el algoritmo de máxima verosimilitud. Se utilizaron las bandas espectrales 4, 3, y 2 de Landsat 7 y 5, 4, 3 de Landsat 8, ya que son las mejores para el análisis de la vegetación (Chuvieco et al., 1995). A la imagen resultante de la clasificación, se le aplicó un filtro de mayoría con un tamaño de ventana de 5*5, con ello se reclasificaron aquellos pixeles aislados. La exactitud de la clasificación se determinó con el valor de la precisión general y el coeficiente Kappa (Lesschen et al., 2005).
Diseño de muestreo
Con base en el mapa de uso de suelo y vegetación del año 2000, así como en los criterios de fototrampeo descritos por Chávez et al. (2013) y Hernández-SaintMartín et al. (2013) se delimitó un polígono de 110 km2, dentro se trazaron tres líneas separadas por 3 km, en cada una se ubicaron seis estaciones de fototrampeo (cámaras trampa: StealthCam ® Delta8 modelo STC-Q8X/STC-D8BZ; Cuddeback ® Ambush Black Flash modelo 1194; Bushnell ® Trophy Cam HD Essential y Covert ®) espaciadas entre sí de 1 a 3 km. Las 18 estaciones colocadas se georreferenciaron (Figura 1).
Las cámaras se instalaron sobre sendas que utilizan los mamíferos, para maximizar la probabilidad de detección (Medellín et al., 2006). Estas se programaron para tomar tres fotografías cada 5 minutos, después de la última fotocaptura. Los equipos se colocaron a una altura de 40 - 50 cm del suelo, a una distancia de 2 m de la vereda. Se implementaron seis estaciones dobles, en las que se puso perfume Obssesion ® como atrayente para felinos.
Se realizaron tres periodos de muestreos. El primero fue de un mes (diciembre de 2013 a enero de 2014), con 18 estaciones a una distancia de 1 km entre ellas. El segundo se realizó durante un mes (abril de 2014), con 11 estaciones espaciadas cada 3 km. El tercero comprendió 3 meses (julio-septiembre de 2014), con 18 estaciones, la distancia entre las cámaras fue de 3 km (Hernández-SaintMartín et al., 2013). La suma de los tres periodos de muestreo generó información de 36 puntos diferentes, ya que ocho cámaras se dañaron y tres repitieron ubicación durante dos temporadas; 18 equipos fotográficos se colocaron en acahuales y 18 en vegetación primaria, sin embrago el esfuerzo de muestreo fue mayor en vegetación primaria: 943 días trampa y en acahual: 702 días, para un total de 1 645 días trampa.
Tasa de cambio de vegetación y uso del suelo
Para conocer la dinámica de cambio de la vegetación y la velocidad a la que se han dado esas transformaciones a una escala local, se estimó la tasa de cambio de la vegetación, para lo cual, se utilizó la ecuación 1 (Palacio-Prieto et al., 2000):
Donde:
C = Tasa de cambio
T1 = Superficie ocupada por la vegetación/uso i en el año de inicio
T2 = Superficie ocupada por la vegetación/uso i en el año más reciente
n = Número de años del periodo de análisis
Fragmentación del Paisaje
Con la finalidad de caracterizar la condición del paisaje y tipificar su ocupación por parte del ocelote, se estimaron métricas de paisaje considerados como relevante, de acuerdo con lo referido por diversos autores: tamaño, número y conectividad de parches (Michalski et al., 2010; Ramírez-Bravo et al., 2010; Cruz-Rodríguez et al., 2015) para ello se usaron los programas Patch Analyst 5.1 (PA51) y Conefor Sensinode 2.2 (CS22).
PA51 permitió calcular el tamaño medio de parches (MPS) y el número de parches (NumP) (Rempel et al., 2012). Como coberturas hábitat del ocelote se incluyeron a la selva alta perennifolia y al bosque mesófilo de montaña. Se utilizó un tamaño de buffer (o borde) de 100 m.
Mediante CS22 se calculó el Índice Integral de Conectividad (IIC, Integral Index of Conectivity, por sus siglas en inglés), el cual estima el grado de conectividad de los relictos de vegetación considerados como hábitat (Saura y Pascual-Horta, 2007). La ecuación 2 muestra las variables utilizadas:
Donde:
IIC = Índice Integral de Conectividad
n = Total de número nodos en el paisaje
ai, aj = Atributo de nodos i y j
nl ij = Número de eslabones de la ruta más corta (distancia topológica) entre parches i y j
A L = Máximo atributo del paisaje (es el valor del atributo que correspondería con un parche que cubre todo el paisaje con el mejor hábitat posible)
Se determinó un umbral de búsqueda de 1 800 m, distancia que se estableció en función del ámbito hogareño del ocelote; en la literatura se registran valores de 1 800 a 4 500 m (Torres-Romero, 2009).
La importancia de los parches se calculó con base en lo obtenido en IIC, y consistió en asignar un valor a cada nodo en términos de su nivel de importancia para mantener la conectividad dentro del paisaje; se calculó en porcentaje y se estimó aplicando la ecuación 3.
Donde:
dIIC = Importancia de nodos calculado mediante el Índice Integral de Conectividad
I = Valor del índice global cuando todos los nodos existentes inicialmente están presente en el paisaje
I removido = Valor del índice general después de la eliminación de un nodo único del paisaje
Resultados y Discusión
La precisión general obtenida para la cartografía de USV del año 2000 fue de 88 % y un coeficiente Kappa de 0.86; para el 2016, se obtuvo una precisión de 91.9 y un coeficiente Kappa de 0.90. De acuerdo con Lesschen et al. (2005) los valores de precisión general obtenidos para ambas fechas son aceptables y confiables para estudios de posclasificación.
Los usos de suelo y vegetación identificados se muestran en las figuras 2 y 3. El acahual ocupó el mayor porcentaje de superficie con 44.3 % (2000) y 48.6 % (2016); el bosque mesófilo de montaña y la selva alta perennifolia representaron 9.6 % del área de estudio. Estos resultados difieren de lo señalado por el Inegi en la cartografía de uso de suelo y vegetación serie V, en donde el área correspondiente a las dos coberturas suma 5.8 %. Tal como lo indican Mas et al. (2009), esos contrastes se deben principalmente a la escala espacial y a la metodología empleada en la elaboración de ambas cartografías, lo cual no denota la superioridad de uno u otro método, sino la condición y dinámica de las coberturas vegetales del área bajo estudio.
El ocelote se observó en 13 estaciones, 23 % de los registros fue en acahuales y 77 % en vegetación primaria (selva alta perennifolia y bosque mesófilo de montaña). Resultados que marcan una mayor presencia de Leopardus pardalis en los ambientes conservados, comparados con los perturbados. En cambio, en el sureste mexicano, Gil-Fernández et al. (2017) determinaron que es uno de los felinos más tolerantes a la fragmentación; y Cruz-Rodríguez et al. (2015) en el caribe colombiano, consignaron 55 % de avistamiento en vegetación con disturbio (agricultura, pastizal, matorral y vegetación secundaria). Es posible que el contraste se deba a que el esfuerzo de muestreo en la zona de estudio fue superior en la vegetación primaria que en los acahuales.
Las tasas de cambio para selva alta perennifolia y bosque mesófilo de montaña fueron de -2.63 y -2.29, respectivamente (Cuadro 1), lo cual supera lo documentado por Díaz-Gallegos et al. (2010) para el sureste mexicano en el periodo 1978-2000, cuyas tasas promedios variaron de - 0.8 a -1.0 %.
Cuadro 1 Superficie y tasa de cambio para el periodo 2000-2016 en la Sierra Negra de Puebla y la Sierra Mazateca de Oaxaca.
| Coberturas Terrestres | Año 2000 | Año 2016 | Tasa de cambio1 % |
|---|---|---|---|
| Superficie (ha) | Superficie (ha) | ||
| Acahual | 23 058.8 | 25 298.3 | 0.58 |
| Agricultura | 6 561.8 | 5 349.6 | -1.27 |
| Asentamientos humanos | 27.7 | 148.1 | 11.04 |
| Bosque mesófilo | 3 040.5 | 2 099.0 | -2.29 |
| Cuerpos de agua | 2 021.2 | 2 006.7 | -0.05 |
| Pastizal | 8 292.6 | 7 411.7 | -0.70 |
| Selva alta perennifolia | 4 448.8 | 2 904.9 | -2.63 |
| Suelo desnudo | 4 608.3 | 6 841.2 | 2.50 |
| Superficie total | 52 059.7 ha | ||
1 = Valores positivos indican ganancia de superficie y valores negativos pérdida.
La vegetación primaria perdida en un lapso de 16 años se convirtió en áreas destinadas para la agricultura y la ganadería, dichos cambios ocurrieron principalmente en zonas cercanas a cuerpos de agua y centros de población; por lo tanto, el crecimiento de los asentamientos humanos son la principal causa de la deforestación y fragmentación del paisaje en la Sierra Negra y en la Sierra Mazateca. Lo anterior concuerda con las investigaciones realizadas por otros autores en sitios similares (Velasco et al., 2014; Reynoso et al., 2016). De mantenerse esta tendencia de cambio, el hábitat del ocelote se reducirá y aumentarán los encuentros con los pobladores, quienes los perciben como una amenaza para sus animales domésticos, lo que deriva en el incremento de la caza (Velasco et al., 2014; Galindo-Aguilar et al., 2016).
Los resultados de las métricas de paisaje, calculados mediante PA51, mostraron un acelerado proceso de fragmentación de la vegetación nativa. Para el bosque mesófilo de montaña se observó un incremento en el número de parches y la disminución del tamaño de los mismos, lo cual indica que las áreas compactas que se tenían en el 2000, para el 2016 se fragmentaron y resultaron pequeños parches aislados al interior del paisaje. La misma dinámica se presentó para la selva alta perennifolia. Actualmente, el tamaño medio de parche de selva alta es de 1.04 ha y el de bosque mesófilo de montaña de 0.85 ha (Cuadro 2); áreas insuficientes para mantener una población de ocelote en la zona de estudio, si se considera que Benchimol y Peres (2015) calcularon que el área critica requerida para este felino es de 20 ha.
Cuadro 2 Métricas de paisaje calculado mediante PA51 para la Sierra Negra de Puebla y la Sierra Mazateca de Oaxaca.
| Cobertura | MPS 2000 (ha) |
MPS 2016 (ha) |
NumP 2000 |
NumP 2016 |
|---|---|---|---|---|
| Acahual | 4.61 | 3.08 | 789.00 | 963.00 |
| Agricultura | 1.11 | 1.96 | 123.00 | 140.00 |
| Bosque mesófilo | 21.55 | 0.85 | 37.00 | 53.00 |
| Cuerpos de agua | 13.93 | 12.27 | 32.00 | 37.00 |
| Pastizal | 0.85 | 1.50 | 252.00 | 248.00 |
| Selva alta perennifolia | 3.98 | 1.04 | 103.00 | 82.00 |
| Suelo desnudo | 1.20 | 1.97 | 74.00 | 189.00 |
2 = Valor promedio de la superficie de todos los parches en el paisaje; 3 = Número de parches por clase.
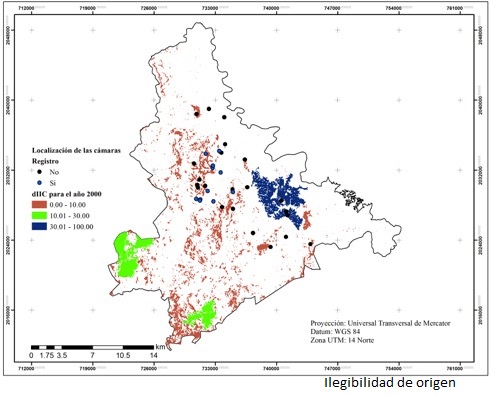
El índice de conectividad evidenció cambios dinámicos. En la Sierra Mazateca, en el año 2000 las zonas donde existía una conectividad era superior a 30 %, en el 2016 disminuyeron a menos de 30 %. Sin embargo, en la Sierra Negra se observó que algunas zonas con conectividad menor a 10 % aumentaron a 30 % (figuras 4 y 5). Es posible que esos cambios se deban al sistema de agricultura de roza, tumba y quema que utilizan las comunidades rurales del trópico (Conklin, 1961). Sistema que está integrado por áreas de cultivo, acahuales y vegetación primaria que se rotan; una vez que termina la época de siembra dejan que la zona se vuelva a repoblarse con vegetación, lo que conlleva a la formación de los acahuales, y después a los bosques maduros. Los acahuales son estratégicos para la conservación de los mamíferos tropicales (Naughton-Treves et al., 2003; Gonzáles-Marín et al., 2008; Guzmán-Aguirre, 2008); siempre y cuando su edad sea mayor a siete años (Ochoa et al., 2007).
Las cámaras que registraron ocelotes se localizaron en el interior o muy cercanas (1.6 km) a zonas con valor de conectividad superior a 10 %. Estos resultados soportan la necesidad de mantener remanentes de vegetación con coberturas densas y alta conectividad, que han señalado otros autores (Martínez-Calderas et al., 2011).











 texto em
texto em