Introducción
El arbolado urbano en condiciones saludables óptimas aporta servicios ecosistémicos tales como sombra, recreación, captura de carbono, intercepción de contaminantes del aire e impacto positivo en el bienestar humano (Moser et al., 2018; Scholz et al., 2018). Sin embargo, en muchas ocasiones, el entorno no es favorable para el crecimiento de los árboles (Martínez et al., 2010; Moser et al., 2017). por limitaciones de espacio, deficiencias nutrimentales, compactación del suelo, falta de agua, temperaturas extremas, contaminación y vandalismo (Stojnic et al., 2016; Allen et al., 2017). Esto estresa al árbol y da como resultado un crecimiento pobre que repercute en la vitalidad y altas tasas de mortalidad (Koeser et al., 2014).
A partir de la fotosíntesis, la síntesis de carbohidratos es fundamental para el árbol, ya que estos compuestos mantienen el metabolismo, acumulan reservas y promueven el crecimiento de nuevos tejidos (Maselli y Silveira, 2017). Si la producción de azúcares depende de la disponibilidad de minerales en el suelo y de factores ambientales (Gamboa y Marín, 2012; Valenzuela et al., 2013), entonces, las condiciones de estrés ambiental, derivado del entorno urbano, provocan una reducción de las reservas de carbohidratos del árbol (Martínez et al., 2010; Koeser et al., 2014; Moser et al., 2018). La vitalidad está relacionada directamente con la cantidad de reservas, por lo que los ejemplares vigorosos son capaces de resistir ámbitos estresantes (Johnstone et al., 2013; Callow et al., 2018; Ramírez et al., 2018).
El suministro exógeno de carbohidratos al sistema vascular de árboles tiene un efecto positivo en su desarrollo, debido al incremento de las reservas de energía (Percival et al., 2004; Martínez et al., 2009; Martínez et al., 2013). Si bien las inyecciones al tronco surgieron para el tratamiento químico de enfermedades, hongos y plagas (Costonis, 1981; Perry et al., 1991; Dal Maso et al., 2014; Acimovic et al., 2015), recientemente se han utilizado como la opción más viable para mejorar el estado del arbolado urbano (Martínez et al., 2009; Percival y Sacre, 2014; Suryanto et al., 2018). La ventaja de la inyección al tronco radica en que el compuesto aplicado es aprovechado en su totalidad al incorporarse en el sistema vascular (Costonis, 1981; Wise et al., 2014; Acimovic et al., 2016) y este lo distribuye por todo el árbol (Kobza et al., 2011).
El árbol de jacaranda (Jacaranda mimosifolia D. Don), es una especie arbórea perteneciente a la familia Bignonaceae (Sharma et al., 2016). Su uso ornamental en espacios urbanos se ha incrementado en las últimas décadas (Miyajima et al., 2013; Zaouchi et al., 2015) porque es una especie de porte medio y que presenta una abundante y colorida floración (Miyajima et al., 2013). Es importante mejorar la condición de vitalidad de jacarandas que crece en ambientes que no siempre son favorables. Por lo tanto, el objetivo del trabajo aquí descrito consistió en evaluar el efecto de la glucosa inyectada al tronco sobre el crecimiento y vitalidad de árboles de Jacaranda mimosifolia localizados en un área urbana como una alternativa de las labores culturales realizadas en el arbolado.
Materiales y Métodos
El trabajo se llevó acabo en el arbolado del Boulevard Texcoco-Chapingo (19°30’04.19’’ N y 98°53’00.85’’ O) en el municipio Texcoco de Mora, Estado de México. La zona tiene una altitud promedio de 2 240 m, un clima templado semi-seco, una temperatura media anual de 15.9 °C y una precipitación media de 686 mm al año; el suelo es Vertisol de textura arcillosa (Gutiérrez y Ortiz, 1999). Se seleccionaron 36 árboles de Jacaranda mimosifolia con un diámetro normal de 27 cm y altura de 7 m en promedio, alineados con un espaciamiento de 6 m.
La aplicación de glucosa se hizo por medio de macro inyecciones en la base del tronco de cada árbol (Costonis, 1981). Se realizaron perforaciones de 4.4 mm de diámetro en la base del árbol a una profundidad de 25.4 mm aproximadamente (Acimovic et al., 2016) de manera perpendicular al tronco; se utilizó un taladro inalámbrico de 550 rpm DW130V (DeWalt Industrial Tool Co.), y una bomba manual (H.D. Hudson Industry TM) a una presión constante de 0.13 MPa, para aplicar en una única ocasión un total de 10 L de solución por árbol en julio de 2017.
Para evaluar el crecimiento de los árboles 11.5 meses después de la aplicación de los tratamientos, se midió al inicio y al final del experimento el diámetro del tronco (cm) a una altura de 10 cm sobre el suelo con una cinta diamétrica 283D (Forestry suppliers Inc.); por la frecuente bifurcación del tronco por debajo de 1.30 m de altura, se marcó el punto de medición con tinta indeleble. La altura total (m) se midió con un clinómetro (Brunton TM). A partir de las variables anteriores, se estimó el incremento de 11.5 meses en diámetro (ID) y en altura (IA).
Para determinar la vitalidad del arbolado, se registró información de la condición de copa de cada árbol en términos de la densidad de copa (Dnc) y la transparencia de copa (Trc); esto se llevó a cabo de forma visual por dos personas ubicadas a una distancia horizontal proporcional a la altura de cada árbol, se determinó con una escala dividida en clases de 5 % (Westfall et al., 2009; Saavedra et al., 2016). Se evaluó el nivel de producción de follaje de cada árbol por el método de 6 clases utilizado para la evaluar infestación por muérdagos (Hawksworth, 1977). Se dividió en tres tercios la copa de cada árbol; cada tercio se evaluó por separado y se le asignó una calificación de 0, 1 o 2, para cada nivel de follaje, en el que 0 es producción no visible o baja, 1 es producción adecuada y 2 es producción alta. Dicha calificación se realizó al final del estudio.
Se calculó el contenido de carbohidratos, azúcares totales y azúcares reductores en tejidos del árbol. Se tomaron al azar muestras de brotes de cinco ramas de la copa baja de cada árbol; además, con un martillo de incrementos (Haglof Company group TM) se tomaron cinco muestras cerca de la base del tronco (4mm × 100 mm) (Martínez et al., 2009). Estas se maceraron en nitrógeno líquido y se almacenaron a -20 °C hasta su procesamiento en laboratorio. Se realizaron dos extracciones alcohólicas de azúcares de los tejidos recolectados, cada una con 40 mL de etanol al 80 % (v/v) por 20 min a 100 °C. El resultante de la extracción se diluyó en 10 mL de agua destilada para la determinación cuantitativa (Quentin et al., 2015); las muestras se trabajaron por triplicado.
La concentración de azúcares totales se determinó por el método de antrona (Witham et al., 1971), se utilizó un espectrofotómetro Genesys TM 10S Vis & UV-Vis para leer la absorbancia a 600 nm; se cuantificaron los azúcares totales con una curva patrón de glucosa en una concentración de 20 a 200 µg mL-1. Para los azúcares reductores, se utilizó el método de Nelson (1944) y Somogyi (1952); la absorbancia se registró en el espectrofotómetro a 540 nm y se utilizó una curva patrón que contenía glucosa de 15 a 150 µg mL-1. Los resultados se expresaron en mg de glucosa por gramo de peso seco (mg g-1 ps-1).
De manera análoga, se cuantificó el contenido de almidón en raíces; para ello se recolectaron, aproximadamente, 5 g de tejido por debajo de la base del tronco, y se hidrolizó el precipitado del proceso de extracción alcohólica descrito anteriormente, con la enzima diastasa (SIGMA) (Palevitz y Newcomb, 1970). Al hidrolizado resultante se le aplicó el método de antrona con base en el contenido de glucosa presente en la muestra; el resultado se expresó en mg g-1 ps-1.
Finalmente, se registró la fluorescencia de la clorofila (Fv/Fm) con un fluorímetro portátil Pocket PEA (Hansatech Instruments Ltd.), con un tiempo de detección de 1 s y que emite luz a una longitud de onda de 650 nm, con una intensidad de 3500 µmol m -2 s -1 (Zhang et al., 2016). Las mediciones se realizaron después de adaptar a la obscuridad por 10 minutos con clips del pocket PEA un total de 10 hojas elegidas al azar del exterior de la copa baja de cada árbol (Martínez et al., 2009).
El diseño experimental fue completamente al azar; los tratamientos consistieron en cuatro concentraciones de glucosa: 0 (testigo), 30, 55 y 80 g L-1; el testigo solo contenía agua purificada. La distribución de los tratamientos fue aleatoria con nueve repeticiones por cada tratamiento (Percival et al., 2004; Martínez et al., 2009).
Se comprobaron los supuestos de normalidad con Shapiro-Wilk (n≤50 y α=0.05) y la homogeneidad de varianzas (prueba de Barttlet). Se realizó un análisis multivariado (MANOVA) en aquellas variables que cumplieron los supuestos de normalidad y homogeneidad (P≤0.05), se procedió con las comparaciones de medias con la prueba DSH (diferencia significativa honesta de Tukey) y una α=0.05. En aquellas variables que no cumplieron los supuestos (P>0.05), se utilizó el método no paramétrico de Kruskal-Wallis y se compararon las medias con la suma de rangos de Wilcoxon. Se analizó estadísticamente con el programa RStudio Team ® (R Core Team, 2015).
Resultados y Discusión
Incremento en diámetro
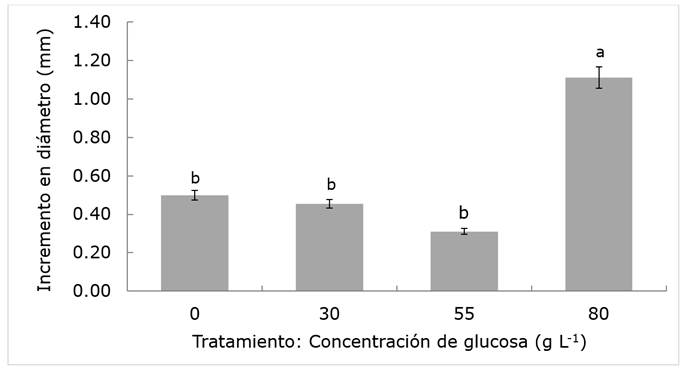
Se registraron diferencias significativas (P≤0.05) en el incremento en diámetro de los árboles de jacaranda después de 11.5 meses de la aplicación de los tratamientos. La concentración más alta de glucosa (80 g L-1) mostró valores promedio de crecimiento 200 % superiores a los de los ejemplares inyectados con el testigo (Figura 1). No obstante, la aplicación de dosis de carbohidratos inferiores a 80 g L-1 de glucosa no tuvo efecto sobre el crecimiento en diámetro posiblemente debido a la demanda de grandes cantidades de carbohidratos (Piper y Fajardo, 2016). Por lo tanto, concentraciones bajas de glucosa son insuficientes para promover crecimiento y probablemente su efecto se diluye al ser movilizadas para cubrir los requerimientos energéticos de otros procesos fisiológicos como la fotosíntesis, respiración, transpiración, absorción y translocación (Martínez et al., 2013; Ramírez et al., 2018). En algunos casos los azúcares son destinados para el almacenamiento de reservas de carbohidratos, todo esto a expensas del crecimiento vegetativo (Piper y Fajardo, 2016). Estudios previos han demostrado que el uso de carbohidratos tiene efectos positivos sobre el crecimiento en diámetro de árboles como encino (Quercus virginiana P. Miller), álamo (Populus nigra (Moench) Koehne), roble inglés (Quercus robur L.) y haya europea (Fagus sylvatica L.) (Martínez et al., 2009; Percival y Sacre, 2014), también se ha observado un efecto positivo en el diámetro de ramas de roble de Ceilán (Schleicera oleosa Merr.) (Suryanto et al., 2018).
Incremento en altura
El incremento en altura presentó diferencias significativas (P≤0.05) a la inyección de glucosa; la altura de los árboles mostró valores promedio superiores para las dos concentraciones más altas de glucosa (55 y 80 g L-1), en comparación con las concentraciones bajas (0 y 30 g L-1) (Figura 2). Esto puede indicar que las primeras estimulan el crecimiento en altura (Martínez et al., 2013; Percival y Sacre, 2014). En ciertas especies de latifoliadas como sauces (Salix sp.), álamos (Populus sp.), abedules (Betula sp.) y arces (Acer sp.). El crecimiento de la yema apical y la floración se manifiesta mucho antes del crecimiento vegetativo (Percival y Sacre, 2014). Etapas iniciales de reproducción vegetativa dependen exclusivamente de las reservas que el árbol acumuló en el ciclo de crecimiento anterior (Percival y Sacre, 2014; Ramírez et al., 2018). Esto apoya la idea de que la aplicación exógena de carbohidratos estimula el crecimiento en árboles urbanos (Martínez et al., 2013).
Condición de copa
Los valores promedio de densidad de la corona (Dnc) fueron significativamente diferentes entre las concentraciones de glucosa (P≤0.05). El más alto se produjo con 80 y 55 g L-1 (75 % y 76 %, respectivamente), mientras que el promedio más bajo se observó en el control (0 g L-1) con 59 % (Figura 3). Más de 50 % de los árboles evaluados desarrollaron 70 % en densidad de copa, lo que indica una buena cantidad de follaje (Saavedra et al., 2016). Es bien sabido que por encima de 75 % es inusual para la mayoría de las especies de árboles urbanos, a menos que crezcan en espacios abiertos (Westfall et al., 2009). Los dnc representan un alto potencial de crecimiento y, por lo tanto, de supervivencia, en comparación con aquellos especímenes maduros con menor cantidad de follaje (Zaragoza et al., 2014; Maselli y Silveira, 2017). Se considera que los árboles sanos son aquellos con una densidad de copa superior a 50 % (Westfall et al., 2009; Saavedra et al., 2016), pero si es inferior a 30 %, tienen una alta probabilidad de morir en un año (Steinman, 2000). Los árboles de jacaranda evaluados portan una mejor densidad de dosel que otras especies ubicadas en espacios urbanos como el Parque San Juan de Aragón, la Alameda Norte, y el sur y el este de la Ciudad de México con promedios inferiores a 70 % (Zaragoza et al., 2014; Saavedra et al., 2016).
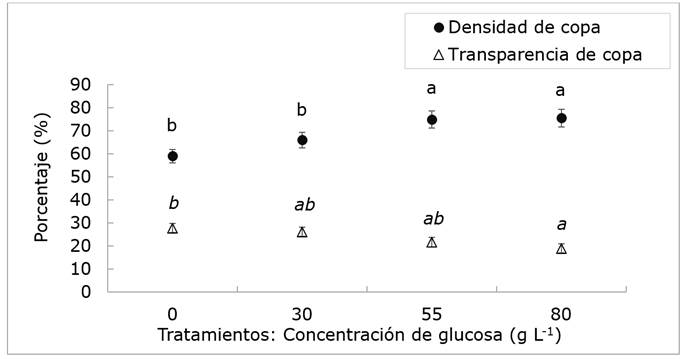
Las barras indican el error estándar. Letras iguales significan medias estadísticamente iguales (P≤0.05) usando la suma de rangos de Wilcoxon.
Figura 3 Densidad y transparencia de copa de árboles de Jacaranda mimosifolia D.Don sometidos a cuatro tratamientos de concentración de glucosa.
Los valores promedio de la transparencia de copa (Trc) fueron significativamente diferentes (P≤0.05). El más alto para esta variable lo exhibieron los árboles testigo (0 g L-1), con 28 %, mientras que el más bajo corresponde al tratamiento con 80 g L-1 de glucosa con un promedio de 19 % (Figura 3). También se observó que, al menos, 50 % de los ejemplares estudiados presentaron un promedio de 25 % de Trc, lo que sugiere que la cantidad de follaje en los árboles es suficiente para llevar a cabo procesos fundamentales como la fotosíntesis y la respiración; sin embargo, la copa no es lo suficientemente densa como para bloquear el paso de la luz (Zaragoza et al., 2014).
Valores altos de Trc se relacionan de forma directa con factores estresantes, como el ataque de plagas, sequías, actividades de poda, contaminación atmosférica, compactación del suelo o vandalismo (Schomaker et al., 2007; Zaragoza et al., 2014); sin embargo, el arbolado evaluado mostraba compactación y poda, principalmente. Cifras inferiores a 30 % de esta variable en el arbolado indican una condición saludable (Saavedra et al., 2016). En general, para los árboles estudiados en el Boulevard Texcoco-Chapingo están por debajo del límite mencionado como para no ser considerados en un estado de degradación o estrés (Figura 3).
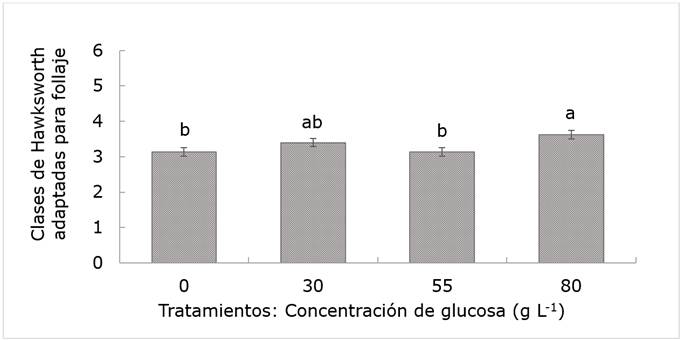
El nivel de producción de follaje estuvo influido por la concentración más alta de glucosa (P≤0.05). A pesar de esto, esta variable, independientemente de la concentración de glucosa, se ubicó entre las clases 3 y 4 (Hawksworth, 1977); por lo tanto, se consideran valores satisfactorios. La producción de follaje se relaciona directamente con la variable Dnc descrita, por lo que se observó que a mayor valor de Dnc, también se incrementó el follaje, como lo muestran los resultados para la concentración de 80 g L-1 (Figura 4). Esta cantidad de hojas le permite al arbolado sobrevivir y realizar sus funciones de forma correcta (Zaragoza et al., 2014).
Azúcares totales y azúcares reductores
El análisis de carbohidratos mostró que tanto azúcares totales como reductores en brotes, tronco y el almidón en raíces registraron una variación anual, con valores máximos en el período de otoño, y que disminuyeron paulatinamente en el invierno, para finalmente llegar a sus valores más bajos durante la primavera, poco después del período de emergencia de follaje. Esta fluctuación se debe a que los azúcares son utilizados en procesos como la respiración durante el invierno y la producción de nuevos tejidos en primavera (Valenzuela et al., 2013; Ramírez et al., 2018). Esta variación anual se ha consignado en los niveles de carbohidratos en especies como: encino siempreverde (Quercus virginiana Mill.), el naranjo (Citrus sinensis L.), la mandarina (Citrus reticulata Blanco) y el mango (Mangifera indica L.) (Martínez et al., 2009; Gamboa y Marín, 2012; Laskowski, 2014). Todas las variables presentaron variaciones relacionadas con las etapas fenológicas del árbol (Laskowski, 2014).
No se observaron diferencias significativas (P>0.05) en azúcares totales y reductores en brotes, ni en almidón proveniente de las raíces de árboles de jacaranda. Los azúcares totales en el tronco las presentaron (P<0.05) en el tratamiento de 80 g L-1, mientras que los azúcares reductores, no mostraron evidencia estadística que indicara una alteración de esta variable con la inyección de glucosa al tronco; estudios previos revelaron un incremento de azúcares reductores, como un indicador del aumento de la vitalidad (Martínez et al., 2009; Laskowski, 2014), lo que no se confirmó en el estudio actual. La determinación de azúcares totales incluye azúcares reductores y fracciones de polisacáridos como el almidón, un importante carbohidrato de reserva en diferentes órganos del árbol (raíz, tallo y ramas) utilizado para situaciones de carencia energética (Martínez et al., 2013; Piper y Fajardo, 2016). Por lo tanto, es posible estimar indirectamente la reserva de carbohidratos de los árboles con una simple diferencia entre los valores de estos azúcares. En este sentido se encontró evidencia estadística (P<0.05) señalando que árboles inyectados con concentraciones altas de glucosa mantienen más del doble de la cantidad de reservas en el tronco que aquellos tratados con concentraciones bajas de glucosa (Figura 5).
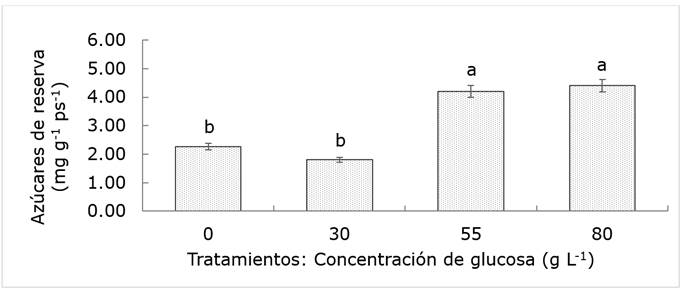
Las barras indican el error estándar. Letras iguales significan medias estadísticamente iguales (Tukey: P≤0.05).
Figura 5 Concentración de azúcares solubles en el tronco de árboles de Jacaranda mimosifolia D.Don sometidos a cuatro tratamientos de concentración de glucosa.
En otro estudio, Ramírez et al. (2018) se ha identificado que árboles urbanos como el arce (Acer platanoides L.) tienen una reserva de carbohidratos mayor que los árboles que crecen en condiciones naturales; esta característica mejora su capacidad de afrontar períodos de desbalance en los niveles de carbohidratos relacionados con los factores abióticos.
Fluorescencia de clorofila
La fluorescencia de la clorofila no mostró diferencias significativas en ninguno de los tratamientos (P>0.05). Esta variable se mantuvo constante a lo largo de la evaluación con valores Fv/Fm promedio de 0.787 para las concentraciones de 0 g L-1, 0.810 para 30 g L-1, 0.804 para 55 g L-1, y 0.811 para 80 g L-1 de glucosa. Los árboles con valores de Fv/Fm entre 0.78 y 0.85 se consideran saludables y libres de cualquier tipo de estrés (Johnstone et al., 2013; Uhrin y Supuka, 2016; Callow et al., 2018). Con base en esta variable, los árboles no exhibieron indicios evidentes de estrés, pues se mantuvieron en una condición de vitalidad constante durante todo el experimento. Lo contrario ocurre en el encino siempre verde (Quercus virginiana Mill.), el arce sicómoro (Acer pseudoplatanus L.) y el kusum (Schleicera oleosa Merr), en los que la fluorescencia de la clorofila fue estimulada por la inyección de carbohidratos o alterada por factores abióticos propios de ambientes urbanos tales como el estrés hídrico, compactación o daños mecánicos (Martínez et al., 2009; Uhrin y Supuka, 2016; Suryanto et al., 2018).
Conclusiones
La inyección de 80 g L-1 glucosa al tronco de árboles de jacaranda estimuló positivamente el crecimiento en diámetro y altura. La condición de copa se mantuvo con una buena densidad y una buena producción de follaje, e indica un buen estado de salud del arbolado; lo cual coincidió con una mayor cantidad de carbohidratos de reserva. No se encontró evidencia de una alteración de la condición de vitalidad con el uso de la fluorescencia de clorofila. Por tanto, la aplicación de glucosa al tronco promueve el crecimiento vegetativo y en menor medida estimula la vitalidad de los árboles de la especie Jacaranda mimosifolia en zonas urbanas de la ciudad de Texcoco de Mora.











 texto en
texto en