Introducción
Acer negundo L., conocido comúnmente como negundo, acezintle, o maple mexicano, es típico de bosque caducifolio, bosque de pino encino, vegetación riparia y se usa como árbol urbano en varias regiones. En México, se distribuye en altitudes de 1 800 a 2 300 msnm y en todo tipo de suelos, excepto los alcalinos, prospera en suelos secos y pobres. Requiere de un clima templado húmedo, pero tolera temperaturas mínimas de 0 °C a -15 °C y sequías estacionales. Se utiliza como ornamental, por su rápido crecimiento, alcanza hasta 20 m de altura y presenta una copa amplia que provee sombra; además, su manejo es sencillo una vez que se ha aclimatado al sitio de plantación (Conafor-Conabio, 2010).
En la propagación asexual o vegetativa se recurre a la utilización y cultivo de tejidos vegetales que conservan la potencialidad de multiplicación y diferenciación celular, para generar nuevos individuos similares a los árboles parentales (planta donante), a partir de partes vegetativas de las plantas (Vázquez-Yanes y Cervantes, 1993). En especies ornamentales para ambientes urbanos, la propagación vegetativa puede ser una opción para obtener una buena fuente de material clonal (Ramos et al., 2012).
En México, se ha trabajado muy poco sobre la calidad de plantas derivadas de propagación vegetativa. La calidad de la planta influye, en gran medida, en la disponibilidad de los productores para plantar nuevos árboles. Se considera que solamente vale la pena preparar el terreno, transportar los árboles al campo, plantarlos y darles mantenimiento, si son de buena calidad (Wightman y Cruz, 2003).
De acuerdo con Ritchie et al. (2010), la calidad de planta son los rasgos cuantificables de un individuo producido en vivero y que puedan usarse como indicadores de su desempeño, una vez establecido en el sitio de plantación; es decir, que con ciertos estándares es más probable que aumente la supervivencia y crecimiento de las plantas.
En este contexto, el objetivo de la presente investigación fue evaluar el efecto morfológico de tipo de estaca, aplicación de enraizador y nivel de fertilización, en los atributos morfológicos de la calidad de planta de Acer negundo en vivero. La hipótesis es que las estacas duras, fertilizadas y con enraizador producirán planta con mejores indicadores morfológicos de calidad.
Materiales y Métodos
Recolección de estacas
Se realizó el 16 de diciembre de 2016, en las instalaciones de la Universidad Autónoma Chapingo, a partir de ramas de la parte media y baja de la copa, de acuerdo con su accesibilidad, de árboles adultos y sanos de Acer negundo. Se utilizó solo el material de los primeros tres nudos, contados desde la punta hacia la base de cada rama. Las estacas tuvieron una longitud promedio de 15 cm, y se recolectaron en una hielera de plástico, se mantuvieron húmedos y sombreados hasta el momento de colocarlos en el sustrato.
Establecimiento del experimento
El experimento se instaló en Tepetlaoxtoc, Estado de México; se utilizaron charolas negras de polietileno, con 54 cavidades y un volumen de 200 mL por cavidad. El sustrato fue una mezcla de turba de musgo, agrolita y vermiculita de textura media, en proporción 40, 20 y 40 %, respectivamente. Se agregó fertilizante de liberación controlada (Osmocote ®) en una dosis de 1 kg m-3 de sustrato. Se aplicó riego con agua corriente.
Los factores considerados fueron: tipo de estaca, aplicación de enraizador y nivel de fertilización. Las estacas se dividieron en dos niveles, el primero llamado “estaca blanda”, que corresponde al material recolectado de la parte apical de las ramas, con diámetros de 4.5 a 8.5 mm, consistencia ligeramente flexible y coloración verde clara. El segundo nivel correspondió a las “estacas duras”, provenientes de la parte basal de la rama, con diámetros entre 9 y 16 mm, con consistencia poco flexible, coloración verde oscuro a café.
Los niveles de enraizador (Radix 10 000®, con 1 % de ácido indolbutírico, AIB, y 99 % de material inerte) fueron: con y sin aplicación. El fertilizante usado fue soluble, con la formulación 20-20-20 (20 % N, 20 % P2O5, 20 % K2O, el resto de material inerte), se consideró una dosis alta (150-60-120) (N, P, K, ppm) y una baja (100-50-80).
Se colocaron 480 estacas en las charolas, una por cavidad, con un total de 60 estacas para cada uno de los ocho tratamientos. Al momento de plantar se asignó al azar si tendría o no aplicación de enraizador, las estacas que lo requerían se humedecieron de la base y se impregnaron con Radix 10 000® y se retiró el excedente antes de colocarlas en el sustrato. Para sellar el corte expuesto, se utilizó pintura acrílica color blanco con fungicida Captán ® en una dosis de 1 g L-1 de pintura.
Al finalizar del trasplante, las charolas se colocaron dentro de un túnel con cubierta de polietileno blanco para invernadero, de 1.5 m de ancho por 3 m de largo y 1.5 m de alto, con ambos extremos cubiertos con malla sombra, y se aplicó un primer riego, agregándole 1 g L-1 de Captán.
Después de ocho semanas de establecido del experimento, al inicio de la emisión de raíces adventicias, se inició el suministro de fertilizante soluble marca Peters Professional ® de uso general, conveniente para la etapa de crecimiento rápido en vivero (20 - 20 - 20), con las dosis antes mencionadas y riego cada tercer día, para mantener el sustrato húmedo.
A los cuatro meses se registró el porcentaje de enraizamiento (respecto al total de estacas), se consideró como enraizada la estaca cuando se observaron raíces laterales. En seguida se obtuvo una muestra de 40 estacas, a las que se les midió: diámetro del brote, longitud del brote hasta la yema, longitud del brote hasta la punta de la hoja, longitud de raíz, altura de brotación de raíz (promedio) desde la base, peso fresco de: hojas, raíz, parte aérea y parte subterránea, y peso seco de: hojas, raíz, parte aérea y parte subterránea. Para ello se empleó una regla plástica graduada en centímetros, un vernier digital Truper y una báscula digital OHAUS Scout ® Pro.
Las hojas, raíces, partes aérea y subterránea se secaron dentro de bolsas de papel estraza, en un horno de secado (Ríos Rocha H-41) a 80 °C hasta que su peso fue constante (generalmente al cabo de 72 h).
Además, se calculó la relación parte aérea/parte radical, a partir de la relación de los pesos secos de cada una de las partes, y el Índice de Calidad de Dickson, el cual se calcula mediante la relación entre el peso seco total de la planta (g) y la suma de la esbeltez (relación entre la altura de la planta, en cm y su diámetro, en mm) con la relación parte aérea/parte radical (Birchler et al., 1998).
En este estudio, ni los pesos secos, frescos, ni los indicadores de calidad incluyeron el peso de las estacas.
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar y se trató de un experimento factorial 2 × 3. Para el análisis estadístico del enraizamiento, se transformó el porcentaje de estacas enraizadas con la función arco seno de la raíz cuadrada de dicho porcentaje expresado en tanto por uno. Se usó el procedimiento PROC ANOVA del programa SAS® (Statistical Analysis System), V. 9.4, para la comparación de medias, se hizo la prueba de Tukey.
El modelo estadístico empleado fue el siguiente:
Donde:
µ = Media general
α i = Efecto del i-ésimo nivel del factor estaca
β j = Efecto del j-ésimo nivel del factor enraizador
γ k = Efecto del k-ésimo nivel del factor fertilización, las combinaciones de letras indican las interacciones entre los niveles de los factores involucrados
E ijk = Error experimental
Resultados y Discusión
El análisis estadístico del enraizamiento, con base en cada factor individual, se obtuvo significancia estadística únicamente para la aplicación de enraizador (P≤0.05) (Cuadro 1); y la comparación de medias indicó el mejor resultado para las estacas con enraizador (20.5 % de enraizamiento) (Cuadro 1). Respuesta relativamente común; así, Palanisamy y Subramanian (2001) registran efectos significativos para la aplicación de ácido indolbutírico (1 000 ppm) en estacas de Tectona grandis L. f., con porcentajes de enraizamiento de 74 a 100 %.
Cuadro 1 Análisis estadístico para porcentaje de enraizamiento de estacas.
| Valores de P | |||||
|---|---|---|---|---|---|
| Tipo de estaca | Aplicación de enraizador | Nivel de fertilización | |||
| 0.5262 | 0.0071 | 0.4950 | |||
| Prueba Tukey | |||||
| Estaca | Enraizador | Fertilización | |||
| Dura | 17.5a | Con enraizador | 20.48a | Alta | 17.5a |
| Blanda | 15.0a | Sin enraizador | 12.08b | Baja | 15.0a |
Medias con letra diferente en la misma columna indican diferencias significativas de acuerdo con la prueba de Tukey, P ≤ 0.05.
El análisis estadístico de las variables medidas en laboratorio, muestra que existieron efectos significativos de cuatro factores o sus interacciones sobre seis variables estudiadas: diámetro del brote, longitudes del brote hasta la yema y hasta la punta de la hoja, y los pesos: fresco de las hojas, fresco de la raíz y seco de las hojas (Cuadro 2).
Cuadro 2 Resultados del análisis estadístico (valores de P) para variables evaluadas en laboratorio.
| Fuente | DB | LBY | LBH | LR | ABR | PFH | PFR | PSH | PSR |
|---|---|---|---|---|---|---|---|---|---|
| M | 0.0569 | 0.0232* | 0.0290* | 0.1231 | 0.8698 | 0.1259 | 0.2079 | 0.1114 | 0.5607 |
| E | 0.0142* | 0.0104* | 0.0227* | 0.3849 | 0.5561 | 0.3791 | 0.5377 | 0.1285 | 0.3000 |
| R | 0.8559 | 0.0338* | 0.0212* | 0.4155 | 0.8081 | 0.0371* | 0.1527 | 0.0276* | 0.1246 |
| F | 0.4106 | 0.5405 | 0.3851 | 0.4200 | 0.8486 | 0.5714 | 0.4488 | 0.9724 | 0.7092 |
| E*R | 0.2596 | 0.6978 | 0.8062 | 0.0947 | 0.6900 | 0.4481 | 0.7543 | 0.7110 | 0.5011 |
| E*F | 0.0967 | 0.9266 | 0.2677 | 0.0538 | 0.7028 | 0.5091 | 0.2599 | 0.7933 | 0.8302 |
| R*F | 0.0989 | 0.0179* | 0.0386* | 0.2010 | 0.2861 | 0.0578 | 0.4348 | 0.0477 | 0.2083 |
| E*R*F | 0.3074 | 0.6458 | 0.8521 | 0.1957 | 0.2938 | 0.2025 | 0.0289* | 0.3949 | 0.9772 |
M = Modelo; E = Estaca; R = Enraizador; F = Fertilización; DB = Diámetro del brote; LBY = Longitud del brote hasta la yema; LBH = Longitud del brote hasta la punta de la hoja; LR = Longitud de raíz; ABR = Altura del brote de raíz; PFH = Peso fresco de hojas; PFR = Peso fresco de raíz; PSH = Peso seco de hojas; PSR = Peso seco de raíz. * = Datos significativos con P ≤ 0.05.
Respuesta al tipo de estaca
De acuerdo con la comparación de medias, las estacas duras tuvieron resultados superiores para el diámetro de brote, longitud del brote hasta la yema y longitud de brote hasta la punta de la hoja (Cuadro 3).
Cuadro 3 Respuesta al tipo de estaca.
| Estaca | DB (mm) | LBY (mm) | LBH (mm) | LR (mm) | ABR (mm) | PFH (g) | PFR (g) | PSH (g) | PSR (g) |
|---|---|---|---|---|---|---|---|---|---|
| Dura | 2.68a | 71.85a | 214a | 104.1a | 13.62a | 3.43a | 0.97a | 0.68a | 0.2a |
| Blanda | 2.23b | 45.45b | 165.60b | 93.1a | 11.92a | 2.94a | 0.83a | 0.52a | 0.13a |
Medias con letra diferente en la misma columna indican diferencias significativas de acuerdo con la prueba de Tukey, P ≤ 0.05.
Las estacas duras procedieron de la parte más cercana al tronco, por lo cual es posible que tuvieran una cantidad superior de carbohidratos que las estacas blandas. Al respecto, Veierskov (1988) señala un gradiente ascendente en la concentración de tales productos de reserva hacia la base de los tallos. Hartmann y Kester (1991) apuntan que las estacas más gruesas provenientes de la porción basal de las ramas acumulan más contenido de carbohidratos de reserva. Patrón que se ajusta y explica la mayor respuesta en las variables referidas. Este resultado es semejante al de Liao et al. (2012), quienes probaron la reproducción vegetativa de Myrciaria dubia (Kunth) McVaugh y obtuvieron los mejores promedios de brotación de hojas en estacas con diámetro grueso. Sin embargo, cabe esperar diferentes respuestas en distintas especies. dos Santos et al. (2011) concluyen que Cestrum laevigatum Schltdl. y Salix humboldtiana Willd. se pueden propagar con cualquier tipo de estaca, pero para especies como Ficus adathodigifolia L. y F. citrifolia Mill. son mejores las de consistencia leñosa, que tienden a ser más gruesas.
Respuesta a la aplicación de enraizador
El enraizador (AIB) produjo una tendencia de mayor valor en las variables longitud del brote, tanto en el que se midió hasta la yema como en el de hasta la punta de las hojas; también incidió en el peso fresco y seco de las hojas (Cuadro 4). Resultado que coincide con el de Boschini y Rodríguez (2002), quienes al aplicar diferentes dosis de AIB a estacas de Morus alba registraron diferencias estadísticamente significativas al evaluar el brote total de yemas y raíces. Asimismo, Maldonado et al. (2017) lograron el enraizamiento de estacas de Malphigia mexicana A. Juss. y Quintero et al. (2008) en estacas de Symphoricarpos microphyllus H. B. K. con enraizadores.
Cuadro 4 Respuesta a la aplicación de enraizador.
| E | DB (mm) | LBY (mm) | LBH (mm) | LR (mm) | ABR (mm) | PFH (g) | PFR (g) | PSH (g) | PSR (g) |
|---|---|---|---|---|---|---|---|---|---|
| C | 2.47a | 69.4a | 214.3a | 103.7a | 13.13a | 3.78a | 1.07a | 0.72a | 0.21a |
| S | 2.44a | 47.9b | 165.3b | 93.45a | 12.43a | 2.59b | 0.74a | 0.49b | 0.12a |
E = Enraizador; C = Con; S = Sin; Medias con letra diferente en la misma columna indican diferencias significativas de acuerdo con la prueba de Tukey, P ≤ 0.05.
Hartmann y Kester (1991) afirman que la formación de raíces adventicias puede depender de ciertos factores inherentes no translocables, determinados por el genotipo de las células individuales del tejido; y a los endógenos del enraizamiento presentes en cada individuo, además que la falta de respuesta a la aplicación de la auxina sintética se debe a que varias especies poseen suficiente cantidad de auxina natural para promover el enraizamiento. En el estudio de dos Santos et al. (2011), con estacas de 20 especies forestales brasileñas, C. laevigatum y S. humboldtiana formaron raíces sin enraizador, pero 11 taxones no las presentaron en ninguno de sus tratamientos; por ejemplo: Dendropanax cuneatus (DC). Decne. & Planch., Erythrina falcata Benth., y Casearia sylvestris Sw.
Respuesta al nivel de fertilización
En el análisis de comparación de medias para los niveles de fertilización, no se obtuvieron diferencias significativas (Cuadro 5), lo cual es posible que responda a que la “fertilización baja” es suficiente para cubrir las demandas nutrimentales de la planta, por lo menos en lo referente a las características morfológicas. Los resultados fueron similares a los registrados por Bualó et al. (2006) en Calibrachoa linearis (Hook.) Wijsman y P. kleinii L. B. Sm. & Downs., las cuales fueron sometidas a dos niveles de fertilización; además su crecimiento y características morfológicas no fueron significativamente diferentes entre tratamientos.
Cuadro 5 Respuesta al nivel de fertilización.
| F | DB (mm) | LBY (mm) | LBH (mm) | LR (mm) | ABR (mm) | PFH (g) | PFR (g) | PSH (g) | PSR (g) |
|---|---|---|---|---|---|---|---|---|---|
| A | 2.53a | 61.65a | 198.7a | 103.7a | 13.05a | 3.34a | 0.99a | 0.61a | 0.18a |
| B | 2.39a | 55.65a | 180.9a | 93.5a | 12.50a | 3.02a | 0.82a | 0.61a | 0.15a |
F = Fertilización; A = Alta; b = Baja; Medias con letra diferente en una columna indican diferencias significativas de acuerdo con la prueba de Tukey, P ≤ 0.05.
Caetano et al. (2010) después de aplicar enraizador (3 000 gL-1 de AIB) por 5 s, probaron diferentes fertilizantes y un control para el enraizamiento de estacas semileñosas de olivo (Olea europaea L.), señalan que un biofertilizante, con 0.1 % K, 0.34 % Zn, 0.02 % Cu, 0.04 % Mn, 0.18 % B, 0.43 % Mo, 0.12 % S, 0.64 % Ca y 0.27 % C orgánico, produjo más raíces.
Interacción enraizador*fertilización
La interacción del enraizador y el fertilizante tuvo efectos sobre la longitud del brote hasta la yema y longitud del brote hasta la punta de la hoja (Cuadro 2). Los mayores valores de longitud de brote se registraron con la aplicación de la dosis baja de fertilización, y disminuyeron con la dosis alta. Cuando se aplicó “fertilización alta” el valor fue similar, independiente del suministro del enraizador. Sin este, la longitud del brote aumentó conforme se incrementó la dosis de fertilización (figuras 1 y 2).
Triple interacción
Si bien, las estacas con diferentes niveles de dureza son convenientes para distintos grupos de especies, las de madera dura tienden a contener más carbohidratos que las de madera blanda (Hartman y Kester, 1991). De ahí que, independientemente del nivel de fertilización, en las estacas duras el AIB favoreció la acumulación del peso fresco de las raíces. Esta última tendencia se sostuvo en las estacas blandas con “fertilización baja”, incluso fue más pronunciada, pero en estas, sin el enraizador a la “fertilización alta” le correspondió el valor más alto (Figura 3).
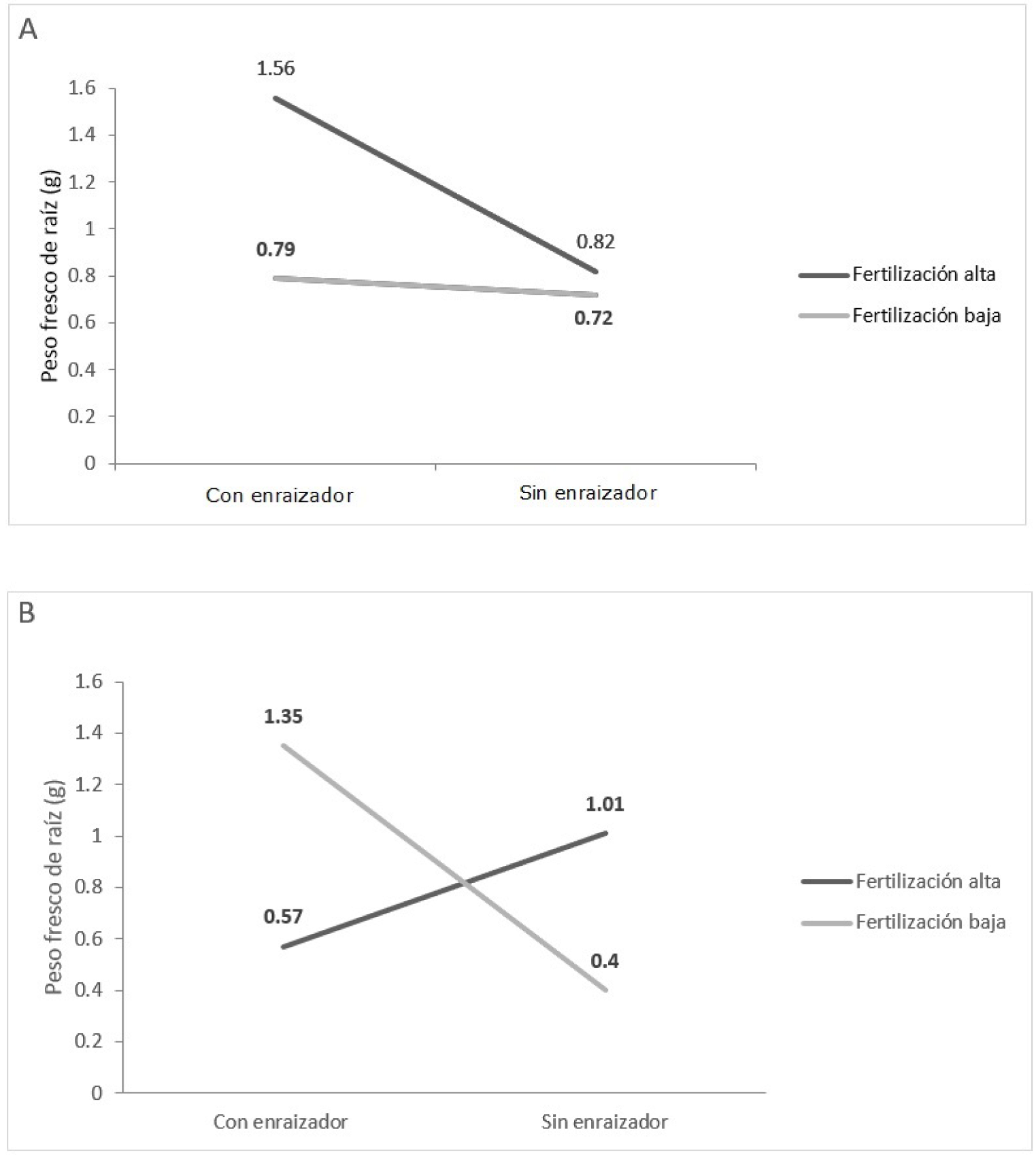
A) Estacas duras; B) Estacas blandas.
Figura 3 Efecto de la interacción tipo de estaca, enraizador y fertilización en el peso fresco de la raíz.
La mayor respuesta en el peso fresco de las raíces en las estacas de madera dura, con “fertilización alta”, puede relacionarse, en parte, con el K, ya que un suplemento adicional de ese nutriente estimula el crecimiento de la raíz, inducido por auxinas. Asimismo, el K es muy importante para la emisión de raíces adventicias, pues como influye en la expansión celular, la presión de turgencia, el contenido de humedad de la célula y la acción estomatal, modula los efectos de la tensión hídrica en las estacas, que inicialmente carecen de raíz y, en consecuencia están bajo tensión hídrica. Lo anterior se observó en estacas de madera dura de Junipers virginiana L., con correlación entre K y porcentaje de enraizamiento (Henry et al., 1992).
En las estacas blandas, se produjeron altos pesos frescos con la aplicación de enraizador con “fertilización baja”, o bien sin este y con “fertilización alta”; tendencia que puede relacionarse con la concentración de nutrientes en las estacas al momento de su corte, lo cual influye en la redistribución del K y es diferente entre tipos de ellas (Henry et al., 1992).
Cabe esperar que en estacas duras, más lignificadas, la concentración de nutrientes es menor y ello incidió en que las estacas blandas, con más K inicialmente, inhibieran la acumulación de peso fresco al adicionar K extra, además la aplicación del enraizador. En otras especies se ha documentado interacciones similares. Por ejemplo, en estacas de madera semidura de Dalbergia sissoo Roxb., la fertilización (NPK) favoreció el enraizamiento y brotación, además la interacción ácido indolbutírico*fertilización resultó significativa (Bakshi, 2008).
Relación peso seco de brote / peso seco de raíces
Con este indicador, una relación igual a uno, significa que la biomasa aérea es igual a la subterránea; pero si es menor a uno, entonces la biomasa subterránea supera a la aérea; lo contrario, ocurre cuando el valor es mayor a uno. En el presente estudio todos los valores fueron superiores a uno; por lo tanto la raíz fue poco desarrollada, con respecto a la parte aérea, lo cual incide en la resistencia al estrés hídrico en el campo (Rodríguez, 2008; Prieto et al., 2009), aunque no se fue estadísticamente significativo (Cuadro 6). Valores similares a los obtenidos de la evaluación de hojas y raíces de Acer negundo (Cuadro 7), se han citado en Tabebuia rosea (Bertol.) DC. y Swietenia humilis Zucc., ambas calificadas como plantas de baja calidad (Sáenz et al., 2014). Este indicador fue desarrollado para individuos producidos por semilla, por lo que es conveniente hacer más pruebas con estacas de otras latifoliadas y en plantaciones en ambiente urbano o en el campo.
Cuadro 6 Valores de P del análisis estadístico de índices de calidad de planta, para dos indicadores de calidad.
| Peso seco brote / peso seco raíz | Índice de Dickson | |
|---|---|---|
| Valores de P | ||
| Modelo | 0.5883 | < 0.0001 |
| Estaca | 0.1617 | < 0.0001 |
| Enraizador | 0.4252 | 0.3800 |
| Fertilización | 0.3597 | 0.3423 |
| Estaca*Enraizador | 0.6220 | 0.1540 |
| Estaca*Fertilización | 0.7789 | 0.5409 |
| Enraizador*Fertilización | 0.4881 | 0.8019 |
| Estaca*Enraizador*Fertilización | 0.2708 | 0.6501 |
Cuadro 7 Prueba de Tukey para dos indicadores de calidad de planta.
| Tratamientos | Peso seco brote / peso seco raíz | Índice de Dickson |
|---|---|---|
| Tipo de estaca | ||
| Dura | 9.08 a | 3.12a |
| Blanda | 4.31 a | 0.66b |
| Enraizador | ||
| Con | 8.04 a | 2.03 a |
| Sin | 5.35 a | 1.75 a |
| Fertilización | ||
| Alta | 8.24 a | 2.04 a |
| Baja | 5.15 a | 1.74 a |
Medias con letra diferente en una misma columna indican diferencias significativas de acuerdo con la prueba de Tukey, P ≤ 0.05.
Índice de Dickson
Índice que se considera uno de los mejores parámetros para indicar la calidad de planta, ya que expresa el equilibrio de la distribución de la masa y la robustez, lo que evita seleccionar plantas desproporcionadas y descartar ejemplares de menor altura, pero con más vigor (García, 2007). En términos generales, en México se categoriza la calidad de planta de acuerdo al índice de Dickson. Las plantas con valores de 0.20 o menos son de baja calidad: calidad de media entre 0.45 y 0.20 y alta, con 0.5 o más en coníferas (Sáenz et al., 2014); con valores más altos la planta tiene más calidad (Basave et al., 2017).
El análisis de varianza evidenció significancia estadística (P<0.05), influenciada por el factor estaca (Cuadro 6). La prueba de Tukey indicó los mejores resultados con este índice para las estacas duras (Cuadro 7), lo que puede relacionarse, proporcionalmente, con más producción de raíces (Guzmán et al., 2012).
Conclusiones
Acer negundo mejora su enraizamiento con el ácido indolbutírico. Las estacas duras, debido a que tienen más carbohidratos de reserva, producen brotes más vigorosos, con mayores diámetros, longitudes a la yema y a la punta de la hoja. Estas dos últimas variables también son favorecidas por el ácido indolbutírico, el que induce la generación de superficie fotosintética, pues incide positivamente en el peso seco y fresco de las hojas. La “fertilización alta” no es afectada por el enraizador, pero en la “fertilización baja”, este promueve las longitudes de los brotes a la yema y a la punta de la hoja, mientras que la dosis baja fertilizante las reduce. Finalmente, en la triple interacción de tipo de estaca, fertilización y enraizador, maximiza el peso fresco de las raíces la aplicación de ácido indolbutírico a estacas furas; pero en especial el postasio extra de la “fertilización alta” facilita la acumulación de agua en los tejidos.











 texto em
texto em 




