Introducción
Los patrones de sucesión en las comunidades de hongos en diversos árboles, tanto de climas templados como tropicales han sido materias de estudio para diversos investigadores: Frankland (1998), discute la naturaleza y los mecanismos de la sucesión de los hongos en el suelo y en la hojarasca; Sieber-Canavesi y Sieber (1993) concluyen que en Abies alba Mill. las condiciones edáficas y las prácticas de manejo inciden en dicha sucesión, y clasifican a los hongos de las hojas en tres grupos: 1) endófitos de las hojas vivas; 2) colonizadores y sobrevivientes endófitos de hojas senescentes y hojas muertas adheridas; 3) hongos que colonizan solo hojas muertas; Tokumasu et al. (1994), en Pinus sylvestris L., separaron los hongos en dos grupos: las de hojas colgantes y recién caídas y los de las hojas en el suelo, concluyeron que su frecuencia se reduce con el avance de la degradación.
Rosenbrock et al. (1995) señalan en Alnus glutinosa (L.) Gaertn. que la biomasa microbiana disminuyó conforme avanzó la degradación; Sridhara y Ahmad (1993) estudiaron la sucesión de hongos en hojarasca de cuatro especies de árboles de un bosque tropical en la India.
Los hongos endófitos no producen síntomas en sus hospederos, son componentes importantes de la micobiota de las plantas; interaccionan y se sobreponen en función con otros grupos fúngicos importantes que colonizan tejidos vegetales, entre ellos, los micorrícicos, patógenos, epífitos y los saprobios (Porras-Alfaro y Bayman, 2011).
Dada la importancia ecológica y, en algunos casos, económica de los hongos endófitos, existen numerosos trabajos en especies de plantas, entre ellas los pinos; destacan Pinus nigra J.F.Arnold (Kowalski y Zych, 2002); P. halepensis Mill. (Botella y Diez, 2011); P. densiflora Siebold & Zucc. y P. koraiensis Siebold & Zucc. (Yoo y Eom, 2012); P. thunbergii Parl. (Kim et al., 2012); P. wallichiana A.B.Jacks. (Qadri et al., 2014); P. massoniana Lamb. (Yuan y Chen; 2014); P. sylvestris L. (Millberg et al., 2015); P. taeda L. (Oono et al., 2015); y P. monticola Douglas ex D.Don (Bullington y Larkin, 2015).
En la literatura se citan diversos estudios referentes a inventarios de hongos en la hojarasca de pinos y latifoliadas (Kendrick, 1958; Sankaran, 1994; Parungao et al. 2002). Así como investigaciones en las que se evalúa la abundancia y diversidad de hongos en la hojarasca (Bills y Polishook, 1994; Prakash et al., 2015; U’Ren y Arnold, 2016).
La hojarasca juega un papel prominente en los ecosistemas forestales, porque proveen energía, carbón, nitrógeno y nutrientes. La productividad del bosque está directamente relacionada con el grado de degradación de la materia orgánica (Rahman et al., 2013). Por estos motivos numerosos autores han hecho investigaciones sobre el papel de los hongos y los grados de descomposición de diversos árboles (Rihani et al., 1995; Sankaran; 1993; Osono, 2011).
En México, los trabajos de Heredia (1987, 1994) y Arias y Heredia (2014) registran los hongos asociados a especies de árboles en bosques tropicales y bosque mesófilo de montaña. Sin embargo, no hay antecedentes sobre hongos relacionados a la hojarasca de pinos, por lo que el objetivo de este estudio fue determinar los patrones de distribución vertical de hongos presentes en las hojas de tres especies de Pinus en Nuevo León.
Materiales y Métodos
Área de estudio
Se establecieron tres parcelas de muestreo, una para cada especie de pino, las cuales se detallan a continuación:
1. Bosque Escuela, Iturbide Nuevo León; bosque de pinos con Pinus pseudostrobus Lindl., otras especies localizadas dentro de la parcela: Quercus canbyi Trel., Amelanchier denticulata (Kunth) K. Koch, Arbutus xalapensis Kunth, Prunus serotina Ehrh. 24º42’51” N, 099º51’67” O; 1 630 msnm.
2. Pablillo, Galeana, Nuevo León; bosque de pinos con Pinus arizonica var. stormiae Mart. 24º36’51” N, 100º00’16” O; 2 000 msnm.
3. Pablillo, Galeana, Nuevo León; bosque de pinos con Pinus cembroides Zucc. 24º37’11” N, 100º00’38 O; 2 000 msnm.
Muestreo de hojas
Cada 15 días, durante un año, se recolectaron en las parcelas seleccionadas 10 fascículos al azar de los siguientes tipos de hojas: hojas verdes, hojas senescentes, hojas muertas aun adheridas al árbol, hojas muertas "colgantes", aquéllas que no han llegado al mantillo y están suspendidas sobre la vegetación, hojas del mantillo que aún no inician el proceso de degradación (L), hojas del mantillo de la capa intermedia con algunos signos de degradación (F1), hojas del mantillo de la capa inferior con signos avanzados de degradación (F2).
Las muestras se utilizaron para el aislamiento de hongos por los métodos que se describen a continuación.
Aislamiento de hongos de las hojas en medio de cultivo
En el laboratorio, se tomaron las medidas de todas las hojas recolectadas y se seleccionaron al azar tres hojas por muestra y se procesaron para el aislamiento de los hongos, mediante una modificación al protocolo propuesto por Kowalski y Zych (2002). Las hojas se esterilizaron, superficialmente, con etanol al 96 % por un minuto. A continuación se trataron luego con hipoclorito de sodio al 3 %, por 10 minutos. Por último, se sumergieron en etanol al 70 %, por 30 segundos. Las hojas tratadas se cortaron transversalmente con una navaja esterilizada (flameada en el mechero). El número de cortes varió según su tamaño. Los cortes se colocaron, con la ayuda de unas pinzas esterilizadas (flameadas en el mechero), en una caja de Petri con extracto de malta agar al 2.5 % y se incubaron a 22 °C, en una incubadora Shellab L120, por el tiempo necesario hasta la observación de colonias a simple vista.
Se contaron todas las colonias obtenidas y se identificaron mediante técnicas rutinarias de micología, a partir de observación directa al microscopio compuesto de preparaciones montadas en ácido láctico, en glicerina alcohol agua (GAW), o en agua destilada. Se utilizaron las obras de Sutton (1980), Minter (1981), Dennis (1981), Ellis (1971, 1976), Arx (1981) y Nag Raj (1993); y se consultó la página web del Index Fungorum (2018) (http://www.indexfungorum.org/) para corroborar los nombres de las especies y los autores de las mismas.
Se realizaron subcultivos de todas las morfoespecies presentes en las cajas, con el propósito de obtener vouchers de los hongos estudiados, los cuales se depositaron en la colección de cepas del Herbario Micológico de la Facultad de Ciencias Forestales (CFNL); así como, de aquellos cultivos, en los que no fue posible la determinación de la especie por no contar, en su momento, con estructuras morfológicas que permitieran su identificación.
Hongos de las hojas en cámaras húmedas
De cada muestra recolectada quincenalmente en los sitios de muestreo y por tipo de hoja, se seleccionó al azar un fascículo de hojas y se colocó en cámara húmeda, la cual consistió en una caja de Petri con papel estraza esterilizado humedecido con agua destilada estéril. Estas cajas se mantuvieron en condiciones húmedas por un mes. Después de este tiempo se pusieron en un congelador Acros modelo ART14JKX a una temperatura de 5 °C por una semana para prevenir una infestación por ácaros. Enseguida, las muestras se examinaron en un microscopio Karl Zeiss Axiostar Plus, de acuerdo a las técnicas micológicas de rutina (Hawksworth, 1974). La identificación de las especies se hizo con base en la literatura especializada las (Sutton, 1980; Minter, 1981; Dennis, 1981; Ellis, 1971, 1976; Arx, 1981; Nag Raj, 1993).
La información por colecta y tipo de hoja se integró en una hoja de cálculo de Excel 2013, para estimar la riqueza, abundancia y frecuencia de los hongos asociados a las hojas. La riqueza correspondió al número de especies de hongos observadas (total, por tipo de hojas, por especie de pino); la abundancia absoluta (Aba) al número de individuos por especie, con respecto al número total de individuos presentes en el área de estudio (ni). La frecuencia absoluta se obtuvo a partir del número de puntos con la especie entre el total de puntos muestreados; para comparar el patrón de hongos en cada una de las hojas estudiadas, se realizó un análisis de conglomerados, con el programa estadístico PAST3 (Hammer et al., 2001).
Resultados y Discusión
Diversidad de hongos mediante el método de cultivo en placa de Petri
Se realizaron 26 muestreos de hojas para cada una de las especies consideradas. Se procesaron 1 638 muestras para las tres especies de pinos.
El análisis incluyó un total de 23 332 colonias de hongos (Cuadro 1).
Cuadro 1 Colonias estudiadas por especie de pino.
| Especie de pino | Número de colonias |
|---|---|
| Pinus arizonica Engelm. | 10 146 |
| Pinus cembroides Zucc. | 1 636 |
| Pinus pseudostrobus Lindl. | 11 550 |
Asimismo, se obtuvieron 1 953 subcultivos, de los cuales se determinaron 57 taxones fúngicos, de ellos 56 se adscriben al Phyla Ascomycota y solo uno (Gymnopus androsaceus) al Basidiomycota. Voříšková y Baldrian (2013) indican que Ascomycota fue el más abundante en hojas verdes y en senescentes, con 88.5 % y 99.5 % de amplificaciones, respectivamente. Lo cual coincide con este trabajo; si bien, dichos autores usaron un método molecular para la determinación de los hongos.
Haňáčková et al. (2015) con el método de cultivo y uno molecular concluyeron que con ambos se obtuvieron especies dominantes similares y en el estadio temprano de la degradación, los ascomicetos son predominantes, y los basidiomicetos solo se presentan ocasionalmente, lo cual, también coincide con los resultados aquí documentados.
Se registraron 40 taxones de hongos para Pinus arizonica, 28 para P. cembroides y 32 para P. pseudostrobus. La lista completa se detalla en el Cuadro 2. Las especies más abundantes fueron Lophodermium australe Dearn., Pestalotia stevensonii Peck y Rhizosphaera kalkhoffii Bubák; mientras que Cladosporium cladosporioides (Fresen.) G.A. de Vries, Alternaria alternata (Fr.) Keissl. y Ceuthospora sp. fueron las más frecuentes. Yuan y Chen (2014) señalan a los taxa de Lophodermium como pioneras frecuentes en las hojas y que juegan un papel importante en la degradación de la hojarasca.
Cuadro 2 Taxones registrados de hongos por especie de Pinus.
| Especies | Pinus arizonica | Pinus cembroides | Pinus pseudostrobus |
|---|---|---|---|
| Alternaria alternata (Fr.) Keissl. | X | X | X |
| Aspergillus sp. | X | X | |
| Aureobasidium pullulans (de Bary & Löwenthal) G. Arnaud | X | X | |
| Ceuthospora sp. | X | X | X |
| Cladosporium cladosporioides (Fresen.) G.A. de Vries | X | X | X |
| Conoplea elegantula (Cooke) M.B. Ellis | X | X | X |
| Epicoccum nigrum Link | X | X | X |
| Fusarium lateritium Nees | X | X | |
| Gymnopus androsaceus (L.) Della Magg. & Trassin. | X | ||
| Leptostroma sp. | X | ||
| Lophodermium australe Dearn. | X | ||
| Mycoglaena sp. | X | ||
| Nigrospora oryzae (Berk. & Broome) Petch | X | ||
| Penicillium sp. | X | X | X |
| Pestalotia stevensonii Peck | X | ||
| Pestalotiopsis funerea (Desm.) Steyaert | X | X | |
| Phialophora sp. | X | X | X |
| Phoma sp. | X | X | |
| Preussia sp. | X | X | |
| Pseudopithomyces chartarum (Berk. & M.A. Curtis) Jin F. Li, Ariyaw. & K.D. Hyde | X | ||
| Rhizosphaera kalkhoffii Bubák | X | ||
| Sarea resinae (Fr.) Kuntze | X | ||
| Scolecobasidium sp. | X | ||
| Sphaeropsis sapinea (Fr.) Dyko & B. Sutton | X | X | |
| Torula herbarum (Pers.) Link | X | ||
| Trichoderma harzianum Rifai | X | ||
| Tritarachium sp. | X | ||
| Ulocladium sp. | X | ||
| No identificado 01 | X | X | X |
| No identificado 02 | X | ||
| No identificado 03 | X | X | |
| No identificado 04 | X | X | X |
| No identificado 05 | X | X | X |
| No identificado 06 | X | ||
| No identificado 07 | X | X | |
| No identificado 08 | X | X | |
| No identificado 09 | X | X | |
| No identificado 10 | X | X | |
| No identificado 11 | X | ||
| No identificado 13 | X | X | |
| No identificado 14 | X | X | X |
| No identificado 15 | X | X | |
| No identificado 16 | X | ||
| No identificado 17 | X | X | |
| No identificado 18 | X | X | |
| No identificado 19 | X | X | |
| No identificado 20 | X | ||
| No identificado 21 | X | ||
| No identificado 22 | X | ||
| No identificado 23 | X | ||
| No identificado 24 | X | X | |
| No identificado 25 | X | X | |
| No identificado 26 | X | ||
| No identificado 27 | X | ||
| No identificado 28 | X | ||
| No identificado 29 | X | X | |
| No identificado 30 | X | X |
El taxón que presentó la mayor riqueza de hongos fue P. arizonica, seguido de P. pseudostrobus y P. cembroides. Sin embargo, la cantidad más grande de colonias se registró en P. pseudostrobus seguido de P. arizonica. El número de colonias en P. cembroides, comparado con los otros pinos, fue de 10 a 11 veces menor. Lo anterior puede relacionarse con la longitud de la hoja. Los promedios de largo de hojas muestreadas fueron de 173.9 mm, para P. pseudostrobus; 156.1mm, para P. arizonica; y de 27 mm, para P. cembroides. Los números mínimo, promedio y máximo de especies de hongos por especie de pino y tipo de hoja se presentan en el Cuadro 3.
Cuadro 3 Números mínimos, promedios y máximos de especies de hongos.
| Tipo de hoja | P. arizonica | P. cembroides | P. pseudostrobus | ||||||
| Mín. | Prom. | Máx. | Mín. | Prom. | Máx. | Mín. | Prom. | Máx. | |
| Verdes | 0 | 1.9 | 6 | 0 | 0.4 | 3 | 0 | 1.7 | 5 |
| Senescentes | 1 | 2.8 | 5 | 0 | 1.5 | 4 | 1 | 2.8 | 6 |
| Adheridas | 2 | 3.7 | 7 | 1 | 2.9 | 5 | 1 | 3.7 | 7 |
| Colgantes | 2 | 4.2 | 9 | 2 | 3.4 | 5 | 1 | 4.5 | 8 |
| En el suelo | 2 | 5.3 | 8 | 2 | 3.0 | 6 | 3 | 4.8 | 10 |
| Grises | 2 | 5.1 | 8 | 0 | 2.7 | 5 | 3 | 5.0 | 8 |
| Fragmentadas | 1 | 1.7 | 4 | 1 | 2.1 | 4 | 1 | 2.0 | 4 |
Las hojas muertas en el suelo y las hojas grises, en todos los casos presentaron la riqueza más alta. A las hojas verdes les correspondió la menor riqueza, lo cual fue particularmente notorio para P. cembroides. Conforme avanza el grado de descomposición de las hojas, el número de especies de hongos siempre disminuyó. Tokumasu et al. (1994) citan resultados similares, consignan que las hojas colgantes y las del suelo mostraron el mayor número de aislamientos.
Al considerar la cantidad de colonias, las hojas muertas colgantes y las hojas muertas en el suelo tuvieron el mayor número. Las hojas fragmentadas y las verdes fueron las que menos colonias registraron (Figura 1).
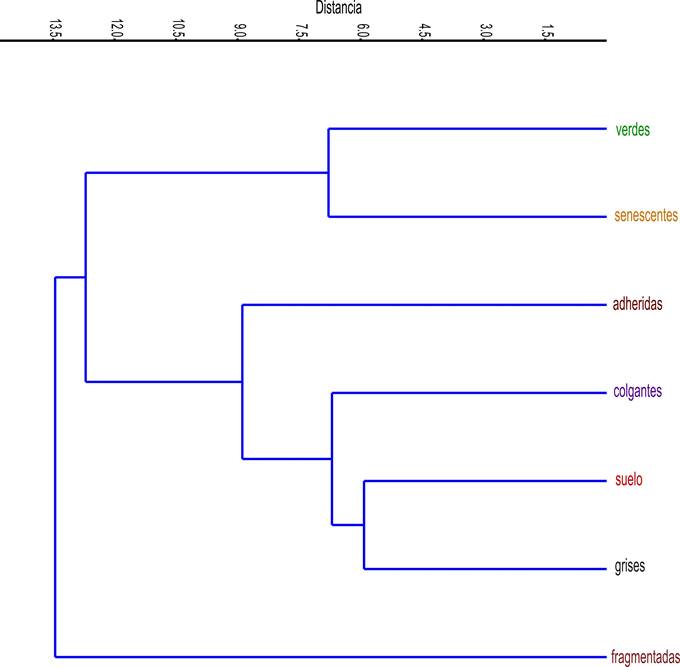
En cuanto a los patrones de riqueza de hongos en los siete tipos de hojas, en el análisis de conglomerados (Figura 2) se distinguen tres grupos: uno formado por las hojas verdes y senescentes, otro por las hojas muertas (adheridas, colgantes y en el suelo) y un tercero solo por las hojas fragmentadas.
Diversidad de hongos de la hojarasca mediante el uso de cámaras húmedas
Se realizaron 27 muestreos para Pinus arizonica y P. cembroides y 26 para P. pseudostrobus. Se analizaron un total de 400 muestras, en las que se identificaron 28 taxones de hongos de las hojas adheridas, las hojas colgantes y las hojas muertas en el suelo. La lista completa de los especies se presenta en el Cuadro 4.
Cuadro 4 Listado de taxones de hongos obtenidos mediante el método de cámara húmeda.
| Aureobasidium pullulans (de Bary & Löwenthal) G. Arnaud |
| Chaetomium sp. |
| Chloridium sp. |
| Coniochaeta ligniaria (Grev.) Cooke |
| Desmazierella acicola Lib. |
| Discosia strobilina Lib. ex Sacc. |
| Fusarium lateritium Nees |
| Herpotrichia sp. |
| Lachnum sp. |
| Leptomelanconium pinicola (Berk. & M.A. Curtis) R.S. Hunt |
| Leptostroma sp. |
| Lophodermium australe Dearn. |
| Gymnopus androsaceus (L.) Della Magg. & Trassin. |
| Meloderma desmazieri (Duby) Darker |
| Mytilinidion mytilinellum (Fr.) H. Zogg |
| Niesslia exilis (Alb. & Schwein.) G. Winter |
| Oidiodendron griseum Robak |
| Penicillium sp. |
| Periconia byssoides Pers. |
| Pestalotia stevensonii Peck |
| Pestalotiopsis funerea (Desm.) Steyaert |
| Phoma sp. |
| Preussia sp. |
| Rhinocladiella sp. |
| Rhizosphaera kalkhoffii Bubák |
| Scolecobasidium sp. |
| Septonema sp. |
| Sphaeropsis sapinea (Fr.) Dyko & B. Sutton |
Se registraron nueve especies para Pinus cembroides, de las cuales Rhizosphaera kalkhoffii, Pestalotia stevensonii y Preussia sp. fueron las más comunes en hojas adheridas. Desmazierella acicola y Discosia strobilina fueron los hongos más comúnmente encontrados en hojas en el suelo (Cuadro 5). Tokumasu et al. (1994) observaron patrones similares para Pinus sylvestris en Europa y citaron la presencia de D. acicola en hojas en el suelo.
Cuadro 5 Frecuencias absolutas de los hongos aislados.
| Pinus | P.cembroides | P. pseudostrobus | P. arizonica | ||||||
|---|---|---|---|---|---|---|---|---|---|
| A | C | S | A | C | S | A | C | S | |
| Aureobasidium pullulans | 5 | 6 | |||||||
| Chaetomium sp. | 1 | 1 | |||||||
| Chloridium sp. | 1 | 1 | |||||||
| Coniochaeta ligniaria | 1 | 1 | 3 | 7 | 7 | 4 | |||
| Desmazierella acicola | 4 | 5 | 21 | 1 | |||||
| Discosia strobilina | 1 | 12 | 6 | 1 | |||||
| Fusarium lateritium | 1 | ||||||||
| Gymnopus androsaceus | 10 | 9 | 1 | 1 | 1 | ||||
| Herpotrichia sp. | 7 | ||||||||
| Lachnum sp. | 3 | 1 | |||||||
| Leptomelanconium pinicola | 6 | 5 | 1 | ||||||
| Leptostroma sp. | 1 | ||||||||
| Lophodermium australe | 27 | 25 | 19 | ||||||
| Meloderma desmazieri | 2 | 3 | 3 | ||||||
| Mytilinidion mytilinellum | 3 | ||||||||
| Niesslia exilis | 12 | 9 | 2 | 1 | 1 | ||||
| Oidiodendron griseum | 1 | 1 | |||||||
| Penicillium sp. | 2 | 6 | 4 | ||||||
| Periconia byssoides | 8 | 7 | 3 | 1 | |||||
| Pestalotia stevensonii | 15 | 17 | 12 | 1 | |||||
| Pestalotiopsis funerea | 3 | 2 | 1 | ||||||
| Phoma sp. | 2 | ||||||||
| Preussia sp. | 14 | 19 | 6 | 2 | 6 | 2 | 5 | 2 | |
| Rhinocladiella sp. | 3 | 1 | 1 | 1 | |||||
| Rhizosphaera kalkhoffii | 18 | 14 | 2 | ||||||
| Scolecobasidium sp. | 1 | ||||||||
| Septonema sp. | 1 | ||||||||
| Sphaeropsis sapinea | 3 | ||||||||
A = Hojas adheridas; C = Hojas colgantes; S = Hojas en el suelo.
En P. pseudostrobus se identificaron 14 especies fúngicas: Lophodermium australe, Niesslia exilis y Gymnopus androsaceus fueron las más abundantes en hojas adheridas; y Lophodermium australe y Discosia strobilina en las hojas en el suelo.
En P. arizonica se registraron 18 taxones. Esta especie de pino presentó la más alta riqueza, también le correspondieron las frecuencias absolutas más bajas.
Se observaron patrones definidos para las tres especies de pinos (Figura 3). Solo Discosia strobilina y Preussia sp. fueron comunes en los pinos estudiados.
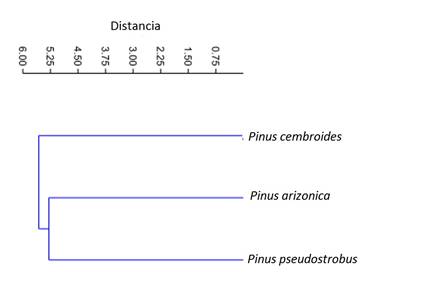
Figura 3 Análisis de conglomerados de la riqueza de hongos de las hojas en las tres especies de pinos.
La comparación de los resultados obtenidos mediante las dos técnicas empleadas, la cámara húmeda (método directo) resultó más efectiva para la determinación de las especies de hongos. Parungao et al. (2002) llegaron a conclusiones similares, en su estudio sobre diversidad de hongos en un bosque tropical. El aislamiento en medio de cultivo (método indirecto), aun cuando permitió obtener el doble de los taxones con el método directo, presentó la desventaja de que muchos cultivos no formaron estructuras reproductivas, por eso la lista de especies no identificadas fue grande (50.87 %) Este problema lo discuten Bills y Polishook (1994) y Polishook et al. (1996), quienes consignan entre 37 y 45 % de taxones no identificables. Asimismo, se definieron mejores patrones para cada especie de pino mediante la técnica de la cámara húmeda. Muchos de los taxa registrados por la técnica de la cámara húmeda no se aislaron en medio de cultivo. Un ejemplo de ello fue Desmazierella acicola, muy frecuente en las hojas muertas de Pinus cembroides; la cual, Ponge (1991) también señaló como un hongo frecuente en hojas muertas de Pinus sylvestris en el suelo. Con ambos taxones se identificaron 13 especies; de ellas, Lophodermium australe fue el hongo más abundante.
Conclusiones
La riqueza de hongos asociados a las hojas de Pinus arizonica, P. cembroides y P. pseudostrobus es alta: 57 taxones mediante el método indirecto y 28 taxones con el directo. Con el método indirecto directo se obtienen el doble de taxones que con el método indirecto, pero el número de hongos no identificables es alto (50 %). Para estimar la riqueza de hongos es necesario usar más de un método. La riqueza y abundancia de hongos es diferente en las especies de pinos y los tipos de hojas.
Las hojas muertas colgantes y las hojas muertas en el suelo presentan la mayor cantidad de colonias de hongos. Conforme avanza el grado de degradación disminuye la riqueza de hongos.











 texto em
texto em