Introducción
Los hongos de la familia Boletaceae tienen importancia ecológica y económica, son carnosos, forman micorrizas con especies de plantas de diversos grupos, particularmente con las familias Ericaceae, Fagaceae, Pinaceae, Dipterocarpaceae, Caryophyllaceae y algunas pocas especies son saprobias (Arora, 1986, 2008; Tedersoo et al., 2010; Sitta y Davoli, 2012; Dentinger y Suz, 2014; Alvarez et al., 2017).
Estos macromicetos se han estudiado, ampliamente, con métodos de taxonomía clásica y molecular en diferentes regiones del mundo (Smith and Thiers, 1971; Corner, 1972; Both 1993; Bessette et al., 2000; Muñoz, 2005; Kuo, 2013).
La recolecta y comercio de algunas especies; por ejemplo, Boletus edulis Bull., B. aereus Bull. y B. pinophilus Pilát & Demerek representan importantes ingresos tanto para recolectores, como para empresas procesadoras de varios países, entre ellos: Estados Unidos de América, Canadá, México, España, Italia, Portugal y Francia (Villarreal et al., 1995; Águeda et al., 2006, Garza et al., 2009; Agreda et al., 2010; Garza et al., 2011).
En México, se han llevado trabajos de diversidad de taxa de Boletaceae (García, 1999), y se tiene registro de 212 especies pertenecientes a 27 géneros adscritos a las familias Boletaceae, Gyroporaceae, Suillaceae, Paxillaceae, Gyrodontaceae y Boletinellaceae. La diversidad de especies de este grupo en el país es mayor, si se consideran los nuevos estudios moleculares así como la gran variedad de condiciones ecológicas, climáticas, tipos de suelo, vegetación y altitudinales existentes en el territorio nacional (García y Garza, 2000). No obstante, hay pocas investigaciones relacionadas con la obtención de cultivos o inoculación de plántulas de encino, o de pino con taxones de Boletaceae.
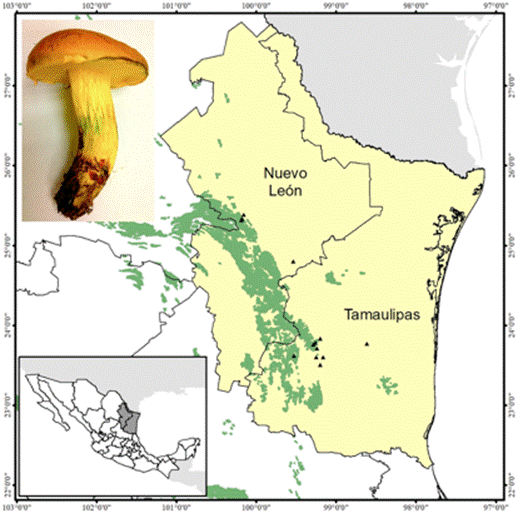
En el presente estudio se documenta el primer registro de Boletus luridellus (Murr.) Murrill para los estados de Nuevo León y Tamaulipas, asociado con Quercus fusiformis Small., Q. polymorpha Schltdl. et Cham. y Q. canbyi Trel. Asimismo, se obtiene su cultivo puro in vitro, la síntesis de micorriza y la producción de esporomas de Quercus fusiformis, en condiciones de invernadero por primera vez.
Materiales y Métodos
Recolecta de esporomas
Se recolectaron y revisaron especímenes de herbario de Boletus luridellus, el material examinado proviene de diferentes localidades de los estados de Nuevo León y Tamaulipas; de los cuales se registraron sus datos morfológicos y de color en fresco (Maerz y Paul, 1930) además de los ecológicos. Para el análisis microscópico del material se utilizó un microscopio compuesto Primo Star Carl Zeiss con micrómetro ocular, con KOH (5 %) y solución Meltzer. La identificación del material se basó en los estudios de Singer, (1986), García, (1999) y Bessette et al., (2000; 2016).
Cultivo in vitro
El aislamiento de las cepas se hizo en una campana de flujo laminar, se usaron pinzas finas estériles con las que se tomaron pequeños pedazos de tejido del contexto de esporomas jóvenes, que fueron abiertos longitudinalmente con un escalpelo estéril. Los pedazos de tejido se colocaron en varias líneas sobre el medio de cultivo sólido de Melin Norkrans, con un pH de 6.5 en cajas de Petri (Garza et al., 2014). Las cajas se incubaron a 25 oC en condiciones de oscuridad.
Con las cuatro cepas aisladas en cultivo puro, se llevó a cabo un experimento para medir, diariamente, durante mes el crecimiento radial in vitro en los medios de cultivo de Melin Norkrans y Extracto de Malta Agar. Se emplearon 10 réplicas por cada cepa y medio de cultivo (80 en total); el pH se ajustó a 6.5, el crecimiento se midió en líneas ortogonales marcadas en la base de las cajas de Petri.
Para evaluar las diferencias significativas entre la relación de medios y cepas, se hizo un análisis de varianza (ANOVA) y prueba de comparación de medias (p≤0.05), con el programa estadístico SPSS versión 2.0.
Producción de inóculo micorrícico
En la micorrización de las plántulas de encino se utilizaron las cuatro cepas de manera individual, de cada una se produjo inoculante en frascos de 500 mL de boca ancha, con vermiculita y peat moss (volumen proporcional 4:1) humedecido (70 %) con medio de cultivo líquido de Melin Norkrans modificado (Garza et al., 2014). Los frascos con el sustrato se esterilizaron a 120 oC por 40 minutos y se dejaron enfriar, para posteriormente llevar a cabo la inoculación por separado con micelio fresco obtenido de las cajas de Petri con medio sólido de Melin Norkrans.
La incubación de los frascos se llevó a cabo por cinco semanas a 25 oC en la oscuridad, y estos se agitaron semanalmente, para acelerar el proceso de colonización del sustrato.
Germinación de semillas de Quercus fusiformis
Las bellotas se obtuvieron de árboles establecidos, previamente, en los jardines de la Facultad de Ciencias Forestales de la Universidad Nacional Autónoma de Nuevo León, las cuales se esterilizaron superficialmente con H2O2 al 30 % por 15 minutos, a continuación se lavaron con agua destilada estéril en tres ciclos de 15 minutos cada uno, a fin de eliminar el exceso de peróxido. La germinación se llevó en cajas de Petri con agar agua 1.6 %, que se colocaron en la oscuridad en una incubadora Shellab LI20 a 25 oC durante una semana.
Mezcla de sustrato inoculante
El sustrato inoculante utilizado de cada cepa estuvo constituido por una mezcla de 50 % del inoculante lavado con agua destilada estéril y 50 % de suelo estéril de lobricomposta. Las bellotas estériles, germinadas por una semana se colocaron boca abajo, semienterradas en el sustrato y en grupos de 10 en cada vaso contenedor de unicel de 250 mL para un total de 100 vasos y 1 000 bellotas. Con cada cepa se inocularon 25 vasos contenedores (250 plántulas), en cuya base se hicieron cuatro perforaciones con un escalpelo estéril, para facilitar el drenaje. Enseguida se colocaron en un invernadero por seis meses (noviembre a abril), a una temperatura promedio de 26 oC y una humedad relativa de 60 %.
Porcentaje de micorrización
Para la determinación del porcentaje de micorrizas en el sistema radicular de las plantas, se llevó a cabo un muestreo al azar de 10 vasos contenedores; es decir, 100 plántulas por cepa (400 en total), de ellas se obtuvieron los sistemas radiculares completos, los cuales se lavaron en el laboratorio con agua destilada para eliminar residuos de las partículas de suelo. Con un estereomicroscopio Zeiss, Stemi 2000Ci se realizó el conteo de las puntas de las raíces con presencia de micorrizas. Se observó su morfología y se efectuaron cortes transversales finos para la observación de la red de Hartig y medición del manto fúngico al microscopio Primo Star Carl Zeiss (Brundrett et al., 1996).
Resultados y Discusión
Descripción taxonómica
Boletus luridellus (Murr.) Murrill Mycologia 30:525. 1938.
Sinonimia
Ceriomyces luridellus Murr.,Mycologia 30: 523.1938.
Ceriomyces subsensibilis Murr. Mycologia 31: 111. 1939.
Boletus subsensibilis Murr., Mycologia 31: 112. 1939.
Píleo de 36 - 105 mm de diámetro, convexo, superficie lisa a ligeramente tomentosa, de color café anaranjado o café rojizo (6E8 - 7E8 K. & W.), o café amarillento (5D7 - E7) (Maerz y Paul, 1930); lisa, víscida o tomentosa en partes, con el margen ligeramente apendiculado.
Himenóforo subadherido, tubos de 5 - 12 mm de largo, amarillo oliváceo, se manchan de azul al exponerse; poros de 0.3 - 0.7 mm de diámetro, angulares, amarillos 3C8, se manchan de azul al exponerse.
Estípite de 75 - 110 × 13 - 29 mm, subcilíndrico, con la base aguda; superficie fuertemente reticulada excepto en el tercio inferior, donde es lisa o ligeramente pruinosa, con la superficie de color amarillo, 4B6 K. & W., (Maerz y Paul, 1930), en la parte superior y rojo púrpura, café rojizo o color chedrón en su base, la reticulación es concolora con la superficie del estípite, se tiñe rápidamente de azul al tacto.
Contexto de 1.2-2.0 cm de grosor, amarillo, se mancha rápidamente de azul al exponerse, olor y sabor ligeramente ácido o dulce afrutado, en función del estado de madurez de los ejemplares. El KOH sobre el píleo reacciona de color café rojizo, con el contexto y superficie del estípite de anaranjado, con los poros de café anaranjado. El NH4OH sobre le píleo de color café obscuro, con el contexto algo ocráceo, con los poros café oliváceo obscuro, con el estípite naranja a oliváceo.
Esporas de (11.2-) 12 - 15 (-19) × 4 - 5.6 (-6.4) μm, elipsoides a fusoides, lisas, algunas con ápice subagudo o inversamente clavadas, algunas de pared gruesa de hasta 1 - 1.2 mµ., café oliváceas en KOH y café anaranjado en solución de Melzer. Esporada de color café olivaceo.
Basidios de 20 - 32 × 8 - 12.8 μm, hialinos en KOH y con contenido granuloso en solución de Melzer. Pleurocistidios de 26 - 48 × 8 - 10 μm, fusoide ventricosos de cuellos de tamaño medio y ápice subagudo hialinos o amarillento en KOH y en solución de Melzer.
Queilocistidios de 32 - 40 × 7.2 - 9 μm, fusoides a algo ventricosas de ápice subagudo, pálido amarillentas en KOH y en solución de Melzer.
Trama de los tubos del tipo bilateral, con un estrato medio de hifas algo gelatinizadas y un estrato lateral de hifas tubulosas, ambos de células hialinas en KOH y solución de Melzer y miden de 3.5 - 6 μm de diámetro.
Epicutis formado por un tricodermo de hifas entrelazadas, con elementos terminales de hifas cilíndricas, claviformes o algunas cistidioides, la mayoría con ápice redondeado, de 36 - 77 × 6.4 - 11.2 μm, con algunos elementos subglobosos a claviformes cortos entremezclados, de 26 - 32 × 10.4 - 13 μm, hialinos o pálido amarillento en KOH y anaranjados en solución de Melzer.
Superficie del estípite formada por un estrato de células cistidioides subglobosas, algunas del tipo esferocistos, claviformes o fusoide ventricosas, hialinos o amarillo pálido en KOH y en solución de Melzer, miden de 20 - 36 × 5.6 - 12.8 μm, también están presentes algunos caulobasidios tetrasterigmados hialinos a amarillo pálido en KOH y solución de Melzer, miden de 20 - 26.5 × 7.2 - 12 μm.
Hábitat
Solitario a subgregario en bosques de Quercus, principalmente, bajo Quercus fusiformis, Q. polymorpha y Q. canbyi, en altitudes de 300 a 1 600 m (Figura 1).
Distribución geográfica
La especie se distribuye desde Carolina del Norte y Florida, al sur de Texas. En México, se conoce de Nuevo León y Tamaulipas, con una posible distribución en otros estados de la región del NE de México (Figura 2).
Comestibilidad
Boletus luridellus es comestible de acuerdo con Metzler y Metzler (1992), Bessette et al., (2016). No existen antecedentes de que esta u otras especies de Boletáceos de la región noreste de México se utilicen para su consumo.
Material examinado
Nuevo León: municipio Linares, Universidad Autónoma de Nuevo León, Facultad de Ciencias Forestales. 15-X-2011, 10-X-2012; 12-X-2014; 15-10-2016; 9-X-2017. Garza 3900, 4025, 4189, 4230, 4600 (CFNL). Nuevo León: municipio Santiago, El Ranchito, 14-IX-1979, García 59 (UNL, ITCV) El Cercado, 10-X-1984, A. Moreno s/n (ITCV), Puerto Genovevo, 14-X-1979, García 63 y Marmolejo 30 (UNL, ITCV). Tamaulipas: municipio Victoria, Cañón de La Libertad, 14-IX-1991, García 7405 (ITCV); mismo municipio km 155 carretera Tula - Cd. Victoria, ejido Altas Cumbres, 15-IX-1991, García 7433; ejido Las Mulas, 13-IX-2008, García 17,468 (ITCV). Municipio Casas, km 80 carretera Cd. Victoria-Soto La Marina, 1-VII-1993, García 8530,1-X-1993; García 8751, 6-X-1993; García 8796, 27-VI-1994; García 8949 y 8951, 24-V-1997; García 10,580 y 10,586 (todos en ITCV). Municipio Victoria, 30-VIII-1998, García 11050 y 11053 (ITCV); Camino del Huizachal al Puerto Arrazolo, 29-VIII-1998, García 11002 (ITCV). Municipio Victoria, Cañón del Novillo, 21-X-1992, García 8280 (ITCV); municipio Jaumave, cerca del Rancho La Reja, 8-IX-1994, García y Martínez Ávalos 9028-D.
Prueba múltiple de medias para diferencias entre cepas
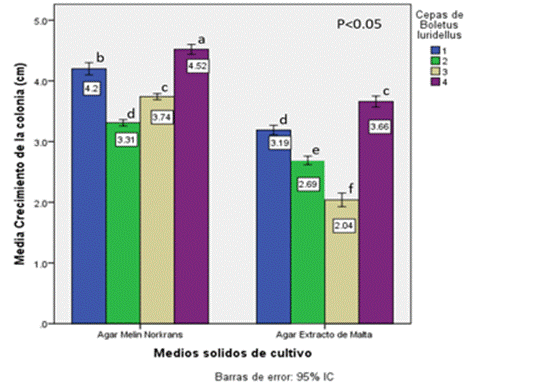
Los resultados del ANOVA muestran que existen diferencias significativas en el efecto de interacción cepa*medio, con una F del modelo, de F=482.78, una F=81.05 para el efecto de interacción cepa*medio, con valores de significancia menores a (P<0.05.). La prueba de Tukey evidenció que el tratamiento de la cepa 4 con el medio Melin Norkrans fue el mejor al presentar el mayor crecimiento de la colonia de Boletus luridellus (Figura 3). En el Cuadro 1 se muestran los resultados del análisis de la prueba de efectos entre sujetos.
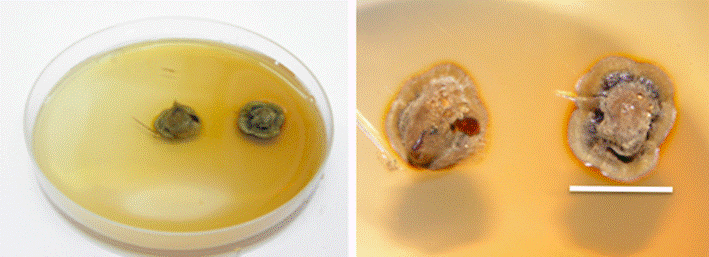
Escala 2 cm.
Figura 3 Cultivo puro de Boletus luridellus (Murr.) Murrill in vitro en medio de Melin Norkrans a los 15 días.
Cuadro 1 Prueba de efectos entre sujetos.
| Fuente | Tipo III Suma de cuadrados | Grados de libertad | Promedio de cuadrados | Valor de F | Sig. |
|---|---|---|---|---|---|
| Modelo corregido | 44.807a | 7 | 6.401 | 482.587 | 0.000 |
| Intercepción | 935.028 | 1 | 935.028 | 70 494.267 | 0.000 |
| Medio | 21.945 | 1 | 21.945 | 1 654.502 | 0.000 |
| Cepas | 19.636 | 3 | 6.545 | 493.480 | 0.000 |
| Media * Cepas | 3.225 | 3 | 1.075 | 81.057 | 0.000 |
| Error | 0.955 | 72 | 0.013 | ||
| Total | 980.790 | 80 | |||
| Total corre. | 45.762 | 79 |
aR2 = 0.979; R2 ajustada = 0.977.
Los resultados del crecimiento en cultivo puro in vitro evidencian que las cuatro cepas crecen mejor en el medio de Melin que en el Extracto de Malta. Las cepas 4, 1, 3 y 2 crecieron en promedio 3.9 cm por mes en el medio de Melin Norkrans; mientras que en el Extracto de Malta el patrón observado fue de 2.8 cm en promedio por mes. La cepa 4 tuvo un crecimiento superior en ambos medios de cultivo y las 2 y 3 registraron los valores más bajos en el medio de Melin Norkrans y Extracto de Malta, respectivamente. El crecimiento fue significativamente diferente entre las cuatro cepas y en los dos medios de cultivo utilizados (Figura 4).
Descripción de las cepas
En relación a la descripción del crecimiento del micelio in vitro, se observó que es de color café, algo brillante, libera un pigmento de color café oscuro alrededor de la colonia y el agar se tiñe de color ocre pálido en el medio de Melin Norkrans (Figura 3). La colonia tiene un crecimiento semicircular, principalmente en la superficie sobre el agar, aunque también lo presenta hacia el interior del medio, pero el micelio no penetra hasta la base del mismo. El micelio superficial, en la colonia, es compacto y apretado en el centro de la misma y en la parte más aérea es laxo o suelto.
Los márgenes de la colonia tienen un color ocre claro, mientras que su centro es más oscuro y tiene gútulas de color café oscuro, el agar se tiñe de color ocre claro en los márgenes de la colonia. Las hifas miden de 2 - 3.5 μm de diámetro, son hialinas en KOH al 10 % y amarillas en reactivo de Melzer; son lisas, se bifurcan, son septadas, tienen fíbulas pero estas no son muy abundantes, más bien son escasas, las paredes de las hifas son delgadas con un grosor de apenas 1 μm.
Producción de frutos y ectomicorrizas
Se produjeron esporomas en 75 % de los contenedores. Las micorrizas son de color café brillante, monopódicas y bifurcadas, presentaron un manto fúngico bien desarrollado, de color café y de 120 μm de grosor, con hifas compactas, sin células emergentes, es dextrinoide en reactivo de Meltzer. Se logró observar el desarrollo de la red de Hartig.
Colonización
El porcentaje de micorrización fue en promedio de 75-100 % de micorrizas en el sistema radicular. Se observó que en 25 % de las puntas de raíz había micorrizas en formación y un manto fúngico poco desarrollado (figuras 5 y 6).

Escala 1 mm
Figura 5 Micorrizas bifurcadas y micelio de Boletus luridellus (Murr.) Murrill y Quercus fusiformis Small.

Figura 6 Producción de esporomas de Boletus luridellus (Murr.) Murrill en plántulas inoculadas de Quercus fusiformis Small en invernadero a seis meses de la inoculación.
Boletus luridellus crece asociándose con Quercus virginiana, Q. fusiformis y Quercus polymorpha en Nuevo León y Tamaulipas, es probable que también se asocie a otras especies de encinos de la región noreste del país. En Estados Unidos de América se distribuye en Carolina del Norte, Sur de Florida y Oeste de Texas (Bessette et al., 2016).
Las especies de encinos mencionados se han plantado en muchas áreas urbanas y suburbanas en Nuevo León y Tamaulipas y existen también en viveros comerciales en la zona citrícola del estado de Nuevo León.
Este macromiceto es micorrícico y se ha citado en Texas por Metzler y Metzler, (1992) y Bessette et al., (2016), quienes lo señalan como comestible, de exquisito sabor. Boletus luridellus no representa un problema de toxicidad, como sucede con Scleroderma texense Berk. S. cepa Pers. que fructifican en jardines, plazas y centrosrecreativos en áreas urbanas y suburbanas de Nuevo León, donde se plantaron encinos de varias especies.
El material fúngico recolectado en Nuevo León tiene sabor ligeramente ácido en ejemplares jóvenes y algo dulce en los maduros. Es comestible y se recomienda utilizar solamente individuos jóvenes libres de larvas de insectos. En árboles inoculados a nivel de jardín se producen abundantes esporomas que llegan a pesar 1.5 a 2 kg por árbol. Los procedimientos de inoculación tendrían repercursiones positivas para reforestar con plántulas preinoculadas que posteriormente produzcan esporomas comestibles de las especies seleccionadas.
En España se inoculan in vitro plántulas de Cistus ladanifer L. (jara pringosa o ládano), de la familia Cystaceae, obtenidas a partir de cultivo de tejidos con Boletus edulis; de las cuales, y se han hecho plantaciones experimentales con muy buenos resultados en cuanto a la producción de esporomas (Agueda et al., 2006; Mediavilla et al., 2016).
Boletus luridellus fue registrada por vez primera de México por García (1999) y en este estudio se documenta el primer registro para Nuevo León.
En lo que respecta a su cultivo, no existen referencias previas para la especie. Las cepas obtenidas producen una colonia de micelio color café oscuro y tiñen el agar de color café oscuro bajo la colonia, en ambos medios utilizados, semejante a lo obtenido para Boletus luridus Schaeff. (Iotti et al., 2005). Esta característica de tinción también ocurre en otros cultivos de macromicetos, obtenidos por el primer autor como: Suillus lakei (Murr.) A.H. Sm. & Thiers y Suillus granulatus (L.) Russell o Exudoporus frostii (J.L. Russell) Vizzini, Simonini & Gelardi; además de otras especies como Pisolithus arhizus (Scop) Rasuchert. Diaz et al. (2009) estudiaron algunas especies de Boletaceos in vitro y lograron producir pequeños primordios, aunque no llevaron a cabo experimentos en invernadero para producir esporomas. Pantidou (1961, 1962) así los obtuvo in vitro del hongo saprobio, Phlebopus sulphureus (Quél.) Singer y P. lignicola (Kallenb.) M.M. Moser ex Groves. Chung et al. (2010) inocularon plántulas de Pinus radiata D.Don con Boletus edulis Bull. y B. pinicola (Vittad.) Vassilkov, C.R. en Chile, determinaron que las micorrizas persistieron en el campo después de 24 meses y las plántulas tuvieron mejores respuestas de crecimiento que las no inoculadas.
Conclusiones
Se obtuvo en cultivo puro varias cepas de Boletus luridellus y estas se reprodujeron para inocular plántulas de Quercus fusiformis. Las plantas inoculadas produjeron esporomas en contenedores bajo condiciones de invernadero. Este es el primer estudio que se realiza con este enfoque para Boletus luridellus y corresponde a su primer registro en Nuevo León, México.











 texto en
texto en