Introducción
El estudio de las zonas áridas y semiáridas es un tema importante en la actualidad, debido a que en este tipo de regiones existen condiciones adversas para la producción y supervivencia de especies forestales existentes, a consecuencia de la sequía severa prolongada (García et al., 2005).
En estos lugares, el agua es uno de los factores más importantes que influyen en la distribución, crecimiento y desarrollo de la vegetación y es esencial para todos los procesos vitales como la fotosíntesis y la respiración. Funciona como un medio para la absorción de los nutrientes y metabolismo de las plantas. La célula vegetal requiere de 85 a 90% de agua para mantener una dinámica vital y realizar los procesos enzimáticos en una célula vegetal. Una disminución en el contenido de agua por debajo de este nivel reduce la actividad metabólica de las células y el crecimiento de las plantas (Maiti et al., 2016); durante esta condición, las células permanecen más pequeñas y las hojas tienen menor tamaño y, en consecuencia, repercute en el área foliar fotosintéticamente activa (Parra et al., 1999). Además, en tal estado, la actividad hidrolítica de las enzimas aumenta considerablemente, el transporte de los iones disminuye y la respiración, por lo general, aumenta (Salisbury y Ross, 2000).
Bajo estas condiciones, las plantas han generado diferentes respuestas y adaptaciones que les permiten sobrevivir en condiciones de constante déficit hídrico (Nilsen y Orcutt, 1996). Muchas de estas se relacionan con una mayor capacidad de absorber agua o con un uso más eficiente de este recurso. Algunas plantas han ajustado procesos como el metabolismo C4 y el del metabolismo ácido de las crasuláceas o CAM, que les permiten adaptarse a ambientes más áridos (Black y Osmond, 2003; Lüttge, 2004) y afrontar con éxito largos periodos de escasez de agua y la colonización de un medio adverso.
Cuando el déficit hídrico se desarrolla lentamente, las plantas pueden presentar respuestas de aclimatación que tienen efectos sobre el crecimiento, como la disminución de la expansión foliar y el aumento del crecimiento radicular (Potters et al., 2007; Shao et al., 2008). Otro mecanismo de resistencia a nivel fisiológico es el cierre de estomas, estructuras responsables de la mayor proporción de pérdida de agua en las plantas (Taiz y Zeiger, 2006). Esta respuesta está mediada por la hormona ácido abscísico (ABA) (Abe et al., 1997; Kang et al., 2002).
Dado que el estrés hídrico es el factor más limitante en la región noreste de México, el presente trabajo se enfocó en estudiar cómo los potenciales hídricos estacionales de especies de árboles nativos están relacionados con la disponibilidad de agua del suelo y los componentes de la demanda evaporativa (temperatura, humedad relativa y precipitación). El estudio de especies nativas en esta región brinda la oportunidad de indagar, desde una perspectiva ecofisiológica, la respuesta de las especies arbustivas a los cambios en la disponibilidad de recursos, en este caso, el contenido de humedad del suelo, para comprender mejor cómo dicho ecosistema puede sostener la productividad de la biomasa. Por tanto, como un enfoque para comprender cómo los potenciales hídricos del xilema de las plantas se relacionan con las condiciones ambientales, se realizó una investigación en cuatro especies de plantas nativas para describir las respuestas adaptativas ante la escasez del recurso hídrico. La aplicación de los resultados puede traducirse en un mejor manejo de cada especie, con una mayor probabilidad de éxito en futuros programas de producción de plantas y reforestación con especies nativas tolerantes a estrés por el déficit hídrico.
Materiales y Métodos
Sitio de estudio
Este estudio se llevó a cabo en la Estación de Investigación Experimental de la Facultad de Ciencias Forestales de la Universidad Autónoma de Nuevo León (24°47' N; 99°32' O, 350 msnm) en el municipio Linares, Nuevo León, México (Figura 1). El clima es subtropical y semiárido con un verano cálido. La temperatura media mensual del aire varía de 14.7 °C en enero a 22.3 °C en agosto. La precipitación promedio anual es de aproximadamente 800 mm (González et al., 2004). Los suelos son predominantemente de color gris oscuro, vertisoles de textura arcillo-limosa, con montmorillonita, la cual se expande y contrae notablemente conforme varía el contenido de humedad del suelo (González et al., 2004).
Material vegetal y medición del potencial hídrico del xilema
Se seleccionaron cuatro especies de arbustos co-existentes, representativas de la comunidad de plantas nativas y de valor nutricional para el ganado doméstico (Domínguez et al., 2014) y de usos múltiples como la madera, el carbón y la estantería: Condalia hookeri M.C. Johnst. (Rhamnaceae), Cordia boissieri A.DC. (Boraginaceae), Prosopis laevigata (Humb. et Bonpl. ex Willd.) M.C. Johnst. (Fabaceae) y Celtis pallida Torr. (Ulmaceae). Se eligieron aleatoriamente cinco individuos de cada especie dentro una parcela del matorral sin disturbio de 20 m × 20 m, previamente delimitada.
Las mediciones del potencial hídrico (Ψ) se realizaron en ramillas terminales de aproximadamente 10 cm de longitud con hojas y <1 cm de diámetro, a intervalos de 15 días (entre el 21 de febrero y el 30 de junio de 2017), a las 06:00 h y a las 14:00 h. La condición hídrica de las especies se evaluó con base en la tensión del xilema (Taiz y Zeiger, 1991), la cual es aproximadamente equivalente al potencial hídrico foliar (Ψ) usando la cámara de presión de Scholander (Modelo 3005, Soil Moisture Equipment). La presión suministrada a la cámara fue a una tasa de 0.05 MPa·s-1 y usando gas nitrógeno (N2) como fuente de presurización (Ritchie y Hinckley, 1975). Dichas mediciones se efectuaron entre 15 y 25 segundos después de recolectar las muestras del tejido vegetal. Este método consiste en aplicar una presión neumática positiva al tejido para aumentar su potencial. Ésta se aplica hasta producir exudación del agua del tejido en la superficie escindida de la ramilla. En el momento de conseguir la exudación, se considera que la presión en el xilema es igual a la presión atmosférica y el valor aplicado será el negativo del potencial del tejido (Muraoka y Tzi, 2000). Por razones de seguridad y por instrucciones de operación, el límite inferior de la cámara de presión fue de -7.3 MPa.
Variables ambientales
Las variables ambientales como la temperatura del aire (ºC) y la humedad relativa (%) se registraron diariamente con sensores automatizados tipo HOBO Pro (HOBO Pro Temp/RH Series). La cantidad diaria de precipitación (mm) se obtuvo con un medidor de lluvia tipo “tipping bucket” (Forestry Suppliers, Inc.). Adicionalmente, en cada fecha de muestreo, se estimó el contenido gravimétrico de humedad del suelo (kg·H2O·kg-1 suelo; base seca) de cuatro muestras extraídas a diferentes profundidades de 0-10, 10-20, 20-30, 30-40 y 40-50 cm mediante una barrena de diseño Veihmeyer (Modelo 215, Soil Moisture Equipment Corp.). Cada muestra se depositó en crisoles de metal. Para la determinación de este contenido, las muestras fueron pesadas inmediatamente para obtener el peso húmedo (Psh), posteriormente se colocaron en una estufa de aire forzado a 105 °C durante 24 horas hasta alcanzar peso seco constante (Pss). El contenido gravimétrico de humedad del suelo se determinó con la siguiente ecuación (Gardner, 1986):
Donde:
W = Contenido de humedad gravimétrica expresada en kg·H2O·kg-1 suelo
Psh = Peso de suelo húmedo (g)
Pss = Peso de suelo seco (g), secado en estufa a 105 °C
Análisis estadísticos
Dado que los datos del potencial hídrico del xilema (06:00 h y 14:00 h) y del contenido de agua en el suelo no se distribuyeron normalmente (prueba de Kolmogorov-Smirnov) y los análisis de la varianza no mostraron homogeneidad para la mayoría de las fechas de muestreo (prueba de Levene), los datos fueron sometidos a la prueba no-paramétrica de Kruskal-Wallis (Ott, 1993). Las relaciones entre los potenciales hídricos (a las 06:00 h y 14:00 h) y las variables ambientales se determinaron mediante el análisis de correlación de Spearman o por rangos, ya que la hipótesis nula de normalidad fue rechazada a P<0.05. Todos los métodos estadísticos aplicados se llevaron de acuerdo con el programa SPSS (por sus siglas en inglés, Statistical Package for the Social Sciences), versión estándar 13.0 para Windows (SPSS, 2000).
Resultados y Discusión
La temperatura del aire, la humedad relativa y la precipitación registrada 15 días antes de cada fecha de muestreo durante el período experimental se muestran en el Cuadro 1.
Cuadro 1 Temperatura del aire (°C), humedad relativa (%) y precipitación (mm) registrada 15 días antes de cada fecha de muestreo.
| Fecha de muestreo | 06:00 h | 14:00 h | Precipitación (mm) | ||
|---|---|---|---|---|---|
| Temp. (°C) | HR (%) | Temp. (°C) | HR (%) | ||
| 21 de febrero | 8.7 | 78.3 | 31.3 | 11.2 | 1.5 |
| 07 de marzo | 19.6 | 92.2 | 31.1 | 48.3 | 17.0 |
| 22 de marzo | 19.2 | 91.5 | 31.1 | 45.7 | 44.0 |
| 04 de abril | 19.3 | 49.5 | 35.2 | 25.7 | 0.4 |
| 18 de abril | 16.6 | 96.4 | 30.5 | 45.0 | 38.2 |
| 02 de mayo | 16.0 | 79.6 | 36.5 | 28.8 | 2.0 |
| 17 de mayo | 25.2 | 86.5 | 38.2 | 36.2 | 10.8 |
| 02 de junio | 23.4 | 89.9 | 32.5 | 57.0 | 152.4 |
| 14 de junio | 23.3 | 92.7 | 35.6 | 51.4 | 10.0 |
| 30 de junio | 24.9 | 91.4 | 35.5 | 53.9 | 63.6 |
Temp. = Temperatura; HR = Humedad relativa.
La precipitación acumulada registrada durante el período de estudio fue de 340 mm. El máximo pico de precipitación ocurrió el 02-Junio con 152 mm y la precipitación mínima se registró el 04-Abril con 0.4 mm. El contenido estacional de humedad del suelo, a diferentes profundidades de la capa del suelo, mostró una respuesta típica con los eventos de lluvia. Se detectaron diferencias significativas (P<0.022 y P<0.026) en el contenido de humedad del suelo entre las capas de suelo para las fechas de muestreo del 22 de marzo y el 18 de abril, respectivamente (Figura 2). Durante el período más seco, 2 de mayo, el contenido de humedad del suelo fue de alrededor de 0.10 kg kg-1, mientras que, durante el período más húmedo, 02 de junio, el contenido de humedad del suelo varió de 0.21 kg kg-1 (profundidad 0-10 cm) a 0.16 kg kg-1 (profundidad 40-50 cm) y coincide con el pico de mayor precipitación. El contenido gravimétrico de humedad del suelo a la profundidad de 0-10 cm fue más sensible a los eventos de lluvia que las capas más profundas. Sin embargo, dado que hubo una gran variabilidad en las precipitaciones y la temperatura del aire, el contenido de agua del suelo no pudo controlarse y mantenerse y, por tanto, la humedad del suelo puede no estar disponible para la absorción en raíces profundas debido a la baja tasa de infiltración.
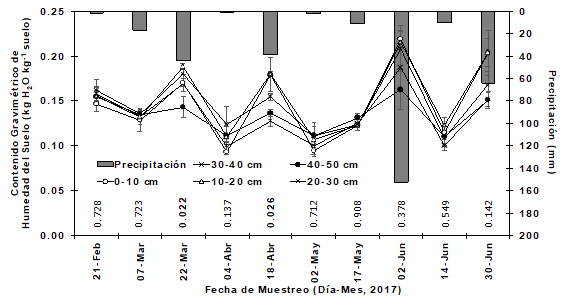
El valor P se muestra en cada fecha de muestreo dentro de la gráfica. Cada valor representa la media ± error estándar (n = 4). Se incluye la precipitación acumulada (mm) durante 15 días antes de cada fecha de muestreo.
Figura 2 Patrón estacional en el contenido gravimétrico de humedad del suelo a cinco profundidades.
Las respuestas del contenido de agua del suelo en el presente trabajo concuerda con otros estudios que han demostrado la variabilidad estacional de la humedad del sustrato en los ecosistemas áridos y de pastizales mediterráneos (Anderson et al., 2001; Bussotti et al., 2002; González et al., 2000; López-Hernández et al., 2010; González-Rodríguez et al., 2016). Las condiciones ambientales erráticas y secas que se observaron durante la mayor parte del periodo experimental podrían estar relacionadas con frecuentes temporadas de condiciones ambientales extremas tales como sequías, típicas de la región noreste de México (González et al., 2000, 2004).
La variación estacional del potencial hídrico del xilema a las 06:00 h y 14:00 h en las cuatro especies de plantas se muestra en la Figura 3. A las 06:00 h, los valores fueron significativamente diferentes (P<0.05) entre las cuatro especies en todas las fechas de muestreo (Figura 3a). En el período más húmedo (2 de junio), los más altos en el potencial hídrico a la misma hora (-0.67 MPa y -0.76 MPa) fueron registrados en C. pallida y C. boissieri, respectivamente, que son superiores a -0.96 MPa observado en P. laevigata y a -0.93 MPa en C. hookeri.

El valor de P se muestra en cada fecha de muestreo. Cada valor representa la media ± error estándar (n = 5).
Figura 3 Potencial hídrico de xilema a las 06:00 h y 14:00 h en cuatro especies de plantas nativas.
Por el contrario, en el período más seco (2 de mayo), cuando las especies arbustivas enfrentaron un severo estrés hídrico, el valor más destacado (-1.52 MPa) en el potencial a las 06:00 h se registró en P. laevigata, mientras que el más bajo (-2.92 MPa) se detectó en C. hookeri, lo que sugiere que esta última especie es más sensible a la falta de agua.
Se puede inferir que la recuperación de los valores de inicio de respuesta en el potencial hídrico a las 06:00 h en las cuatro especies arbustivas para las fechas de muestreo del 2 de junio al 30 de junio está relacionada, principalmente, con los eventos de precipitación (Cuadro 1).
Con respecto al mismo potencial a las 14:00 h, se identificaron diferencias significativas (P<0.05) entre las especies nativas en siete de diez fechas de muestreo (Figura 3b). En la más húmeda (2 de junio), cuando el potencial hídrico a la hora indicada fue el más alto y cuando el contenido de agua del suelo en la capa 0-50 cm fue superior 0.20 kg kg-1 (20 %) (Figura 2), C. pallida registró el mayor valor (-1.07 MPa), mientras que C. hookeri el mínimo (-1.78 MPa); en cambio, en la fecha de muestreo más seca (2 de mayo), cuando el contenido promedio de agua en el suelo fue de 0.10 kg kg-1 (10 %), los valores en el potencial hídrico a las 14:00 h variaron de -1.76 MPa (C. pallida) a -3.10 MPa (C. hookeri). Resultados similares han sido documentados por González y Cantú (2001); López-Hernández et al. (2010); González et al. (2011) González-Rodríguez et al. (2011); y González-Rodríguez et al. (2016); Adhikari y White (2014) quienes estudiaron la adaptación de los arbustos nativos al estrés por sequía.
Para las fechas de muestreo entre 2 de marzo y el 17 de mayo, cuando el contenido promedio de humedad en el suelo fue de aproximadamente 0.12 kg kg-1, se encontró una respuesta inusual, en el potencial hídrico a las 14:00 h en particular en C. hookeri y C. pallida, para las cuales el potencial hídrico registrado en el horario vespertino fue más alto que el matutino. De hecho, el desequilibrio entre el contenido de humedad del suelo (o potencial hídrico del suelo) antes del amanecer y el potencial hídrico del tejido vegetal (hoja y xilema) ha sido consignado en diversas plantas mesófitas y xerofitas (Donovan et al., 2003).
Entre los posibles factores responsables de este desequilibrio se considera la resistencia hidráulica al continuo suelo-planta (Myers y Neales, 1984), el tamaño más pequeño de la planta (Brown y Archer, 1990); la heterogeneidad de humedad del suelo (Ourcival et al., 1994); la reducción del potencial hídrico de las células debido al crecimiento nocturno (Boyer, 1995); el bajo potencial osmótico (Berger et al., 1996), estomas abiertos y transpiración durante la noche (Donovan et al., 2003; Bucci et al., 2004; Howard et al., 2009). Además, se supone que la transpiración nocturna y el levantamiento hidráulico benefician la absorción de nutrientes de las plantas bajo condiciones de sequía (Matzner y Richards, 1996; Sellin, 1999; Donovan et al., 2003).
Estas observaciones son consistentes con los resultados obtenidos en el presente trabajo, pero en el contexto de las determinaciones del potencial hídrico de la planta ya que los procesos anteriormente mencionados no se llevaron a cabo en este trabajo.
A excepción de C. hookeri, en las profundidades 0-10 cm (0.705) y 10-20 cm (0.717), el potencial hídrico a las 06:00 h de todas las especies arbustivas estudiadas no mostró una correlación significativa (P>0.05) con el contenido de humedad del suelo para cada profundidad del mismo. En cambio, los valores del potencial hídrico a las 06:00 h se correlacionaron de manera significativa y positiva con los de las 14:00 h; los valores fluctuaron de 0.867 en C. pallida, a 0.900 en C. boissieri. En cuanto a la precipitación, todas las especies manifestaron una relación positiva y significativa (Cuadro 2); los valores fluctuaron de 0.697 (C. pallida) a 0.894 (C. hookeri).
Cuadro 2 Coeficientes de correlación de Spearman (n=10) y valor P entre el potencial hídrico a las 06:00 h con el potencial hídrico a las 14:00 h, contenidos de humedad gravimétrica a diferentes profundidades y precipitación recibida 15 días antes del muestreo durante el periodo de estudio en cuatro especies arbustivas.
| Especie | Potencial hídrico (14:00 h) | Contenido de humedad gravimétrica (kg H2O·kg-1 suelo seco) en el suelo a diferentes profundidades (cm) |
Precipitación | ||||
|---|---|---|---|---|---|---|---|
| 0-10 | 10-20 | 20-30 | 30-40 | 40-50 | |||
| C. hookeri | 0.893** | 0.705* | 0.717* | 0.474ns | 0.395ns | 0.377ns | 0.894** |
| C. boissieri | 0.900** | 0.371ns | 0.395ns | 0.182ns | 0.085ns | 0.036ns | 0.711* |
| P. laevigata | 0.220ns | 0.480ns | 0.480ns | 0.286ns | 0.152ns | 0.176ns | 0.766** |
| C. pallida | 0.867** | 0.503ns | 0.503ns | 0.309ns | 0.164ns | 0.212ns | 0.697* |
Diferencia altamente significativa (**P≤0.01); Diferencia significativa (*P≤0.05); ns = Diferencia no significativa (P>0.05).
Durante el transcurso del estudio y de acuerdo con los datos del potencial hídrico, las cuatro diferentes especies de plantas enfrentaron períodos de sequía de leves a severos; P. laevigata y C. pallida mostraron valores de potenciales hídricos mayores tanto a las 06:00 h como a las 14:00 h, en comparación con las otras especies, lo que indica una regulación isohídrica y probablemente una mejor adaptación a condiciones severas de sequía (Breshears et al., 2009). Parece ser que P. laevigata y C. pallida son ejemplos de especies arbustivas que se han adaptado a la baja disponibilidad hídrica del suelo, ya que tienden a mantener una humectación de los tejidos, mientras que la adaptación de C. hookeri y C. boissieri en los periodos secos parece depender de las estrategias que les permitan hacer frente a la desecación interna y, en consecuencia, presentan valores más bajos en los potenciales hídricos (Gebrekirstos et al., 2006).
El estudio sugiere que las dos primeras especies pueden servir como modelo para evaluar las estrategias de adaptación a la sequía en especies vegetales con alto potencial hídrico, mientras que las últimas funcionarían como un modelo adecuado para estudiar la adaptación de la planta a la sequía con un potencial bajo. Además, P. laevigata es la especie que en condiciones de estrés por sequía tiende a lograr y mantener significativamente un mayor potencial.
A pesar de sus diferentes capacidades para resistir un intervalo más amplio de disponibilidad de agua, todas las especies investigadas se consideran candidatas idóneas para la restauración y conservación continua de sitios propensos a la sequía. Por tanto, se puede recomendar una combinación de P. laevigata y C. pallida con otras especies nativas tolerantes a la sequía para reforestación, con el fin de prevenir la erosión del suelo y mantener, de manera sostenible, la cobertura vegetal de los ecosistemas de matorral.
Con base en el desarrollo incierto de las variables climáticas y la gama de respuestas al estrés hídrico de la especie, mantener la diversidad actual del matorral espinoso tamaulipeco puede ser difícil en el futuro. De hecho, el crecimiento de la planta y la supervivencia en campo dependen en gran medida de una interacción compleja de numerosos factores ambientales y mecanismos internos de la planta. Por tanto, la evaluación de la variabilidad del estado hídrico del xilema en arbustos nativos de los matorrales del noreste de México adaptados a la sequía, representa un paso importante en la evaluación de algunas características ecofisiológicas de las plantas para los estudios de estrés hídrico.
Conclusiones
Las implicaciones de este estudio mostraron que las especies P. laevigata y C. pallida registraron los valores más altos del potencial hídrico del xilema a las 06:00 h y a las 14:00 h, bajo condiciones de estrés hídrico, por lo que estas especies se consideran como tolerantes a la sequía; en cambio, C. hookeri y C. boissieri, que registraron valores inferiores, menores, serían susceptibles al déficit hídrico, y por tanto, estarán en una situación de desventaja fisiológica en condiciones de escasez de agua.
El decremento gradual en el potencial hídrico xilemático a las horas definidas para las cuatro especies arbustivas dio una notable respuesta a las tendencias del contenido de agua del suelo y a la precipitación. La temperatura del aire influyó negativamente en los valores del potencial hídrico del xilema en todas las especies. En cambio, los valores del potencial hídrico del xilema se acrecentaron conforme el contenido de agua del suelo y la humedad relativa aumentan.
Con esta clase de estudios se hace posible identificar y conocer los patrones de absorción y requerimientos hídricos entre las especies arbustivas y entender los procesos de sucesión vegetal. Con base en ello, se podrán seleccionar las especies tolerantes a la sequía, que pueden ser utilizadas en la recuperación productiva de los ecosistemas áridos y semiáridos, de tal manera que la reforestación con ellas generen condiciones favorables para la recuperación natural de los ecosistemas de este tipo.











 texto em
texto em