Introducción
El sector ganadero está creciendo muy rápido en los trópicos con consecuencias ambientales negativas como la deforestación, la pérdida de la biodiversidad, la degradación de suelo y las emisiones de gases de efecto invernadero (Miles y Kapos, 2008; Liu et al., 2015). De 1960 a 2010, las emisiones mundiales de gases de efecto invernadero (GEI) del sector pecuario aumentaron 51 % a nivel mundial y 117 % en los países en desarrollo (Caro et al., 2014). Las emisiones de CH4 por la fermentación entérica y las emisiones de CO2 derivadas de la conversión de tierras forestales a de pastoreo se han considerado como las principales fuentes de GEI dentro del sector ganadero (O'Mara et al., 2011; Gerber et al., 2013; Opio et al., 2013).
El principal cambio de uso de suelo en México ha sido la deforestación de bosques para establecer pasturas para la ganadería, y en la actualidad siguen incrementándose dichas áreas (De Jong et al., 2010). Chiapas es una de las entidades con mayor biodiversidad y recursos naturales; sin embargo, estos últimos han experimentado una enorme reducción y degradación en años recientes (González-Espinosa et al., 2009). El cambio severo de uso de suelo y fragmentación de la vegetación original ha causado la pérdida de más de 50 % de la superficie forestal en el estado (De Jong et al., 1999; Ochoa-Gaona et al., 2004; Flamenco-Sandoval et al., 2007; Rocha-Loreda et al., 2010; Nahed-Toral et al. 2013). Según el inventario estatal de GEI, 77 % de las emisiones totales proviene del cambio de uso de suelo, la agricultura y la ganadería. La mayor parte de esas emisiones se atribuyen a las actividades ganaderas del estado (PACCCH, 2007).
Esto hace que sea urgente tomar medidas a escala tanto local como regional, para buscar estrategias de mitigación de las emisiones de GEI en sistemas de producción ganadera y restaurar la funcionalidad de los ecosistemas a largo plazo. Las áreas boscosas y sistemas silvopastoriles dentro de los ranchos tienen la capacidad de almacenar carbono, por lo que pueden servir como alternativas para la mitigación de los gases de efecto invernadero y par la conservación de la biodiversidad (Lamb et al., 2016; Pompa-García et al., 2017a).
La sustentabilidad de un sistema de producción agropecuaria y forestal depende, en gran medida, de su capacidad de provisión de servicios ecosistémicos (Chazdon, 2008; Balvanera, 2012; Casanova et al., 2016). En el contexto actual de cambio de uso de suelo, de la ganaderización, y de la emisiones de gases de efecto invernadero (Torres-Rivera et al., 2011; Trilleras et al., 2015; Kauffman et al., 2016) es imperativo encontrar las alternativas que podrían contribuir a mitigar las emisiones y mejorar las capacidades de provisión de servicios ecosistémicos a nivel de las unidades de producción (Lamb et al., 2016). La captura de CO2 atmosférico, el reciclaje de nutrientes, la regulación de ciclo hidrológico y la conservación de biodiversidad son algunos de los servicios ecosistémicos que los productores podrían apreciar de las áreas forestales y agroforestales dentro de una unidad de producción ganadera (Balvanera, 2012).
Sin embargo, el potencial de almacenamiento de carbono y la diversidad arbórea de las áreas forestales presentes dentro de un sistema de producción ganadera no se ha estudiado con mayor cabalidad en México. Se carece de datos específicos sobre la contribución de las actividades forestales en la mitigación de los GEI a escala de la unidad de producción. Es de gran importancia conocer los acervos de carbono, la diversidad florística que estos sistemas reúnen y el potencial de captura de CO2 de los terrenos forestales para reducir los impactos ambientales del sector pecuario.
El objetivo del presente estudio fue evaluar la diversidad arbórea y el potencial de almacenamiento de carbono en biomasa viva área, biomasa viva subterránea, mantillo, madera muerta y carbono orgánico del suelo en las áreas forestales de un rancho ganadero en el municipio Villaflores, Chiapas, México. Se plantearon las siguientes hipótesis: el carbono almacenado en biomasa y en suelo es mayor en áreas forestales que en potreros; las áreas forestales presentes dentro de la unidad de producción pecuaria contribuyen positivamente a la conservación de la biodiversidad.
Materiales y Métodos
Área de estudio
El estudio se realizó en un sistema ganadero de producción ubicado en el municipio Villaflores, Chiapas (Figura 1). El clima dominante de la región es cálido subhúmedo, con lluvias en verano y humedad media. Los sitios de muestreo se ubican entre los 16°23´57.63” N y 93°11´50.91” O, a 847 msnm, con una precipitación pluvial de 1 200 - 1 500 mm, con un periodo lluvioso de cinco meses. El tipo de suelo predominante es Leptosol. En la región predomina el bosque tropical subcaducifolio, con mayor abundancia de especies como Quercus rugosa Née, Acacia collinsii Saff., Bursera simaruba (L.) Sarg., Enterolobium cyclocarpus (Jacq.) Griseb. y Guazuma ulmifolia Lam.
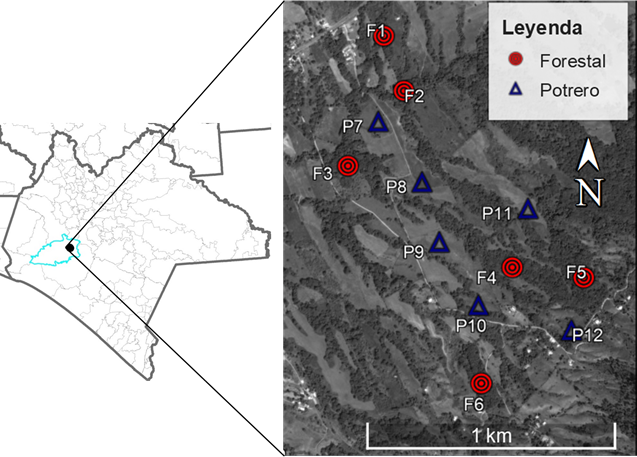
Fuente: Elaborado con mapas de INEGI (2012) y Google Earth (2015).
Los sitios de F1 a F6 representan áreas forestales y de P7 a P12, áreas de potreros.
Figura 1 Localización de los puntos de muestreo dentro del municipio Villaflores, Chiapas, México.
El área de estudio tiene una superficie total de 62.5 ha, de las cuales el área boscosa abarca 39.5 % (24.54 ha), 40 % son áreas de potrero y el resto tiene otros usos como agricultura de temporal, huertos frutales e infraestructura urbana (edificios). En la Figura 1, se esquematiza la distribución de las parcelas de muestreo de carbono en áreas forestales y potreros.
Establecimiento de parcelas y cuantificación de biomasa viva
El levantamiento de las muestras se realizó en las áreas forestales y de potreros del rancho ganadero Los Flamboyanes. Se hicieron recorridos de campo en las áreas forestales del rancho mediante los cuales se definieron 12 parcelas en total, seis de bosque que no tuvieran cruces de caminos, ni presencia de disturbio antrópico y otras seis en potreros, con o sin árboles. Posteriormente, se hizo otra captura sistemática de datos, adaptada a la metodología del Inventario Nacional Forestal y de Suelo (INFyS) (Conafor, 2005).
Se establecieron parcelas rectangulares de 40 × 25 m (1 000 m2), con una distancia mínima de 200 m entre ellas. Bajo el principio de parcelas anidadas, se registraron todos los árboles con un DAP (1.30 m del nivel del suelo) mínimo de 2.5 cm en una superficie de 500 m2, y árboles con un DAP de 10 cm en adelante en 1 000 m2.
Las alturas totales de los árboles se midieron con un palo de bambú graduado y se corroboraron las mediciones con el clinómetro. Para determinar la dominancia de las principales especies identificadas en el área de muestreo, se calculó la sumatoria del área basal en m2 de cada una de las especies por hectárea.
Para el área basal, se utilizó la siguiente fórmula:
Donde:
AB = Área basal del árbol
ϖ = Constante (pi)
DAP = Diámetro del árbol a la altura del pecho
La biomasa área de los árboles se cuantificó mediante la ecuación propuesta por Cairns et al. (2003) con la corrección de densidad de madera de cada especie. A fin de evaluar el ajuste con los datos y hacer la comparación en la cantidad de biomasa entre dos ecuaciones, se utilizó la ecuación de Chave et al. (2015).
Donde:
BA = Biomasa aérea
DAP = Diámetro del árbol a la altura del pecho
AT = Altura total del árbol
P = Densidad de madera
Pm = Densidad de la madera de las especies utilizadas para generar el modelo
Para calcular la biomasa de raíces se utilizó la siguiente fórmula (Cairns et al., 1997):
Donde:
BR = Biomasa de raíces
BA = Biomasa aérea
La biomasa de la vegetación asociada (hierbas, arbustos y árboles <2.5 cm de DAP) se cuantificó a partir de cuatro muestras al azar en un cuadrante de 1 × 1 m en cada parcela. Las muestras fueron secadas en el horno RIOSSA HCF-125 a 70 oC hasta 72 horas para obtener el peso seco de la biomasa. Posteriormente, se procedió a cuantificar el carbono, por medio de la fracción de carbono en la biomasa (47 %), se extrapoló a Mg C ha-1 (Aryal et al., 2014; Fonseca et al., 2011; Pompa-García y Sigala, 2017). Para calcular Mg de C ha-1 con los datos de carbono por árbol, se utilizó la siguiente formula:
Mantillo y madera muerta
Se tomaron cuatro muestras, completamente al azar, por parcela en un cuadrante de 50 × 50 cm. Las muestras de mantillo fueron recolectadas por separado en tres estados de descomposición: fresca (Oi), fragmentada y en proceso de descomposición (Oe) y descompuestas o humus (Oa). El material se procesó en el laboratorio de la Facultad de Ciencias Agronómicas Campus V, de la Universidad Autónoma de Chiapas, donde se determinó el peso seco de las muestras (g m-2). Después se obtuvo la cantidad de carbono (Mg ha-1) al multiplicarlo por la fracción de carbono según su estado de descomposición: Oi (39 %), Oe (36 %), Oa (27 %), propuesto por Orihuela-Belmonte et al. (2013).
La madera muerta en cada parcela, se midió en cuatro transectos de 25 m, donde se tomaron los diámetros de 2.5 cm en adelante en los primeros 10 m, y 5 cm en adelante en los 15 m restantes. Se clasificaron en tres estados de descomposición: fuerte, intermedio y descompuesto, ya que la densidad de madera varía según su estado de descomposición. El volumen de madera de cada uno de ellos se calculó con la siguiente fórmula:
Donde:
V = Volumen de madera muerta (m3 ha-1)
L = Longitud de la línea de muestreo (m)
di = Diámetros de madera muerta en la intersección (cm)
El volumen de madera se multiplicó por la densidad de madera según su estado de descomposición: fuerte (78 %), intermedio (62 %) y descompuesto (27 %) para cuantificar su peso seco (Eaton y Lawrence, 2006). El contenido de carbono de la biomasa de madera muerta fue calculado con la fracción de carbono (47 %) propuesto por Fonseca et al. (2011).
Carbono orgánico del suelo
Se tomaron en cada parcela cuatro muestras de suelo al azar a una profundidad de 15 cm, con un nucleador (AMS) de 5 cm de diámetro interno para cuantificar la densidad aparente del suelo y otras cuatro muestras para el análisis químico. Las muestras para densidad aparente se procesaron en el laboratorio, donde se obtuvo el peso seco (105 °C, 72 h), y con el dato del volumen de cilindro se calculó la densidad aparente (g cm-3). El contenido de materia orgánica, pH y conductividad eléctrica fueron analizada en el laboratorio de la Facultad de Ciencias Agronómicas Campus V, de la Universidad Autónoma de Chiapas. Con los datos de contenido de carbono (%), densidad aparente (g cm-3) y la fracción gruesa (% de rocas y raíces), se calculó el almacenamiento de carbono orgánico en suelo (Mg C ha-1), con la siguiente ecuación:
Donde:
CC = Contenido de carbono en las muestras de suelo (%)
DA = Densidad aparente de suelo (Mg m-3 o g cm-3), corregido de fracciones gruesas
PS = Profundidad de suelo muestreado (m)
Análisis de datos
Para calcular la abundancia de cada especie de árboles, se usó el número de individuos registrados dentro del área de muestreo y se extrapoló a individuos por hectárea, en dos clases diamétricas (<10 cm DAP y ≥10 cm DAP). Las especies con mayor abundancia relativa (%) fueron consideradas como las más abundantes. La dominancia se determinó considerando la suma de las áreas basales por hectárea (m2 ha-1) y su contribución relativa en área basal total. La comparación de contenido de carbono en cada reservorio entre área forestal y la de potreros, fue analizado mediante el ANOVA de una vía (p<0.05). Posteriormente, se utilizó la prueba de Tukey, (p<0.05), cuando fue necesario. Se calcularon las estadísticas básicas como media, error estándar y frecuencias para cada uno de los reservorios y sistemas. Se realizó el análisis de regresión no lineal para comparar la bondad de ajuste de dos ecuaciones alométricas (Cairns et al., 2003; Chave et al., 2015) para estimar la biomasa viva con los datos de DAP de los árboles. Los análisis se realizaron con el paquete estadístico Statistica 7.0 (Statsoft, 2007).
Resultados y Discusión
Abundancia de los árboles
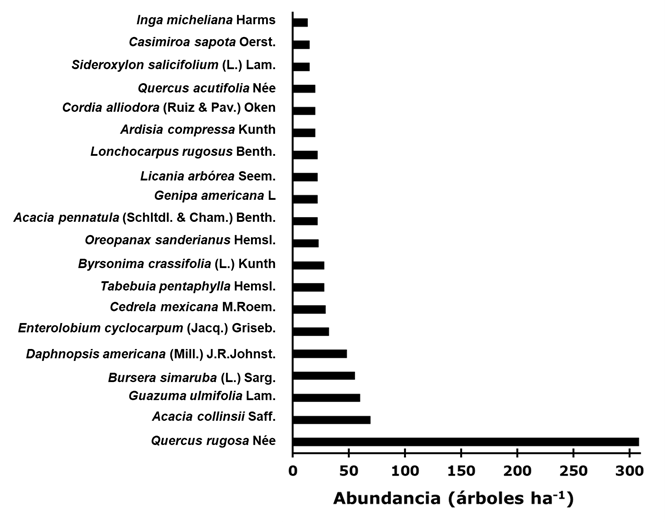
En las parcelas forestales se encontraron 46 diferentes especies de árboles, las 20 con mayor abundancia por hectárea se muestran en la Figura 2. Quercus rugosa, Acacia collinsii, Guazuma ulmifolia, Bursera simaruba y Daphnopsis americana (Mill.) J. R. Johnst. fueron las más abundantes en el área de estudio.
Dominancia de los árboles
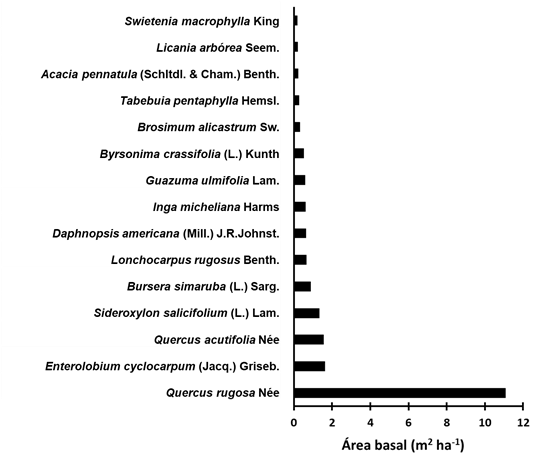
La especie con mayor dominancia fue Quercus rugosa (Figura 3), con un AB total de 11.07 m2 ha-1, seguida por Enterolobium cyclocarpum con 1.62 m2 ha-1. Los taxa con menor dominancia fueron Diphysa robinoides Benth. & Oerst., Albizia nipoides (Benth.) Burkart y Coccoloba cozumelensis Hemsl., cuya área basal fue igual o menor a 0.01 m2 por hectárea.
El papel de la vegetación remanente en paisajes fragmentados es apreciado, no solo por su capacidad de acumulación de carbono y mitigación del cambio climático, sino por su contribución a la regeneración natural y conservación de la biodiversidad (Chazdon, 2008; Martínez-Sánchez et al., 2015; Mora et al., 2018). Los fragmentos de áreas forestales (cerca de 40 % de la superficie total del rancho) albergan más de 40 especies de árboles con diferentes niveles de abundancia y dominancia dentro de la comunidad arbórea.
De los taxones arbóreos registrados son pocos los más abundantes, lo que se puede deber a que algunos como Quercus rugosa, Guazuma ulmifolia y Bursera simaruba, que son los más numerosos en parches aledaños del paisaje, producen frutos y semillas que sirven de alimento a los animales silvestres, los cuales las dispersan con facilidad por todo el bosque (Chazdon et al., 2010). Además, estas especies pueden adaptarse a ecosistemas forestales con bajos y medios niveles de disturbio antrópico.
En una revisión de 161 investigaciones realizadas en el territorio mexicano, Pompa-García et al. (2017a) demostraron la importancia de los ecosistemas forestales en la conservación de la diversidad y de los taxa forestales de importancia ecológica, en particular. Los autores concluyeron que el ecosistema más estudiado es la selva baja caducifolia, respecto a las especies predominantes corresponden a los géneros Quercus, Pinus, Acacia y Bursera, mismas que son de gran trascendencia para efectos de resiliencia de ecosistemas con presencia de disturbio.
El número de especies (46) y el total de árboles por hectárea (1 081) registrados en el presente estudio fueron superiores a los resultados de Basáñez et al. (2008), quienes documentan 30 taxa y 810 individuos ha-1 para una selva media subperennifolia. Taylor (2016) cita un valor mayor de taxones (95 en total), pero menor cantidad de individuos (303 ha-1) en un bosque de pino-encino. Hernández (2015), en bosques de Quercus rugosa indican 983 individuos ha-1, de los cuales 820 tenían un DAP de 0-10 cm, resultados que son similares a los aquí consignados (1 081 individuos ha-1, de ellos 663 con DAP de <10 cm; esto sugiere la existencia de procesos de regeneración natural.
La dominancia de las principales especies identificadas, expresadas en área basal, son inferiores a los registros de Basáñez et al. (2008) para una selva media subcaducifolia de Papantla, Veracruz (76.77 m2 ha-1). En los Altos de Chiapas, Taylor (2016) calculó 49 m2 ha-1, en bosques de pino-encino. En San José, Estado de México, Hernández (2015) registró 12.31 m2 ha-1 en bosques de Quercus rugosa.
Reservorios de carbono
La mayor acumulación de carbono se concentró en la biomasa aérea viva de los árboles, con 46.71±9.00 Mg C ha-1 (promedio ± error estándar) para el área forestal y 0.30±0.13 Mg C ha-1 en área de potreros (Cuadro 1). Se verificó diferencia significativa entre el área forestal y el área de potrero en biomasa aérea y biomasa de raíces (P= 0.00012). La vegetación asociada reunió mayor cantidad de carbono en el área de potrero 1.14±0.09 Mg C ha-1 que en la forestal (0.33±0.05 Mg C ha-1), con una diferencia significativa (P= 0.0000) entre los dos sistemas.
Cuadro 1 Contenido de carbono en biomasa viva área en los dos sistemas evaluados.
| Área forestal Mg C ha -1 |
Área potrero Mg C ha -1 |
|||
|---|---|---|---|---|
| Media | Error estándar | Media | Error estándar | |
| Biomasa aérea de árboles | 46.71 (65.07) a | 9.00 (6.53) | 0.30 (0.51) b | 0.13 (0.21) |
| Biomasa de raíces de árboles | 16.46 (23.08) a | 2.69 (3.09) | 0.14 (0.24) b | 0.06 (0.09) |
| Vegetación asociada | 0.33 b | 0.05 | 1.14 a | 0.09 |
| Carbono total en biomasa viva | 63.5 (88.48) a | 9.69 (8.60) | 1.58 (1.90) b | 0.22 (0.31) |
Los valores iniciales fueron calculados con la ecuación alométrica de Cairns et al. (2003) y los valores entre paréntesis con la ecuación de Chave et al. (2015). Medias seguidas de letras diferentes entre columnas, son diferentes estadísticamente (Tukey, p<0.05).
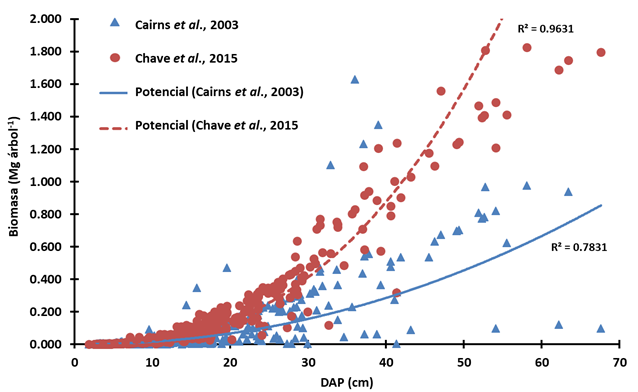
La selección adecuada de las ecuaciones alométricas para cuantificar la biomasa viva de los árboles puede reducir la incertidumbre en la estimación del almacenamiento de carbono. En un análisis comparativo, la cantidad de carbono cuantificado con la ecuación de Cairns et al. (2003) fue 28.2 % menor que el resultado obtenido con la de Chave et al. (2015). La primera se desarrolló para las especies forestales de la selva mediana subperennifolia de la Península de Yucatán, y la segunda mediante datos recopilados de varias regiones del trópico. En un análisis de regresión no lineal con los datos del estudio de interés, la ecuación de Chave tuvo mayor bondad de ajuste (R2 = 0.96) que la de Cairns (R2 = 0.78), lo que supone su mejor aplicabilidad (Figura 4).
La cantidad de carbono almacenado en el mantillo de las áreas forestales varió según el estado de descomposición (Figura 5). Se registró una mayor cantidad de carbono almacenado en el horizonte Oa (material descompuesto) comparado con los horizontes Oi (fresco) y Oe (parcialmente descompuesto). No existe reservorio de mantillo en el área de potrero.
Carbono orgánico y propiedades del suelo
En el contenido de carbono orgánico del suelo entre zonas forestales y de potreros (p= 0.268, ANOVA de una vía) no se presentaron diferencias significativas. El carbono orgánico acumulado en el suelo forestal fue de 72.57 Mg C ha-1 con un error estándar de 2.89, muy similar al contenido de carbono en el suelo de potreros, 74.37 Mg C ha-1 con un error estándar de 3.30. Al contrastar los dos sistemas en cuanto a densidad aparente, pH, conductividad eléctrica y contenido de carbono en porcentaje, tampoco se obtuvieron diferencias significativas (Cuadro 2).
Cuadro 2 Carbono almacenado, pH y conductividad eléctrica en suelo en los sistemas forestales y potreros a una profundidad de 15 cm.
| Propiedades físico-químicas de suelo |
Área forestal | Área potrero | ||
|---|---|---|---|---|
| Media | E.E. | Media | E.E. | |
| Carbono orgánico de suelo (Mg C ha-1) | 72.57 a | 2.89 | 74.37 a | 3.30 |
| Densidad aparente (g cm-3) | 1.39 a | 0.038 | 1.34 a | 0.022 |
| pH | 5.23 a | 0.11 | 5.21 a | 0.18 |
| Conductividad eléctrica (mS m-1) | 119.18 a | 7.20 | 119.65 a | 10.60 |
| Contenido de carbono (%) | 3.50 a | 0.14 | 3.71 a | 0.18 |
E.E. = Error estándar. Medias seguidas de la misma letra entre columnas, son estadísticamente iguales (Tukey, p<0.05).
Se realizó una comparación de medias de los suelos de potreros, buenos y degradados; no resultó diferencia significativa en el contenido de carbono, 73.81 Mg C ha-1, cifra semejante a la del potrero degradado, 74.92 Mg C ha-1, densidad aparente y carbono en porcentaje (P >0.05, ANOVA de una vía). El pH presentó diferencia significativa (P=0.030), de 5.56 en los suelos de potreros buenos y 4.87 en los degradados (Cuadro 3). De igual forma, en la conductividad eléctrica hay diferencia significativa (P=0.042), pues fue menor en los potreros buenos (100.01 mS m-1) que en los degradados (139.29 mS m-1). Los valores superiores de conductividad eléctrica en estos últimos podrían atribuirse a las altas concentraciones de sales.
Cuadro 3 Carbono almacenado, pH y conductividad eléctrica en suelos de potreros buenos y degradados a una profundidad de 15 cm.
| Propiedades físico-químicas de suelo | Potrero no degradado | Potrero degradado | ||
|---|---|---|---|---|
| Media | E.E. | Media | E.E. | |
| Almacenamiento de carbono (Mg ha-1) | 73.81a | 3.91 | 74.92a | 2.69 |
| Densidad aparente (g cm-3) | 1.33a | 0.04 | 1.35a | 0.01 |
| pH | 5.56a | 0.12 | 4.87b | 0.23 |
| Conductividad electrica (mS m-1) | 100.01a | 7.23 | 139.29b | 13.96 |
| Carbono orgánico (%) | 3.74a | 0.23 | 3.68a | 0.13 |
E.E. = Error estándar. Medias seguidas de letras diferentes entre columnas son diferentes estadísticamente, por (Tukey, p<0.05).
El carbono total almacenado en el área forestal registró mayor cantidad de carbono (144.45 Mg C ha-1), en comparación con la de potrero (75.95 Mg C ha-1). El carbono orgánico de suelo (COS) fue el principal reservorio en los dos sistemas (Cuadro 4). En el forestal, el COS contribuye con 50.2 % del carbono total y en potreros, con 97.9 % (Cuadro 4).
Cuadro 4 Almacenamiento de carbono total Mg C ha-1, en área forestal y potreros.
| Reservorios de carbono |
Área forestal (Mg C ha -1 ) |
Área de potrero (Mg C ha -1 ) |
|---|---|---|
| Biomasa aérea | 46.71 a (32.3 %) | 0.30 b (0.4 %) |
| Biomasa de raíces | 16.46 a (11.4 %) | 0.14 b (0.2 %) |
| Vegetación asociada | 0.33 b (0.2 %) | 1.14 a (1.5 %) |
| Suelo | 72.57 a (50.2%) | 74.37 a (97.9%) |
| Mantillo | 4.89 a (3.4%) | 00 b (0.0%) |
| Madera muerta | 3.49 a (2.4%) | 00 b (0.0%) |
| Total de carbono | 144.45 (100%) | 75.95 (100%) |
Medias seguidas de letras diferentes, entre columnas, son diferentes estadísticamente, por (ANOVA, Tukey, p<0.05).
Separar ciertas áreas de conservación dentro de una unidad de producción ganadera no es una práctica común en el sureste mexicano. Sin embargo, algunos productores, consciente o inconscientemente, mantienen un área forestal que acumula carbono atmosférico y contribuye a reducir las emisiones netas de gases de efecto invernadero (CO2 equivalente) de sus ranchos. La acumulación de carbono en biomasa y suelo dentro de estas unidades también apoya, de manera significativa, el control de las emisiones evitadas por deforestación (García-Oliva et al., 2006; De Jong et al., 2010; Soto-Pinto et al., 2010; Nahed-Toral et al., 2013). Al respecto, el área forestal del rancho bajo estudio participa, de forma ecológica, en el almacenamiento de carbono en biomasa viva área, biomasa viva subterránea, madera muerta, hojarasca y carbono orgánico del suelo.
Como es de esperarse, la cantidad de carbono almacenado en reservorios como biomasa viva de los árboles, madera muerta y hojarasca fue superior en las áreas forestales que en las de potrero. Sin embargo, la hipótesis de que el carbono orgánico del suelo en las primeras áreas es mayor que en las segundas se rechazó, ya que no se obtuvieron diferencias significativas.
Lo anterior puede atribuirse a los siguientes factores: i) el carbono orgánico del suelo es un reservorio más estable y es afectado, lentamente, por el cambio de uso suelo, patrones que también se han observado en otros estudios realizados en el sur-sureste mexicano (Orihuela-Belmonte et al., 2013; Aryal et al., 2015, Villanueva-López et al., 2016; Aryal et al., 2017).
ii) El aporte de materia orgánica por el recambio de raíces de áreas de potrero contribuye, de manera significativa, a mantener el carbono orgánico del suelo en pastizales, lo cual es consistente con el hecho de que el carbono acumulado en la vegetación asociada (pastos, arbustos y árboles <2.5 cm de DAP) fue superior en áreas de potrero. Sin embargo, se requiere de estudios sobre producción, recambio y descomposición de raíces entre áreas forestales y pastizales para entender la dinámica del carbono orgánico del suelo en estos ecosistemas. Además, el manejo de un potrero en términos de rotación de pastoreo, número de animales por unidad de superficie, adición de materia orgánica y fertilizantes sintéticos pueden explicar las variaciones y tendencias de la acumulación de carbono orgánico del suelo en áreas de potrero, los cuales no fueron considerados en la presente investigación.
Los valores promedio de carbono almacenado en el componente arbóreo fueron inferiores a los calculados por Hernández (2015), quien registró 109 Mg C ha-1 en la biomasa de árboles. En cuanto a los componentes de biomasa de raíces y vegetación asociada, el mismo autor calculó 19.88 y 1.44 Mg C ha-1, que resultan muy similares a los de este trabajo. Ibrahim et al. (2006) refirió un promedio de 90.78 y 4.83 Mg C ha-1 de carbono en biomasa viva aérea en bosques secundarios y potreros en monocultivo, respectivamente en Esparza, Costa Rica. Aguilar (2007) obtuvo 1.99 Mg C ha-1 en biomasa aérea para los potreros de sistemas de monocultivos en Marqués de Comilla, Chiapas; parecidos a los aquí documentados.
En el componente biomasa de la vegetación asociada, se determinó mayor contenido de carbono en el sistema de potreros que en el forestal, posiblemente por que reciben más radiación solar y por la poca competencia entre los integrantes del estrato herbáceo, en el segundo. Esta diferencia puede estar en función de la densidad de árboles, el tipo de especies, edad del ecosistema y número de estratos presentes (Aguilar, 2007). Además, recientemente, se ha consignado que el carbono almacenado en la biomasa viva varía no solo de un sistema al otro, sino entre especies, a lo que se agregan las condiciones ecológicas derivadas de la diferencia en las concentraciones de carbono en los tejidos (Pompa-García et al., 2017b).
Los resultados de carbono almacenado en madera muerta (3.49 Mg C ha-1) fueron menores a los de Bolaños et al. (2017) y Aryal et al. (2014), quienes calcularon 16 y 35.87 Mg C ha-1, respectivamente en bosques de pino y bosques secundarios subperennifolios. El valor de carbono en mantillo registrado en la presente investigación (4.89 Mg C ha-1) es inferior a los de Bolaños et al. (2017), de 11 Mg C ha-1. Hernández (2015) registró 17.09 Mg C ha-1 para mantillo en bosques de Quercus rugosa.
Los datos de carbono orgánico del suelo en el trabajo aquí descrito son similares a los calculados por Ruíz (2002), quien dio a conocer un promedio de 84.3 Mg C ha-1 a una profundidad de muestreo de 20 cm, en potreros sin árboles. Bolaños et al. (2017) obtuvieron 68 Mg C ha-1 a una profundidad de muestreo de 30 cm, semejante a los de esta investigación. Céspedes et al. (2012) determinaron 29.05 Mg C ha-1 a una profundidad de muestreo de 10 cm y 23.58 Mg C ha-1 a 20 cm en pastizales, lo que resulta inferior a las cifras registradas en las áreas bajo estudio (74.37 Mg C ha-1 a 15 cm profundidad de muestreo). García-Oliva et al. (2006) calcularon 3.6 % de C en suelos de bosques secos de Chamela, Jalisco, porcentaje cercano a los datos aquí reunidos. La variación de estos contenidos de C en el suelo, son atribuibles al manejo del pastoreo, tipo de suelo, estado fisiológico del pasto y al contenido de nutrimentos (Aguilar, 2007).
El carbono total obtenido en la presente investigación en bosques subcaducifolios y potreros (144.45 y 75.95 Mg C ha-1) es inferior al consignado por Aryal et al. (2014) que corresponde a 231.67 Mg C ha-1 en bosques secundarios de la Península de Yucatán. Hernández (2015) llegó a un valor total de carbono de 302.50 M g C ha-1 en bosque templado del Estado de México. Bolaños et al. (2017) estimó 376 Mg C ha-1 de carbono total en bosques de pino. Ruiz et al. (2004) refirió un valor total de carbono almacenado en pastos nativos en Matíguas, Nicaragua de 151.4 Mg C ha-1, similar al de este trabajo. Aguilar (2007) determinó 64.62 Mg C ha-1 en potreros de monocultivo en Chiapas, México, que está por debajo a los resultados aquí generados.
El rancho donde se realizó la investigación incluye 24.7 ha (40 % de la superficie total) de áreas forestales, en las que cada hectárea almacena un promedio de 144.45 Mg C ha-1; por lo tanto, dicha extensión de bosque derribado para destinarlo a potrero emite 257.76 Mg de CO2 ha-1. Si se decidiera tirar las 24.65 ha de bosque para sembrar pasturas y darles el mismo uso, se aportarían 6 353.95 Mg CO2 de emisiones de GEI.
Mediante una estimación de GEI con equivalencias energéticas, Molina (2014) cuantificó 93.15 Mg CO2eq. de emisiones durante seis meses en la época de estiaje en el rancho de estudio. Con base en dicha contribución, se puede reducir 23 % de esas emisiones, a través de tecnologías agroecológicas, como el uso de biodigestores, compostas y sistemas silvopastoriles. Se espera que la remoción de carbono por las actividades forestales y agroforestales contribuya significativamente en la mitigación de las emisiones restantes.
Conclusiones
Los resultados descritos confirman que los bosques poseen una gran capacidad de almacenamiento de carbono en sus distintos reservorios. Se obtuvo mayor almacenamiento de carbono en biomasa viva aérea y de raíces de árboles en el sistema forestal que en el de potreros, debido a la escasez de árboles en estos últimos. El contenido de carbono en la vegetación asociada se comportó de forma inversa. Los resultados demuestran que los ecosistemas forestales albergan una alta diversidad de especies arbóreas según las condiciones ecológicas y experimentan un proceso de recuperación natural, debido al alto número de individuos con DAP < 10 cm.
A pesar de haberse confirmado una diferencia entre áreas forestales y pastizales, el carbono orgánico del suelo es el principal reservorio de carbono al aportar más de 60 % en las primeras y más de 90 % en área de potrero, con respecto al carbono total del ecosistema. Se sugiere realizar remediciones de carbono en las mismas parcelas para conocer la tasa de remoción de CO2 atmosférico.











 texto em
texto em