Introducción
Los árboles de uso múltiple se cultivan para hacer más de una aportación significativa a las funciones de producción y de servicio en los agroecosistemas. Existe una gran diversidad de estas especies nativas distribuidas en distintas regiones ecológicas, con gran valor cultural para la sociedad (Aguilar y Condit, 2001). Sin embargo, implementar taxa locales en sistemas agroforestales conlleva la necesidad de conocer sus características: fenología, hábitos y forma de crecimiento (Wood y Burley, 1995), capacidad productiva, capacidad para reciclar nutrientes, fijación de nitrógeno, resistencia a plagas y enfermedades, así como la preferencia de los productores que las usarán (Huxley, 1983; Owino, 1992).
La fenología de las especies es útil para decidir el manejo del dosel que asegure la producción; además, se busca que este provea niveles variables de sombra durante el año, en forma sincronizada con el ciclo fenológico de los cultivos (Somarriba, 2005). La arquitectura es otro aspecto importante cuando se implementan sistemas agroforestales, porque la forma y características de la copa definen cómo crecerá el árbol, su eficiencia en la producción de madera (Sestras, 2004), y de los cultivos asociados (Beer et al., 2003).
En el centro de veracruz, las selvas baja y mediana presentan disturbios a causa de la agricultura y ganadería (Pennigton y Sarukhán, 2005; Gómez et al. 2010); y para su restauración, se ha propuesto implementar sistemas agroforestales con especies nativas multipropósito. Algunas de las importantes en estos ecosistemas son Calyptranthes schiedeana O. Berg (Myrtaceae), Lysiloma acapulcense (Kunth) Benth (Fabaceae) y Tabebuia chrysantha (Jacq.) G. Nicholson (Bignoniaceae); características de vegetación secundaria y notables en bosques maduros. Tienen alta importancia cultural y también son fundamentales para la vida silvestre, aunque, actualmente son escasas en la región (Suárez et al., 2012).
Aun, si se reconoce la relevancia de plantar árboles nativos, se cuenta con información escasa sobre su ecología, biología y rendimiento; por lo tanto, las opciones de árboles para la restauración y la industria forestal son limitadas (Condit et al., 1993; Wishnie et al., 2007). Dada la necesidad de conocer la vegetación originaria de la región con potencial para integrarse en sistemas agroforestales, el presente estudio tuvo como objetivo describir los patrones fenológicos y la arquitectura arbórea de C. schiedeana, L. acapulcense y T. chrysantha dentro de agroecosistemas con árboles dispersos y aglomerados en potreros, parcelas agrícolas y cercos vivos, donde se pueden evaluar su características en condiciones similares a las prevalecientes en los sitios para su posible establecimiento en sistemas agroforestales.
Materiales y Métodos
El estudio se realizó en diversas localidades ubicadas dentro del municipio Paso de Ovejas, veracruz (19°1’58.27’’-19°12’54.18’’ N, 96°25’25.28’’-96°30’46.29’’ O), en un intervalo altitudinal de 84 a 203 m, con 24 °C temperatura media anual y 973 mm de precipitación anual (Inegi, 2009). El tipo de vegetación corresponde a una selva baja caducifolia, importante por su estructura, diversidad florística, y el número de especies en peligro (Castillo-Campos, 2005).
Se consideraron T. chrysantha, L. acapulcense y C. schiedeana, pertenecientes al grupo de plantas heliófitas (Pennigton y Sarukhán, 2005); se eligieron por su importancia cultural y su escasez dentro de la zona de estudio (Bautista, 2009; Suárez et al., 2012). De cada especie se eligieron 10 individuos maduros dentro de 14 sitios de uso agropecuario (superficies de 0.5 a 30 ha), seleccionados en un radio de aproximadamente de 18 km. Los árboles evaluados se ubicaban en cercos vivos, dispersos en potreros y parcelas agrícolas, o en bosquetes asociados a otros taxa.
Registro de fenofases y arquitectura arbórea
La fenología se evaluó cada 14 días, de febrero 2014 a marzo 2015. Se registraron los cambios en las fases fenológicas: 1) formación de yemas florales, 2) floración, 3) fructificación, 4) dispersión de semillas, 5) presencia de hojas, 6) caída de hojas y 7) brote de hojas (Milla et al. 2009; Pineda-Herrera et al. 2012). En cada ejemplar se consignó el avance de las etapas fenológicas en una escala de 0 al 100 en cinco intervalos: 0,1-25, 26-50, 51-75 y 76-100 % (Pineda-Herrera et al., 2012).
Se determinó la arquitectura arbórea en 20 ejemplares fustales por especie (DAP > 2.5 cm), localizados en los sitios descritos (algunos fueron los mismos que se incluyeron en la parte de fenología). Para establecer el contexto dendométrico de la arquitectura, se midió el diámetro del fuste (1.3 m de la base), diámetro de copa (Bahco, cinta métrica de 30 m), altura de copa y altura total (clinómetro 360, marca Brunton). Se definió el modelo arquitectónico de las tres especies de acuerdo a las propuestas de Hallé et al. (1978) e Interián-Ku et al. (2009). Se valoró cualitativamente el crecimiento del eje principal por su patrón (monopódico o simpódico) y forma (determinado o indeterminado); la ramificación, por su orientación y simetría (ortotrópico o plagiotrópico); el ángulo de inserción de ramas (ascendente de 16 a 45° o difuso de 46 a 75°); la longitud de ramas (largas o cortas); las estructuras reproductivas por su posición (axilar o apical); las reiteraciones de las ramas (total o parcial, adaptativa o traumática); y el ángulo de inserción, así como la longitud de ramas Image Tool versión 3.0 (IT, 2002).
Como parte de la arquitectura, también se midieron los ángulos de inserción de las hojas con un transportador, y el área foliar (Portable Area Meter LI-3000C). Se tomaron en cuenta atributos del contorno, cobertura y arquitectura (forma, segmentación, división y profundidad) de las copas (Trichon, 2001). Adicionalmente, se estimó la densidad del follaje en 10 individuos por taxón, en la época de lluvias (LAI-2000, LI-COR Biosciences); y la cobertura del suelo bajo y fuera de la copa para cuantificar el grado en que la sombra de cada especie modifica la cobertura del suelo (Bonham, 1989).
Análisis de datos
Se calculó el promedio de ocurrencia de cada etapa fenológica por especie, fecha de muestreo (catorcenalmente) y se graficaron. Se obtuvieron coeficientes de correlación paramétrica de Pearson con los valores de las fenofases, la precipitación acumulada y temperatura media del aire (del periodo correspondiente de 14 días). Después de verificar la distribución normal de las variables, se efectuaron análisis de varianza que incluyeron el efecto de especie, de árbol, mediante el procedimiento GLM y pruebas de medias LS Means ajustadas a Tukey, con SAS (SAS, 2010).
Resultados
Fenología de las especies
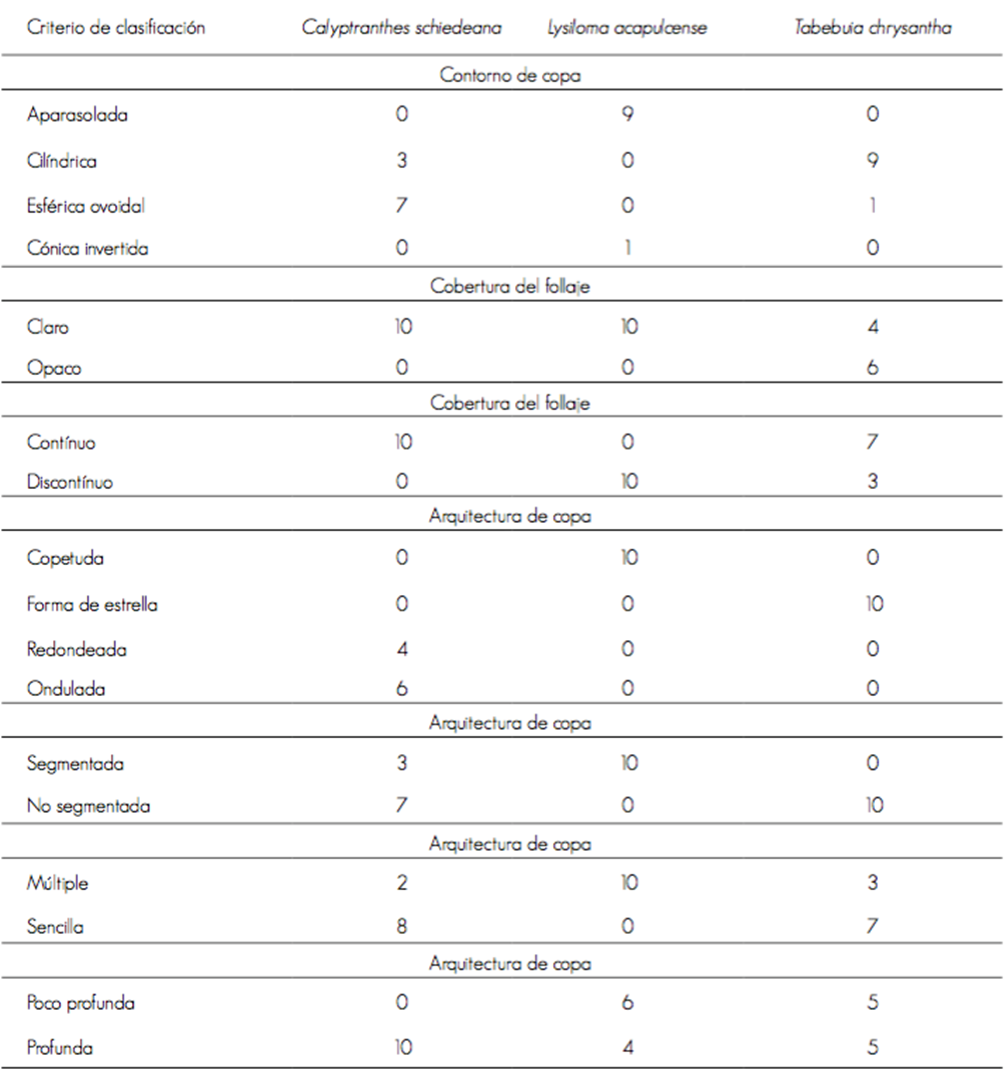
Calyptranthes schiedeana mantuvo hojas a lo largo del año, mostró rápida formación de yemas foliares en mayo, hasta cubrir su copa completamente en junio. La caída de hojas inició en enero y se intensificó en abril y mayo. Una vez que el árbol revistió su copa de follaje, comenzó a formar rápidamente yemas florales durante junio, para empezar a fructificar, en forma lenta en julio, e intensificarse en octubre, lo que coincidió con una mayor dispersión de frutos (Figura 1). La precipitación fue necesaria para que esta especie formara yemas foliares (r = 0.60, P = 0.0004), y la temperatura influyó en la fructificación (r = 0.46, P = 0.0108).
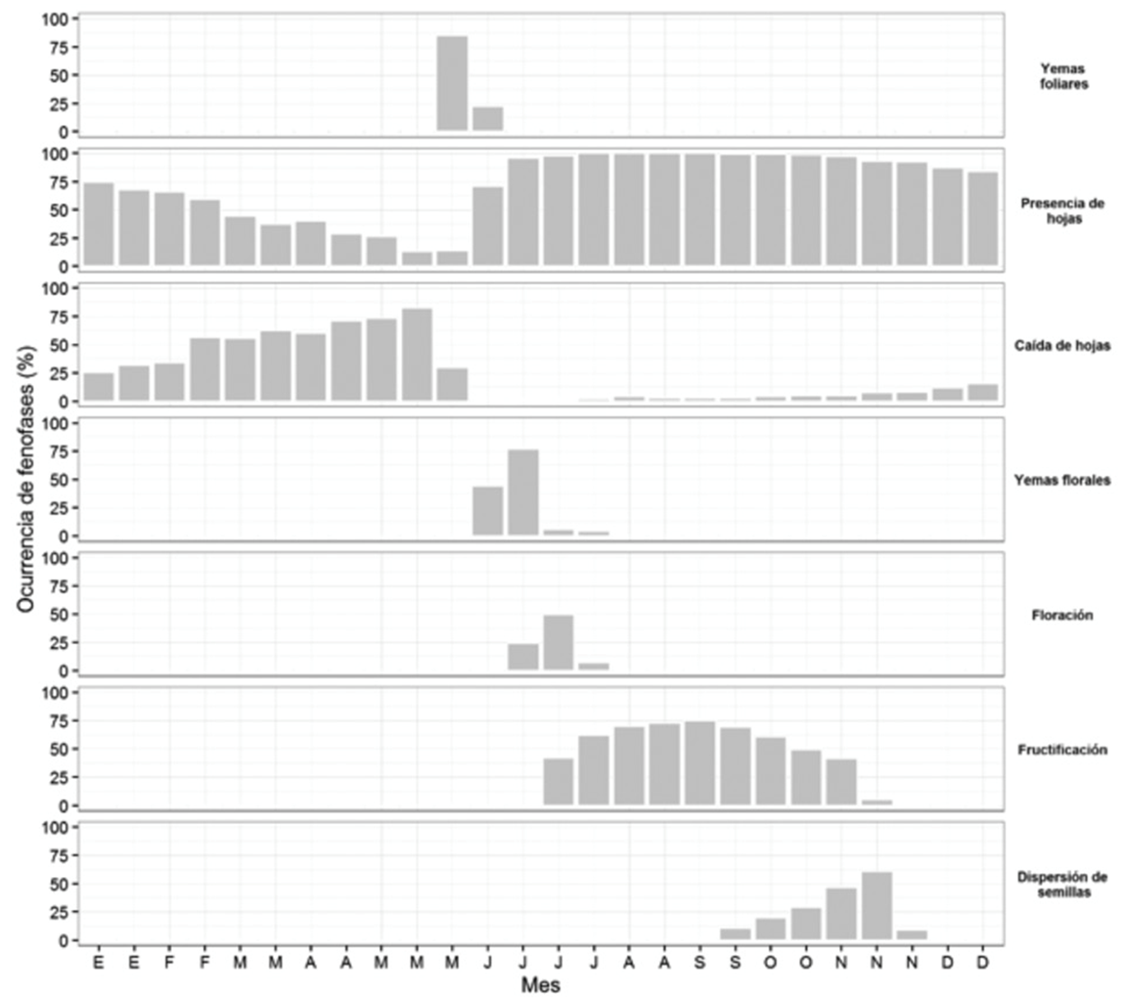
Figura 1 Ocurrencia de siete fenofases de Calyptranthes schiedeana O. Berg, evaluadas cada 14 días, en el periodo 2014-2015.
Tabebuia chrysantha alcanzó su máxima formación de yemas foliares en mayo, y mayor cobertura de hojas de junio a diciembre, con la defoliación más alta en febrero, para quedar completamente sin hojas en abril y mayo. La formación de yemas florales se observó de junio a marzo, cuando ocurrió la floración; la fructificación y dispersión de frutos se presentó en abril (Figura 2). La disminución de la temperatura incidió en la formación de yemas florales (r = -0.58, P = 0.0008) y la caída de hojas (r = -0.67, P < 0.0001); en tanto que el aumento de la precipitación tuvo relación con la formación de yemas foliares (r = 0.45, P = 0.0107).
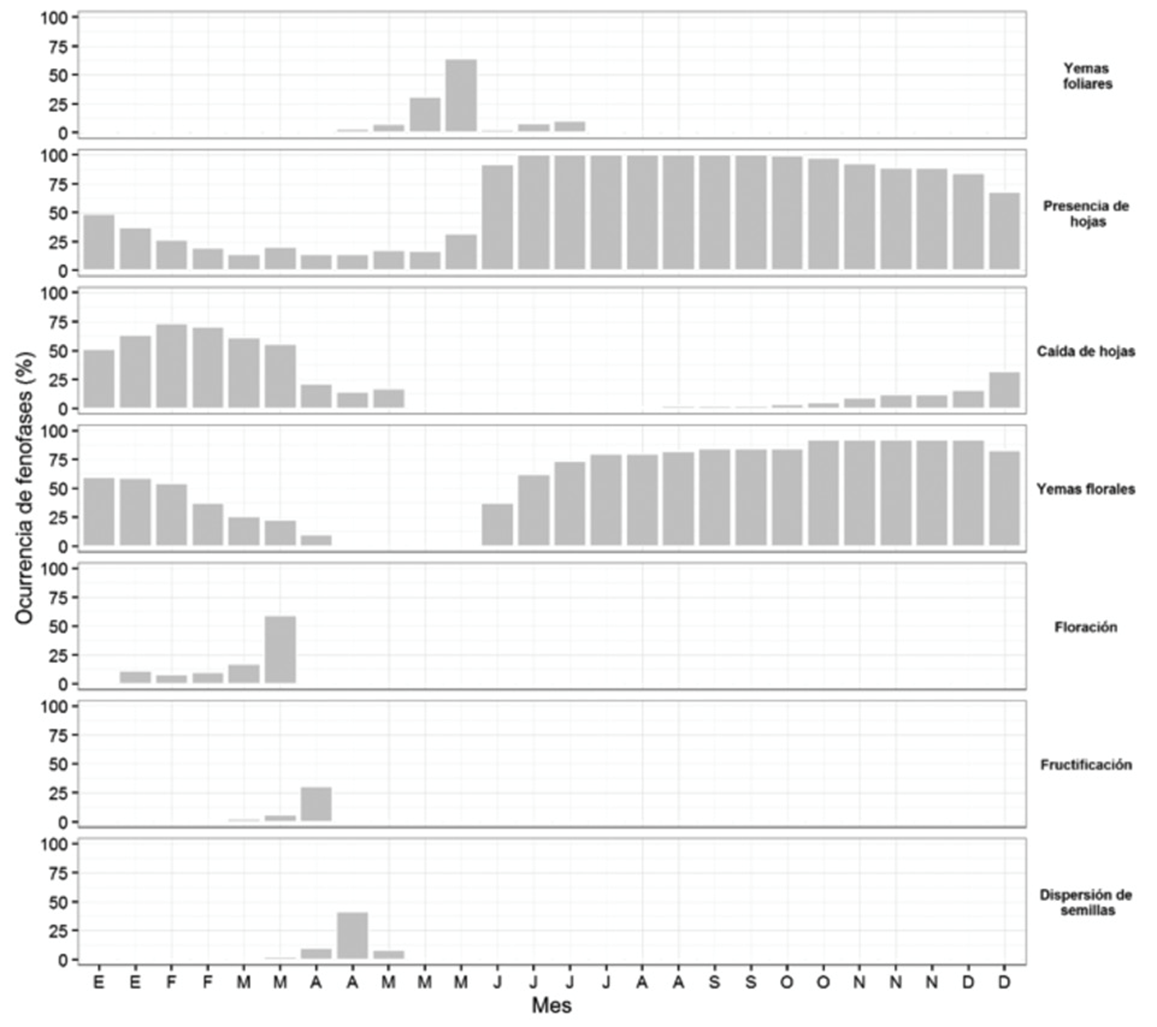
Figura 2 Ocurrencia de siete fenofases de Tabebuia chrysantha (Jacq.) G. Nicholson, evaluadas cada 14 días, en el periodo 2014-2015
Lysiloma acapulcense, al igual que C. schiedeana, mantuvo hojas durante todo el año, formó yemas foliares en marzo, que coincidió con el periodo más intenso de caída de hojas (febrero-marzo); mientras que en abril (mes con menor precipitación) se observó una rápida transición de formación de yemas florales a floración. La emergencia de frutos sucedió, mayormente, en noviembre y la dispersión de semillas en abril del año siguiente (Figura 3). La fructificación en L. acapulcense disminuyó con temperaturas bajas (r = -0.90, P < 0.0001).
Arquitectura de las especies
Calyptrantes schiedeana presentó un patrón de crecimiento simpódico del eje principal y determinado; actividad meristemática proléptica; el patrón de ramificación fue simpodial con orientación y simetría plagiotrópica; la orientación de ramas de primer orden, con respecto al eje principal, fue ascendente (29.5°), con estructuras reproductivas axilares; la morfología de las inflorescencias es monopodial, con reiteraciones totales y adaptativas.
Lysiloma acapulcense tuvo crecimiento simpódico del eje principal, forma determinada y actividad meristemática proléptica; las ramas son simpodiales y plagiotrópicas, y las de primer orden tienen una orientación difusa (51.2°). Las estructuras reproductivas se ubicaron en posición axilar, con morfología monopodial de sus inflorescencias, con reiteraciones adaptativas y totales. Tabebuia chrysantha evidenció un patrón de crecimiento monopódico, de forma determinado y actividad meristemática proléptica, con un patrón de ramificación simpodial, orientación y simetría ortotrópica; las ramas de primer orden fueron ascendentes (44.1°). La posición de las estructuras reproductivas fue apical (terminal), y las inflorescencias evidenciaron una morfología simpódica, con reiteraciones adaptativas y totales.
Lysiloma acapulcense y T. chrysantha tuvieron ángulos de ramas de primer orden iguales (P = 0.067) que superaron a los de C. schiedeana (P < 0.0001); igualmente, los ángulos de ramas de segundo orden difirieron entre C. schiedeana y T. chrysantha (P = 0.044), y los de tercer orden fueron similares entre las especies (P = 0.943). Claramente, L. acapulcense es un árbol de mayor tamaño, con ramas más largas (P < 0.0001) que T. chrysantha (P < 0.0001) y C. schiedeana (P < 0.0001), que resultó ser el árbol con ramas más cortas (Cuadro 1).
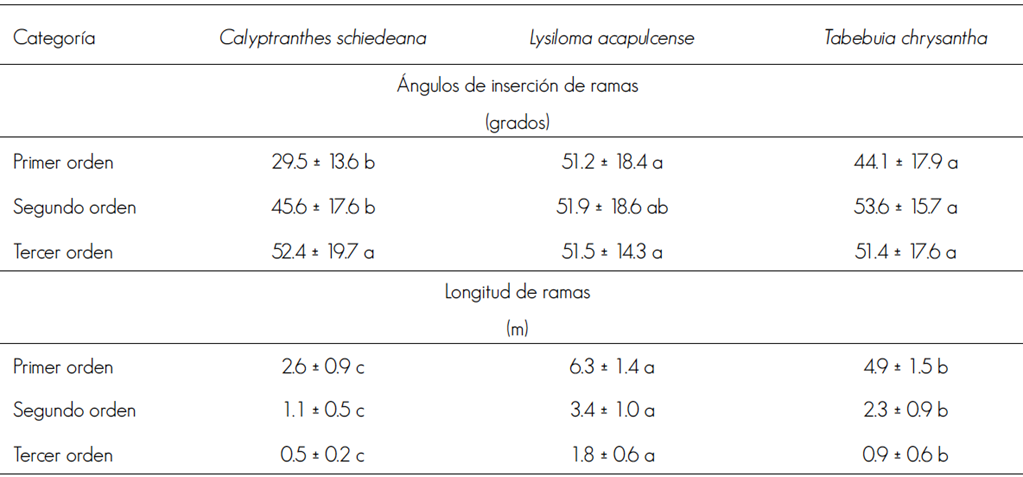
Letras diferentes en la misma línea indican diferencia estadística, Tukey (P<0.05).
Cuadro 1 Arquitectura de las ramas en árboles fustales de Calyptranthes schiedeana O. Berg, Lysiloma acapulcense (Kunth) Benth y Tabebuia chrysantha (Jacq.) G. Nicholson
Los tres taxa mostraron igual ángulo de inserción de hojas (P = 0.642); las de L. acapulcense, fueron compuestas (foliolos y foliolulos pequeños) con mayor área foliar (P = 0.05) y longitud de láminas (P = 0.05); sin embargo, su índice de densidad foliar fue más bajo. C. schiedeana con hojas más pequeñas y no compuestas, tuvo un índice de densidad foliar superior; lo mismo ocurrió en T. chrysantha (Cuadro 2).
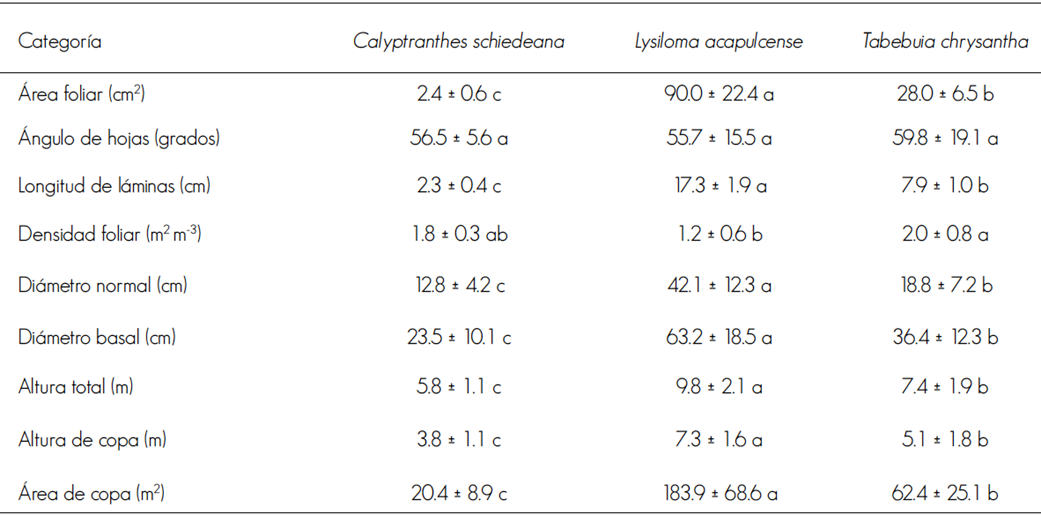
Letras diferentes en la misma linea indican diferencia estadistica, Tukey (P < 0.05).
Cuadro 2 Arquitectura de las hojas y medidas dasométricas de árboles fustales de Calyptranthes schiedeana O. Berg, Lysiloma acapulcense (Kunth) Benth y Tabebuia chrysantha (Jacq.) G. Nicholson
Lysiloma acapulcense destacó por tener diámetro normal (P < 0.0001), diámetro basal (P < 0.0001) y altura (P < 0.0001) más grande que otros taxa; también porque su copa está situada a más altura (P < 0.0001) y su tamaño es superior (P < 0.0001); y C. schiedeana presentó las dimensiones más chicas (Cuadro 2).
La arquitectura de las copas varió, la de L. acapulcense tiene forma aparasolada, T. chrysantha cilíndrica y C. schiedeana, en su mayoría, esférica ovoidal (Cuadro 3). La disposición del follaje es uniformemente clara y discontínua en L. acapulcense, mientras que en C. schiedeana varía de clara a contínua, y en T. chrysantha, la cobertura está menos definida. En Lysiloma acapulcense se observó una arquitectura copetuda, segmentada, múltiple y de poco profunda a profunda; T. chrysantha en forma de estrella, no segmentada, entre múltiple y sencilla, de poco profunda a profunda. En C. schiedeana es, principalmente, ondulada y segmentada, sencilla, y profunda (Cuadro 3). El manejo y las características de los sitios en que se encontraban los árboles, originó que algunos aspectos de la arquitectura no estuvieran bien definidos; por lo que, individuos de la misma especie presentaron patrones distintos.
Discusión
Los tres taxa registraron patrones fenológicos característicos de especies de selva baja caducifolia y subcaducifolia, aunque tendieron a diferenciarse en algunos aspectos. L. acapulcense no se defolió completamente en ningún momento y cuando llegó a 75 % comenzó a cubrir su copa con renuevo (en primavera); mientras que la mayoría de los ejemplares de C. schiedeana y T. chrysantha sí perdieron la totalidad de su follaje (época seca), como ocurre con muchas especies deciduas que desprenden sus hojas al iniciar el estrés hídrico (Wright, 1996), y producen hojas nuevas un mes antes del inicio de las lluvias (Opler et al., 1980). También, fue notorio que L. acapulcense se defolió durante un período de tiempo más prolongado que los otros taxa, esto es indicativo de diferencias en el mecanismo de tolerancia al estrés hídrico entre los taxa (Sánchez et al., 2004).
Los momentos de floración no coincidieron, en C. schiedana correspondió con el período de sequía intraestival (agosto) y las otras florecieron durante el seco. Sin embargo, todas tuvieron lapsos cortos y definidos de floración. Asimismo, la dispersión de semillas sucedió a un ritmo distinto, en L. acapulcense y T. chrysantha ocurrío en secas (primavera) y C. schiedeana a inicios de invierno. En las especies caducifolias, el crecimiento foliar no coincide con la maduración de frutos, que se presenta durante primavera y otoño. Esto se debe a la distribución de recursos (nutrientes) para la producción de órganos, en los períodos más favorables del año (Opler et al., 1980).
En general, las especies estudiadas tuvieron distintos patrones fenológicos a pesar de compartir la misma región fisiográfica, y pueden identificarse con una de las tres estrategias (competidores, tolerantes al estrés y ruderales) propuestas por Grime (2001). Las pioneras florecen a lo largo del año, en cambio las de fases sucesionales tardías lo hacen en períodos marcados anualmente o, incluso, cada dos o tres años (Plana, 2000). El desfase de los picos de floración y fructificación entre especies disminuye la competencia por los dispersores y polinizadores comunes dentro de una comunidad vegetal (Snow, 1965), y además define la dieta de los consumidores acorde con la disponibilidad de alimento (van Schaik et al., 1993). Por lo tanto, la coincidencia de los factores bióticos con los ciclos fenológicos determinan la fuerza u ocurrencia de los picos de las fenofases; los climáticos definen el tiempo en que se dan los procesos bióticos relacionados con la fenología. En este estudio, el manejo del suelo pudo ejercer algún efecto en los patrones fenológicos descritos, aunque el alcance de la investigación no permitió discernir su magnitud.
En estudios realizados en Costa Rica y México se ha observado que T. chrysantha florece en secas (enero-mayo) (Borchert et al., 2004), y al igual que T. neochrysantha A.H.Gentry y T. rosea (Bertol.) Bertero ex A. D.C. produce flores, inmediatamente, después del desprendimiento de sus hojas (Borchert, 1983); asimismo coinciden con la mayoría de los árboles de selva baja, que florecen en tiempos cortos (7-9 semanas) y de extrema sequía (Opler et al., 1980; Kochmer y Handel, 1986).
El patrón fenológico de L. acapulcense fue diferente a lo citado por Pennington y Sarukhán (2005), ya que su floración y fructificación fueron más prematuras que en el bosque tropical lluvioso, donde taxa de la familia Fabacea presentan flores en distintos momentos del año (Ochoa-Gaona et al., 2008). L. watsonii Rose, taxon siempre verde, comparte la floración con L. acapulcense (abril-mayo). No obstante, la caída de hojas coincidió, parcialmente, con lo señalado por Pennington y Sarukhán (2005), con una duración de dos meses (febrero-marzo) en la zona de estudio.
Sólo algunos eventos fenológicos tuvieron relación con las variables climáticas. La formación de yemas foliares en C. schiedeana y T. chrysantha presentó una relación positiva evidente con la precipitación: las yemas foliares se formaron a medida que avanzó la época de lluvia.
En cambio L. acapulcense no pareció depender de la precipitación, porque sus yemas emergieron en la estación con menor lluvia y temperaturas más altas. Esta respuesta puede deberse a que L .acapulcense tiene un sistema radicular más profundo que le permite mayor acceso a la humedad del suelo (Meinzer et al., 1999), por lo que es tolerante a la sequía.
La caída de hojas, formación de yemas florales y fructificación se relacionaron con la temperatura. La fructificación y la defoliación de L. acapulcense y T. chrysantha avanzaron conforme disminuyeron las temperaturas; es decir, correspondieron con el otoño e invierno. La velocidad de la caída de hojas en épocas secas coindició con la disminución de la humedad del suelo y el aumento del estrés hídrico de los árboles (Reich y Borchert, 1984).
Los taxa mostraron arquitecturas muy distintas. El modelo de Troll, adoptado por L. acapulcense es uno de los principales en la familia Fabaceae; y se caracteriza por la presencia de ejes horizontales con superposición continua (Hallé et al., 1978), sus características morfométricas permiten inferir atributos estructurales relacionados con el ambiente: árbol pionero, láminas pinnadas, ramas secundarias y terciarias lo suficientemente flexibles para reducir la resistencia aerodinámica a fuertes rachas de viento; desarrollan un número reducido de hojas pequeñas, sostenidas en peciolos delgados y más flexibles (Vogel, 1989; Ennos, 1997).
Tabebuia chrysantha adquirió el modelo de Leeuwenberg, por sus ejes erectos (ortótropos), con crecimiento determinado y con inflorescencias terminales, característico de especies de vegetación secundaria y sitios con disturbio (Hallé et al., 1978).
El modelo de Attims se asoció a C. schiedeana, con un eje principal y ramas ortótropas, con crecimiento y ramificación contínua e inflorescencias laterales.
El modelo de L. acapulcense se asemejó al propuesto por Vester (2002) para L. latisiliquum (modelo de Troll). El de Leeuwenberg que representó a T. chrysantha se ha atribuido a T. rosea (Borchert y Tomlinson, 1984; Vester, 2002). Sin embargo, Vester (2002) atribuye el modelo de Roux a C. pallens, diferente del modelo de Attims de C. schiedeana, por la orientación horizontal de las ramas.
La arquitectura de los árboles es el resultado de la influencia de factores ontogenéticos y morfogenéticos que afectan todos los niveles de organización del organismo, en cada etapa de su desarrollo y durante todo su periodo de vida (Barthélémy y Caraglio, 2007). Así, la combinación espacial y temporal de los caracteres, el ciclo de vida y el hábitat determinan los distintos tipos de ramificación (Weberling et al., 2002). Sin embargo, la arquitectura de los árboles examinados en este estudio difirió de aquéllos que crecen en sitios sin disturbio, porque las condiciones de competencia en suelos de uso agropecuario son distintas a las que existen en comunidades vegetales.
En la agroforestería se desea manejar y dar forma a los componentes leñosos que comparten, en lugar de competir por los recursos ambientales (Huxley, 1999). Por eso, es necesario agrupar las plantas leñosas usadas con base en su funcionalidad, para lo cual se deben tomar en cuenta las formas que mejor se adapten a una circunstancia particular para optimizar la producción (Donald, 1968). Las tres especies consideradas en la presente investigación pueden considerarse ideotipos competentes y complementarios, cuyos atributos estructurales son compatibles con otras plantas cultivadas y con el ganado, en las situaciones particulares de los sitios estudiados.
Los tres taxa evidenciaron cualidades fenológicas y arquitectura arbórea adecuadas para incluirse en sistemas agroforestales. La presencia de hojas en L. acapulcense y C. schiedeana en época de lluvias (verano), no interfiere con el desarrollo de cultivos de temporal y de gran importancia en la región (maíz y frijol), porque tienen hojas de tamaño reducido que garantizan menor interferencias al paso de luz. Por su arquitectura, C. schiedeana con su copa estrecha, índice de densidad foliar (1.75 m2 m-3) y la cobertura de suelo bajo su dosel (solo 7.5 % menor que a pleno sol) constituyen atributos aprovechables para establecerla en cercos vivos de potreros.
Lysiloma acapulcense, con foliolos y foliolulos pequeños, ramas horizontales que mejoran la captura de luz (King y Maindonald, 1999) y menor índice de densidad foliar en época de lluvias (1.17 m2 m-3) proporciona una cobertura del suelo bajo su dosel igual o mayor que a pleno sol (24.6 %) que lo diferencia de las otras dos especies, probablemente, por ser de la familia
Fabaceae. Por lo tanto, es factible aprovecharla como árbol disperso dentro de los potreros, asociados a gramíneas u otros taxa forrajeros, ya que favorece el desarrollo de estas, debido a la simbiosis que las Fabaceas establecen con bacterias del suelo (Bloom, 2015). Tabebuia chrysantha, con un índice de área foliar (2.01 m2 m-3) superior a las otras especies, su influencia en la cobertura de suelo (55.8 % menos bajo el dosel) y copa amplia es ideal para establecerla en cercos vivos y linderos maderables, además como árboles dispersos en los potreros para sombra del ganado y protección de corrientes y fuentes de agua (Beer et al., 2003).
Conclusiones
Las tres especies arbóreas estudiadas tienen fenología y arquitectura que les confieren potencial para plantarlas en sistemas agroforestales, con algunas diferencias que significan asignarles distintos espacios y funciones en esos sistemas. L. acapulcense tiene más atributos que la hacen idonea para asociarse a pastizales u otros cultivos, disperso o con algún arreglo espacial. C. schiedeana y T. chrysantha pueden utilizarse en espacios como cercos vivos y linderos maderables para no interferir con los cultivos, y al mismo tiempo brindar servicios ambientales, como embellecimiento del paisaje, reforestacion y mejoramiento de suelos, y, a la vez, contribuir al rescate de especies nativas de importancia cultural y con valor de uso.











 texto em
texto em