Introducción
Phytophthora cinnamomi Rands, 1922 es un patógeno del suelo causante de pudrición de la raíz, que en el siglo pasado devastó 200 mil hectáreas de vegetación natural en Australia, y destruyó a más de 400 especies hospedantes (Malajczuk, 1979). Es también responsable de serias pérdidas anuales de castaño (Castanea sativa Miller), plantas de arándano (Vaccinium myrtillus L.) y plantas ornamentales dentro de los viveros forestales de Estados Unidos de América. Este patógeno se ha registrado, además, en Argentina, España, Sudáfrica, Sudamérica y Taiwán donde ataca a un amplio número de hospederos (Zentmyer, 1980; Robin et al., 1992; Brasier et al., 1993; Erwin y Ribeiro, 1996). En México, Ph. cinnamomi ha causado daños en extensas áreas productoras de aguacate (Persea americana L.), como en Atlixco, Puebla, cuyo cultivo ha desaparecido de grandes regiones (Téliz y Mora, 2007). Además, incide en especies forestales en los bosques de El Arrayanal, en el estado de Colima, donde provocó la muerte de árboles de encino (Tainter et al., 2000); lo mismo ocurrió en Tecoanapa, Guerrero (Alvarado et al., 2008).
Este oomicete fitopatógeno es muy agresivo para las plantas, y repercute en aspectos económicos diversos (Hardham, 2005). Los síntomas característicos de la enfermedad a partir del daño radicular, consisten en clorosis del follaje, su marchitamiento y en un rápido desprendimiento del mismo, lo que propicia una reducción en la transpiración (Erwin y Ribeiro, 1996; Moralejo et al., 2009). Ingresa a la planta a través de la raíz y también invade la base del tronco de su hospedante, pero las plantas poseen mecanismos de defensa que impiden que el organismo avance, limitando su infección; algunas de estas defensas son las barreras bioquímicas preformadas y los compuestos fenólicos. La resistencia de la planta a los patógenos que afectan la raíz con frecuencia se evalúa a nivel histológico (Glazebrook, 2005; Obwald et al., 2014). Por lo anterior, los objetivos de este estudio consistieron en determinar la susceptibilidad de plántulas de Pinus patula Schiede ex Schltdl. et Cham. y P. pseudostrobus Lindl. a la infección por Phytophthora cinnamomi, así como realizar un análisis histológico de la raíz para describir los daños inducidos por este hongo.
Materiales y Métodos
Se trabajó con 48 árboles de 11 meses de edad donados por el vivero forestal Molino de las Flores, a razón de 24 individuos por especie (P. patula y P. pseudostrobus), que se mantuvieron en condiciones de invernadero, para posteriormente ser inoculados. El experimento se realizó en dos etapas: la primera fase consistió en la incorporación de Phytophthora cinnamomi en las plantas, mientras que la segunda se basó en el proceso histológico de las muestras inoculadas; se seleccionaron las especies forestales citadas, debido a su amplio intervalo de adaptación y a su importancia comercial.
Prueba de patogenicidad
Se aplicó el método de inoculación de sustrato con micelio, que consiste en tomar colonias de Phytophthora cinnamomi para obtener inóculo a una concentración de 3.3 x 108 fragmentos miceliales. Los árboles se inocularon a raíz desnuda por inmersión en la suspensión de fragmentos miceliales durante 3 h; como testigo se usaron 12 plantas de cada especie, a las cuales se les sumergió la raíz solo en agua destilada estéril. Una vez pasadas las 3 h, cada árbol se plantó en un sustrato estéril compuesto por Peat Moss y tierra de monte estéril en una relación de 3:1. Las plantas se sometieron a 100 % de humedad relativa y una temperatura 22±3 °C durante 72 h; se mantuvieron en el invernadero en condiciones de manejo normal.
Antes de la aparición de síntomas, se obtuvieron muestras de raíces de 10 mm de longitud, tanto de los árboles inoculados como de los testigo. Una vez que se observaron los primeros indicios de daño, se tomaron las siguientes muestras, para lo cual se realizó un corte de la raíz de aproximadamente 1 cm, que se sumergió en una solución fijadora a base de una mezcla de formaldehido, ácido acético glacial, agua destilada y alcohol etílico al 96 % (FAA). En total se realizaron seis recolecciones de muestras de cada especie de Pinus a intervalos de 4 días a partir de la inoculación.
Análisis histológico
Para el procesamiento de las muestras para estudios histológicos, se siguió el procedimiento modificado descrito por Leyva et al. (2012) y Tovar et al. (2012). Para ello, se lavaron muestras de raíz fijadas en la solución de FAA con agua corriente durante 10 min y se infiltraron en un procesador automático de tejidos modelo 4640-B (Tissue-Tek II®). La deshidratación se realizó en una serie gradual de alcohol etílico (30, 50, 70, 85, 96 y 100 %), después de lo cual se pasaron por una mezcla de etanol absoluto-xileno (1:1) y tres cambios de xileno al 100 % a intervalos de 2 h en cada uno de los cambios. La inclusión en Paraplast (Sigma®) se llevó a cabo durante 96 h.
Con la ayuda de un micrótomo de rotación Spencer 820 (American Optical®) se obtuvieron cortes transversales de 10 μm de cada muestra, mismos que se colocaron en baño de flotación a 45-50 °C. Bajo estas condiciones los cortes se extendieron y adhirieron a los portaobjetos. Los cortes obtenidos se desparafinaron en tres cambios de xileno absoluto (3 min cada uno). Paso seguido, las se hidrataron en alcohol etílico al 100, 96 y 70 % (3 min en cada cambio); se tiñeron con safranina (Sigma®) al 1 % durante 24 h y se enjuagaron con agua corriente hasta que el agua se tornó cristalina. Enseguida, las secciones se lavaron con alcohol etílico al 50, 70 y 96 % (3 min cada uno) más ácido pícrico y se tiñeron con verde rápido (Química Técnica®) durante 10 s. Después, se lavaron con aceite de clavo para retirar el exceso de colorante y se aclararon con una mezcla de aceite de clavo, xileno y etanol absoluto. Para finalizar, las muestras se colocaron en xileno al 100 %, se montaron en resina sintética y se examinaron en un microscopio compuesto (Olympus BX41).
Resultados y Discusión
Prueba de patogenicidad
Phytophthora cinnamomi indujo diferentes síntomas según el tiempo de infección en las dos especies de Pinus inoculadas artificialmente, mientras que las plantas testigo no presentaron ningún cambio apreciable y permanecieron asintomáticas (Figura 1A y 2A). Cuatro días después de la inoculación (ddi), las plantas de P. patula mantuvieron su vigor y su apariencia (Figura 1B), además de que no exhibieron signos del patógeno. A los 8 ddi los arboles mostraron severo decaimiento de acículas, a partir de la sección superior del árbol (Figura 1C). A los 12 ddi, aunado al decaimiento del árbol, se apreció amarillamiento de las acículas, y, en la base del árbol, algunas de ellas se secaron y adquirieron una coloración amarilla y café-clara (Figura 1D). A los 16 ddi la deshidratación de acículas se tornó más evidente y la parte de arriba del tallo tomó una coloración grisácea (Figura 1E). A los 20 ddi los árboles estaban secos en más de tres cuartas partes y tenían color café intenso, además de pérdida de vigor y a los 24 ddi estaban completamente secos (Figura 1F).

Figura 1 Síntomas causados por Phytophthora cinnamomi Rands, 1922 en plántulas de Pinus patula Schiede ex Schltdl. et Cham. observados a diferentes días después de la inoculación (ddi). (A) Planta testigo, B) Planta a 4 ddi, C) Planta a 8 ddi, D) Planta a 12 ddi, E) Planta a 16 ddi, F) Planta a 20 ddi.
Por otra parte, los ejemplares de P. pseudostrobus inoculados no exhibieron signos que indicaran la presencia del patógeno, además de que conservaron su tono y su vigor hasta los 4 ddi (Figura 2B). A los 8 ddi se pudo distinguir un muy ligero decaimiento de acículas, las cuales empezaron a perder turgencia (Figura 2C). A los 12 ddi los árboles experimentaron un decaimiento visible de acículas con un amarillamiento incipiente (Figura 2D). A los 16 ddi el debilitamiento de las mismas prevaleció y comenzó a destacarse un color café claro en ellas (Figura 2E). A los 20 ddi estas estructuras ya no tenían turgencia y la mayor parte del árbol se cambió hacia un tono café (Figura 2F).

Figura 2 Síntomas causados por Phytophthora cinnamomi Rands, 1922 en plántulas de Pinus pseudostrobus Lindl. observados a diferentes días después de la inoculación (ddi). (A) Planta testigo, B) Planta a 4 ddi, C) Planta a 8 ddi, D) Planta a 12 ddi, E) Planta a 16 ddi, F) Planta a 20 ddi.
Los daños que evidenció la parte aérea de las plantas de P. patula fueron ostensibles a partir de la declinación del árbol, que consistió en un marchitamiento de la copa; a esto continuó un amarillamiento de las acículas para después tornarse café y luego marrón, lo que continuó hasta que el árbol quedó completamente seco. Las acículas se hicieron frágiles y se desprendían con facilidad, y, por su parte, las raíces se volvieron quebradizas y con necrosis.
En P. pseudostrobus los síntomas fueron semejantes, con la diferencia de que el decaimiento de las acículas fue gradual, es decir más lento, sin embargo, después se verificó su amarillamiento hasta que el árbol estuvo muerto. De igual forma, las raíces se tornaron frágiles y necrosadas. El aspecto anterior coincidió con lo descrito por Zentmyer (1980) y Chavarriaga et al. (2007) para ejemplares de Pinus spp. infectados por Phytophthora cinnamomi.
Análisis histológico de raíces de P. patula
Los árboles testigo no registraron cambios significativos durante todo el proceso. El corte histológico correspondiente a las raíces de estos ejemplares reveló la presencia de la peridermis, conformada por una capa de células lignificadas (esclereidas) y por la hipodermis ubicada por debajo de la capa anterior (Figura 3A). El floema y el xilema no exhibieron ninguna alteración ni estructuras fúngicas (Figura 3B).
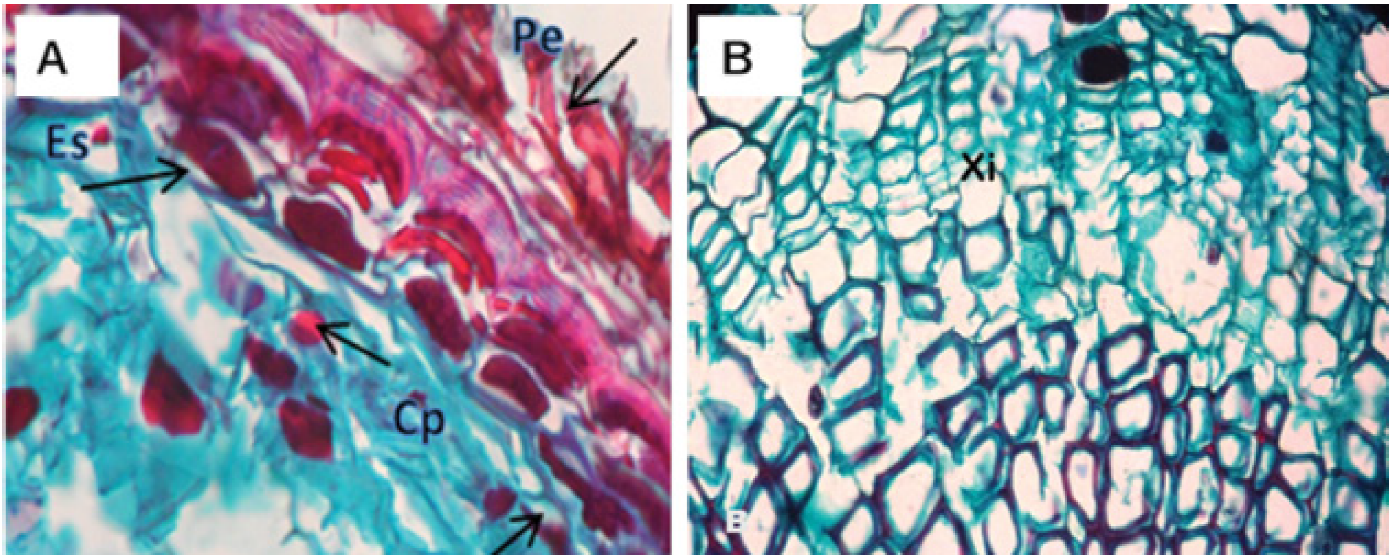
Figura 3 Microfotografía de corte transversal de raíz sana de Pinus patula Schiede ex Schltdl. et Cham. A) Vista de peridermis (Pe), contenido de polifenoles (Cp) y esclereidas (Es). B) Floema (Flo) y xilema (Xi).
El análisis histológico de raíces recolectadas a los 4 ddi no mostró modificaciones importantes, ya que la estructura celular (peridermis, floema y xilema) se mantuvo en orden. Sin embargo, se observaron indicios de polifenoles en las células del xilema (Figura 4A). A los 8 ddi, en este último ocurrió desprendimiento de paredes, pero sin taponamiento de haces vasculares, ni existencia de cuerpos fúngicos, y, al igual que en la muestra anterior, el contenido de polifenoles fue muy escaso (Figura 4B). A los 12 ddi, se identificó una reducción en los polifenoles en el xilema, que fueron densos y más grandes que en los materiales colectados a los 8 ddi, además de que hubo necrosamiento en la peridermis, aunque aún conservó su estructura (Figura 4C y D). En las muestras recolectadas a los 16 ddi se advirtió adelgazamiento de la peridermis, nula presencia de esclereidas y estabilidad en el contenido de polifenoles (Figura 4E). A los 20 ddi se formó una textura rugosa de las paredes del xilema, lo que es atípico en el tejido sano (Figura 4F). Asimismo, a los 32 ddi, los árboles mostraron necrosis generalizada en la peridermis de la raíz y los tejidos como el xilema y el floema ya no fueron reconocibles (Figura 4G).
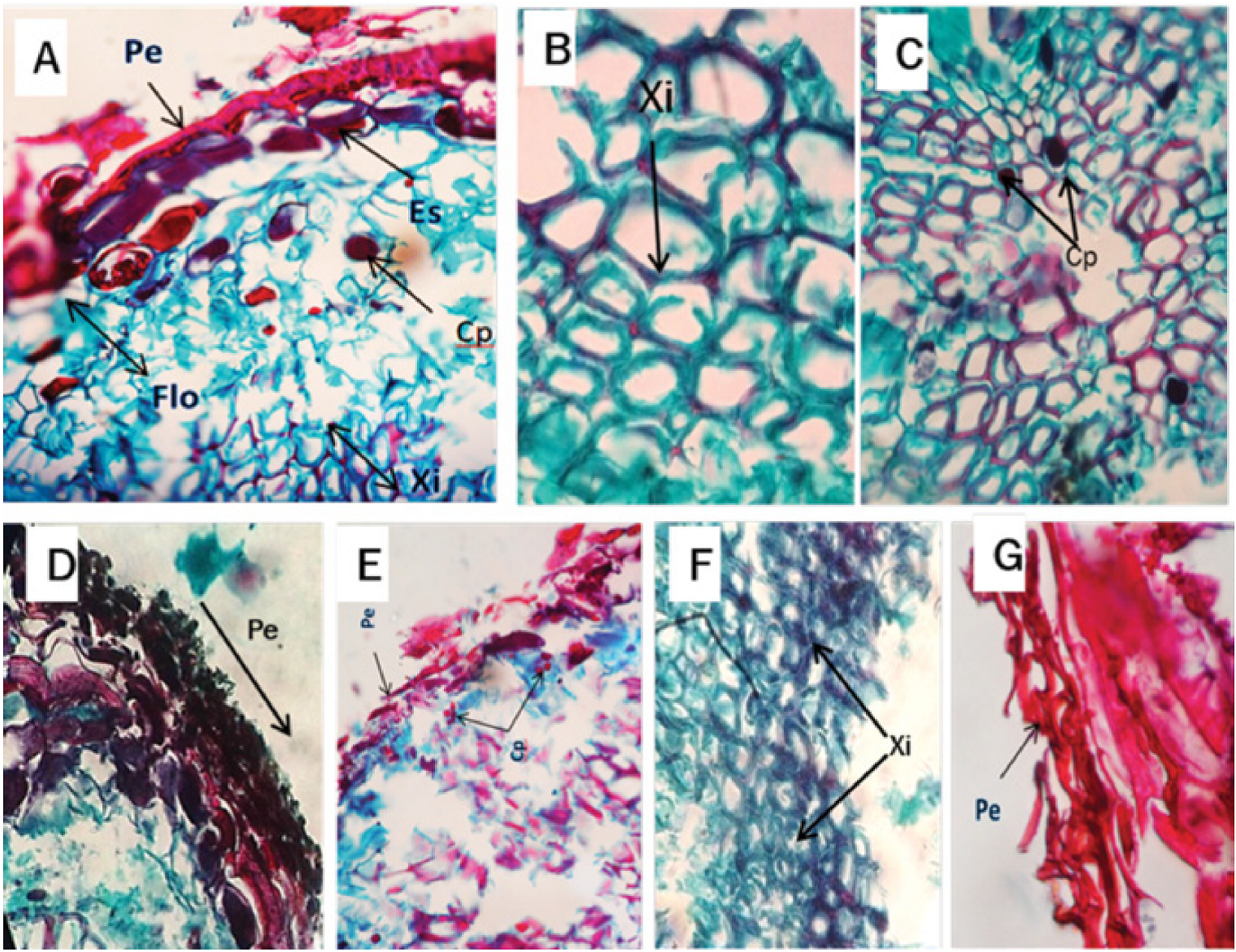
Figura 4 Microfotografía de corte transversal de la raíz de Pinus patula Schiede ex Schltdl. et Cham. infectada por Phytophthora cinnamomi Rands, 1922. A) Peridermis (Pe), esclereidas (Es) floema (Flo), contenido de polifenoles (Cp) y xilema (Xi) a los 4 días después de la inoculación (ddi). B) Corte trasversal de raíz con alteraciones de los tejidos, observándose desprendimiento de las paredes del xilema (Xi) a los 8 ddi. C y D) Corte trasversal de raíz con presencia de polifenoles (Cp) en el xilema a los 12 ddi. E) Peridermis (Pe) y contenido de polifenoles (Cp) a los 16 ddi. F) Corte trasversal de raíz mostrando xilema (Xi) con paredes rugosas a los 20 ddi. G) Peridermis (Pe) a los 32 ddi.
Análisis histológico de raíces de P. pseudostrobus
Al igual que en P. patula, los árboles testigo no presentaron cambios significativos en ningún momento. La estructura del corte histológico correspondiente a sus raíces estaba constituida por la peridermis, que a su vez estaba conformada por una capa de células lignificadas (esclereidas), por debajo de la cual se identificó la hipodermis. El floema no sufrió alteraciones y el xilema no exhibió células con polifenoles ni estructuras fúngicas.
A los 4 ddi, la muestra histológica de los árboles inoculados de P. pseudostrobus mostró presencia moderada de polifenoles en el xilema (Figura 5A y B). A los 8 ddi reveló una gran cantidad de ellos tanto en el xilema como en el floema, además de la formación de tílides en los vasos del xilema (Figura 5C). A los 12 ddi se observó un adelgazamiento de la peridermis, mayor número de polifenoles e incluso incremento del tamaño en las células del floema (Figura 5D). A los 16 ddi el corte histológico del xilema mostró un engrosamiento de sus paredes (Figura 5E). A los 20 ddi se verificó una completa desorganización celular de los elementos de la raíz (Figura 5F) y a los 32 ddi los árboles se murieron.
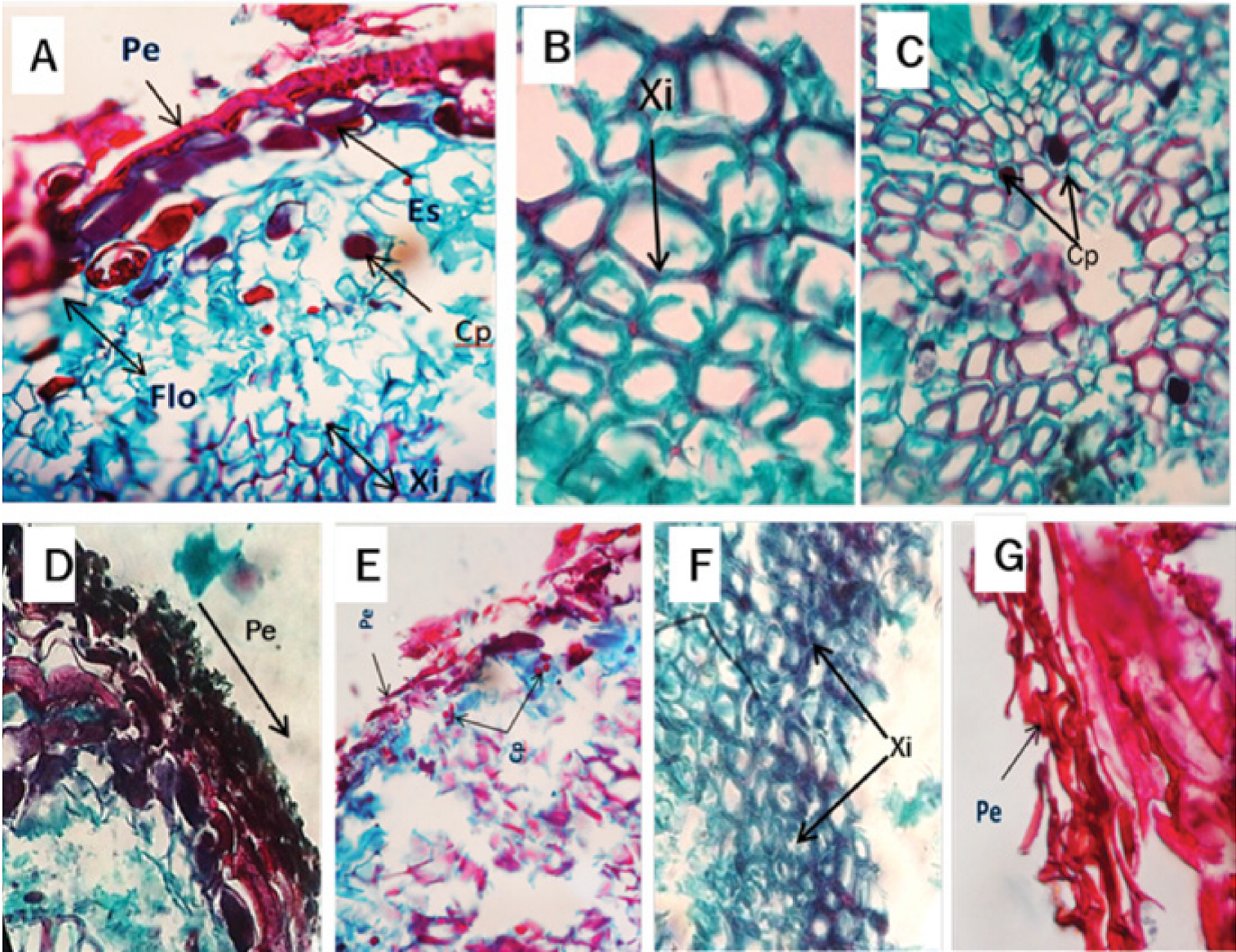
Figura 5 Microfotografía de corte transversal de la raíz de Pinus pseudostrobus Lindl. infectada por Phytophthora cinnamomi Rands, 1922. A y B) Presencia de polifenoles (Cp) en el xilema a los 4 días después de la inoculación (ddi). C) Tílides (Ti) en el xilema a los 8 ddi. D) Peridermis (Pe), contenido de polifenoles (Cp) y floema (Flo) a los 12 ddi. E) Xilema normal (XiN) y xilema engrosado (XiE) a los 16 ddi. F) Peridermis (Pe) a los 20 ddi.
En el análisis histológico realizado en plantas de P. patula infectadas por Ph. cinnamomi se observó daño en el floema y en menor medida en el xilema, comportamiento propio de la infección por especies del género Phytophthora generalmente desarrollado como producto de la invasión de hifas sobre la corteza (Brummer et al., 2002; Oh y Hansen, 2007; Horta et al., 2010; Portz et al., 2011). Además, el xilema exhibió desprendimiento celular, lo que indica la pérdida severa de turgencia, y degradación de las paredes celulares, probablemente por efecto de las enzimas extracelulares como pectinas, las cuales son producidas por especies de Phytophthora (Brummer et al., 2002). Asimismo, se detectaron polifenoles y necrosamiento de la peridermis, lo cual es común en infecciones inducidas por el hongo. (Erwin y Ribeiro, 1996).
Por otra parte, las plantas inoculadas de P. pseudostrobus mostraron el xilema menos afectado en comparación con el floema, además de que hubo una gran concentración de polifenoles, principalmente en el xilema. Esto pudiera deberse a que la síntesis y la acumulación de fenoles aumenta después de haberse producido la infección; varios de estos compuestos son potentes inhibidores de diversas enzimas hidrolíticas incluyendo las pectolíticas. Se observaron tílides en los vasos del xilema, que debido a su tamaño y abundancia, pueden obstruir los vasos por completo y bloquear, así, el avance del patógeno. En general, las variedades vegetales que forman pocas tílides o ninguna frente al patógeno son siempre susceptibles a las enfermedades (Agrios, 2005).
Los tejidos presentaron engrosamiento de las paredes celulares debido a una plasmólisis por un desequilibrio grave en la osmorregulación de las raíces, así como necrosamiento de la peridermis.
A pesar de confirmar diversos cambios en los tejidos internos de la raíz, no se detectaron hifas de Ph. cinnamomi, debido, tal vez, a que varias de Phytophthora spp. son capaces de infectar directamente el tronco de ciertas especies hospedantes por medio de lenticelas, raíces adventicias o heridas, y luego invaden y destruyen con suma rapidez la corteza y el tejido del floema. Tal es el caso de la acción del patógeno referido sobre Eucalyptus marginata Donn ex Sm. (Hardy et al., 1996) y E. calophylla Lindl. (O´Gara et al., 1997), que invadió a los ejemplares por el tronco. Sin embargo, estudios realizados por Ruiz et al. (2015) en plantas de Quercus ilex L. de seis meses de edad e inoculadas con Ph. cinnamomi, registraron una colonización del apoplasto y penetración en las células corticales. Al llegar a los tejidos parenquimatosos del cilindro central, el hongo desarrolló diferentes estructuras reproductivas dentro de la célula y provocó algunas respuestas por parte del hospedante como el engrosamiento de la pared celular y la acumulación de compuestos fenólicos.
Conclusiones
Las raíces de Pinus pseudostrobus y de Pinus patula infectadas con Phytophthora cinnamomi mostraton diversas alteraciones histológicas como aumento del contenido de polifenoles, degradación de paredes celulares, presencia de tílides y necrosamiento de la peridermis. Las alteraciones fueron más ostensibles en los árboles de P. pseudostrobus.











 texto en
texto en 


