Introducción
La superficie forestal en México supera 144 millones de hectáreas, lo que equivale a 74 % del territorio nacional; casi 120 millones de hectáreas son severamente explotadas sin un manejo correcto, lo que propicia un gran deterioro (Cibrián et al., 2007).
El pino mexicano (Pinus patula Schiede ex Schltdl. & Cham.) es una de las principales especies utilizadas para las plantaciones comerciales intensivas en el país y en el extranjero, debido a su tasa de crecimiento excepcionalmente rápido, buena forma de tronco y características favorables de la madera para los productos de celulosa (Dvorak et al., 2000). El pino blanco (Pinus pseudostrobus Lindl.) tiene una amplia distribución geográfica natural en México y ofrece buena calidad de madera y productividad (Perry, 2009).
En los últimos años, en México se ha considerado conveniente reconocer la importancia de las enfermedades forestales en cuatro escenarios: bosques naturales, plantaciones, viveros forestales y árboles en áreas urbanas. El damping-off o marchitez de plántulas es una de las primeras enfermedades que el viverista enfrenta y que en ocasiones le causa entre 15 y 40 % de merma (Cibrián et al., 2007). Además de, ser una limitante para la producción de algunos taxa, sobre todo de coníferas, constituye uno de los obstáculos más serios en la producción de plantas a gran escala (Torres, 2003).
Los árboles de coníferas pueden sufrir un daño significativo por enfermedades en vivero, causadas por Fusarium spp. Estos hongos fitopatógenos son responsables tanto de damping-off en pre y posemergencia, como de que las infecciones latentes resulten en el fracaso de las plántulas trasplantadas y en su establecimiento (Cibrián et al. 2007; Gordon et al., 2015). Fusarium oxysporum Schltdl. se ha reconocido como la causa más importante de la pudrición de raíz e hipocotilo, en viveros. Asimismo, el manejo de las enfermedades de raíz provocadas por Fusarium en dicho ámbito se basa, principalmente, en la fumigación de suelos antes de la siembra (Gordon et al., 2015).
En este contexto, los objetivos propuestos en el presente estudio consistieron en identificar a las especies de fitopatógenos causantes de los síntomas de pudrición de raíces y marchitez de plántulas de Pinus patula y P. pseudostrobus, mediante la combinación de su caracterización morfológica, análisis de secuencias ITS del ADNr, y pruebas de patogenicidad, así como determinar la incidencia y severidad provocada por los patógenos responsables de inducir dicha enfermedad.
Materiales y Métodos
Recolección de muestras
Durante 2013 y 2014 se llevó a cabo un muestreo dirigido en un vivero forestal localizado en Chilpancingo, Guerrero, México, en donde se recolectaron 20 plántulas de Pinus patula y P. pseudostrobus con síntomas de marchitez y pudrición de raíz.
Aislamiento, purificación y conservación de hongos
Para aislar al agente causal, se desinfestaron fragmentos de raíces de P. patula y P. pseudostrobus con síntomas de pudrición seca; para ello, se utilizó la inmersión en una solución de hipoclorito de sodio al 2 % durante 3 min; enseguida se lavaron dos veces en agua destilada esterilizada y se colocaron en cajas de Petri de 90 mm de diámetro con 20 mL de medio de cultivo papa dextrosa agar (PDA) (Difco), con estreptomicina (Sigma®). Las cajas se colocaron en incubación a 25 °C, bajo un régimen de 12 h luz / 12 h de oscuridad.
Después de tres días de incubación, las colonias fúngicas con mayor frecuencia se transfirieron a cajas Petri con medio de cultivo PDA fresco y se colocaron en incubación bajo las condiciones anteriormente descritas. Una vez que se produjeron esporas, la purificación de los aislados se realizó con la técnica de cultivos monospóricos, mediante la transferencia de una espora a medio de cultivo PDA fresco. La conservación de los aislamientos se llevó a cabo con la transferencia de discos miceliales (5 mm de diámetro) a tubos criogénicos de 2 mL, con 1.5 mL de glicerina al 20 % (v/v) y almacenados a -80 °C.
Caracterización morfológica
La identificación de los aislados fúngicos se realizó a partir de la caracterización morfológica de sus estructuras de reproducción asexual. Para ello, fueron transferidos a medio de cultivo PDA y se incubaron a 25 °C bajo condiciones de luz continua. Después de 12 días de incubación, se hicieron preparaciones semipermanentes en glicerina al 100 %, con la finalidad de reconocer sus componentes en el microscopio compuesto Olympus BX41. Se efectuó la observación de 100 macroconidios y 100 microconidios, se registró la forma, tamaño, coloración y número de septos. Para la formación de fiálides fue necesario cultivar los aislados fúngicos en medio de cultivo a base de puré de papa-agar durante cuatro días. Posteriormente, se preparó una cámara húmeda en una caja Petri de 90 mm con papel secante humedecido a punto de saturación, con agua destilada estéril; se transfirieron discos de 5 mm de PDA con crecimiento micelial y se incubaron durante tres días. Una vez transcurrido el tiempo, las fiálides producidas en la cámara húmeda se observaron en el microscopio compuesto antes señalado. La identificación morfológica de los hongos, a nivel de género, se llevó a cabo con el uso de claves especializadas (Barnett y Hunter,1998); la identificación de las especies se basó en las descripciones de Leslie y Summerell (2006).
Prueba de patogenicidad
La patogenicidad de seis aislados identificados morfológicamente como Fusarium, se determinó con base en la inoculación de 70 plántulas de Pinus patula y P. pseudostrobus de un año de edad. La inoculación se hizo por inmersión de las raíces en una suspensión de conidios (1 x 106 esporas mL-1) por 10 h. Se utilizaron 10 plántulas de cada especie, cuyas raíces se colocaron por 10 h en agua destilada estéril, mismas que sirvieron como testigo. Concluido este paso, las plántulas se depositaron, individualmente, en macetas con Peat Moss y agrolita (2:1), las cuales se colocaron en un invernadero bajo condiciones de 20 a 25 °C y humedad relativa de 50-80 %. La prueba de patogenicidad se efectuó dos veces.
La incidencia de la enfermedad se determinó mediante el registro de los síntomas y el número de árboles muertos. Con estos datos se calculó el área bajo la curva del progreso de la enfermedad (ABCPE), con el método de integración trapezoidal (Campbell y Madden, 1990). La severidad de la enfermedad se estimó por aislado fúngico y en cada una de las dos especies de Pinus, con la fórmula de Townsend y Heuberger:
Donde:
n = Grado de infección acorde a la escala
v = Número de plantas por categoría
N = Grado máximo de infección
V = Número de plantas en total
De acuerdo a los diferentes grados de infección, se definió una escala porcentual de la severidad aparente, de la siguiente manera: Clase 0 = 0 % de daño (planta asintomática); Clase 1 = 20 % de daño (acículas caídas); Clase 2 = 40 % de daño (clorosis o amarillamiento); Clase 3 = 60 % de daño (puntas secas); Clase 4 = 20 % de daño (marchitez); Clase 5 = 20 % de daño (plantas muerta). Con los resultados obtenidos a partir de las interacciones de cada uno de los aislados y las dos especies de pino evaluadas, se construyeron curvas de progreso de la enfermedad, las cuales fueron ajustadas a modelos epidemiológicos (Logístico, Exponencial, Monomolecular y Gompertz) con la finalidad de determinar los parámetros de intensidad inicial de la enfermedad (0) y la tasa de incremento (r), y con ello tener un indicativo de la forma y estructura de desarrollo de la enfermedad (Campbell y Madden, 1990). El ajuste de los modelos epidemiológicos y ABCPE se realizó con el programa SAS ver. 9.3. (SAS, 2011).
Extracción de ADN, amplificación por PCR y secuenciación
La extracción de ADN genómico de seis aislados fúngicos evaluados en la prueba de patogenicidad e identificados morfológicamente como pertenecientes al género Fusarium se hizo mediante la maceración de 50 a 100 mg del micelio de colonias con 10 días de edad. Posteriormente, se siguió el protocolo indicado en el kit de extracción Plant DNeasy Mini Kit (Qiagen®). La calidad del ADN se verificó por electroforesis en gel de agarosa al 0.8 %, con buffer de corrida TBE 0.5 X, para lo cual se usaron 5 μL de ADN, a 90 volts. El gel se analizó en un transiluminador Gel-Docmod 2000 (BIORAD®)
Para la PCR se utilizaron los iniciadores universales ITS5/ITS4 (White et al., 1990). La mezcla de reacción se preparó a un volumen final de 25 μL, buffer de PCR 1X, 2.5 mM MgCl2, 0.2 mMdNTP, 0.4 μM de cada primer, 1U ADN polimerasa BioTecMol® y 100 ng de ADN. La PCR se llevó a cabo en un termociclador C1000 (BIORAD®) con una desnaturalización inicial de 94°C por 2 min, seguida de 35 ciclos de 94°C por 30 s, 55 °C por 30 s, 72 °C por 1 min; y una extensión final de 72 °C por 10 min. Los productos amplificados se verificaron por electroforesis en gel de agarosa al 0.8 %. El gel se analizó en un transiluminador Gel-Docmod 2000 (BIORAD®).
Los fragmentos amplificados con los iniciadores ITS5/ ITS4, se purificaron siguiendo el protocolo de DNA clean and concentrator (Zymo Research ®). Para ello, en un tubo de microcentrífuga de 1.5 mL se agregaron 5 volúmenes del buffer DNA Binding y se mezcló por inversión. La mezcla se transfirió en una columna Zymo-Spin en un tubo de colección de 2 mL. Se centrifugó durante 30 s a 8 000 rpm, y se descartó el sobrenadante. Se agregaron 200 μL de buffer DNA Wash dentro de la columna y se centrifugó durante 30 s a 8 000 rpm. Se descartó el sobrenadante y se cambió a un tubo nuevo de 2 mL. Se adicionaron 60 μL buffer de DNA Elution directamente en la columna, y el producto se incubó durante 1 min. Se transfirió la columna a un tubo nuevo de 1.5 mL y se diluyó el ADN. Los fragmentos de ADN purificados se mandaron a secuenciar a la empresa Macrogen ® de Corea. Las secuencias obtenidas se compararon en la base de datos en NCBI con la herramienta BLASTn.
Resultados y Discusión
Identificación morfológica
Del material vegetal sintomático se obtuvieron seis aislados, de los cuales los de mayor frecuencia fueron de dos tipos: el primero mostró crecimiento micelial blanco-amarillento, y el segundo crecimiento micelial inicialmente blanco, pero con el paso del tiempo se tornó de color rojo-violáceo; ambos tipos de crecimiento fueron afelpados. Tales tipos de colonias se han registrado para especies de Fusarium (Nelson et al., 1983; Leslie y Summerell, 2006).
El aislado con crecimiento micelial de coloración púrpura- violeta en medio de cultivo PDA (Figura 1A-B), presentó macroconidios falcados, hialinos, con pared delgada, de 3-5 septos, de 19-43 x 3.1-5.4 μm y con célula basal en forma de pie (Figura 1C). Microconidios elípticos a ovales, unicelulares (Figura 1D). Monofiálides no ramificadas cortas y agudas (Figura 1E). Clamidosporas en pares, intercalares y terminales (Figura 1F). Todas las características coincidieron con lo consignado por Leslie y Summerell (2006) para Fusarium oxysporum.

A) Colonia de 8 días de edad; B) Reverso de colonia con coloración roja-purpura; C) Macroconidios; D) Microconidios; E) Fiálides; F) Clamidosporas.
Figura 1 Morfología de colonias y estructuras de reproducción asexual de Fusarium oxysporum Schltdl. obtenido de raíces de Pinus spp. con síntomas de pudrición de raíz
El aislado fúngico con crecimiento micelial algodonoso blanco-amarillento (Figura 2A-B) exhibió macroconidios hialinos, fusiformes, robustos, con 5-6 septos, con la célula apical levemente encorvada y puntiaguda (Figura 2 C). Los microconidios fueron ovales y reniformes, hialinos, con 1-2 septos (Figura 2D), y producidos en monofiálides largas (Figura 2E). Las clamidosporas se formaron rápidamente, ovales, intercalares entre las hifas o terminales en las ramas laterales de las mismas, se presentaron solas y en pares. Todas las características coincidieron con los resultados de Leslie y Summerell (2006) para Fusarium solani (Mart.) Sacc. (Teleomorfo: Haematonectria haematococca).
Análisis de secuencias ITS
Las secuencias obtenidas a partir del ADN de los seis aislados fúngicos identificados morfológicamente como Fusarium se compararon con las secuencias de la base de datos del GenBank, cinco de ellas (KU056813, KU056814, KU056816, KU056817, KU056818) mostraron 99 % de identidad con F. oxysporum, mientras que una (KU056815) presentó 99 % de identidad con las de Fusarium solani. Lo anterior confirmó los resultados de la caracterización morfológica; por lo tanto ambas especies del género de interés están involucradas como agentes causales de enfermedades de la raíz en Pinus spp., en México.
A Fusarium oxysporum se le reconoce como agente infeccioso de Pinus strobus L. en Estados Unidos de América (Ocamb y Juzwik, 1995; Ocamb et al., 2002); P. elliottii Engelm. y P. taeda L. en Argentina (Lori y Salerno, 2003); P. wallichiana A. B. Jacks en India (Hassan et al., 2011); P. halepensis Miller en Argelia (Lazreg et al., 2014) y P. tecunumanii F. Schwerdtf. ex Eguiluz & J. P. Perry en Colombia (Herron et al., 2015). Fusarium solani se asocia con tejidos de Pinus strobus en Estados Unidos de América (Ocamb y Juzwik, 1995); P. radiata D. Don en Nueva Zelanda (Dick y Dobbie, 2002); P. elliottii y P. taeda en Argentina (Lori y Salerno, 2003); P. tropicalis Morelet en Cuba (Guerra et al., 2004) y P. halepensis en Argelia (Lazreg et al., 2014).
Prueba de patogenicidad
Quince días después de la inoculación (ddi), todas las plantas inoculadas con la suspensión de esporas exhibieron síntomas de marchitez, mientras que las plántulas testigo permanecieron asintomáticas. A partir de los ejemplares inoculados, se reaislaron colonias de Fusarium, las cuales presentaron las mismas características morfológicas que las inoculadas originalmente, lo que completó así los postulados de Koch. Esto confirmó que Fusarium oxysporum y F. solani son las especies de hongos fitopatógenos causantes de los síntomas de pudrición de raíz y marchitez en plántulas de P. patula y P. pseudostrobus en Guerrero, México. De manera similar, Herron et al. (2015) realizaron pruebas de patogenicidad exitosas con aislados de F. circinatum Nirenberg & O’Donnell, F. marasasianum Herron, Marinc. & M. J. Wingf., F. parvisorum Herron, Marinc. & M. J. Wingf. y F. sororula Herron, Marinc. & M. J. Wingf. en plántulas de Pinus patula en Colombia. Latiffah et al. (2009) identificaron a F. solani y F. oxysporum como los hongos prevalecientes en suelos de un área forestal en Malasia, pero no determinaron la patogenicidad de los aislados.
Incidencia y severidad de la enfermedad
Con respecto a la incidencia de la enfermedad, el aislado 1 de F. oxysporum tuvo 100 % únicamente en P. pseudostrobus a los 8 ddi, mientras que el aislado 2 de F. oxysporum registró el mismo porcentaje en igual periodo para las dos especies de Pinus. Igualmente, F. solani ocasionó 100 % de ella en los dos taxa de Pinus a los 14 ddi (Cuadro 1). Lo anterior es indicativo de que el aislado 2 de F. oxysporum causa enfermedad a una velocidad mayor que los demás, lo cual está sujeto a una combinación positiva de intensidad inicial de la enfermedad y una tasa de incremento, mientras que en los otros aislados no sucedió, y la velocidad en que se alcanzó la totalidad de infestación fue menor.
Cuadro 1 Área bajo la curva del progreso de la enfermedad (ABCPE) en plántulas de Pinus patula Schiede ex Schltdl. & Cham. y Pinus pseudostrobus Lindl. inoculadas con cinco aislados de Fusarium oxysporum Schltdl., y un aislado de Fusarium solani (Mart.) Sacc.
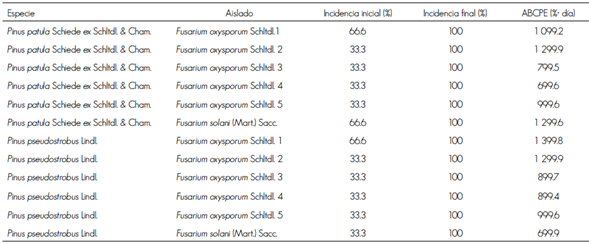
Al determinar la severidad de cada aislado de Fusarium, el de mayor valor fue el 1 de F. oxysporum en P. pseudostrobus, entretanto el aislado de 2 de F. oxysporum fue más virulento en P. patula, pues llegó a matar a los árboles a los 21 ddi. Asimismo, es importante destacar que el aislado de F. solani provocó lo mismo en las plántulas inoculadas en ambos pinos. Lo anterior coincidió con lo establecido por Lazreg et al. (2014) quienes identificaron a siete especies de Fusarium asociadas a plántulas de P. halepensis; definieron diferencias significativas en la longitud de brotes y de raíces, e índice de vigor en plántulas inoculadas con los diversos aislados; además, señalaron que F. solani sobresalió sobre otras especies del género, con respecto a la rapidez con la que colonizaron las raíces completas de los pinos inoculados.
El modelo logístico (y= 1 / (1 + ((1-yo) / yo)* exp (-rL*t)) fue el que mejor describió el progreso de los síntomas en ambos taxa de Pinus, con la presencia de los aislados de Fusarium evaluados a través del tiempo. Para el caso del aislado 2 de F. oxysporum en P. pseudostrobus, se observó que la intensidad inicial de la enfermedad fue mayor con respecto a P. patula, pero la velocidad de incremento de la severidad fue menor. Para el aislado de F. solani, las dos especies de pino mostraron una intensidad inicial de la enfermedad de 0.030 % y una tasa de incremento del porcentaje de severidad por día de 0.32 %. Por lo tanto, el aislado 2 de Fusarium oxysporum fue el más virulento, ya que registró un crecimiento de 0.397 % por día en comparación con el aislado de F. solani, el cual exhibió un crecimiento de 0.32 % por día (Cuadro 2). Esto es indicativo de que una mayor intensidad inicial de la enfermedad afecta el desarrollo de la misma; en el ABCPE, la intensidad inicial se relacionó con la cantidad de inóculo al tiempo 0, pero este inóculo aumentará según la tasa de incremento, el cual está sujeto, además, a la virulencia del patógeno y la especie de pino.
Cuadro 2 Ajuste de modelo logístico del progreso de la severidad de cinco aislados de Fusarium oxysporum Schltdl. y un aislado de Fusarium solani (Mart.) Sacc. inoculados en plántulas de Pinus patula Schiede ex Schltdl. & Cham. y Pinus pseudostrobus Lindl.

De manera similar, Herron et al. (2015) determinaron que diversos aislados de Fusarium marasasianum, F. parvisorum y F. sororula causaron enfermedad en plántulas de Pinus patula; además de que existió variación en la patogenicidad y virulencia entre aislados fúngicos del mismo taxon.
Conclusiones
De acuerdo a la combinación de datos de caracterización morfológica, análisis de secuencias ITS y pruebas de patogenicidad, se demostró que Fusarium solani y F. oxysporum son las especies de hongos responsables de ocasionar los síntomas de pudrición de raíz y marchitez de plantas de Pinus patula y P. pseudostrobus en Guerrero, México. Asimismo, no se observó diferencia entre la incidencia y severidad de la enfermedad causada por cinco aislados de F. oxysporum y un aislado de F. solani.











 texto em
texto em 



