Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias forestales
Print version ISSN 2007-1132
Rev. mex. de cienc. forestales vol.6 n.30 México Jul./Aug. 2015
Nota de investigación
Enfermedades foliares del arbolado en el Parque Cultural y Recreativo Tezozómoc, Azcapotzalco, Distrito Federal
Foliar diseases of the trees in the Tezozómoc Cultural and Recreational Park, Azcapotzalco, Distrito Federal
José Francisco Reséndiz Martínez1, Lidia Guzmán Díaz2, Ana Lilia Muñoz Viveros2 Cecilia Nieto de Pascual Pola1 y Lilia Patricia Olvera Coronel3
1 Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales. INIFAP. Correo: resendiz.francisco@inifap.gob.mx
2 Laboratorio de Control de Plagas, Unidad de Morfología y Función. Facultad de Estudios Superiores Iztacala. UNAM.
3 Ex investigadora del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias.
Fecha de recepción: 6 de marzo de 2014
Fecha de aceptación: 20 de abril de 2015
Resumen
Ante el interés por conservar al Parque Cutural y Recreativo Tezozómoc (PCyRT) a partir de los beneficios ecológicos que brinda a la sociedad y a la fauna que alberga, se realizó un diagnóstico fitosanitario de su arbolado, así como una revisión de las condiciones físicas y sanitarias para determinar su estado actual. Se muestreó 10 % del total de las especies dominantes, mientras que para las asociadas se consideraron todos los individuos. Se recolectó material botánico para su determinación mediante claves y para su análisis con base en sus signos y síntomas patológicos. Los patógenos se encontraron en arboles adultos. Se contabilizaron 3 758 árboles, que pertenecen a 30 especies o variedades agrupadas en 16 familias; 67 % (20) son perennifolias y 33 % (10) son caducifolias. Las especies más abundantes y de mayor cobertura fueron Eucalyptus camaldulensis, Populus tremuloides, Pinus radiata var. binata, Fraxinus uhdei, Schinus molle y Cupressus lusitanica, lo que indica la poca diversidad. De ellas, nueve presentaron daños en el follaje por diferentes hongos; y cinco, en particular, por Fusarium, que se identifica por manchados cloróticos. La necrosis observada en Erythrina coralloides y Fraxinus uhdei se relaciona con Alternaria sp. Los hongos con mayor incidencia en sus hospederos fueron Phoma glomerata en Acacia retinoides y Alternaria alternata en Fraxinus uhdei, ambas presentes en la totalidad de los ejemplares y Melampsora epitea en Salix babylonica en 90 %. Se tiene como nuevo registro de la posible asociación del eriófido de la flor Aceria fraxiniflora en Fraxinus uhdei con el micromiceto Fusarium sporotrichioides.
Palabras clave: Azcapotzalco, fitófagos, fitosanitario, Fusarium, Parque Cultural y Recreativo Tezozómoc, patógenos forestales.
Abstract
In view of the interest to preserve the Tezozómoc Cultural and Recreational Park (TCRP) due to the environmental benefits that it provides to the fauna that lives in it as well as to society, a phytosanitary diagnosis of its trees was performed and the physical and sanitary conditions of the trees were examined in order to determine their current status. 10 % of the total dominant species were sampled, and all the individuals of the associated species were considered. Botanical materials were collected for their determination and for their analysis based on pathological signs and symptoms. Pathogens were found in adult trees. 3 758 trees were counted, belonging to 30 species or varieties grouped into 16 families; 67 % (20) of these trees are evergreen, and the remaining 33 % (10) are deciduous. The most abundant species and those with the largest cover were Eucalyptus camaldulensis, Populus tremuloides, Pinus radiata var. binata, Fraxinus uhdei, Schinus molle and Cupressus lusitanica, which is indicative of little diversity. Nine of these species exhibited foliar damage from various fungi; five of these –particularly Fusarium– are characterized by chlorotic mottling. The necrosis observed in Erythrina coralloides and Fraxinus uhdei is related to Alternaria sp. The most prevalent fungi and their hosts were Phoma glomerata in Acacia retinoides and Alternaria alternata in Fraxinus uhdei, both present in all the individuals, and Melampsora epitea, occurring in 90 % of the Salix babylonica specimens. A potential association between the ash flower eriophyid Aceria fraxiniflora in Fraxinus uhdei and the Fusarium sporotrichioides micromycetes fungus has recently been reported.
Key words: Azcapotzalco, phytofagous, phytosanitary, Fusarium, Tezozómoc Cultural and Recreational Park, forest pathogens.
El concepto de áreas verdes urbanas agrupa un conjunto de espacios libres de pavimento o construcción dentro de las ciudades y cuya vegetación es nativa o introducida; con ese concepto se denominan bosques, parques y jardines, así como barrancas, glorietas, camellones y espacios abiertos (Martínez, 2008). Los beneficios que otorgan están ligados a funciones como regulación del microclima, equilibrio y control de problemas ambientales, arquitectura del paisaje, hábitat, recreación y esparcimiento (González y García, 2007).
La Organización Mundial de la Salud (OMS) establece que el óptimo para una buena calidad de vida en la ciudad es de 8 a 12.5 m2 de áreas verdes por habitante. En el Distrito Federal existe una clara distribución desigual de las áreas verdes: mientras que delegaciones como Tlalpan y Miguel Hidalgo albergan 12.11 y 10.8 m2 por habitante respectivamente, otras como Xochimilco y Azcapotzalco tienen apenas 0.77 y 0.97 m2 (PAOT, 2010). El crecimiento acelerado de la ciudad ha ocasionado que estas extensiones disminuyan.
Las especies vegetales durante su crecimiento y desarrollo enfrentan diferentes tipos de presiones selectivas de naturaleza biótica y abiótica. En los primeros queda comprendido el daño causado por fitófagos y patógenos principalmente, mientras que entre los segundos se incluyen a las deficiencias nutricionales del suelo, la mala calidad del agua, las condiciones microclimáticas, el pH y la luz (Azcon-Bieto, 1993), que provocan lesiones de tipo mecánico o fisiológico a los árboles, como deformaciones, disminución del crecimiento, debilitamiento o incluso la muerte, con las respectivas repercusiones negativas de tipo ecológico, económico y social (Semarnat, 2002).
Por lo anterior, es necesario proteger y conservar los espacios verdes de cualquier tipo de actividad que los deterioren, que restrinjan su desarrollo normal, o que conduzcan a su pérdida; es importante, entonces, realizar evaluaciones continuas de las áreas verdes, por medio de inventarios que proporcionen información para propósitos de inversión, administración y financiamiento.
Desde hace varias décadas se han realizado esfuerzos orientados al diagnóstico fitosanitario de las áreas verdes en la Ciudad de México con el fin de detectar los agentes causales de los síntomas de daño que ostentan, a fin de definir las bases para su eventual recuperación.
Así, por ejemplo, la condición patológica de Pinus radiata D. Don., en el sur de esta gran metrópoli se ha asociado con la infestación de Alternaria sp. y con menor frecuencia a Helmithosporium sp. y Curvularia sp.
Velasco et al. (2003) hicieron un diagnóstico sanitario de los bosques al sur del Distrito Federal y determinaron que entre 8.9 y 18.5 % están plagados, mientras que el de árboles enfermos está entre 4.2 y 13.7 %; identificaron a Pinus hartwegii Lindl. como la especie forestal más atacada por plagas (8.1 %) y enfermedades foliares (7.6 %) como Lophodermium sp., con 5.7 %. En virtud de que los porcentajes de enfermedades son relativamente bajos, se considera que no ejercen un impacto negativo sobre los recursos forestales.
Con base en lo anterior se juzgó importante llevar a cabo un estudio sobre los patógenos foliares en el Parque Cultural y Recreativo Tezozómoc (PCyRT), Azcapotzalco, México, D.F., cuyos objetivos consistieron en localizar y describir la sintomatología en el arbolado ocasionado por los organismos identificados, así como detectar y determinar los organismos micro y macroscópicos que afectan al arbolado de la zona de estudio.
El Parque Cultural y Recreativo Tezozómoc (PCyRT) fue diseñado en 1978 por el arquitecto Mario Schjetman de Garduño e inaugurado el 21 de marzo de 1982 como un espacio cultural-recreativo, en una zona densamente poblada del noroeste de la Ciudad de México, donde escasean las áreas verdes; el propósito de este proyecto fue recrear la topografía-orografía del Valle de México y sus cinco lagos de finales del siglo XV, para ofrecer a través de un recorrido cultural, una visión histórica y ecológica de manera fácil y atractiva.
El PCyRT se ubica al noroeste de la delegación Azcapotzalco, en el Distrito Federal; sus coordenadas son 19°29'05" norte y 99°12'38" oeste a 2 250 msnm (Figura 1) y abarca una superficie de 270 000 m2 (González y Moctezuma, 2000). Hacia el norte colinda con el municipio Tlalnepantla, al oeste con el municipio Naucalpan, al sur con las delegaciones Cuauhtémoc y Miguel Hidalgo y al oriente con la Gustavo A. Madero.

Fuente: https://www.google.com.mx/maps/@19.49858,-99.2059035,1462m/data=!3m1!1e3
Source: https://www.google.com.mx/maps/@19.49858,-99.2059035,1462m/data=!3m1!1e3
Figura 1. Vista aérea del Parque Cultural y Recreativo Tezozómoc.
Figure 1. Aerial view of the Tezozómoc Cultural and Recreational Park.
De acuerdo con la estación meteorológica de Azcapotzalco, el clima corresponde al tipo C (w0), templado subhúmedo con lluvias en verano, de humedad media, según la clasificación de Köppen modificado por García (Delegación Azcapotzalco, 2000).
En la actualidad los suelos que existen en el Parque Tezozómoc son rellenos sanitarios compuestos principalmente por escombro y basura, por lo que dada su influencia antrópica este tipo de suelo se le conoce como Andosol (DEA, 2014).
Actividades de campo
Se realizó un recorrido preliminar en el parque Tezozómoc, con ayuda de un mapa local. Se exploraron las diferentes zonas del parque, y se definieron la distribución y tipo de agregación que presenta el arbolado. Con esta información se llevó a cabo un muestreo de 10 % de la frecuencia total de las especies dominantes, mientras que para aquellas especies con poca frecuencia se consideró el total de los individuos.
Colecta de material botánico y patológico
Las especies botánicas fueron determinadas con el apoyo de la bibliografía especializada en arbolado y vegetación urbana (Rodríguez y Cohen, 2003; Martínez, 2008), en el caso de los pinos que no se pudieron identificar en el área de muestreo se realizaron colectas, las cuales fueron prensadas y desecadas para su herborización (Vela et al., 1979).
Para la colecta de material patológico se tomaron estructuras de los hospedantes que presentaron algún síntoma, utilizando navajas y tijeras para podar de uso convencional, posteriormente se colocó en bolsas de plástico previamente etiquetadas con la fecha y lugar de colecta; se mantuvieron en refrigeración para evitar su desecación y preservarlas en condiciones óptimas para su análisis. Todas las colectas de este tipo se llevaron al Laboratorio de Entomología y Fitopatología Forestal del Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales (Cenid-Comef) del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP).
Determinación botánica y patológica
Para la identificación de los pinos se realizaron cortes transversales de las acículas y se colocaron con unas gotas de glicerina en un porta objetos, para ser observados en el microscopio óptico y ver la disposición de los canales resiníferos, utilizando las claves de Farjon et al. (1997) y Martínez (1948).
Las muestras con síntomas patológicos fueron observadas en el microscopio estereoscópico (Carl Zeiss, Stemi 2000- C) con el fin de detectar estructuras fúngicas, se hicieron raspados y para las cenicillas detectadas se utilizó una cinta adhesiva. En ambos casos, el material se colocó sobre laminillas y se tiñó con azul-lactofenol-algodón, para su determinación y observación en el microscopio óptico. De los ejemplares que no presentaron alguna estructura fúngica, se realizaron disecciones aproximadamente de 1 cm de la parte afectada, enseguida se desinfectaron con una solución de hipoclorito de sodio al 1 %, durante 1 minuto para aseptizarlos, se enjuagaron 3 veces en agua destilada esterilizada y se colocaron en cajas Petri con papel filtro estéril. Una vez secadas las muestras se sembraron en medio PDA (Papa-Dextrosa-Agar) y se incubaron a una temperatura de 28 °C, hasta que se observó crecimiento fúngico.
Con los micromicetos ya desarrollados se hicieron preparaciones semipermanentes, para lo cual se colocaron en laminillas con el colorante azul-lactofenol algodón para su observación y se identificaron con ayuda de las claves taxonómicas de Barnett y Hunter (1972), Ellis (1971), Ainsworth (1973), Domsch y Anderson (1980), Cummins e Hiratsuka (1983); posteriormente se tomaron fotografías con una cámara Canon PowerShot A640, adaptada al microscopio óptico Carl Zeiss Axiostar Plus.
Análisis patológico
Para procesar los datos obtenidos de las muestras patológicas se utilizó la frecuencia relativa, la cual se considera como el número de estaciones en las que una especie aparece registrada cuando menos una vez y se expresa en porcentaje (Dix, 1959), cuya fórmula es:
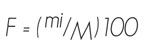
Donde:
mi = Número de muestras en las que aparece una especie
M = Total de las muestras
Composición arbórea
Con base en el censo realizado en el Parque Tezozómoc se registró un total de 3 758 árboles, conformado por 30 especies y variedades, de las cuales 15 son nativas y 15 exóticas; 67 % (20) son perennifolias y 33 % (10) caducifolias, que se agrupan en 16 familias botánicas (Cuadro 1).
Cuadro 1. Frecuencia total y relativa de las especies arbóreas.
Table 1. Total and relative frequency of tree species
.
Hacer clic en agrandar
Micromicetos
A partir de los cultivos obtenidos de las muestras que mostraban algún síntoma ocasionado por un patógeno y de aquellas partes en las cuales se observaron los cuerpos fructíferos, se tienen los resultados que se indican en el Cuadro 2; la frecuencia se obtuvo conforme a los cultivos y a la presencia de cuerpos fructíferos en los árboles muestreados.
Cuadro 2. Patógenos y frecuencia relativa presente en los hospederos.
Table 2. Pathogens and relative frequency of the hosts.

Hacer clic en agrandar
Los micromicetos obtenidos pertenecen a siete familias, nueve géneros y 14 especies, de los cuales 10 son patógenos obligados y cuatro saprobios facultativos; los primeros necesitan otro organismo para desarrollar su ciclo, mientras que los segundos tienen la capacidad de vivir de materia orgánica muerta o de infectar a otro organismo vivo, según las condiciones ambientales (Ulloa, 1991).
Patógenos obligados
Melampsora epitea Thümes, micromiceto común en Salix babylonica L. (90 %) perteneciente al grupo de las royas; su principal síntoma son las pústulas (Uredinios) de color amarillo-naranja sobre la superficie de las hojas de sauce (Figura 2A), de preferencia en el envés, en donde ocasiona el rompimiento de su epidermis y el aumento del volumen de la hoja y en ciertos casos la formación de agallas (Agrios, 1995); al impedir que se realice efectivamente la fotosíntesis y el paso de nutrientes, provoca defoliación prematura. Las esporas (uredosporas) son de color amarillo brillante o naranja cuando fresco y pared con espinas o púas (Figura 2B) (Cummins e Hiratsuka, 1983).

Figura 2. A) Pústulas en hojas de Salix babylonica L.; B) Uredosporas de Melapsora epitea Thümes (10x).
Figure 2. A) Pustules observed in Salix babylonica L. leaves; B) Melapsora epitea Thümes uredospores (10x).
Tranzschelia discolor Tranz & Lity es otro género de royas que se detectó en Prunus persica (L.) Batsch (100 %); su sintomatología se caracteriza por la presencia de pústulas amarillas o cobrizas que aparecen en el envés de las hojas (Figura 2A), mientras que en el haz se observa un moteado clorótico que ocasiona defoliación temprana, aunque en hojas viejas se pueden reconocer pústulas de color negro (Cibrián et al., 2007). Las esporas, elipsoidales (uredosporas), son de color amarillo pálido, de 18-32 x 11-18 μm, con 3 a 4 poros germinales ecuatoriales, con la pared más gruesa en el ápice y espinosa para 2/3 de la superficie (Figura 3B) (Cummins e Hiratsuka, 1983). Otro síntoma de T. discolor es la formación de cancros en la rama, es el primero que se identifica en la primavera después de la caída de los pétalos durante el desarrollo de los frutos iniciales (Adaskaveg et al., 2000); todos los síntomas antes mencionados coinciden con lo que se advirtió en el campo para ambas especies.

Figura 3. A) Síntomas ocasionados por la roya en el envés de las hojas de Prunus persica (L.) Batsch, B) Uredosporas de Tranzschelia discolor Tranz & Lity (40x).
Figure 3. A) Symptoms caused by rust on the underside of Prunus persica (L.) Batsch leaves, B) Tranzschelia discolor Tranz & Lity uredospores (40x).
Fusarium es un micromiceto común en el suelo, que penetra e infecta a las plantas directamente o a través de heridas en sus raíces; tan pronto como llega a la raíz de la planta, el micelio del hongo se extiende hasta los vasos xilémicos y se propaga a través de ellos en el tallo y el resto de la planta. A veces las infecta por otros vectores como el viento o el agua, siempre y cuando esté viable la espora;los síntomas principales se manifiestan como un amarillamiento que se extiende con rapidez hacia la nervadura central y hacia las hojas más jóvenes de la parte superior de la planta, por lo que todas las hojas se marchitan, se debilitan y se tornan grisáceas. En la mayoría de los casos, mueren sin haber presentado una decoloración previa (Agrios, 1995). Cabe mencionar que los síntomas anteriores no son los únicos producidos por Fusarium sp., ya que también ocasiona pudrición de las raíces y de los tallos inferiores, entre otros.
En Prunus persica (L.) Batsch, Erythrina coralloides Mill. y Cupressus lusitanica Miller (Figura 4) se reconoció manchado foliar asociado con este género, en 16.67 %, 15 % y 10 % de los ejemplares, respectivamente. La forma y tamaño de las esporas es la característica más destacada del hongo (micro y macroconidias) (Figuras 4B). Pinus radiata var. binata Engelmann, además del manchado foliar manifestó una resinación en 56.2 % de los individuos muestreados. Existen registros de que especies de Fusarium, tales como F. circinatum Nirenberg & O' Donnell, causa resinación en Pinus radiata, que es la especie más susceptible y representa un problema en Estados Unidos de América, Chile, España y México (Iturritxa y Ortiz, 2006).

Figura 4. A) Manchado foliar observado en Cupressus lusitanica Miller, B) Macroconidos de Fusarium sp. (40x).
Figure 4. A) Foliar mottling observed in Cupressus lusitanica Miller, B) Fusarium sp. macronides (40x).
Por otro lado en Fraxinus uhdei (Wenz) Lingelsh. durante su floración se detectó la presencia de F. sporotrichioides Sherb., asociado al eriófido Aceria fraxiniflora Felt que forma una agalla, lo que puede definirse como un nuevo registro de dicha asociación, a reserva de confirmarse; sin embargo no es el primer eriófido vinculado a Fusarium, ya que se tiene a A. mangiferae (Sayed) como agente etiológico de F. mangiferae Britz en plantas de mango (Gamliel et al., 2009; Otero et al., 1999).
Guignardia sp., se identificó en todos los individuos de Yucca elephantipes Regel y ha sido consignado como un problema para esta especie en el ámbito urbano. Se caracteriza por la existencia de manchones negros en las hojas (Figura 5A); en cada una de dichas manchas están los pseudotecios que producen ascas (Figura 5B), las que contienen en su interior ascosporas que se liberan cuando hay una capa de agua (Cibrián et al., 2007); esta condición favoreció su alta frecuencia sobre la yuca, además de que en el lugar existe alta densidad de Washingtonia robusta Wendl. y Phoenix canariensis Hort. ex Chabaud, lo que interfiere el paso de rayos solares y por lo tanto, se evita la evaporación del agua que se acumula en las hojas, y con ello el micromiceto se desarrolla.
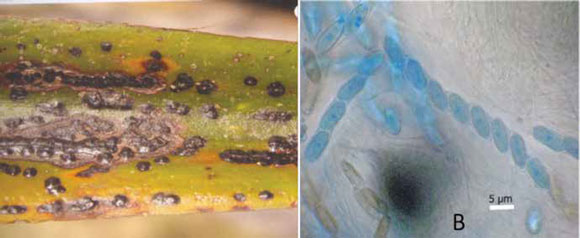
Figura 5. A) Manchones encontrados en Yucca elephantipes Regel., B) Ascas con ascosporas de Guignardia sp. (40x).
Figure 5. A) Patches found in Yucca elephantipes Regel., B) Ascae with Guignardia sp. ascospores (40x)
Phyllactinia angulata (E. S. Salmon) S. Blumer se identificó en 40 % de Erythrina coralloides; es un micromiceto que produce cenicillas y el síntoma principal de su presencia es su manto micelar de color blanco o pardo-cremoso, por lo general circular o semicircular, en el haz o envés de las hojas y ocasionalmente, las cubre todas (Figura 6A). Las hojas infestadas muestran deformaciones y cambios de color, tienen un tamaño menor que las no infectadas y caen de manera prematura. La estructura reproductora de este patógeno está conformada por cleistotecios, con apéndices periciales (bulbos en la base y agudos en el ápendice). Los cleistotecios aparecen sobre el micelio hialino en forma de diminutas esferas blancas de aproximadamente 190 μm de diámetro, las cuales al ir creciendo van cambiando de color, pasando por el amarillo, naranja, café claro, café oscuro y negro al madurar (Hanlin, 1990) (Figura 6B). En campo se observó como el principal problema de E. coralloides.

Figura 6. A) Cenicilla en hoja de Erythrina coralloides Mill., B) Cleistotecio de Phyllactinia angulata (E. S. Salmon) S. Blumer (40x).
Figure 6. A) Powdered mildew on a Erythrina coralloides Mill. leaf, B) Phyllactinia angulata (E. S. Salmon) S. Blumer cleistothecium (40x).
Kirramy cesepicoccoides (Cooke & Massee) es un micromiceto muy común para las especies de Eucalyptus y es fácil de identificar en campo. Se caracteriza por exhibir manchas irregulares de color púrpura o pardusco-púrpura en el haz y envés de las hojas; la forma de las manchas es angular, de 2-10 mm de diámetro, y está delimitada por las venas de las hojas (Figura 7A). Dentro de las manchas se presentan picnidios de color negro, más o menos globosos, con una dimensión de 50-130 μm de diámetro. Los conidios son de forma cilíndrica, de color marrón claro, en su mayoría tienen tres septos y son curvados (Figura 7B) (Liberato et al., 2006). Esta especie se identificó en 89 % de los individuos muestreados de E. camaldulensis.

Figura 7. A) Mancha foliar de forma irregular de color púrpura, B) Conidios de Kyrramyces epicoccoide (Cooke & Massee) (40x).x
Figure 7. A) Irregular purple foliar mottling, B) Kyrramyces epicoccoide (Cooke & Massee) conidia (40x).x
Saprobios facultativos
Phoma sp. es un micromiceto que se reconoció en 100 % de los ejemplares de Acacia retinodes y se asoció con manchados foliares (Figura 8A); no hay registros de que el microorganismo cause esa sintomatología en el hospedero, pero también se ha identificado a Phoma sp. como causante de este aspecto en Fraxinus uhdei (Wenz.) Lingelsh. Solo se le ha consignado en el ámbito agrícola en hojas, frutos, ramas y tallos (Romero, 1993). A nivel microscópico, tiene picnidios globosos o membranosos o coriáceos o casi carbonosos, negros, ligeramente lenticulares con una papila pequeña en el ápice (Figura 8B). Sus esporas son de tamaño reducido, oviformes (forma de huevo), fusiformes o cilíndricas a casi esféricas, unicelulares, hialinas. Conidióforos delgados, pocas veces cortos, simples o algunas veces bifurcados (Gilman, 1963).

Figura 8. A) Manchado foliar en Acacia retinodes Schltdl., B) Picnidio de Phoma sp. (40x).
Figure 8. A) Foliar mottling in Acacia retinodes Schltdl., B) Phoma sp. pycnidium(40x).
El género Alternaria se identificó por una clorosis en la totalidad de las hojas de Fraxinus uhdei (Figura 9A) y 30 % en las de Erythrina coralloides. Wayne et al. (1996) mencionan que Alternaria alternata (Fr.) Keissl. es causante de manchados necróticos y clorosis foliar en fresno, pero bajo ciertas condiciones funciona como saprobio. Este hongo presenta conidióforos solitarios o agrupados, erectos, septados, la mayoría simples, cortos. Esporas (conidios) en forma de clava invertida (más amplias en un extremo que el otro), la mayoría con el ápice alargado, con septos transversales y longitudinales que las dividen en numerosas células, lo que da la apariencia de una pared de ladrillos en la porción inferior, de color oscuro, más claros en los extremos, en cadenas más o menos largas y generalmente simples (Figura 9B) (Gilman, 1963).

Figura 9. A) Manchado foliar en Fraxinus uhdei (Wenz.) Lingelsh.; B) Conidióforos y conidios de Alternaria sp. (40x).
Figure 9. A) Foliar mottling in Fraxinus uhdei (Wenz.) Lingelsh.; B) Alternaria sp. conidiophores and conidia (40x).
Penicilium sp. es un hongo que se nutre de materia orgánica en descomposición, por lo que no ocasiona daños al arbolado; sin embargo se ha citado como pudridor de frutos y otros órganos suculentos, debido a los mohos azules (Agrios, 1995). Esté género se denomina así porque el órgano especial de reproducción asexuada formado por conidiosporas tiene el aspecto de un pequeño pincel. Se caracteriza porque los esterigmas se implantan directamente sobre el conidióforo o sobre órganos alargados en forma de U o V llamados métulas (Figura 10A) (Barnett, 1972).

Figura 10. Conidióforos y conidios de Penicilium sp. (40x).
Figure 10. Penicilium sp. conidiophores and conidia (40x).
De las 30 especies de árboles y arbustos identificados, nueve presentaron daños en el follaje por diferentes especies de hongos patógenos; de estos hospederos, en cinco fueron causados por Fusarium que se asocia a manchados cloróticos.
La necrosis observada en Erythrina coralloides y Fraxinus uhdei se asoció al patógeno Alternaria sp.
Los patógenos aquí descritos se encontraron en árboles adultos.
Los hongos con mayor incidencia en sus hospederas fueron Phomaglo merata en Acacia retinodes, Alternaria alternata en Fraxinus uhdei, ambas con 100 % de infestación y Melampsor aepitea en Salix babylonica con 90 %.
Se tiene el registro de asociación del eriófido de la flor Aceria fraxiniflora en Fraxinus uhdei con el micromiceto Fusarium sporotrichioides.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribución por autor
José Francisco Reséndiz-Martínez: concepción del proyecto original, selección de métodos de análisis de laboratorio, identificación de organismos patológicas y elaboración del manuscrito; Lidia Guzmán-Díaz: selección de unidades de estudio y muestreo de material patológico y estructuración de manuscrito; Ana Lilia Muñoz-Viveros: elaboración y revisión de manuscrito; Cecilia Nieto de Pascual Pola: aplicación de correcciones arbitrales y revisión editorial del manuscrito final; Lilia Patricia Olvera Coronel: trabajo de laboratorio y revisión preliminar del manuscrito.
Agradecimientos
Los autores desean expresar su agradecimiento a las autoridades administrativas del Parque Cultural y Recreativo Tezozómoc por haber otorgado las facilidades para la realización del presente estudio.
Referencias
Adaskaveg, J. E., A. Soto E., H. Förster, D. Thompson, J. Hasey, B. T. Manji and B. Teviotdale. 2000. Peach rust caused by Tranzschelia discolor in California. ANR Publication 8011. University of California. Division of Agriculture and Natural Resources. Oakland, CA, USA. 9 p. [ Links ]
Agrios, G. N. 1995. Fitopatología. Editorial Limusa. Grupo Noriega Editores. México, D. F., México. 838 p. [ Links ]
Ainsworth, G. C., F. K. Sparrow and Alfred S. Sussman. 1973. The fungi. Taxonomic review with keys: Basidiomycetes and lower fungi. Vol. IVB. Academic Press. New York, NY, USA. 504 p. [ Links ]
Azcon-Bieto, J. y M. Talon.1993. Fisiología y bioquímica vegetal. Mc Graw-Hill Co. Barcelona, España. 581 p. [ Links ]
Barnett, H. L. and B. Hunter. 1972. Illustrated genera of imperfect fungi. Burgess Publishing Co. 3rd ed. Minneapolis, MN, USA. 241 p. [ Links ]
Cibrián T., D., D. Alvarado R. y S. García D. 2007. Enfermedades forestales en México. Universidad Autónoma Chapingo/USDA Forest Service/ Natural Resources Canada. Chapingo, Edo. de Méx., México. 587 p. [ Links ]
Cummins, G. B. and Y. Hiratsuka. 1983. Illustrated genera of rust fungi. American Phytopathological Society. St Paul, MI, USA. 152 p. [ Links ]
Delegación Azcapotzalco. 2000. Cuaderno estadístico delegacional. Departamento de Parques y Jardines. México, D.F., México. 20 p. [ Links ]
Dirección de Educación Ambiental (DEA). s/f. Áreas verdes, vida para todos. Parque Tezozómoc. Subdirección de Procesos Escolarizados. Secretaría de Medio Ambiente de la Ciudad de México (SEDEMA). http://www.sedema.df.gob.mx/areasverdesvidaparatodos/parques_emblematicos.html#.VCwbj_l5MYE (1 de agosto de 2014). [ Links ]
Dix, R. L. 1959. The influence of grazing on the thin-soil prairies of Wisconsin. Ecology 40(1): 36-49. [ Links ]
Domsch, G. and H. Anderson. 1980. Compendium of soil fungi. Vol. I. Academic Press. New York, NY, USA. 859 p. [ Links ]
Ellis, M. B. 1971. Dematiaceous, Hyphomycetes. Commonwealth Mycologial Institute. Kew, UK. 595 p. [ Links ]
Farjon, A. and B. T. Styles.1997. Pinus (Pinaceae). Flora Neotropica Monograph 75: 1-293. p. [ Links ]
Flores A., I. y A. J. Romero C. 2001. Diagnóstico fitosanitario del arbolado en pie de 8 especies de angiospermas en el vivero de Coyoacán. Facultad de Estudios Superiores. Iztacala. Universidad Nacional Autónoma de México. Tlalnepantla, Edo. de Méx., México. 167 p. [ Links ]
Gamliel, A. E., S. Freeman, A. Sztejnberg A., Maymon M., Ochoa R., Belausov and E. Palevsky E. 2009. Interaction of the mite Aceria mangiferae with Fusarium mangiferae, the causal agent of mango malformation disease. Phytopathology 99(2): 152-9. [ Links ]
Gilman, J. C. 1963. Manual de los hongos del suelo. Ed. Continental, S.A. México, D. F., México. 572 p. [ Links ]
González, M y B. Moctezuma P. 2000. Ciudad de México. Delegación Azcapotzalco. Monografía 1999-2000. Edición Delegacional. México, D. F., México. 74 p. [ Links ]
González O., G y J. García V. 2007. Riesgo por caída de árboles en un Parque Metropolitano de Guadalajara, Jalisco, México. Instituto de Medio Ambiente y Comunidades Humanas, Centro Universitario de Ciencias Biológicas y Agropecuarias. Universidad de Guadalajara. Guadalajara, Jal., México. pp. 93-98. [ Links ]
Hanlin, R. T. 1990. Illustrated genera of Ascomycetes. APS Press. The American Phytopathological Society. St. Paul, MN, USA. 263. [ Links ]
Hinojosa, R. E. 2014. El manejo de áreas verdes en la Ciudad de México y Pekín: la búsqueda de la sustentabilidad en grandes ciudades. Investigación Ambiental 6 (1): 69-76. [ Links ]
Iturritxa, E. y A. Ortiz, B. 2006. Fusarium circinatum, el hongo causante de la enfermedad del chancro resinoso. Técnica Forestal. Basogintza, País Vasco. pp. 36-39. [ Links ]
Liberato, J. R., P. Barber, T. I. Burguess y A. R. McTaggart. 2006. Eucalyptus leaf spot (Phaeophleospora destructans) PaDil. http://www.padil.gov.au (21 de octubre de 2013). [ Links ]
Martínez, M.1948. Los pinos mexicanos. Ediciones Botas. México D. F., México. 361 p. [ Links ]
Martínez, G. L. 2008. Árboles y áreas verdes urbanas de la Ciudad de México y su Zona Metropolitana. Fundación Xochitla, A. C. México D. F., México. 549 p. [ Links ]
Moll, G. y D. Gangloff. 1987. Silvicultura urbana en los Estados Unidos. http://www.fao.org/docrep/s1930s/s1930s05.htm (12 de noviembre de 2013). [ Links ]
Otero C., G., D. H. Noriega, C. R. Sánchez M. R., M. C. Acosta R., M. T. Santillán G. y F. Miranda Z. 1999. Descripción morfológica de la escoba de bruja del mango en brotes vegetativos y florales. Colegio de Postgraduados. Instituto de Fitosanidad. Montecillo, Edo. de Méx., México. pp. 5-7. [ Links ]
Procuraduría Ambiental y del Ordenamiento Territorial (PAOT). 2010. Presente y futuro de las áreas verdes y del arbolado de la Ciudad de México. México, D. F., México. 257 p. [ Links ]
Rodríguez S., L. M. y E. J. Cohen F. 2003. Guía de árboles y arbustos de la zona metropolitana de la Ciudad de México. REMUCEAC-GDFUAM. México, D. F., México. 380 p. [ Links ]
Romero C., S. 1993. Hongos fitopatógenos. Universidad Autónoma Chapingo. Chapingo, Edo. de Méx., México. 244 p. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (Semarnat). 2002. Informe de la situación del medio ambiente en México 2002. Compendio de Estadística Ambiental. México D. F., México. 272 p. [ Links ]
Ulloa, M. 1991. Diccionario ilustrado de micología. Departamento de Botánica. Instituto de Biología. Universidad Nacional Autónoma de México. México, D. F. México. 310 p. [ Links ]
Vela G., L., A. Hernández R. y J. C. Boyás D. 1979. Instructivo para la colecta de material botánico. Boletín Divulgativo Instituto de Investigaciones Forestales. México, D. F., México. Núm. 49. 27 p. [ Links ]
Velasco B., E., J. F. Reséndiz M., L. Sandoval C. L. P. Olvera C., F. Moreno S., M. V. Gutiérrez y O. Cedeño S. 2003. Diagnóstico sanitario de los bosques del Distrito Federal México. Revista Ciencia Forestal en México 27(91):91-108. [ Links ]
Wayne, A. S., L. Howard and J. Warren. 1996. Diseases of trees and shrubs .4 imp. Cornell University press. Ithaca, NY, USA. 575 p. [ Links ]














