Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias forestales
versión impresa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.6 no.30 México jul./ago. 2015
Artículo
Análisis de semilla, tratamientos pregerminativos de Enterolobium cyclocarpum (Jacq.) Griseb. y su crecimiento inicial
Enterolobium cyclocarpum (Jacq.) Griseb. seed analysis, pre-germination treatments and initial growth
Héctor Viveros Viveros1, Juan Diego Hernández Palmeros2, Mario Valerio Velasco García3, René Robles Silva3, César Ruiz Montiel1, Armando Aparicio Rentería1, María de Jesús Martínez Hernández2, Julia Hernández Villa1 y María Luisa Hernández Hernández3
1 Instituto de Investigaciones Forestales, Universidad Veracruzana. Correo: heviveros@hotmail.com
2 Facultad de Ciencias Agrícolas Campus Xalapa, Universidad Veracruzana.
3 Universidad del Mar, Campus Puerto Escondido.
Fecha de recepción: 27 de abril de 2014
Fecha de aceptación: 3 de marzo de 2015.
Resumen
Enterolobium cyclocarpum es utilizada en la recuperación de zonas deforestadas del bosque seco subtropical. Sin embargo, sus semillas tienen una testa dura e impermeable al agua, lo que ocasiona una germinación lenta y dispareja. Por tal motivo, antes de iniciar la producción de planta de esta especie para reforestaciones y plantaciones, se deben conocer los tratamientos pregerminativos que favorezcan su germinación. Se determinó el peso, el contenido de humedad y la viabilidad de las semillas. Los tratamientos aplicados fueron: testigo, lijado de la semilla, remojo en agua a temperatura ambiente (20 °C) por 96 h, remojo en agua caliente (75 °C) durante 4 h y remojo en ácido sulfúrico concentrado durante 30 min. Las semillas se sembraron en charolas de unicel; como sustrato una mezcla de 75 % de arena y 25 % de tierra de monte; el diseño experimental fue completamente al azar con cuatro repeticiones de 100 semillas por tratamiento. Se evaluó la capacidad germinativa, germinación media diaria, valor pico y germinativo, altura y diámetro basal de las plántulas a los seis meses de edad. Existieron diferencias significativas (P < 0.0001) entre los tratamientos evaluados en los parámetros germinativos y de crecimiento. Los mejores tratamientos pre-germinativos para la semilla de E. cyclocarpum fueron el remojo en ácido sulfúrico y el lijado de la semilla; sin embargo para el crecimiento en diámetro basal y altura de la plántula fueron el lijado y el remojo en agua a temperatura ambiente por 96 h.
Palabras clave: Capacidad germinativa, contenido de humedad de la semilla, germinación media diaria, peso de la semilla, valor germinativo, viabilidad de la semilla.
Abstract
Enterolobium cyclocarpum is used in the recovery of deforested areas of subtropical dry forests. However, seeds are hard-coated and impermeable to water, so that germination is slow and uneven. Therefore, before starting the production of seedlings of this species for reforestation and plantations, appropriate pre-germination treatments to encourage germination should be determined. In this study, seed weight, moisture content and viability were estimated, and pre-germination treatments applied, including: controls, sanding the seeds, and soaking the seeds in water at room temperature (20 °C) for 96 h, in hot water (75 °C) for 4 h, and in concentrated sulfuric acid for 30 minutes. The seeds were sown in Styrofoam trays, using as substrate mixture of 75 % sand and 25 % forest soil. A completely randomized design was used with four replications of 100 seeds for treatment. The germination capacity, mean daily germination, peak and germination value, height and basal diameter of seedlings at six months of age were evaluated. There were significant differences (P < 0.0001) among treatments for all germination and growth parameters. The best pre-germination treatments for prompt seeds germination of E. cyclocarpum were soaking in sulfuric acid and sanding the seed, while sanding and soaking in water at room temperature during 96 h proved best for basal diameter growth and seedling height.
Key words: Germination capacity, seed moisture content, mean daily germination, seed weight, germination value, seed viability.
Introducción
Enterelobium cyclocarpum (Jacq.) Griseb. es una especie con amplia distribución natural, desde México hasta el norte de Sudamérica, así como en Jamaica, Cuba, Trinidad y Guyana (Espejel y Martínez, 1979). En México, se le encuentra en la vertiente del Golfo de México (desde el sur de Tamaulipas hasta la Península de Yucatán), y en la del Pacífico (desde Sinaloa hasta Chiapas) (Manzanilla et al., 2001).
Su importancia ecológica radica en que es utilizada en la recuperación de zonas deforestadas del bosque seco subtropical, y sirve de albergue a la fauna silvestre. Se recomienda en programas de enriquecimiento y restauración (Vázquez-Yanes et al., 1999). Desde el punto de vista económico, la madera de E. cyclocarpum está considerada como preciosa, y como tal, es muy cotizada; con ella se elaboran productos que brindan bienes y servicios en las regiones rurales como leña, postes, cercas vivas, sombra, madera industrial rural, forraje y mejoradores de suelo (Espejel y Martínez, 1979; Serratos, 2000). Por sus atributos se espera que en los próximos años se apoye el establecimiento de plantaciones forestales con esta especie (Benítez et al., 2004).
Sin embargo, las semillas de E. cyclocarpum tienen una testa impermeable al agua (latencia física) (Baskin y Baskin, 2004), lo que hace que su germinación sea lenta y dispareja. De acuerdo a la literatura existen diferentes taxa leñosos con dicha forma de latencia, como Caesalpinia velutina (Britton & Rose) Standl., Leucaena, Leucaena leucocephala (Lam.) de Wit. y Mimosa aculeaticarpa Ortega (Buch et al., 1997; Young y Young, 1992).
Ante esta situación es necesario aplicar tratamientos pregerminativos para obtener una germinación rápida y uniforme pues de no hacerlo E. cyclocarpum tiene un porcentaje de germinación de 8 %, aproximadamente (Buch et al., 1997). Por lo anterior, para que se produzca en forma masiva y se incorpore a reforestaciones y plantaciones de manera efectiva se debe identificar cuál es la mejor opción (Hernández et al., 2001). Según Napier (1985) bajo condiciones naturales y con suficiente tiempo, los bloqueos a la germinación se eliminan.
Los tratamientos pregerminativos pueden consistir en la escarificación manual de la semilla, la inmersión en agua caliente o fría, en ácido sulfúrico, entre otros (Vázquez-Yanes y Pérez, 1977; Hernández y García, 1980). Su finalidad es romper la latencia inducida por la testa al ablandar, perforar, rasgar o abrirla para hacerla permeable sin dañar el endospermo y el embrión (Padilla, 1995). Algunos de ellos, aplicados en semillas de árboles aceleran y aumentan su germinación (Somarriba y Ferreiro, 1984; Hernández et al., 2001); sin embargo, no todos son eficientes para cualquier especie, por lo que se debe definir el indicado para cada una.
Los tratamientos pregerminativos pueden consistir en la escarificación manual de la semilla, la inmersión en agua caliente o fría, en ácido sulfúrico, entre otros (Vázquez-Yanes y Pérez, 1977; Hernández y García, 1980). Su finalidad es romper la latencia inducida por la testa al ablandar, perforar, rasgar o abrirla para hacerla permeable sin dañar el endospermo y el embrión (Padilla, 1995). Algunos de ellos, aplicados en semillas de árboles aceleran y aumentan su germinación (Somarriba y Ferreiro, 1984; Hernández et al., 2001); sin embargo, no todos son eficientes para cualquier especie, por lo que se debe definir el indicado para cada una.
Por lo antes mencionado se plantean los siguientes objetivos: determinar el tratamiento físico o químico más eficiente para la germinación de la semilla de E. cyclocarpum y evaluar el efecto que tiene la aplicación de tratamientos pregerminativos en el crecimiento inicial de sus plántulas.
Material y Métodos
Recolección de las semillas
Las semillas utilizadas en el presente estudio fueron recolectadas de marzo a mayo de 2008, en la región Costa de Oaxaca (16°27"- 15°49" N y 96°27"-98°16" O). Para ello, se seleccionaron de 7 a 12 individuos mayores a 2 m de altura, libres de plagas y enfermedades, con fustes rectos y limpios. La recolección de frutos se hizo a partir de material depositado en el suelo, o del presente en la copa del árbol, con cuerdas y pértigas; se colocaron en costales etiquetados con la ubicación geográfica del sitio y la fecha de muestreo para ser transportadas a las instalaciones de la Universidad del Mar, Campus Puerto Escondido.
Para extraer las semillas, los frutos se secaron al sol directo y al calor del fuego sobre un comal; una vez secos se depositaron en costales, y mediante impacto físico propinado con una pieza de madera, se les trituró. El material derivado de esta operación se vació en una superficie plástica. Las impurezas tales como semillas vanas, trozos de material vegetal y piedras fueron eliminadas de forma manual. Las semillas limpias se deshidrataron al sol para uniformizar su contenido de humedad. Posteriormente fueron almacenadas a temperatura ambiente en bolsas de plástico oscuro, previo etiquetado con los siguientes datos: fecha de recolecta y de almacenamiento, así como el lugar de colecta. Una vez extraída la semilla, se mezcló y se trasladó a un vivero de la Facultad de Ciencias Agrícolas de la Universidad Veracruzana, en Xalapa, Veracruz.
Análisis de las semillas
Peso de la semilla. Se tomaron ocho réplicas de 100 semillas; cada una se pesó con una balanza analítica (Presición en mg, marca ScientechTM modelo SA 210). Con estos valores se estimó el peso de 1 000 semillas mediante la siguiente fórmula (ISTA,1993):
A continuación se calculó el número de semillas que contiene un kilogramo:
Peso de 1000 semillas = Σ de los pesos de ocho repeticiones individuales X 1.25
Contenido de humedad de la semilla. El contenido de humedad de la semilla se determinó tanto en semilla entera como en semilla triturada. Para realizar la prueba se utilizaron dos muestras de semillas de entre 4 y 5 g, las cuales se colocaron en recipientes separados para secarse durante 17 h a 103 °C en un horno de secado (ISTA, 1993) marca Cole PalmerTM modelo 05015-58. Al término de ese período se pusieron en un desecador para enfriarlas durante 30 minutos, y después se volvieron a pesar. El porcentaje del contenido de humedad se calculó con la siguiente fórmula:

Donde:
M1 = Peso del recipiente en g
M2 = Peso del recipiente y su contenido en g antes del secado
M3 = Peso del recipiente y su contenido en g después del secado
Viabilidad de la semilla. Las pruebas de viabilidad se realizaron en el Laboratorio de Análisis de Semillas de la Gerencia Estatal de Veracruz de la Comisión Nacional Forestal, ubicado en Banderilla, Ver. Se aplicaron dos métodos: 1) Contraste con tetrazolio, y 2) Contraste por rayos X.
En el primer método se mezclaron 0.75 g de cloruro de tetrazolio (2,3,5-cloruro de trifenil tetrazolio) de la marca Sigma® al 1.5 % en 500 mL de agua destilada. Se remojaron cuatro muestras de 50 semillas llenas, previamente lijadas cada una (200 en total), durante 17 h en agua destilada a temperatura ambiente; se escarificaron y se les realizó un corte longitudinal. Después, se colocaron en la solución de cloruro de tetrazolio y se dejaron 24 h a 25 °C en completa oscuridad. Con la ayuda de un microscopio de disección (Nikon, Modelo SM5 61417) se analizaron las semillas y se consideraron viables las que se tiñeron de rojo en todas sus estructuras y no viables aquellas cuya tinción fue menor a 75 % o no se tiñeron (Kolotelo et al., 2001).
El segundo método consistió en radiografía de rayos X a una muestra de 10 semillas con diez repeticiones (100 semillas) mediante un equipo marca Faxitron X-ray® modelo MX-20DC4. Se empleó una placa Plexiglás® de 5 mm de grueso, de 15 x 8 cm y un área central de 7 x 2 cm donde se dispuso la muestra compuesta por 10 semillas, a las cuales se les aplicaron rayos gamma con un potencial de tubo de 26 kV por tres segundos. Las semillas viables exhibieron el desarrollo completo de sus estructuras internas y las inviables no lo mostraron, o bien presentaron daños.
Tratamientos pregerminativos
Los tratamientos pregerminativos fueron los siguientes:1) testigo (semilla sin tratamiento); 2) lijado (se lijó la testa de las semillas hasta que se observó el embrión); 3) remojo en agua a temperatura ambiente (20 °C) durante 96 h; 4) remojada en agua caliente (a 75 °C) durante 4 h; y 5) remojo en ácido sulfúrico (H2SO4) concentrado durante 30 min
A continuación, se sembraron las semillas en charolas de unicel para germinación. El sustrato estaba formado por una mezcla de 75 % de arena y 25 % de tierra de monte. Los riegos se aplicaron para conservar la humedad suficiente y no se adicionaron fertilizantes. Se siguió un diseño experimental completamente al azar, con seis tratamientos y cuatro repeticiones de 100 semillas por cada tratamiento, lo que dio un total de 2 400 semillas.
Variables evaluadas
Se evaluaron los siguientes parámetros: la capacidad germinativa, la germinación media diaria, el valor germinativo y el valor pico. La capacidad germinativa se obtuvo como el porcentaje de semilla que germinó, con base en la cantidad de plántulas que emergieron del total sembrado durante 90 días; la germinación media diaria, al dividir los porcentajes de germinación acumulados diariamente entre la longitud en días del periodo de cada evaluación; el valor pico fue la máxima germinación acumulada y el valor germinativo se estimó mediante dos métodos, uno con la fórmula de Czabator (1962):
Valor germinativo = Germinación media diaria x el valor pico
Y el otro, por la fórmula de Diavanshir y Pourbeik (1976):

Donde:
DGS= Velocidad de germinación diaria
N = Frecuencia del número de DGS que se calcularon durante la prueba
GP= x Porcentaje de germinación al final de la prueba y 10 es una constante
Con la finalidad de evaluar el efecto de los tratamientos pre-germinativos en el crecimiento inicial de E. cyclocarpum, se midieron la altura total (cm) y el diámetro basal (mm) de la plántula, a los seis meses de edad.
Análisis estadísticos
Se realizó un análisis de varianza para todas las variables evaluadas, incluyendo tanto los parámetros germinativos como las variables del crecimiento de las plántulas. El modelo utilizado fue el siguiente:

Donde:
Yi = Valor de la i-ésima observación
μ = Media general
Ti= Efecto del i-ésimo tratamiento y
Ei = Error experimental
En las variables que así lo requirieron se realizó una transformación con el arco seno de la raíz de los datos originales divididos entre 100.
Cuando existieron diferencias significativas entre tratamientos se realizó la prueba de comparación de medias de Tukey. Los análisis se realizaron mediante el procedimiento GLM de SAS (Statiscal Analysis System, 2004).
Para conocer si existen diferencias estadísticas entre los tratamientos pregerminativos, a partir del conjunto de variables (capacidad germinativa, germinación media diaria, valor germinativo, valor pico, día de inicio de la germinación, día de máxima germinación, altura total y diámetro basal), se hizo un análisis multivariado de varianza (MANOVA). Asimismo, para conocer el mejor tratamiento pregerminativo, a partir del conjunto de variables, se llevó a cabo un análisis multivariado de componente principales (ACP), en combinación con un análisis de varianza (ANOVA). Al componente principal uno, como nueva variable, resultante ACP, se le realizó un ANOVA y una prueba de comparación de medias de Tukey. Debido a que las variables originales no tienen la misma escala de medición, se aplicó ACP a la matriz de correlación de respuestas, es decir a datos estandarizados (Johnson, 2000).
Resultados y Discusión
Análisis de semillas
Peso de la semilla. En la medición se observó que el coeficiente de variación fue menor a cuatro (valor máximo permisible establecido por el ISTA), por lo que se consideró que la muestra fue homogenéa y no fue necesario tomar nuevas muestras. El peso de 1 000 semillas de E. cyclocarpum fue de 836.4 g, valor cercano al de Shannon et al. (1997) y Sautu et al. (2006) para la especie (892.9 y 807.8 g, respectivamente). Mientras que el número de semillas por kilogramo fue de 1 196, como lo registrado por los dos autores antes citados (1 120 y 1 238 semillas kg-1, respectivamente).
Contenido de humedad de las semillas. El contenido de humedad varió de aproximadamente 9.4 a 10 %, con un promedio de 9.7 %, en semilla entera; y de casi 4.4 a 6.3 %, y un valor medio de 5.3 % en semilla triturada; por lo tanto, la media general en conjunto de ambas formas de semillas fue de 7.5 %. Los intervalos en la semilla entera de E. cyclocarpum quedan comprendidos entre los registrados por Buch et al. (1997), de 8 a 10 %, y el promedio es cercano al de Sautu et al. (2006) (12 %).
Viabilidad de la semilla. La viabilidad de las muestras de semilla de E. cyclocarpum evaluadas mediante el método de tetrazolio, varió de 48 a 94 %, con un promedio de 75.5 % del total de las 200 semillas llenas probadas, cifra muy próxima a lo consignado por el CATIE (2000) en semilla recién recolectada de esta especie (80 %), lo que significa que mantiene buena viabilidad.
De un total de 10 semillas por repetición, el número medio de semillas con embriones desarrollados fue 9.8, mientras que solo dos repeticiones mostaron una semilla con embrión no desarrollado; el número promedio de semillas con cotiledones en esta condición fue de 9.3 y con cotiledones incipientes fue cercano a uno. La viabilidad de las muestras varió del 70 a 100 %, con un promedio de 98 %, que, mediante el método de tetrazolio fue menor a la estimada por el método radiográfico, mismo que refleja el estado de la semilla, pero no revela si está viva (Bonner et al., 1994). El primer método da una mejor aproximación a la germinación promedio que se obtuvo de la semilla tratada con ácido sulfúrico, ya que indica el tejido vivo de la semilla.
Parámetros germinativos
Existieron diferencias significativas entre los tratamientos pregerminativos probados para todos los parámetros evaluados (P<0.0001), lo que coincide con otros trabajos realizados anteriormente en E. cyclocarpum y otras latifoliadas (Somarriba y Ferreiro, 1984; Hernández et al., 2001).
En la curva de acumulación de la germinación, como lo señala Come (1982), el porcentaje máximo se alcanza en un tiempo dado y luego se estabiliza (Figura 1). Los tratamientos de remojo de la semilla en ácido sulfúrico y de semilla lijada aceleraron el tiempo de germinación, ya que en ambos casos se inició el proceso a los siete días de sembradas. Del mismo modo, el remojo de semilla en agua caliente (75 °C) favoreció el ritmo de la misma, pues comenzó un día después de los tratamientos señalados. No se verificaron diferencias al principio de la germinación de la semilla remojada en agua a temperatura ambiente por 96 h y el testigo (aproximadamente al decimocuarto día).
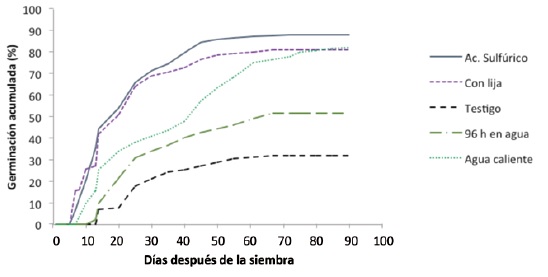
Figura 1. Germinación diaria acumulada de la semilla de Enterolobium cyclocarpum (Jacq.) Griseb. procedente de la Costa de Oaxaca.
Figure 1. Daily accumulated germination of Enterolobium cyclocarpum (Jacq.) Griseb. seeds from the Coast of Oaxaca.
Hacer clic para agrandar
En lo referente a los días que tardan en alcanzar la máxima germinación no hubo diferencias significativas entre los tratamientos probados (Figura 1). El tiempo en el que se inició la germinación de las semillas remojadas en ácido sulfúrico y las lijadas es muy similar al registrado por Hernández et al. (2001) en la especie de interés (séptimo día vs. sexto día), aunque la máxima tardó más tiempo en alcanzarse en la presente investigación (alrededor de 65 y 50, días) que en la de Hernández et al. (2001) (13 a 16 días). El inicio de la germinación de las muestras tanto del testigo, como del remojo en agua a temperatura ambiente durante 96 h se dio en el decimosegundo y decimotercer día, respectivamente; Chakco y Chandrasekhara (1997) indican que para material recién recolectado de la especie y sin ningún tratamiento pregerminativo (testigo) este momento se verificó a los 14 días y en el tratamiento de remojo en agua potable, a los cuatro días a partir de la siembra; la diferencia entre tal trabajo y el actual puede deber a que ellos utilizaron semillas "frescas" y en este estudio se manejaron semillas bajo conservación, lo que coincide con lo planteado por Buch et al. (1997) en el sentido de que la velocidad de germinación de la semilla de E. cyclocarpum disminuye después de tres meses de almacenamiento.
En lo referente a la capacidad germinativa, los tratamientos de remojo en ácido sulfúrico, agua caliente y lijado tuvieron los mayores porcentajes. El segundo, aunque registró un valor aceptable, no resultó tan efectivo como los otros dos por el tiempo requerido para alcanzar tal valor, mientras que el testigo tuvo los porcentajes más bajos (Cuadro 1). Hernández et al. (2001) confirmaron que los mejores resultados se obtuvieron con el lijado de la semilla y la inmersión en ácido sulfúrico por 35 min; y la inmersión de ácido sulfúrico por 45 min, con una capacidad germinativa de 98, 92 y 87 %, respectivamente, lo cual es similar a los porcentajes del presente trabajo, sobre todo si se considera que ellos no incluyeron el remojo en agua caliente. Algo semejante registran Somarriba y Ferreiro (1984), que la inmersión de semillas en ácido sulfúrico y en agua en ebullición, tratamientos con los cuales se alcanzó una capacidad germinativa de 87 y 83 %, respectivamente; además no detectaron diferencias significativas entre el remojo de semillas en agua a temperatura ambiente por 24 h y el testigo. Buch et al. (1997) declararon que las semillas de E. cyclocarpum remojadas en agua caliente a 100 °C tuvieron una capacidad germinativa de 44 a 53 % vs de 6 a 11 % para el testigo (sin tratamiento).
El remojo de la semilla en ácido sulfúrico propició la mayor germinación media diaria, mientras que el testigo fue el del valor más bajo (Cuadro 1). El de ácido sulfúrico y el de lijado presentaron los más altos valores pico y valores germinativos, tanto los estimados según Czabator (1962) como los de Diavanshir y Pourbeik (1976). El de remojo de semilla por 96 h en agua a temperatura ambiente no se diferenció del testigo, y generaron los menores valores pico y los germinativos según Czabator (1962) y Diavanshir y Pourbeik (1976) (Cuadro 1). Buch et al. (1997) calcularon valores germinativos [estimados según Diavanshir y Pourbeik (1976)] superiores en semilla remojada en agua caliente (100 °C) que en el material sin tratamiento alguno (testigo).
Cuadro 1. Valores promedios de los parámetros germinativos y agrupamiento Tukey (α = 0.05) de seis tratamientos pregerminativos en semillas de Enterolobium cyclocarpum (Jacq.) Griseb.
Table 1. Average values for the germination parameters and Tukey grouping (α = 0.05) of six pre-germination treatments in Enterolobium cyclocarpum (Jacq.) Griseb. seeds.

Los tratamientos se ordenaron de mayor a menor capacidad germinativa; CG = Capacidad germinativa; GMD = Germinación media diaria; VP = Valor pico; VG1 = Valor germinativo según Czabator (1962); VG2 = Valor germinativo según Diavanshir y Pourbeik (1976).
The treatments are listed in descending order of germination capacity; GC = Germination capacity; MDG = Mean daily germination; PV = Peak value; GV1 = Germinative value according to Czabator (1962); GV2 = Germinative value according to Diavanshir and Pourbeik (1976).
Hacer clic para agrandar
Los buenos resultados que arrojaron los tratamientos pregerminativos de inmersión de la semilla en ácido sulfúrico, lijado y remojo en agua caliente se pueden explicar porque el ácido adelgaza la testa de la semilla, el lijado reduce la resistencia mecánica de la testa y el agua caliente ablanda la testa al mismo tiempo que presiona la barrera física de las macroesclereidas, de modo que los espacios intercelulares quedan conectados; estos tratamientos, por lo tanto, permiten o facilitan el contacto del agua con el embrión y estimulan su desarrollo. Además, el ácido sulfúrico y el agua caliente elimina y lava los inhibidores de los inhibidores de la germinación presentes en la cubierta de la semilla, lo que favorece la germinación (Kramer y Kozlowski, 1979).
Crecimiento de plántulas
Existieron diferencias significativas entre los tratamientos pregerminativos para las variables del crecimiento (p<0.0001). De manera similar, Sánchez y Ramírez (2006) confirmaron lo anterior en el crecimiento en altura de plántulas de Leucaena leucocephala evaluadas al mes de edad.
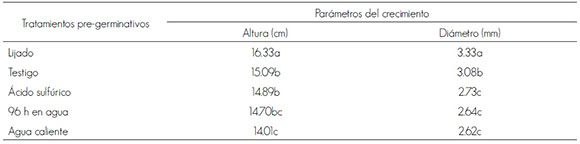
El lijado mostró el mayor promedio a los seis meses de edad, mientras que el remojo de la semilla en agua caliente tuvo los valores más bajos (Cuadro 2). Es interesante observar que a pesar de que la semilla lijada y la remojada en ácido sulfúrico por 30 min germinan al mismo tiempo, las plántulas que se originaron a partir de las primeras superaron en altura a las segundas; no obstante que el testigo comenzó a germinar siete días más tarde que la semilla remojada en ácido sulfúrico, en agua caliente y la lijada, las plántulas que surgieron de ellas se reponen al retraso en la germinación, y no mostraron diferencias significativas en el crecimiento en altura con respecto a las plántulas procedentes de las semillas remojadas en ácido, lo que se puede deber a que el testigo, al tener menor capacidad germinativa, dio lugar a una menor cantidad de plántulas, con lo que se favoreció el crecimiento de las mismas al tener menor competencia por la luz.
De igual forma, en lo referente al crecimiento en diámetro basal, la semilla lijada favoreció las plántulas con el mayor valor promedio, seguido por el testigo, y el remojo de la semilla en agua caliente presentó los menores valores (Cuadro 2). Las diferencias existentes en el crecimiento de las plántulas según el tratamiento pregerminativo, se explican como una consecuencia de estos sobre la velocidad de germinación: es decir, en los primeros meses las plantas provenientes de semillas que germinaron más rápido tuvieron una altura mayor, sin embargo con el tiempo el crecimiento se va homogenizando y van desapareciendo las diferencias, debido a la buena calidad de la semilla que origina plántulas normales y con el tiempo tiende a homogenizar el crecimiento (Sánchez y Ramírez, 2006). Las diferencias se evidencian durante la primera etapa de crecimiento de las plántulas, pero tal superioridad no persiste en los periodos de crecimiento posterior.
Cuadro 2. Valores promedios del crecimiento en altura, en diámetro basal a los seis meses de edad y agrupamiento Tukey (α = 0.05) de seis tratamientos pregerminativos en semillas de Enterolobium cyclocarpum (Jacq.) Griseb.
Table 2. Average values for growth in height and in basal diameter at the age of six months and Tukey grouping (α = 0.05) of six pregermination treatments in Enterolobium cyclocarpum (Jacq.) Griseb. seeds.
Hacer clic para agrandar
Análisis multivariado
Todos los estadísticos del análisis multivariado mostraron diferencias estadísticas altamente significativas (p<0.0001) entre los tratamientos germinativos (Cuadro 3), lo que reafirma las resultados generados por el análisis univariado (ANOVA) de cada variable por separado. Esto significa que, con base en los parámetros germinativos, incluidos los días de inicio y de máxima germinación, así como la altura y diámetro a los seis meses, los tratamientos pregerminativos son estadísticamente diferentes entre sí.
Cuadro 3. Análisis multivariado de varianza (MANOVA) de parámetros germinativos y de crecimiento de seis tratamientos pregerminativos en semillas de Enterolobium cyclocarpum (Jacq.) Griseb.
Table 3. Multivariate analysis of variance (MANOVA) of Enterolobium cyclocarpum (Jacq.) Griseb. seed germination and growth parameters for six pre-germination treatments.

Hacer clic para agrandar
El componente principal uno, como nueva variable, resultado del análisis multivariado de componentes principales, incluyó 64.44 % de la variabilidad total de las variables originales. El análisis de varianza de dicho componente mostró diferencias estadísticas significativas (p˂0.0001) entre los tratamientos pregerminativos. La comparación de medias de Tukey del mismo sugiere que el lijado fue el mejor, aunque fue estadísticamente igual que el ácido sulfúrico, mientras que los demás tratamientos tuvieron valores inferiores (Cuadro 4).
Cuadro 4. Valores promedios del componente principal uno y agrupamiento de Tukey (α = 0.05) de seis tratamientos pre-germinativos en semillas de Enterolobium cyclocarpum (Jacq.) Griseb.
Table 4. Average values of principal component one and Tukey grouping (α = 0.05) of six pre-germination treatments in Enterolobium cyclocarpum (Jacq.) Griseb. seeds.

En el análisis univariado, el tratamiento de ácido sulfúrico tuvo los mayores valores en los parámetros germinativos, comparado con el de lijado; sin embargo, este último tuvo los valores más altos para las variables de altura y diámetro basal. Dichas diferencias hacen que al tratamiento de lijado le corresponda el valor máximo en la variablecomponente principal uno.
El resultado de la comparación de medias de Tukey del componente principal uno, permite recomendar al lijado como el mejor tratamiento pregerminativo para semillas de E. cyclocarpum, aunque presenta menores valores de los parámetros germinativos, comparados con el tratamiento de ácido sulfúrico, presenta mayores valores en crecimiento de altura y diámetro basal. Asimismo, el tratamiento de lijado presenta mayores ventajas ecológicas sobre el tratamiento de ácido sulfúrico.
Conclusiones
Los mejores tratamientos fueron el lijado y el remojo de la semilla en ácido sulfúrico para efectos de germinación. Para crecimiento en diámetro basal y altura de la plántula, el primero fue el más exitoso. Por lo tanto, al integrar los resultados de la germinación y el crecimiento de las plántulas, se puede establecer que el mejor tratamiento fue el lijado de la semilla, por lo cual puede ser utilizado como una alternativa por los viveristas para el manejo de Enterolobium cyclocarpum. Finalmente, los resultados encontrados en este trabajo pueden servir para la toma de decisiones al momento de iniciar la producción de E. cyclocarpum en vivero y para el establecimiento de plantaciones o programas de reforestación, además de futuras investigaciones.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribución por autor
Héctor Viveros Viveros: director y responsable del experimento, contribución en la idea inicial del experimento, definición de los tratamientos por probar y del diseño experimental, establecimiento del experimento, realización de los análisis estadísticos univariados, estructuración del manuscrito; Juan Diego Hernández Palmeros: establecimiento del experimento y realización de las mediciones en vivero; Mario Valerio Velasco García: Co-responsable del experimento, contribución en la idea inicial del experimento, definición de los tratamientos a probar y realización de los análisis estadísticos multivariados; René Robles Silva: recolección y beneficio de la semilla; César Ruiz Montiel: definición de los tratamientos por probar, encargado de conseguir el sitio del experimento además del sustrato y de las sustancias químicas utilizadas en los tratamientos aplicados; Armando Aparicio Rentería: encargado de conseguir el sustrato y las sustancias químicas utilizadas en los tratamientos aplicados; María de Jesús Martínez Hernández: mediciones en vivero; Julia Hernández Villa: realización de las pruebas de laboratorio; María Luisa Hernández Hernández: recolección y beneficio de la semilla.
Agradecimientos
Los autores agradecen a la Comisión Nacional Forestal en el estado de Veracruz por su apoyo con instalaciones, material y asesoría en la realización de las pruebas de viabilidad, peso y contenido de humedad de las semillas. A los dueños y poseedores de los predios por permitir la recolecta de semillas.
Referencias
Baskin, J. M. and C. C. Baskin. 2004. A classification system for seed dormancy. Seed Science Research 14:1-17. [ Links ]
Benítez B., G., M. T. P. Pulido S. y M. Equihua Z. 2004. Árboles multiusos nativos de Veracruz para reforestación: restauración y plantaciones. Instituto de Ecología, A.C. SIGOLFO, Comisión Nacional Forestal. Xalapa, Ver., México. 288 p. [ Links ]
Bonner, F. T., J. A. Vozzo, W. W. Elam and S. B. Land. 1994. Tree seed technology training course. Instructor's Manual. USDA Forest Service. Southern Forest Experiment Station. New Orleans, LA, USA. General Technical Report SO-106. 160 p. [ Links ]
Buch, M. S., L. F. Jara y E. Franco. 1997. Viabilidad de semillas pre tratadas de Caesalpinia velutina (B. & R.) Standl., Enterolobium cyclocarpum (J.) Griseb. y Leucaena leucocephala (Lamb.) de Wit. Boletín de Mejoramiento Genético y Semillas Forestales 18: 8-14. [ Links ]
Centro Agronómico Tropical de Investigaciones y Enseñanzas (CATIE). 2000. Enterolobium cyclocarpum (Jacq.) Griseb. In: Salazar R., F. (coord.téc.), C. Soihet y M. J. Méndez (comps. técs.). Manejo de semillas de 100 especies forestales de América Latina. Sanidad Forest Seed Centre. Nota Técnica No. 25. Turrialba, Costa Rica. pp. 49-50. [ Links ]
Chacko, K. C. and P. K. Chandrasekhara P. 1997. Storage and hot-water treatments enhance germination of Guanacaste (Enterolobium cyclocarpum) seeds. International Tree Crops Journal 9:103-107. [ Links ]
Come, D. 1982. Germination. In: Mazliak, P. (ed.). Croissance et developpement. Collection méthodes. Paris, France. pp. 129-225. [ Links ]
Czabator, F. J. 1962. Germination value: an index combining speed and completeness of pine seed germination. Forest Science 8 (4):386-396. [ Links ]
Diavanshir, K. and H. Pourbeik. 1976. Germination value -a new formula. Silvae Genetica 25 (2):79-83. [ Links ]
Espejel, I. y E. Martínez. 1979. El guanacaste. Instituto Nacional de Investigaciones sobre Recursos Botánicos. Comunicado 33. Jalapa, Ver., México. 4 p. [ Links ]
Hernández G., R. and F. García. 1980. Anatomical changes and in the storage substances during the process of water uptake of Enterolobium cyclocarpum seeds. Acta Científica Venezolana 31 (2):167–73. [ Links ]
Hernández V., G., L. R. Sánchez V. y F. Aragón. 2001. Tratamientos pregerminativos en cuatro especies arbóreas de uso forrajero de la selva baja caducifolia de la sierra de Mazatlán. Foresta Veracruzana 3 (1):9-15. [ Links ]
International Seed Testing Association (ISTA). 1993. International Rules for Seed Testing Rules 1993. Seed Science and Technology 21: Supplement. pp.1-75. [ Links ]
Johnson, D. E. 2000. Métodos multivariados aplicados al análisis de datos. International Thomson Editores, S. A. de C. V. México, D. F., México. 566 p. [ Links ]
Kramer, P. J. and T. Kozlowski. 1979. Physiology of woody plants. Academic Press. New York, NY, USA. 826 p. [ Links ]
Kolotelo, D., E. V. Steenis, M. Peterson, R. Bennett, D. Trotter and J. Dennis. 2001.Seed handling guidebook. Ministry of Forests. British Columbia, Canada. 106 p. [ Links ]
Manzanilla B., H., M. Martínez D. y A. Moreno M. 2001. Monografías de especies nativas promisorias para el establecimiento de plantaciones forestales comerciales en Jalisco: cedro rojo y rosa morada. Programa de Desarrollo Forestal de Jalisco. Documento Técnico 31. Guadalajara, Jal., México. pp. 51-73. [ Links ]
Napier, I. 1985. Técnicas de viveros forestales con referencia especial a Centroamérica. Escuela Nacional de Ciencias Forestales. Siguatepeque, Honduras. 274 p. [ Links ]
Padilla, M. 1995. Tratamientos pregerminativos. In: Trujillo, E. (ed.). Memoria del curso nacional de recolección y procesamiento de semillas forestales. CATIE-PROSEFOR. Turrialba, Costa Rica. pp. 1-6. [ Links ]
Sánchez P., Y. y M. Ramírez V. 2006. Tratamientos pregerminativos en semillas de Leucaena leucocephala (Lam.) de Wit. y Prosopis juliflora (Sw.)DC. Revista de la Facultad de Agronomía Luz 23: 257-262. [ Links ]
Statistical Analysis System (SAS). 2004. SAS/STAT 9.1 User's guide. SAS Institute Inc. Cary, NC, USA. n/p. [ Links ]
Sauto, A., J. M. Baskin, C. C. Baskin and R. Condit. 2006. Studies on the seed biology of 100 native species of trees in a seasonal moist tropical forest, Panama, Central America. Forest Ecology and Management 234:245-263. [ Links ]
Serratos A., J. C. 2000. Aislamiento y caracterización de proteínas de las semillas maduras de Enterolobium cyclocarpum para su aprovechamiento alimenticio. Tesis de doctorado. Universidad de Colima. Postgrado Interinstitucional en Ciencias Pecuarias. Tecoman, Col., México. 76 p. [ Links ]
Shannon, D. A., L. Isaac and F. E. Brockman. 1997. Assessment of hedgerow species for seed size, stand establishment and seedling height. Agroforestry Systems 35: 95-110. [ Links ]
Somarriba, E. y O. Ferreiro. 1984. Efecto de tres tratamientos pregerminativos sobre la germinación y viabilidad de las semillas de Enterolobium cyclocarpum (Jacq) Griseb. Turrialba 34 (1):99-101. [ Links ]
Vázquez-Yanes, C., A. I. Batis M., M. I. Alcocer S., M. Cual D. y C. Sánchez D. 1999. Árboles y arbustos potencialmente valiosos para la restauración ecológica y la reforestación. Reporte técnico del proyecto J084. CONABIO - Instituto de Ecología, Universidad Nacional Autónoma de México. México, D. F., México. pp. 161-164. [ Links ]
Vázquez-Yanes, C. y B. Pérez G. 1977. Notas sobre la morfología, la anatomía de la testa y la fisiología de las semillas de Enterolobium cyclocarpum. Turrialba 27:427-430. [ Links ]
Young J. A. and C. G. Young. 1992. Seeds of woody plants in North America. Dioscorides Press, Portland, OR, USA. 407 p. [ Links ]














