Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias forestales
versión impresa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.6 no.28 México mar./abr. 2015
Artículo
Obtención de azúcares fermentables desde residuos de cartón para cultivar levaduras de interés biotecnológico
Procurement of fermentable sugars from cardboard waste for the cultivation of yeasts for biotechnological use
Yolanda González García1, Juan Carlos Meza Contreras1, José Anzaldo Hernández1y Rubén Sanjuán Dueñas1
1 Departamento de Madera, Celulosa y Papel. Universidad de Guadalajara. Correo e: yolacea@yahoo.com
Recibido el 25 de noviembre de 2014
Aceptado el 10 de febrero de 2015.
Resumen
Se estudió el efecto de diferentes condiciones de hidrólisis ácida (tipo y concentración de ácido, relación sólido: líquido, temperatura) sobre la obtención de azúcares fermentables a partir de residuos de cartón. El hidrolizado resultante se describió en términos de la concentración y tipo de azúcares así como del contenido de compuestos fenólicos. Después dicho hidrolizado se evaluó como fuente de carbono para el crecimiento de las levaduras oleaginosas de Rhodotorula glutinis y Cryptococcus curvatus, que fue previamente destoxificado con carbón activado, con el fin de disminuir la concentración de compuestos inhibidores del crecimiento microbiano, tales como derivados fenólicos generados durante el proceso de hidrólisis ácida. Se obtuvo un hidrolizado con una concentración máxima de azúcares fermentables de 20.9 g L-1 bajo las siguientes condiciones: catalizador, ácido sulfúrico al 10 %, temperatura, 125 °C, relación sólido: líquido, 60 g L-1. La glucosa resultó ser el principal carbohidrato presente y se detectó una pequeña proporción de oligosacáridos. Se encontraron 328.7 mg L-1 de compuestos fenólicos totales como subproductos de la hidrólisis del cartón. Respecto al crecimiento microbiano, los resultados sugieren que R. glutinis es tolerante al hidrolizado sin destoxificar, alcanzando hasta 8.1 g L-1 de biomasa, mientras que C. curvatus no fue capaz de desarrollarse en este, a pesar de haberse destoxificado con diferentes concentraciones de carbón activado. Se concluye que los residuos de cartón son una fuente importante de azúcares para ser utilizados en procesos de fermentación.
Palabras clave: Azúcares fermentables, cartón, compuestos fenólicos, Cryptococcus curvatus (Diddens & Lodder) Golubev, 1981, levaduras oleaginosas, Rhodotorula glutinis (Fresen.) F. C. Harrison (1928).
Abstract
The effect of different acid hydrolysis conditions (acid concentration, solid:liquid ratio and temperature) on the production of fermentable sugars from cardboard waste was studied. The hydrolysate so obtained was characterized with regard to the sugar concentration and specific monosaccharides composition as well as to the phenolic compounds content. Next its use as carbon source for the growth of the yeasts Rhodotorula glutinis and Cryptococcus curvatus was evaluated. The hydrolysate was previously detoxified with activated charcoal in order to decrease the concentration of growth-inhibitory compounds, such as phenolics produced during the acid hydrolysis process. An hydrolysate with a maximum fermentable sugars concentration of 20.9 g L-1 was obtained under the following conditions: catalyst, sulfuric acid 10 %, temperature, 125 °C, solid:liquid ratio, 60 g L-1. The main carbohydrate present in the hydrolysate was glucose. Concerning to the hydrolysis byproducts it was found 328.7 mg L-1 of phenolic compounds. About the microbial growth, the results suggest that R. glutinis is able to tolerate the inhibitory compounds present in the hydrolysate producing up to 8.1 g L-1 of biomass, while C. curvatus was unable to growth on this carbon source. It is concluded that the findings of the present study demonstrated that the cardboard waste is a potential source of fermentable sugars to be used in biotechnology processes for obtaining microbial metabolites of commercial interest.
Key words: Fermentable sugars, cardboard, phenolic compounds, Cryptococcus curvatus (Diddens & Lodder) Golubev, 1981, oleaginous yeasts, Rhodotorula glutinis (Fresen.) F. C. Harrison (1928).
Introducción
En la actualidad, existe gran interés por el uso de biomasa lignocelulósica como productora de azúcares fermentables para obtener compuestos de importancia comercial tales como bioetanol, ácido láctico, xilitol y proteína unicelular (Kuloyo et al., 2014; Guerfali et al., 2014; Wu et al., 2014).
Una de las principales fuentes de material celulósico residual es sin duda la industria de la madera, celulosa y papel, que genera una gran cantidad de productos y subproductos ricos en carbohidratos. Entre estos destacan los lodos de papel y los residuos de cartón que representan 13.8 % de los residuos sólidos municipales de México (Semarnat, 2012); dichos materiales contienen de 20 a 75 % de celulosa y hemicelulosa en base seca, aunque también incluyen lignina, recubrimientos y aditivos. Su alto contenido de hidratos de carbono los convierte en fuente de azúcares para el cultivo de diferentes microorganismos (Ming-Jun et al., 2011).
Al comparar con otros efectos lignocelulósicos (MLig) como el olote de maíz, la paja de trigo, de arroz, y los bagazos, los residuos de papel y cartón son más susceptibles a los tratamientos de hidrólisis debido a que ya han sido expuestos a un extenso procesamiento mecánico y químico durante el pulpeo (Marques et al., 2008). La hidrólisis y fermentación de estos residuos para obtener etanol han sido previamente estudiados (Fan y Lynd, 2007; Marques et al., 2008), sin embargo, no existen trabajos documentados sobre su uso para el cultivo de levaduras oleaginosas como Rhodotorula glutinis (Fresen.) F. C. Harrison (1928) y Cryptococcus curvatus (Diddens & Lodder) Golubev, 1981 que son capaces de acumular aceite como materia prima para producir biodiesel. Una opción viable para la producción biotecnológica de lípidos es el cultivo de estas levaduras con residuos de bajo costo (Gao et al., 2014), como los materiales mencionados previamente. En este sentido, la principal limitante para aprovechar la biomasa celulósica como fuente de carbohidratos para fermentaciones es la disponibilidad de los azúcares simples, como glucosa y xilosa, ya que estos forman parte de los polímeros de celulosa y hemicelulosa.
Por lo anterior es necesario llevar a cabo un proceso de hidrólisis para la obtención de los azúcares asimilables por los microorganismos. Los procesos más documentados son el biológico (por medio de microorganismos o enzimas) y el químico (mediante el uso de ácidos o álcalis). La hidrólisis ácida es el método más empleado y se ha implementado a escala comercial desde 1909 en Estados Unidos de América y algunos países de Europa y Asia para generar azúcares fermentables y utilizar madera como sustrato para la producción de bioetanol (Tsao et al., 1978). Incluso, a partir de hidrolizados ácidos de residuos agroindustriales se han desarrollado también fermentaciones para obtener proteína unicelular y otros compuestos químicos (Ferrer et al., 2002).
Algunos de los parámetros más estudiados en este proceso han sido la temperatura y el tipo de ácido entre los que destacan el clorhídrico y el sulfúrico, de los cuales el último ofrece mayores ventajas (Pedersen et al., 2010). Sin embargo, los hidrolizados obtenidos por el proceso ácido contienen inhibidores del crecimiento microbiano como el ácido acético, el ácido fórmico, el furfural (Chandel et al., 2013) y compuestos fenólicos que se derivan de la compleja estructura de la lignina (Binder y Raines, 2010), por lo que es importante evaluar el efecto de los mismos sobre el proceso de fermentación.
En este trabajo se estudió la obtención y caracterización química de un hidrolizado ácido de residuos de cartón bajo diferentes condiciones de reacción, su tratamiento con carbón activado para eliminar compuestos inhibidores del crecimiento microbiano y su uso posterior como fuente de carbono para el cultivo de levaduras oleaginosas.
Materiales y Métodos
Residuos de cartón
Se trabajó con residuos de cartón corrugado (malla 40). Se tomaron muestras de cinco lotes diferentes y se describieron de acuerdo a las normas TAPPI (TAPPI, 2007), de acuerdo a los siguientes criterios: humedad, extraíbles totales, celulosa, hemicelulosa, lignina y cenizas.
Hidrólisis ácida del cartón
Se ensayaron el ácido clorhídrico (HCl) y el ácido sulfúrico (H2SO4) para la hidrólisis de los residuos de cartón. Se analizó el efecto de su concentración, la temperatura y la relación sólido:líquido sobre la eficiencia de hidrólisis (Rendimiento) y la concentración de azúcares fermentables. Se aplicó un diseño experimental factorial 23 con dos réplicas, con los tres factores cada uno en dos niveles: concentración de ácido, 2 y 10 %; temperatura de hidrólisis, 100 y 125 °C; relación sólido: líquido (cartón:ácido), 20 y 60 g L-1.
Se realizó un análisis. Obtención de azúcares fermentables obtenidos con cada ácido, con apoyo del software Statgraphics Plus 5.1 (Manugistics, 2005).
El proceso de hidrólisis se llevó acabo en tubos de vidrio de 25 mL que fueron colocados en una autoclave durante 120 min, a lo largo de los cuales se tomaron muestras cada 30 min para evaluar la cinética de conversión de los residuos de cartón en azúcares fermentables para lo cual se aplicó la técnica del ácido 3, 5-Dinitrosalisílico (DNS) (Miller, 1959). La eficiencia de sacarificación (rendimiento) se hizo con la siguiente fórmula:

Posteriormente, al utilizar el método más eficiente, se efectuó una segunda cinética de hidrólisis, y se tomaron muestras cada 20 min, a las cuales se les determinó tanto azúcares reductores, por la misma técnica (Miller, 1959) como compuestos fenólicos totales (subproductos de hidrólisis) por el Método de Folin-Ciocalteu (Singleton et al., 1999). El experimento se realizó por duplicado.
Caracterización del hidrolizado
Los residuos de cartón fueron procesados según el procedimiento establecido previamente y se midió la humedad con un analizador Hohaus modelo MB45, la cantidad de azúcares reductores (Miller, 1959), de compuestos fenólicos totales (Singleton et al., 1999), la concentración de azúcares totales por el Método de Fenol-Sulfúrico (Dubois et al., 1956) y la composición específica de carbohidratos (HPLC). Para esta última técnica se usó un cromatógrafo de líquidos Walters 600 provisto de un detector de índice de refracción (Waters R401), un sistema de bombas cuaternarias, horno y columna BIO RAD (Aminex HPX-87C). Las condiciones de operación fueron las siguientes: temperatura de la columna a 80 °C; flujo eluyente (agua), 0.6 mL min-1; volumen de muestra, 20 mL.
Activación y conservación de cepas
Las levaduras que se estudiaron fueron Rhodotorula glutinis (ATCC 204091) y Cryptococcus curvatus (ATCC 20509) adquiridas de la Colección Americana de Cultivo Tipo, conocida como ATCC por sus siglas en inglés, las cuales fueron activadas y propagadas en medio YPD. Para su conservación 1.5 mL de suspensión celular de cada levadura colectada en la fase de crecimiento exponencial se metió en un congelador Torrey modelo CH25 a -20 °C en viales de 2 mL con 0.5 mL de glicerol al 20 %.
Evaluación del crecimiento de las levaduras en el hidrolizado
Durante el proceso de hidrólisis química del cartón, debido a la degradación de carbohidratos y lignina, se generan subproductos que pueden resultar inhibitorios para el crecimiento microbiano. Por lo tanto, se evaluó la capacidad de las levaduras para crecer directamente en el hidrolizado, sin destoxificar, y en hidrolizado previamente destoxificado con carbón activado para remover compuestos inhibidores. Cabe mencionar que el pH del hidrolizado fue previamente ajustado a 5.5 mediante hidróxido de calcio y después se le añadió 20, 50 o 100 g L-1 de carbón activado, y se agitó constantemente durante 12 horas. Por último, el carbón se removió con una centrifuga Heraeus modelo Varifugue y se analizó la concentración de azúcares y de compuestos fenólicos al sobrenadante, a fin de determinar la eficiencia de remoción de inhibidores por parte del carbón y la cantidad de carbohidratos adsorbidos en el material.
Los hidrolizados destoxificados fueron utilizados como base para preparar medio de cultivo para las levaduras al que se le adicionaron, también, otros nutrientes (por L de hidrolizado): (NH4)2SO4, 4 g; peptona, 1 g; KH2PO4, 3 g; MgSO4, 1 g; elementos traza, 1 mL. La composición de estos últimos es (por L): CaCl2, 3.6 g; ZnSO4, 0.75 g; CuSO4, 0.13 g; MnSO4, 0.5 g; CoCl2, 0.13 g; Na2MoO4, 0.17 g; FeSO4, 0.025 g; EDTA, 0.04 g. Como medio control se utilizó glucosa como fuente de carbono (20 g L-1) y todos los demás compuestos mencionados previamente disueltos en agua destilada en lugar de en hidrolizado. El pH de los medios se ajustó a 5.5 y para medio sólido se añadieron 16 g L-1 de agar.
Para la siembra de las levaduras en las cajas agar-cartón hidrolizado, se desarrolló un pre-inóculo en medio YPD (extracto de levadura, 20 g L-1; peptona, 20 g L-1; dextrosa, 20 g L-1) durante 24 h, al término de las cuales se tomaron 10 μL de la suspensión celular (DO600 = 0.3) y se inocularon sobre el agar (10 puntos de inoculación). Las cajas se metieron en una incubadora Luzeren modelo DHP9162 a 30 °C durante 72 h y posteriormente se cuantificaron las colonias desarrolladas. También se realizó una cinética de crecimiento en medio líquido (control y base hidrolizada) para determinar el perfil de crecimiento de las levaduras (producción de biomasa). Este cultivo se llevó a cabo en un matraz Erlenmeyer de 500 mL con deflectores y se incubó a 30 °C en agitación a 200 rpm.
Resultados y Discusión
Descripción del cartón
La mayoría de los productos (papel y cartón) y subproductos de la industria papelera (fibras recicladas y lodos) contienen carbohidratos (celulosa y hemicelulosa) en el intervalo de 20 a 75 %, incluyendo lignina, revestimientos y rellenos (Zhu et al., 2011). En los resultados experimentales mostrados en el Cuadro 1, se observa una cantidad total de polisacáridos de 65.6 % (celulosa y hemicelulosa), una proporción superior a la observada en maderas de Eucalyptus globulus Labille. (62.3 %) (Parajó et al., 1993) o en Pinus pinaster Ait. (59.6 %) (Parajó et al., 1995). Los resultados mostrados indican que el cartón utilizado en este estudio tiene un alto contenido de polisacáridos, lo cual es apropiado para la producción de azúcares fermentables.
Cuadro 1. Composición de los residuos de cartón.
Table 1. Composition of cardboard wastes.

Para el caso del contenido de celulosa en cartón, el valor fue superior al citado por Yuan et al. (2012) (57 %) y similar al de Yañez et al. (2004), mientras que el de hemicelulosa resultó ser menos de la mitad al mencionado por este último autor (13.8 %).
La hemicelulosa es el segundo polisacárido en la pared celular de plantas, usualmente constituye alrededor de 20-35 % de la biomasa vegetal (Wyman et al., 2005). Sin embargo, la cantidad cuantificada de ese material en el cartón (5.6 %) fue más baja a la registrada en otros MLig como bagazos, pajas y madera. Este hecho se debe posiblemente al tipo de pulpeo químico empleado en el proceso de producción de cartón (Kraft, por lo general), o al probable uso de fibras o pulpa reciclada para dicho propósito. Otro de los principales componentes de los MLig es la lignina, la cual le confiere solidez a la estructura vegetal, debido a que mantiene unidas a la celulosa y hemicelulosa (Ragauskas et al., 2006); además es resistente al ataque biológico y agentes químicos, lo que constituye un obstáculo a la eficiente hidrólisis de los polisacáridos de la biomasa celulósica. El contenido de lignina en el cartón (Cuadro 1) fue similar al documentado por Yañez et al. (2004) y menor al observado en materiales celulósicos forestales y agrícolas (15-30 %), quizás como consecuencia de la remoción de esta durante el proceso de pulpeo Kraft.
Hidrólisis ácida
La hidrólisis ácida como pretratamiento de MLig favorece el rompimiento de los polímeros de hemicelulosa y celulosa, a oligosacáridos, glucosa u otros monómeros. Los ácidos a altas concentraciones son muy efectivos para hidrolizar muchos MLig, lo que da altos rendimientos de glucosa o xilosa a partir de celulosa o hemicelulosa, a baja temperatura y con baja generación de productos de degradación. También el uso de soluciones diluidas de ácidos (H2SO4, HCl, H3PO4, HNO3, CH3COOH) han sido ampliamente investigadas para dicho fin, las de ácido sulfúrico y clorhídrico son las más comúnmente usadas (Linde et al., 2008).
En este estudio, se evaluó la hidrólisis ácida como una de las técnicas más eficientes para el procesamiento de Mlig, comparando el ácido clorhídirico (HCl) y ácido sulfúrico (H2SO4). Los resultados muestran el efecto del tipo y la concentración de ácido (Figura 1A y B), así como la concentración de sólidos (cartón) y la temperatura, sobre la producción y rendimientos de azúcares a partir de cartón. En el caso del HCl, los factores que resultaron tener una influencia significativa sobre la cantidad de azúcares fermentables generados, fueron la concentración del ácido y de sólidos (cartón) así como su interacción (cuadros 2 y 3). La máxima concentración de azúcares (14.8 g L-1) se alcanzó con la siguiente combinación de factores: HCl 10 %; 60 g L-1 de concentración de sólidos (cartón); temperatura de 100 o 125 °C. El rendimiento de la hidrólisis en estas condiciones fue de 25.8 %.

Figura 1. Producción y rendimiento de azúcares obtenidos por hidrólisis con HCl (A) y H2SO4 (B), en diferentes condiciones de temperatura y concentración de sólidos (cartón).
Figure 1. Production and yield of sugars obtained by hydrolysis with HCl (A) and H2SO4 (B) and in different temperature conditions and concentration of solids (cardboard).
Cuadro 2. Análisis de varianza de los tres factores estudiados en la hidrólisis de cartón para la obtención de azúcares fermentables, usando como catalizador HCl.
Table 2. Analysis of variance of the three factors studied in cardboard hydrolysis to obtain fermentable sugars, using HCl as a catalyst.

Nivel de confianza del 95%.
Confidence level of 95 %.
Cuadro 3. Medias de los niveles que tuvieron un impacto significativo en la obtención de azúcares fermentables usando como catalizador HCl.
Table 3. Means levels had a significant impact on the production of fermentable sugars using HCl as a catalyst.
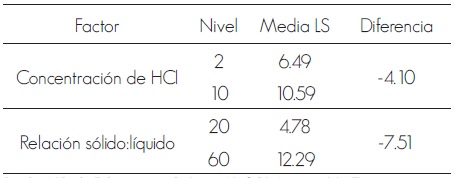
Prueba LSD de Fisher; casos, 8; Sigma LS, 0.82; Límites, +/-2.67.
Fisher LSD test; cases, 8; Sigma LS, 0.82; Limits, +/- 2.67
Para el caso de la hidrólisis con H2SO4 (Figura 1B), los tres factores estudiados resultaron significativos, así como la interacción entre la concentración de ácido y de sólidos (cuadros 4 y 5). Al utilizar la siguiente combinación de factores se obtiene la mayor concentración de azúcares (19.2 g L-1): H2SO4 10 %; 60 g L-1 de concentración de sólidos (cartón) y temperatura de 125 °C. En estas condiciones el rendimiento de la hidrólisis fue de 31.2 %.
Cuadro 4. Análisis de varianza de los tres factores estudiados en la hidrólisis de cartón para la obtención de azúcares fermentables, usando como catalizador HCl.
Table 4. Analysis of variance of the three factors studied in cardboard hydrolysis to obtain fermentable sugars, using HCl as a catalyst.

Nivel de confianza de 95 %.
Confidence level of 95 %.
Cuadro 5. Medias de los niveles que tuvieron impacto significativo en la obtención de azúcares fermentables usando como catalizador H2SO4.
Table 5. Mean levels that had significant impact on the production of fermentable sugars using H2SO4 as catalyst.

En general se observó que al utilizar la carga de sólidos baja (20 g L-1), el rendimiento de la hidrólisis incrementa, sin embargo se obtienen hidrolizados con bajo contenido de azúcares; mientras que al aumentar la carga de sólidos (60 g L-1) el rendimiento disminuye, pero la concentración de azúcares que se obtiene es superior.
La mayor producción de azúcares en ambos ácidos se obtuvo al utilizar tanto la concentración más alta de ellos (10 %), como de sólidos (60 g L-1 cartón) en la mezcla de reacción. Adicionalmente, estos valores fueron alcanzados cuando se aplicó la temperatura más alta (125 °C), aunque para el caso de HCl a 100 °C también se lograron niveles significativos de azúcares.
El H2SO4 en las condiciones mencionadas permitió obtener 30 % más de azúcares (19.2 g L-1) y un rendimiento de estos superior a 20 % (31.2 %), al registrado con HCl (Figura 1A y B). Al respecto, Yañez et al. (2004) determinaron las cantidades más altas de azúcares (29 g L-1) y rendimiento de conversión de hemicelulosa (78 %), cuando utilizaron 10 % de cartón y 3 % de H2SO4, aunque con un tiempo (180 min) y temperatura (130 °C) muy superiores a las del presente trabajo. Recientemente, Escorza et al. (2011) hidrolizaron química (60 % H2SO4) y biológicamente (Phanerochaete sp.) cartón. Los autores indican con el tratamiento ácido un rendimiento de 20 % de azúcares reductores, mientras que con el biológico fue casi del doble (39 %), para una concentración de 10 g L-1 de azúcares en el medio a una carga de cartón de 2 %; esta concentración de carbohidratos fue menor a la registrada en el estudio que aquí se documenta (19.2 g L-1) en las mejores condiciones de hidrólisis (10 % H2SO4, 60 g L-1 cartón y125 °C) (Figura 1B).
Concentraciones similares de estos compuestos han sido citados por Aguilar et al. (2002), (24.6 g L-1) al hidrolizar bagazo de caña de azúcar (6 %) con H2SO4 (2 %, 122 °C, 24 min) y solubilizar 90 % de hemicelulosa. El efecto de la temperatura identificado es congruente con lo publicado, donde se menciona que con valores mayores a 100 °C (120-130 °C) generan tanto las concentraciones como los rendimientos más importantes de azúcares (Camargo et al., 2014; Reales et al., 2013; Laopaiboon et al., 2010; Yañez et al., 2004; Aguilar et al., 2002). Recientemente, también se han consignado cantidades relevantes de azúcares reductores (33 g L-1) a partir de cargas elevadas de biomasa vegetal de jacinto de agua (Eichhornia crassipes (Mart.) Solms, 12 %) y soluciones ácidas diluidas (2.5 % H2SO4), con una temperatura de 121 °C y tiempo de 20 min, condiciones similares a las manejadas en la presente investigación (Reales et al., 2013).
Por otro lado, se ha realizado la hidrólisis enzimática de cartón a diferentes concentraciones (5-10 %) y se alcanzaron rendimientos de azúcares que varían entre 56 y 80 % (Kádár et al., 2004; Wayman et al., 1992), de papel periódico (10 % sólidos) (Li et al., 2007) y lodos de papel (6 % sólidos) (Kádár et al., 2004), con 40 % y 59 % de conversión de celulosa, respectivamente.
La producción de azúcares a partir de MLig parece estar limitada por el alto grado de complejidad inherente en el procesamiento de estas materias primas, lo cual se relaciona con la naturaleza y composición química de la biomasa lignocelulósica. Los dos principales polímeros que la constituyen son la celulosa y la hemicelulosa, cuya hidrólisis provee azúcares fermentables que pueden convertirse en productos de alto valor agregado (Sánchez y Cardona, 2008). La eliminación de hemicelulosas o de lignina conduce a cambios estructurales en los MLig, lo que facilita la accesibilidad de agentes químicos y enzimas a las cadenas de celulosa. Los pretratamientos con ácidos diluidos han sido empleados para dicho propósito, pues mejoran los rendimientos de azúcares (Saha y Bothast, 1999), ya que incrementan el área superficial, la porosidad y la humectación del MLig, y hace a los polisacáridos más susceptibles a la hidrólisis química o enzimática.
La efectividad del pretratamiento y mejoramiento de la hidrólisis se correlaciona con la remoción de hemicelulosa, lignina y con la reducción de la cristalinidad de la celulosa (Yang y Wyman, 2008; Sun y Cheng, 2002; Mansfield et al., 1999). En un pretratamiento de MLig con ácidos diluidos, la hemicelulosa es, preferentemente atacada, seguida por la celulosa amorfa (du Toit et al., 1984). Los parámetros críticos en los pretratamientos ácidos incluyen la temperatura, el tiempo y la relación ácido:sólidos (concentración de sólidos).
Las cinéticas de hidrólisis de residuos de cartón en las que se usaron H2SO4 o HCl en las condiciones óptimas, según el análisis estadístico del diseño experimental utilizado, muestran perfiles diferentes de liberación de azúcares (Figura 2), que inició rápidamente su producción entre los 30 y 60 min, para el caso del HCl. Sin embargo, con ambos ácidos se observó que a los 90 min se alcanza la máxima concentración de azúcares, la cual fue 30 % superior para el H2SO4; posteriormente, se evidencia un proceso de degradación de los mismos.

Figura 2. Cinética de hidrólisis de residuos de cartón utilizando como catalizador HCl y H2SO4 bajo las mejores condiciones de obtención de azúcares (concentración del ácido, temperatura, y contenido de sólidos).
Figure 2. Kinetics of hydrolysis of waste cardboard with HCl and H2SO4 as catalysts under the best conditions for obtaining sugars (acid concentration, temperature and solid content).
Resultados similares de efectividad entre el HCl y el H2SO4 (0.5 %) han sido registrados en el pretratamiento de bagazo de caña de azúcar (6.6 % sólidos, 120 °C, 4h) deslignificado producen concentraciones de azúcares de 19 y 16 g L-1, respectivamente (Laopaiboon et al., 2010). A pesar de que el HCl permitió generar una cantidad ligeramente superior de carbohidratos, la desventaja fue que promovió la producción de furfural (0.7 g L-1), uno de los principales compuestos tóxicos para el desarrollo microbiano (Laopaiboon et al., 2010).
La hidrólisis de celulosa a glucosa mediante ácidos diluidos es un proceso relativamente simple, el cual origina rendimientos moderadamente altos en tiempos cortos. El tamaño pequeño de los protones les permite tener accesibilidad a la catálisis de los enlaces glucosídicos sin problema. No obstante, los azúcares producidos pueden ser susceptibles a reacciones catalizadas en medio ácido y, por la misma temperatura, se generan productos de degradación.
Aumentar la temperatura, además de incrementar los rendimientos de obtención de azúcares tiene como desventaja la formación de los productos de degradación, tales como furfural, hidroximetilfurfural, ácido acético, fórmico, levulínico, etcétera (Kumar et al., 2009). Para evaluar la generación de subproductos (compuestos fenólicos) durante el proceso de hidrólisis, se utilizaron las condiciones descritas, previamente (de las cuales resultó la mayor concentración de azúcares): H2SO4 al 10 %, 60 g L-1 de sólidos y 125 °C. Durante el proceso se tomaron muestras cada 20 min para determinar azúcares y compuestos fenólicos.
En la Figura 3 se observa que la generación de compuestos fenólicos, derivados de la lignina presente en el cartón, está relacionada con la producción de los azúcares. Es decir, a medida que se realiza la hidrólisis de la celulosa se ataca químicamente a la lignina, y el tiempo al que se alcanza la máxima concentración de carbohidratos es el mismo que para compuestos fenólicos (90 min). Posteriormente, los azúcares se degradan y la concentración de compuestos fenólicos ya no se incrementa. Gupta et al. (2009) señalaron que la liberación de azúcares es mayor al aumentar la concentración de ácido hasta alcanzar el valor óptimo. Después, crece la formación de compuestos inhibidores tóxicos y como consecuencia disminuye la concentración de azúcares.

Figura 3. Cinética de hidrólisis de residuos de cartón para la obtención de azúcares fermentables y de subproductos de degradación (H2SO4 10 %, 60 g L-1 de sólidos, 125 °C).
Figure 3. Hydrolysis kinetics of cardboard wastes to obtain fermentable sugars and degradation byproducts (H2SO4 10 %, 60 g L-1 solids, 125 °C).
Sin embargo este tipo de pretratamiento ha sido aplicado a diversos MLig, como los residuos de semillas de girasol desengrasadas (10 %) con H2SO4 (6 %, 121 °C, 20 min) de los que se obtuvieron 54 g L-1 de azúcares y una recuperación de 75.5 % de hemicelulosa. Además, se produjeron compuestos inhibidores (fenoles: 3.9 g L-1; ácido acético: 1.9 g L-1; furfural: 0.018 g L-1; hidroximetilfurfural: 0.051 g L-1), que se incrementaron de manera significativa, sobre todo de fenoles (hasta 2.5 veces), al prolongar el tiempo de reacción hasta 60 min (Camargo et al., 2014). La lignina bajo condiciones ácidas se despolimeriza y degrada en una amplia variedad de monómeros y oligómeros aldehídicos, aromáticos y fenólicos. Los compuestos fenólicos de bajo peso molecular inhiben a enzimas y microorganismos. La vainillina, siringaldehído e hidroxibenzaldehído son algunos de estos compuestos liberados en hidrólisis ácida.
Caracterización del hidrolizado
Los azúcares provenientes del cartón pueden ser empleados como medios de fermentación apropiados para la producción biotecnológica de una variedad importante de compuestos químicos de relevancia industrial; algunos ejemplos son las celulasas y xilanasas (Moretti et al., 2012), el metano (Yuan et al., 2012), bioetanol (Wang et al., 2012) y el ácido láctico (Yañez et al., 2005).
La composición del hidrolizado es de interés porque las levaduras en cuestión tienen diferente afinidad para el consumo de carbohidratos, con mayor capacidad para asimilar glucosa que xilosa. Se esperaba que estos dos carbohidratos pudieran estar en el hidrolizado debido a que el cartón está constituido principalmente por celulosa, aunque contiene hemicelulosa que es la fuente de la xilosa. Sin embargo en el análisis del hidrolizado por cromatografía de líquidos (HPLC) se determinó la mayor proporción de glucosa, no se detectó xilosa, ni otro monosacárido (Figura 4). Cabe señalar que gran parte parte de los carbohidratos presentes en el hidrolizado están como monosacárido (glucosa) y solo una pequeña proporción corresponde a oligosacáridos. Lo anterior es relevante, ya que las levaduras estudiadas en este trabajo carecen de sistemas enzimáticos para degradar polisacáridos, así que el tener una mayor cantidad de azúcares en forma simple implica una mejor conversión de dicho substrato por el microorganismo.

Figura 4. Determinación de la composición de carbohidratos del hidrolizado obtenido con H2SO4 (10 %, 60 g L-1 de sólidos, 125 °C) por cromatografía de líquidos (HPLC).
Figure 4. Determination of the composition of the hydrolyzate resulting from H2SO4 (10 %, 60 g L-1 solids, 125 °C) by liquid chromatography (HPLC).
Evaluación del crecimiento de las levaduras en el hidrolizado
Una vez caracterizado, se procedió con el cultivo de las levaduras en el hidrolizado destoxificado o sin destoxificar, ya que existen estudios previos de cultivo de levaduras oleaginosas en hidrolizados de residuos lignocelulósicos, en los que se hace mención del efecto tóxico de los compuestos inhibidores y la necesidad de aplicar métodos de destoxificación (Huang et al., 2009). En el Cuadro 6 se resume la caracterización del hidrolizado después de someterlo a tratamiento con carbón activado para remover compuestos inhibidores. Se observa que después de destoxificar el hidrolizado la concentración de compuestos fenólicos disminuye drásticamente, aunque hay un efecto de retención de azúcares.
Cuadro 6. Caracterización del hidrolizado después de llevar a cabo la destoxificación con carbón activado a diferentes concentraciones.
Table 6. Description of the hydrolyzate after detoxification with activated carbon at different concentrations.

Hacer clic para agrandar
Para determinar si el hidrolizado requiere ser destoxificado antes de usarse como medio para el crecimiento de las levaduras, estas fueron sembradas en medio sólido preparado en base al hidrolizado sin tratar o tratado con carbón (tratamiento I, II, III). Como control se utilizó un medio mineral con glucosa, como fuente de carbono; es decir un sin hidrolizado. Se observó que las dos levaduras crecieron satisfactoriamente en el control (medio en base a glucosa); C. curvatus no se desarrolló en el hidrolizado de cartón (destoxificado o sin destoxificar), lo cual sugiere que es sensible a los compuestos de inhibición a las concentraciones presentes, aún después de los tratamientos con carbón activado. Para el cultivo de esta levadura se han utilizado hidrolizados de bagazo de sorgo y fibra de maíz (Liang et al., 2014). En el primer caso el crecimiento fue favorable a pesar del contenido de compuestos inhibidores, mientras que con el hidrolizado de fibra de maíz, C. curvatus no tuvo ninguna reacción en ese sentido, pese haberlo enriquecido con otros nutrientes.
R. glutinis tuvo un desarrollo colonial favorable tanto en el medio control, como en el hidrolizado sin destoxificar, por lo que se deduce que cuenta con una mayor resistencia a los compuestos inhibitorios, o bien posee un mecanismo enzimático para degradarlos o transformarlos, de manera que no le resulten tóxicos para su desarrollo. Al respecto, esta cepa se ha cultivado en hidrolizados de paja de trigo; de hojas de Populus euramevicana Guinier; Miscanthu ssp. (Mast et al., 2014); y paja de arroz (Yen y Chang, 2014). Los resultados de la toxicidad del hidrolizado son contrastantes. Los investigadores como Chen et al. (2009) indican que algunos de los productos de degradación de los MLig inhiben su crecimiento, mientras que en otros estudios (Yu et al., 2011; Tao et al., 2010) se informa que no presentan un efecto negativo, ya que R. glutinis fue capaz de crecer en hidrolizado sin destoxificar, e incluso el crecimiento fue superior en comparación de lo observado en hidrolizado destoxificado.
Esta cepa fue seleccionada para continuar con el estudio de crecimiento en medio líquido. Se utilizó el medio en base a glucosa y en base a hidrolizado de cartón. Los resultados se exhiben en la Figura 5.

Figura 5. Cinética de crecimiento de Rhodotorula glutinis (Fresen.) F. C. Harrison (1928) en medio mineral y a base de hidrolizado de cartón sin destoxificar.
Figure 5. Kinetics of Rhodotorula glutinis (Fresen.) F. C. Harrison (1928) growth in mineral medium and on cardboard non-detoxified hydrolyzate.
Se aprecia que el perfil de crecimiento es muy similar en ambos medios, y que se alcanzó una concentración máxima de biomasa muy parecida (7 a 8 g L-1). Resultado que coincide con lo observado en medio sólido, lo que sugiere que R. glutinis es tolerante a los compuestos inhibitorios generados durante el proceso de hidrólisis de cartón, e incluso, tal como observó Yu et al. (2011), la producción de biomasa fue ligeramente mayor cuando se utiliza medio en base a hidrolizado sin destoxificar. La misma tendencia se observó respecto a la velocidad de crecimiento la cual fue de 0.46 h-1 en el medio control, mientras que en el medio en base a hidrolizado de cartón fue de 0.51 h-1.
Conclusiones
El cartón como uno de los principales residuos de la industria papelera contiene una cantidad importante de polisacáridos (celulosa y hemicelulosa), la cual constituye una fuente potencial de azúcares fermentables para la generación biotecnológica de productos de interés. La hidrólisis ácida de este residuo, en especial con H2SO4, fue un método eficiente para la obtención de azúcares, sin embargo, el incremento en el tiempo de hidrólisis más allá de 120 min provocó la degradación de los carbohidratos y un incremento en la concentración de compuestos fenólicos, inhibidores del crecimiento microbiano. Al aplicar carbón activado al hidrolizar, la concentración de los inhibidores disminuye de manera importante, aunque sucede lo mismo con la concentración de azúcares. La levadura R. glutinis creció favorablemente en el hidrolizado de cartón aún sin destoxificar con carbón activado, lo que evidencia su tolerancia a los subproductos de degradación y su potencial para la obtención de aceite microbiano, a partir de esta fuente de carbono.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribución por autor
Yolanda González García: diseño del experimento, ejecución, análisis y discusión de resultados; Juan Carlos Meza Contreras: definición de las condiciones de hidrólisis, análisis y discusión de resultados de la hidrólisis química; José Anzaldo Hernández: ejecución de la caracterización de la materia prima; Rubén Sanjuán Dueñas: análisis y discusión de resultados de la caracterización de la materia prima.
Agradecimientos
Este trabajo fue realizado en el marco del proyecto Conacyt-Sener Estudio de fuentes alternativas de lípidos para la producción de biodiesel de tercera generación: aceite microbiano a partir de residuos celulósicos (clave: 152663).
Referencias
Aguilar, R., J. A. Ramírez, G. Garrote and M. Vázquez. 2002. Kinetic study of the acid hydrolysis of sugar cane bagasse. Journal of Food Engineering 55: 309–318. [ Links ]
Binder, J. B. and R. T. Raines. 2010. Fermentable sugars by chemical hydrolysis of biomass. Proceedings of the National Academy of Sciences 107:4516-4521. [ Links ]
Camargo, D., S. D. Gomes, M. G. A. Felipe and L. Sene. 2014. Response of by-products of sunflower seed processing to dilute-acid hydrolysis aiming fermentable sugar production. Journal of Food Agriculture and Environment 12 (2): 239-246. [ Links ]
Chandel, A. K., S. S. da Silva and O. V. Singh. 2013. Detoxification of lignocellulose hydrolysates: Biochemical and metabolic engineering toward white biotechnology. BioEnergy Research 6(1): 388-401. [ Links ]
Chen, X., Z. Li, X. Zhang, F. Hu, D. D. Y. Ryu and J. Bao. 2009. Screening of oleaginous yeast strains tolerant to lignocellulose degradation compounds. Applied Biochemistry and Biotechnology 159: 591–604. [ Links ]
du Toit, P. J., S. P. Olivier and P. L. van Biljon. 1984. Sugar cane bagasse as a possible source of fermentable carbohydrates. I. Characterization of bagasse with regard to monosaccharide, hemicellulose, and amino acid composition. Biotechnology and Bioengineering 26:1071-1078. [ Links ]
Dubois, M., K. Gilles, J. Hamilton, P. Rebers and F. Smith. 1956. Colorimetric method from determination of sugars and related substances. Nature 28(3):350–356. [ Links ]
Escorza, G., J. Martínez, M. Cruz, A. Arcos, F. Caballero e I. Membrillo. 2011. Hidrólisis química y microbiana de cartón para producción de azúcares fermentables. In: Martínez-Jiménez, A., J. G. Saucedo-Castañeda, O. Loera-Corral y M. Trujillo-Roldán (eds.). Memorias del XIV Congreso Nacional de Biotecnología y Bioingeniería. Querétaro, Qro., México. pp. 29. [ Links ]
Fan, Z. and L. R. Lynd. 2007. Conversion of paper sludge to ethanol. I: Impact of feeding frequency and mixing energy characterization. Bioprocess and Biosystems Engineering30: 27–34. [ Links ]
Ferrer, J. R., G. Páez, L. Arenas de Moreno, C. Chandler, Z. Mármol y L. Sandoval. 2002. Cinética de la hidrólisis ácida de bagacillo de caña de azúcar. Revista de la Facultad de Agronomía 19: 23-33. [ Links ]
Gao, Q., Z. Cui Z., J. Zhang J. and J. Bao. 2014. Lipid fermentation of corncob residues hydrolysate by oleaginous yeast Trichosporon cutaneum. Bioresource Technology 152:552-556. [ Links ]
Guerfali, M., A. Saidi, A. Gargouri and H. Belghith. 2014. Enhanced enzymatic hydrolysis of waste paper for ethanol production using separate saccharification and fermentation. Applied Biochemistry and Biotechnology 175(1):25-42. [ Links ]
Gupta, R., K. K. Sharma and R. C. Kuhad. 2009. Separate hydrolysis and fermentation (SHF) of Prosopis juliflora a wood substrate, for the production of cellulosic ethanol by Saccharomyces cerevisiae and Pichia stipitis – NCIM 3498. Bioresource Technology 100:1214–1220. [ Links ]
Huang, C., M. H. Zong, H. Wu and Q. P. Liu. 2009. Microbial oil production from rice straw hydrolysate by Trichosporon fermentans. Bioresource Technology 100(19): 4535–4538. [ Links ]
Kádár, Z., Z. Szengyel and K. Réczey. 2004. Simultaneous saccharification and fermentation (SSF) of industrial wastes for the production of ethanol. Industrial Crops and Products 20:103–110. [ Links ]
Kuloyo, O., J. C. du Preez, M. P. García-Aparicio, S. G. Kilian, L. Steyn and J. Görgens. 2014. Opuntia ficus-indica cladodes as feedstock for ethanol production by Kluyveromyces marxianus and Saccharomyces cerevisiae. World Journal of Microbiology and Biotechnology 30(12):3173-3183. [ Links ]
Kumar, S., S. P. Singh, I. M. Mishr and D. K. Adhikari. 2009. Recent advances in production of bioethanol from lignocellulosic biomass. Chemical Engineering and Technology 32(4): 517-526. [ Links ]
Laopaiboon, P., A. Thani, V. Leelavatcharamas and L. Laopaiboon. 2010. Acid hydrolysis of sugarcane bagasse for lactic acid production. Bioresource Technology 101:1036-1043. [ Links ]
Li, A., B. Antizar-Ladislao and M. Khraisheh. 2007. Bioconversion of municipal solid waste to glucose for bio-ethanol production. Bioprocess and Biosystems Engineering 30:189–196. [ Links ]
Liang, Y., K. Jarosz, A. T. Wardlow, J. Zhang and Y. Cui. 2014. Lipid production by Cryptococcus curvatus on hydrolysates derived from corn fiber and sweet sorghum bagasse following dilute acid pretreatment. Applied Biochemistry and Biotechnology 173(8):2086-2098. [ Links ]
Linde, M., E. L. Jakobsson, M. Galbe and G. Zacchi. 2008. Steam pretreatment of dilute H2SO4-impregnated wheat straw and SSF with low yeast and enzyme loadings for bioethanol production. Biomass Bioenergy 32: 326-332. [ Links ]
Manugistics. 2005. Statgraphics Plus Ver. 5.1. Manugistics, Inc. Rockville, MA, USA. n/p. [ Links ]
Mansfield, S. D., C. Mooney and J. N. Saddler. 1999. Substrate and enzyme characteristics that limit cellulose hydrolysis. Biotechnology Progress 15:804–816. [ Links ]
Marques, S., L. Alves, J. C. Roseiro and F. M. Girio. 2008. Conversion of recycled paper sludge to ethanol by SHF and SSF using Pichia stipitis. Biomass Bioenergy 32: 400–406. [ Links ]
Mast, B., N. Zöhrens, F. Schmidl, R. Hernandez, W. T. French, N. Merkt, W. Claupein and S. Graeff-Hönninger. 2014. Lipid production for microbial biodiesel by the oleaginous yeast Rhodotorula glutinis using hydrolysates of wheat straw and Miscanthus as carbon sources. Waste Biomass Valorization 5 (6): 955-962. [ Links ]
Miller, G. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31:426–428. [ Links ]
Ming-Jun, Z., Z. Zhi-Sheng and L. Xu-Hui. 2011. Bioconversion of paper sludge with low cellulosic content to ethanol by separate hydrolysis and fermentation. African Journal of Biotechnology 10(66):15072-15083. [ Links ]
Moretti, M. M. S., D. A. Bocchini-Martins, R. D. Silva, A. Rodrigues, L. D. Sette and E. Gomes. 2012. Selection of thermophilic and thermotolerant fungi for the production of cellulases and xylanases under solid-state fermentation. Brazilian Journal of Biotechnology 43(3):1062-1071. [ Links ]
Parajó, J. C., J. L. Alonso and V. Santos. 1995. Kinetics of catalyzed organosolv processing of pine wood. Industrial and Engineering Chemistry Research 34:4333–4542. [ Links ]
Parajó, J. C., J. L. Alonso and D. Vázquez. 1993. On the behaviour of lignin and hemicelluloses during the acetosolv processing of wood. Bioresource Technology 46:233–240. [ Links ]
Pedersen, M., A. Viksø–Nielsen and A. S. Meyer. 2010. Monosaccharide yields and lignin removal from wheat straw in response to catalyst type and pH during mild thermal pretreatment. Process Biochemistry 45:1181–1186. [ Links ]
Ragauskas, A. J., C. K. Williams, B. H. Davison, G. Britovsek, J. Cairney, C. A. Eckert, W. J. Frederick, J. P. Hallett, D. J. Leak and C. L. Liotta. 2006. The path forward for biofuels and biomaterials. Science 311(5760):484-489. [ Links ]
Reales-Alfaro, J. G., L. T. Trujillo-Daza, G. Arzuaga-Lindado, H. I. Castaño-Peláez and A. D. Polo-Córdoba. 2013. Acid hydrolysis of water hyacinth to obtain fermentable sugars. Ciencia Tecnología y Futuro 5(2): 101-111. [ Links ]
Saha, B. C. and R. J. Bothast. 1999. Pretreatment and enzymatic saccharification of corn fiber. Applied Biochemistry and Biotechnology 75:65–77. [ Links ]
Sánchez, O. J. and C. A. Cardona. 2008. Trends in biotechnological production of fuel ethanol from different feedstocks. Bioresource Technology 99: 5270–5295. [ Links ]
Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). 2012. Compendio de estadísticas ambientales, México. www.semarnat.gob.mx (17 de noviembre de 2014). [ Links ]
Singleton, V., R. Orthofer and R. Lamuela. 1999. Analysis of total phenols and other oxidation subtrates and antioxidants the means of Folin-Ciocalteau reagent. Methods in Enzymology 299:152–178. [ Links ]
Sun Y. and J. Cheng. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresource Technology 83: 1–11. [ Links ]
Tao, J., C. C. Dai, Q. Y. Yang, X. Y. Guan and W. L. Shao. 2010. Production of biodiesel with acid hydrolysate of Populus euramevicana CV Leaves by Rhodotorula glutinis. International Journal of Green Energy 7(4): 387-396. [ Links ]
Technical Association of the Pulp and Paper Industry (TAPPI). 2007. Official Test Methods. TAPPI Press. Atlanta, GA, USA. pp. 1-4, 14-19, 23-29. [ Links ]
Tsao, G., M. Ladisch, T. Hsu, B. Dale and T. Chou. 1978. Fermentation substrate from cellulosic material: Production of fermentable sugars from cellulosic materials. Annual Reports on Fermentation Processes 2: 1-21. [ Links ]
Wang, L., R. Templer and R. J. Murphy. 2012. High-solids loading enzymatic hydrolysis of waste papers for biofuel production. Applied Energy. 99: 23–31. [ Links ]
Wayman, M., S. Chen and K. Doan. 1992. Bioconversion of waste paper to ethanol. Process Biochemistry 27:239–245. [ Links ]
Wu, C. H., W. C. Chien, H. K. Chou, J. Yang and H. T. Lin. 2014. Sulfuric acid hydrolysis and detoxification of red alga Pterocladiella capillacea for bioethanol fermentation with thermotolerant yeast Kluyveromyces marxianus. Journal of Microbiology and Biotechnology 24(9):1245-1253. [ Links ]
Wyman, C. E., B. E. Dale, R. T. Elander, M. Holtzapple, M. R. Ladisch and Y. Y. Lee. 2005. Coordinated development of leading biomass pretreatment technologies. Bioresource Technology 96(18):1959-1966. [ Links ]
Yang, B. and C. E. Wyman. 2008. Pretreatment: the key to unlockingLow-cost cellulosic ethanol. Biofuels, Bioproducts and Biorefining 2(1):26-40. [ Links ]
Yáñez, R., J. L. Alonso and J. C. Parajó. 2004. Production of hemicellulosic sugars and glucose from residual corrugated cardboard. Process Biochemistry 39:1543–1551. [ Links ]
Yáñez, R., J. L. Alonso and J. C. Parajó. 2005. D-lactic acid production from waste cardboard. Journal of Chemical Technology and Biotechnology 80: 76–84. [ Links ]
Yen, H. W. and Chang J. T. 2014. Growth of oleaginous Rhodotorula glutinis in an internal-loop airlift bioreactor by using lignocellulosic biomass hydrolysate as the carbon source. Journal of Bioscience and Bioengineering. DOI: 10.1016/j.jbiosc.2014.10.001.
Yu, X., Y. Zheng, K. M. Dorgan and S. Chen. 2011. Oil production by oleaginous yeasts using the hydrolysate from pretreatment of wheat straw with dilute sulfuric acid. Bioresource Technology 102: 6134–6140. [ Links ]
Yuan, X., Y. Cao, J. Li, B. Wen, W. Zhu, X. Wang and Z. Cui. 2012. Effect of pretreatment by a microbial consortium on methane production of waste paper and cardboard. Bioresource Technology 118:281-288. [ Links ]
Zhu, M. J., Z. S. Zhu and X. H. Li. 2011. Bioconversion of paper sludge with low cellulosic content to ethanol by separate hydrolysis and fermentation. African Journal of Biotechnology 10: 15072-15083. [ Links ]














