Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias forestales
versión impresa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.6 no.28 México mar./abr. 2015
Artículo
Contenido mineral y tamizaje fitoquímico en Physalis chenopodifolia Lam. en condiciones de desarrollo
Mineral content and phytochemical compounds in Physalis chenopodifolia Lam. on two conditions of vegetal growth
Eduardo Salcedo-Pérez1, María de Lourdes Arvizu1, José de Jesús Vargas-Radillo1, Ofelia Vargas-Ponce2, Antonio Bernabe-Antonio3 y Lucía Barrientos-Ramírez1
1 Departamento de Madera, Celulosa y Papel: CUCEI, Universidad de Guadalajara. Correo e: lbarrien@dmcyp.cucei.udg.mx
2 Departamento de Botánica y Zoología, Universidad de Guadalajara.
3 Departamento de Química, Universidad Autónoma de Morelos.
Recibido 17 de noviembre de 2014.
Aceptado 30 de enero de 2015.
Resumen
Dada su riqueza forestal, México cuenta con numerosas especies silvestres del género Physalis (Solanaceae) que poseen potencial para su aprovechamiento, desde el punto de vista fitoquímico; además tiene importantes propiedades medicinales. Physalis chenopodifolia es una de ellas. Taxon de amplia presencia en el territorio nacional, pero poco estudiado. Por este motivo, el objetivo del presente trabajo fue la caracterización mineral y el tamizaje fitoquímico del fruto y las hojas (follaje) de especímenes recolectados en condiciones silvestres y en plantas cultivadas bajo condiciones controladas. Se determinó mayor contenido de minerales en las muestras procedentes de cultivo. En el fruto: K y Mn, principalmente, y en hoja: K, N, Mn y Fe. Respecto al perfil fitoquímico, la mayor variedad de compuestos biológicos correspondió al tallo y hojas; los solventes acuosos e hidroalcóholicos fueron los medios de extracción más eficientes. Los metabolitos con mayor presencia resultaron ser los esteroides/terpenos, fenoles y flavonoides, los cuales se determinaron de forma cualitativa. La experiencia en el manejo agronómico y tecnficado de Physalis chenopodifolia en diversas regiones permite establecer que se trata de una planta de fácil incorporación al cultivo y constituye una fuente potencial de metabolitos de interés alimentario y biomédico, lo que la hace una especie forestal no maderable relevante.
Palabras clave: Actividad biológica, metabolitos secundarios, minerales, producto forestal no maderable, tamizaje, uso medicinal.
Abstract
Due to its abundant forestry resources, Mexico has numerous species of the Physalis genus (Solanaceae), plants with a phytochemical potential and important medicinal properties. Physalis chenopodifolia, one of these Solanaceae with a widespread presence in our country, has been little studied. Therefore, the purpose of this work was the mineral characterization and phytochemical screening of the fruits and leaves (foliage) of the plants collected under both wild and controlled conditions. A higher mineral content was found in the cultured samples: K and Mn in the fruits, and K, N, Mn and Fe in the leaves. As for the phytochemical profile, a greater variety of biological compounds was found in the stem and leaves, using aqueous and hydroalcoholic solvents as the most effective means of extraction. Terpenes/steroids, phenols and flavonoids, the most prevalent metabolites, were qualitatively determined. Experience in the technical and agronomic management of this species in various regions makes it possible to establish that this species can be easily cultivated and is an important potential source of metabolites of biomedical interest, and therefore, a forest species with an important non-timber potential.
Key words: Biological activity, secondary metabolites, minerals, non-timber forest products, phytochemical screening, medical use.
Introducción
Physalis, al igual que otras solanáceas, es un género que incluye especies de importancia económica y cultural; algunas son cultivadas por su carácter alimenticio, como el caso del tomate verde (Physalis philadelphica Lam.) en México y Guatemala (Zamora et al., 2015) y la uchuva (P. peruviana L.) cultivada en Sudamérica, de valor comercial por sus frutos dulces (Herrera et al., 2011).
Se tiene evidencia que desde tiempos precolombinos varias etnias de América consumen diversos taxa silvestres de Physalis, los cuales forman parte de la cocina tradicional, y el fruto en fresco (Herrera et al., 2011; Kindscher et al., 2012). También se reconoce el empleo de partes de la planta (fruto, hojas, raíz, cáliz) en la herbolaria y medicina tradicional (Rengifo y Vargas, 2013).
En el ámbito mundial, una de las especies más conocida y con mayor atención científica es Physalis peruviana, la cual se identifica como una planta utilizada en el tratamiento de diversas afecciones: el cáncer, leucemia, malaria, etcétera. Se han hecho pruebas in vitro e in vivo (Pinto et al., 2009; Franco et al., 2007; Arun y Asha, 2007), por lo que es de interés etnobotánico, además de que se cultiva y aprovecha para diversos fines. Entre los taxa tropicales no recolectados, Physalis es un modelo muy prometedor. La perpectiva comercial en el género se ha incrementado en varias regiones del mundo en la última década, debido a la creciente demanda internacional e importancia como cultivo frutícola (e.g. uchuva) y hortícola (tomate verde), ambos casos por el valor nutritivo de sus frutos (Zamora et al., 2015), y el interés por su análisis nutricional se ha extendido a otras especies como Physalis pubescens Lam. (Donkor et al., 2012).
Varias propiedades benéficas del fruto son asociadas, principalmente, a su composición nutricional: agua (77-86 %); carbohidratos (11-20 %); lípidos (0.2-0.5 %); además contiene componentes biológicamente activos como vitaminas A, B y C (20–43 mg 100 g-1), E y K, fitoesteroles, minerales esenciales (potasio; 210–467, magnesio 7-19, Calcio 2-28, fósforo 27–55.3, todas en mg 100 g-1) (Puente et al., 2011); asimismo se han extraído withanólidos, alcaloides, glicósidos y flavonoides (An et al., 2006) con importante actividad antibiótica, antiinflamatoria y antioxidante. En particular, los withanólidos, considerados el metabolito secundario característico de las solanáceas, son esteroides que al oxidarse forman un anillo de γ ó δ-lactona (Guimaraes et al., 2009) a los que se les atribuye acción antitumoral, citotóxica (Ramadan, 2011), antiparasitaria (Puente et al., 2011), antimicrobial; y funciones como la de activar el crecimiento de neuritas, promover la inducción de quinona reductasa, tener acción tripanocida, así como propiedades antinflamatorias (Yu-Zhou et al., 2014).
México, debido a su riqueza forestal, cuenta con numerosas especies silvestres de Physalis con potenciales propiedades medicinales, entre ellas: las de tipo antibacterial, antinflamatorios y anticancerígenas, de las cuales aún no se ha aislado el principio bioactivo, por lo que es necesario realizar más evaluaciones y esfuerzos en el campo de la fitoquímica (Rengifo y Vargas, 2013). Existe un creciente interés popular por el aprovechamiento de otras especies, tal es el caso de Physalis chenopodifolia Lam., cuyo fruto (baya) es de color naranja, con tonalidades rojizas al madurar, de sabor dulce y que ha sido sujeto de consumo por los Mazahuas del centro del país (Williams, 1993); asimismo se documentó su respuesta favorable a las prácticas agrícolas y al cultivo intensivo (Valdivia, 2014). No obstante, hay poca información relacionada con la composición fitoquímica, el valor nutritivo y contenido de minerales, a pesar de su alta disponibilidad.
Los objetivos del presente trabajo fueron determinar el contenido mineral en frutos y follaje de Physalis chenopodifolia, y hacer un análisis preliminar de los principales compuestos fitoquímicos en tallo, hojas, cáliz y fruto de plantas silvestres y sometidas a cultivo intensivo.
Materiales y Métodos
Recolecta
Physalis chenopodifolia. Se distribuye en 19 estados de la república mexicana, en algunos del norte, principalmente en el Centro de México y hacia el sur hasta Guerrero (Figura 1).

Fuente: Vargas et al. (2003).
Source: Vargas et al. (2003).
Figura 1. Mapa de distribución de Physalis chenopodifolia Lam. en la república mexicana.
Figure 1. Distribution map of Physalis chenopodifolia Lam. in Mexico.
Especie forestal herbácea, perenne, endémica del país. Se caracteriza por ser una planta erecta, con un tallo central de hasta 70 cm de largo. Las hojas son alternas, geminadas y desiguales en tamaño, el borde de la lámina exhibe varios dientes irregulares (Vargas et al., 2003); el fruto es una baya de color naranja, con tonalidades rojizas al madurar (Figura 2C); se desarrolla en áreas forestales, en lugares abiertos y laderas dentro del bosque de pino-encino (Figura 2A).

Figura 2. Physalis chenopodifolia Lam. en estado silvestre y cultivado.
Se recolectaron ejemplares silvestres en una de las poblaciones con más abundancia del taxon de interés, ubicada en la localidad de San Nicolás de Los Ranchos municipio Cholula, Puebla (19°04'17.6'' N, 98°30'04.07'' O); donde crecen en lugares abiertos de laderas y en la parte alta dentro del bosque de encino (Figura 2A). También se emplearon plantas germinadas a partir de semilla silvestres y cultivadas en predios del Centro Universitario de Ciencias Biológico Agropecuarias (CUCBA) de la Universidad de Guadalajara, en Zapopan, Jalisco (20°44'41.18" N, 103°30'58.53" O) (Figura 2B).
Condiciones edafo-climáticas y de cultivo de los sitios de recolecta
Las condiciones ambientales y edáficas en las localidades de estudio presentan contrastes entre si (Cuadro 1). A partir de los datos cartográficos (Inegi-INE-Conagua, 2007), Cholula, Puebla tiene un clima templado subhúmedo, con lluvias en verano; mientras que en Zapopan, Jalisco es semicálido subhúmedo con lluvias en verano.
Cuadro 1. Condiciones ambientales y topográficas en las dos áreas de desarrollo de Physalis chenopodifolia Lam.
Table 1. Environmental and topographical conditions in the two development areas of Physalis chenopodifolia Lam.
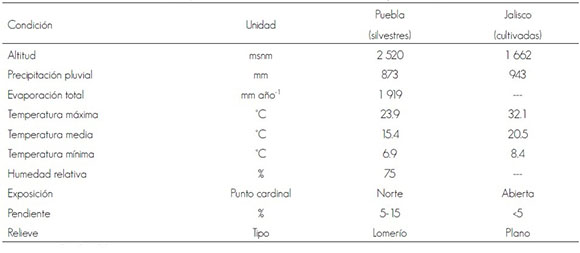
msnm = metros sobre el nivel de mar
masl = Meters above sea level
Se consideraron muestras de plantas silvestres recolectadas entre octubre y noviembre del 2011, así como individuos cultivados en el mes de julio del 2012, estas últimas provenían de semillas de fruto silvestres germinadas en charola y bajo condiciones de invernadero, las cuales fueron trasplantadas a campo (año 2012) con una densidad de 13 778 plantas ha-1, en surco con acolchado plástico, y cintilla de riego por goteo, ya que el cultivo fue en época seca (enero a mayo). Además se aplicó fertilizante foliar, con humus de lombriz y dos fórmulas de nitrógeno-fósforo-potasio (NPK): una durante el desarrollo vegetativo (proporción de fertilizante, 30:30:30) y otra en la floración y fructificación (15:45:25); se realizaron aplicaciones preventivas de insecticida sistémico para evitar el ataque de plagas, de ellas, sobresalen la mosca blanca {Trialeurodes vaporariorum (Westwood, 1856)}, el minador de la hoja (Liriomyza trifolii (Burgess)} y el gusano barrenador del fruto {Heliothis subflexa (Guenée)}; se realizó deshierbe de manera manual. El trabajo agronómico del cultivo se llevó a cabo con base en las condiciones establecidas por Valdivia (2014).
Análisis del suelo
La caracterización física y química de la fertilidad del suelo se basó en la norma NOM-021 (Semarnat, 2002), a partir de una muestra compuesta recolectada en los dos sitios de estudio; tamizada y secada al ambiente antes de su análisis. Se utilizó el sistema de clasificación FAO/UNESCO/ISRIC (FAO, 1988).
Preparación de la muestra
Para el análisis se utilizó material procedente de tallo, fruto, cáliz y hojas, tanto de las plantas silvestres como de las cultivadas. Las muestras fueron separadas manualmente, lavados por inmersión en agua potable y enjuagada con agua destilada. Después, se dejaron en un sitio seco a temperatura ambiente hasta que se les eliminó el exceso de agua. Las hojas, tallo y cáliz se molieron con un molino de impacto de palas Retsch GmbH, modelo SK100; se tamizaron y reservó la muestra retenida en la malla 60. Se almacenaron en bolsas de polietileno selladas y se conservaron a temperatura de -20 °C, hasta la realización de los análisis correspondientes. Los frutos se separaron manualmente y seleccionaron solo aquellos ejemplares vigorosos y sanos. Enseguida, se lavaron con abundante agua y se enjuagaron con agua destilada, molieron en licuadora. La pulpa se guardó en bolsas de polietileno, se selló, pesó y conservó a -20 °C.
Contenido mineral
El nitrógeno se determinó por el método del Kjeldahl (Purcell y King, 1996). Los minerales (Ca, Mg, K, Cu, Mn, Zn, Na, Fe, Cu) se evaluaron por "digestión húmeda", con la mezcla concentrada de ácido nítrico-perclórico y espectrofotometría de absorción atómica (AOAC, 1990), con emisión de llama y registro de los valores de absorbancia.
Ensayos fitoquímicos
Extracción. Se utilizaron las muestras procesadas y molidas. Se sometieron a extracciones con solventes de polaridad creciente; hidroalcohólico (proporción 1:1), diclorometano, hexano y acuoso. Los extractos se filtraron en papel Whatman 3 y concentración al vacío a 40 °C, hasta eliminar el solvente. Se conservó en refrigeración (-4 °C).
Tamizaje
Se utilizaron muestras de tallo, hojas, cáliz y fruto para la identificación de compuestos tales como alcaloides (reactivo de Dragendorff y reactivo de Mayer); flavonoides, esteroles y metilesteroles (reacción de Shinoda); esteroides y terpenoides (reactivo de Liebermann-Burchard), con base en las metodologías de Harbone (1998). El tamizaje fitoquímico es un protocolo usual en el estudio de compuestos bioactivos, que provee resultados cualitativos sustentados en la formación de precipitados o cambios visibles de color expresados como (+) para presencia y (-) para ausencia.
Cromatografía de capa fina (TLC). Se usaron placas cromatográficas base de aluminio de 3 x 10 cm, con gel de sílice con granulometría de 60 F254, tamaño de partícula 2-2.5 μm. En principio, se hicieron ensayos con diferentes mezclas de solventes para determinar el sistema con el mejor rendimiento, que permitiera observar la mayor cantidad de manchas a partir del extracto y emplearlo como fase móvil en la cromatografía de columna. La mezcla seleccionada fue la compuesta por cloroformo-metanol-agua (2:8:1). Después de efectuado el ensayo se observaron las placas con el auxilio de luz UV a una longitud de onda de 254 nm y 365 nm. El siguiente paso consistió en evaluar y caracterizar estructuralmente los componentes mediante la cromatografía en columna.
Estadística
Los análisis vegetales fueron practicados sobre muestras compuestas de las diferentes secciones de 30 plantas, tanto cultivadas como silvestres. El análisis del suelo se practicó sobre la mezcla de cinco zonas de ambos sitios. El procesamiento de los datos (suelo y minerales), obtenidos por duplicado, fue por el método de Tukey, en el programa estadístico SAS 9.1 (SAS, 2002).
Resultados y Discusión
Las condiciones ambientales de clima y topografía (Cuadro 1), así como las características físicas y las propiedades químicas de los suelos en los sitios de muestreo (Cuadro 2), denotan diferencias. En relación con las características edáficas, estas fueron estadísticamente significativas (Tukey P ≤ 0.05). Al sitio de cultivo le corresponde un suelo franco arcilloso y tiene mayor contenido de limo, agua aprovechable, CE, nitrógeno y potasio; mientras que en el sitio con las plantas silvestres, el suelo es arenoso con mayor contenido en materia orgánica, CIC y calcio.
Cuadro 2. Análisis de suelo en los sitios de recolecta.
Table 2. Soil analysis in the collection sites.
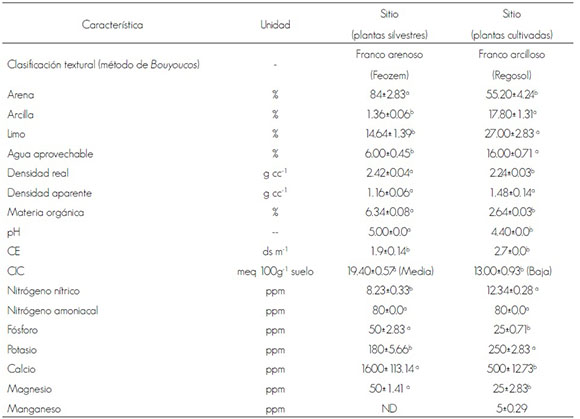
CE = Conductividad eléctrica; ds m-1 = DeciSiemens/metro; CIC = Capacidad de intercambio catiónico; meq = Miliequivalentes químicos; ND = No detectado
Medias ± desviación estándar seguidas de la misma letra entre columnas son estadísticamente iguales (Tukey P ≤ 0.05).
EC = Electric conductivity; ds m-1 = DeciSiemens/meter; CEC = Cation exchange capacity; mEq = Chemical milliequivalents;
±standard deviation followed by the same letter are statistically equal between columns (Tukey P ≤ 0.05).
Los suelos de ambos sitios tienen CIC entre 5 y 30 meq 100 g-1, que se considera un valor adecuado, ya que suelos con CIC < 5 meq 100 g-1 son suelos pobres, arenosos, limitados para la vida de las plantas; en cambio suelos con CIC >30 meq 100 g-1 son muy arcillosos y poco permeables. Respecto a los valores de CE el suelo del sitio de muestreo con individuos silvestres es normal, mientras que la CE del sitio de cultivo es ligeramente salino. La reacción del suelo resultó ácida en las dos condiciones, sobretodo en el de Zapopan (pH=4.4); por lo que se sugiere la aplicación de cal dolomítica para mejorar la disponibilidad de minerales; además de evaluar su efecto en el cultivo de la especie bajo estudio; con esta práctica se incrementa el pH, y se aporta Ca y Mg, lo que ayudará a mejorar el balance de cationes.
Respecto a la presencia de minerales en la hoja y fruto, se registraron diferencias (Cuadro 3). El fruto de los ejemplares cultivados tuvo más potasio, manganeso, fósforo y sodio. El material silvestre fue ligeramente mayor en su contenido de nitrógeno, zinc y cobre. Los valores para el resto de los minerales fue similar.
Cuadro 3. Composición de minerales en hoja y fruto de Physalis chenopodifolia Lam. silvestre y cultivado.
Table 3. Mineral composition of the fruits and leaves of wild and cultivated Physalis chenopodifolia Lam.

Medias con la misma letra son estadísticamente iguales entre columnas en fruto y entre columnas en hoja (Tukey P ≤ 0.05).
Measures with the same letter are statistically equal between the columns for the fruits and the between the columns for the leaves (Tukey P ≤ 0.05).
En la hoja, la muestra cultivada tuvo más nitrógeno, fósforo, potasio, manganeso, zinc y fierro, mientras que el material silvestre presentó mayor valor en calcio. Al respecto, existe una relación directa entre las condiciones edafo-climáticas, el tipo de suelo y la fertilización en el cultivo, con la producción y calidad del fruto. De acuerdo con los resultados descritos, las plantas provenientes del sitio de cultivo fertilizado tuvieron contenido mineral más alto en follaje y fruto, lo que les adjudica una calidad superior.
Resultados que coinciden con los de experimentos similares con uchuva (Physalis peruviana), en suelos significativamente diferentes, en particular en cuanto a los contenidos de materia orgánica y de algunos elementos (N, K, Ca y Mg); con clase textural franco arenosa y franco arcillosa, condiciones que concuerdan con las de los suelos del presente trabajo (Roveda et al., 2012). En dicho estudio se recomiendan los suelos areno-arcillosos, con un buen drenaje para el desarrollo de la uchuva, mientras que el parámetro, realmente, diferente y de mayor impacto fue el contenido de MO, pues en los sitios donde se realizó el trabajo fue entre 10 y 15 %, muy por arriba a lo determinado en el estudio con que aquí se documenta (2.6 para el sitio de cultivo y 6.4 para el sitio silvestre).
Martínez et al. (2008) indican que en el cultivo de la uchuva, plantas deficientes en nitrógeno y potasio redujeron el peso fresco y seco de sus frutos, considerablemente. Una menor aplicación de boro, nitrógeno y potasio ocasionó una disminución superior a 90 % en la cantidad de frutos producidos, y una menor cantidad de fósforo provocó una caída de 50 %. Por su parte, Cooman et al. (2005) señalan que los rendimientos en cosecha disminuyeron por la deficiencia de calcio y cobre, pero el boro no incidió en este aspecto.
Tamizaje fitoquímico
El resultado del análisis se resume en el Cuadro 4. En el tallo, cáliz y hojas se determinó el mayor contenido de metabolitos. Por presencia destacan esteroides/terpenos, fenoles y flavonoides. Los extractos acuoso e hidroalcohólico fueron más eficientes, en cuanto a desempeño. El rendimiento y tipo de metabolitos dependen del extracto utilizado.
Cuadro 4. Resultados del tamizaje de los extractos de tomate silvestre y cultivado.
Table 4. Results of the screening of the extracts from wild and cultivated tomatillo.

+ = Presencia escasa; ++ = Presencia media; +++ = Presencia alta; - = Ausencia
+ = Scarce presence; ++ = M edium presence; +++ = High presence; - = Absence
Entre los metabolitos secundarios de interés biológico y farmacológico destacaron, por su significativa presencia, los whitanólidos y fenólicos, en menor proporción los alcaloides. Estos se han registrado en otras solanáceas, específicamente la solanina, escopolamina, atropina, hiosciamina, y nicotina (Zeiger, 1998; Hu et al., 1999). Diversos estudios citan la presencia de alcaloides, saponinas, taninos, esteroides y flavonoides en hojas de Physalis peruviana extraídas con ácido acético glacial (Maobe et al., 2013), así como en extractos metanólicos de hojas, en los que se identificaron alcaloides, flavonoides y taninos, pero no saponinas (Pfoze et al., 2013).
Cromatografía en capa delgada
En la Figura 3 se presentan los cromatogramas de capa fina con el extracto hidroalcohólico. Se observan manchas con diferente relación de recorrido (Rf). La muestra vista con luz UV de λ =254 presentó 10 manchas con Rf de 0.21 a 0.91, mientras que la muestra vista con luz UV de λ =365 nm, presentó tres manchas con Rf de 0.80, 0.80 y 0.88.

A) Visto con luz de λ de 254 nm; B) Visto con luz de λ de 365 nm.
A) Seen with a UV light of λ = 254 nm; B) Seen with a UV light of λ = 365 nm.
Figura 3. Imágenes de capa fina del extracto hidroalcohólico de Physalis chenopodifolia Lam.
Figure 3. Thin-layer chromatograms of the hydroalcoholic extract of Physalis chenopodifolia Lam.
La cromatografía de capa fina verifica el mejor extracto o sistema de solventes para obtener la mayor cantidad de metabolitos antes y después del fraccionamiento en columna, además de que permite identificar y agrupar metabolitos similares.
Las familias de metabolitos secundarios determinados en los extractos de P. chenopodifolia como witanólidos, flavonoides, cumarinas y alcaloides han demostrado tener propiedades biológicas útiles.
Debido a que en México se desarrollan una gran cantidad de solanáceas, es importante fijar las condiciones agronómicas de cultivo tecnificado, con el propósito de llevar a cabo su aprovechamiento como alimento o fuente de sustancias de interés biomédico. En este contexto, Gordillo et al. (2004) señalan que existe un claro efecto, en el rendimiento y calidad del fruto de Physalis peruviana, de las prácticas de aplicación de fertilizantes y de riego en su cultivo, lo cual es importante puesto que se trata de un producto de exportación importante en la economía de Colombia. Esta especie ha pasado de carecer de manejo agronómico a recibir prácticas de culturales tecnificadas, con la finalidad de conseguir frutos de mayor tamaño y lograr las características que exigen los mercados externo e interno.
El uso potencial de Physalis chenopodifolia requiere de fomentar trabajos de investigación (Valdivia, 2014) en aspectos como la cuantificación de sus componentes bioactivos, identificaciones estructurales por medio de purificación en columna cromatográfica y cromatografía de gases-espectrometría de masas, así como de sus posibles propiedades biológicas y biomédicas. Asimismo es importante evaluarlo como fuente de metabolitos, iniciando por su caracterización fitoquímica.
Conclusiones
Las condiciones edáficas y ambientales tienen influencia en la presencia de minerales y componentes fitoquímicos de Physalis chenopodifolia. El contenido mineral de las plantas cultivadas, respecto de las silvestres mostró mayores valores en calcio, fosforo, potasio, manganeso, nitrógeno y fierro, lo cual es favorable desde el punto de vista de su calidad alimenticia, así como por su participación en los procesos de biosíntesis de componentes activos biológicamente.
Las diferentes secciones de P. chenopodifolia evidenciaron la presencia (reacción positiva en el tamizaje) de compuestos de alto interés biológico, por sus propiedades antioxidantes benéficas para la salud y en la prevención del riesgo de enfermedades. Se destaca la identificación de terpenos/esteroides, flavonoides y fenoles, sobre todo en hoja y tallo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribución por autor
Eduardo Salcedo-Pérez: dirección y asesoría del proyecto; así como en la escritura del manuscrito; María de Lourdes Arvizu: realización de la parte experimental, redacción del texto; José de Jesús Vargas-Radillo: elaboración y redacción del manuscrito, y respuesta a las observaciones del arbitraje; Ofelia Vargas-Ponce: contribuyó con la localización de la muestra, muestreo y revisión del texto; Antonio Bernabe-Antonio: colaboración y asesoramiento estadístico; Lucía Barrientos-Ramírez: asesoría y dirección del proyecto, escritura del manuscrito y respuesta a las observaciones arbitrales.
Referencias
An, L., J. T. Tang, X. M. Liu and N. N. Gao. 2006. Review about mechanisms of anti-cancer of Solanum nigrum. China Journal of Chinese Materia Medica 31(15): 1225-60. [ Links ]
American Association of Analytical Chemists (AOAC).1990. Horwitz, W. (ed.). AOAC. Washington, DC, USA. s/p. [ Links ]
Arun, M. and V. V. Asha 2007. Preliminary studies on antihepatotoxic effect of Physalis peruviana Linn. (Solanaceae) against carbon tetrachloride induced acute liver injury in rats. Journal of Ethnopharmacoly 111(1): 110-114. [ Links ]
Cooman, A., C. Torres y G. Fischer. 2005. Determinación de las causas del regado del fruto de uchuva (Physalis peruviana L.) bajo cubierta. II. Efecto de la oferta de calcio, boro y cobre. Agronomía Colombiana 23(1): 74-82. [ Links ]
Donkor, A. M., R. L. K. Glover, J. K. Bateng and V. Y. Gakpo. 2012. Antibacterial activity of the fruit extract of Physalis angulata and its formulation. Journal of Medical and Biomedical Sciences 1(4): 21-26. [ Links ]
Food and Agriculture Organization of the United Nations (FAO).1988. Soil map of the world. Revised legend, by FAO-Unesco-ISRIC. World Soil Resources. Roma, Italy. Report Num. 60. 140 p. [ Links ]
Franco, L. A., G. E. Matiz, J. Calle, R. Pinzón and L. F. Ospina. 2007. Antiinflammatory activity of extracts and fractions obtained from Physalis peruviana L. calyces. Biomedica 27(1): 110-115. [ Links ]
Gordillo, O., G. Fischer y R. Guerrero. 2004. Efecto del riego y de la fertilización sobre la incidencia de rajado en frutos de uchuva (Physalis peruviana L.) en la zona de Silvania (cundinamarca). Agronomia Colombiana 22(1): 53-62. [ Links ]
Guimarães, E., M. Lima, L. Santos, I. Ribeiro, T. Tomassini, R. Dos Santos, W. Dos Santos and M. Soares. 2009. Activity of physalins purified from Physalis angulata in in vitro and in vivo models of cutaneous leishmaniasis. Journal of Antimicrobial Chemotherapy 64: 84-87. [ Links ]
Herrera M., A. M., J. D. Ortiz A., M. I. Chacón S. and G. Fischer. 2011. Behavior in yield and quality of 54 Cape gooseberry (Physalis peruviana L.) accessions from north-eastern Colombia. Agronomía Colombiana 29(2):189-196. [ Links ]
Harbone, J. B. 1998. Phytochemical methods: a guide to modern techniques of plant analysis. 3rd ed. Chapman & Hall. London, UK. 302 p. [ Links ]
Hu, K., H. Kobayashi, A. Dong, Y. Jing, S. Iwasaki and X. Yao. 1999. Antineoplastic agents III: steroidal glycosides from Solanum nigrum. Planta Medica 65: 35-8. [ Links ]
Instituto Nacional de Estadística y Geografía-Instituto Nacional de Ecología- Comisión Nacional de Agua (Inegi-INE-Conagua). (2007). Mapa de cuencas hidrográficas de México. 1: 250 000. México, D.F., México. s/p. [ Links ]
Kindscher, K., Q. Long, S. Corbett, K. Bosnak, H. Loring, M. Cohen and B. N. Timmerman. 2012. The ethnobotany and ethnopharmacology of wild tomatillos, Physalis longifolia Nutt., and related Physalis species: A review. Economic Botany 66: 298–310. [ Links ]
Maobe, M. A. G., E. Gatebe, L. Gitu and H. Rotich. 2013. Preliminary Phytochemical Screening of Eight Selected Medicinal Herbs Used for the Treatment of Diabetes, Malaria and Pneumonia in Kisii Region, Southwest Kenya. European Journal of Applied Science 5 (1): 01-06. [ Links ]
Martínez F., E., J. Sarmiento, G. Fischer y F. Jiménez. 2008. Efecto de la deficiencia de N, P, K, Ca, Mg y B en componentes de producción y calidad de la Uchuva (Physalis peruviana L.). Agronomía Colombiana 26(3): 389-398. [ Links ]
Pinto M., S., L. G. Ranilla, E. Apostolidis, F. M. Lajolo, M. I. Genovese and K. Shetty. 2009. Evaluation of antihyperglycemia and antihypertension potential of native Peruvian fruits using in vitro models. Journal of Medicinal Food 12(2): 278-291. [ Links ]
Pfoze, N. L., Y. Kumar and B. Myrboh. 2013. Screning of bioactive phytochemicals obtained from lesser known ethnomedicinal plants of Senapati district of Manipur, India. Pleione 7(2): 489–50. [ Links ]
Puente L., A., C. A. Pinto-Muñoz, E. S. Castro and M. Cortés. 2011. Physalis peruviana Linnaeus, the multiple properties of a highly functional fruit: A review. Food Research International 44:1733–1740. [ Links ]
Purcell, L. C. and C. A. King. 1996. Total nitrogen determination in plant material by persulfate digestion. Agronomy Journal 88: 111-113. [ Links ]
Ramadan, M. F. 2011. Bioactive phytochemicals, nutritional value, and functional properties of Cape gooseberry (Physalis peruviana): An overview. Food Research International 44: 1830–1836. [ Links ]
Roveda G., A. Peñaranda, M. Ramírez, I. Baquero y R. Galindo. 2012. Diagnóstico de la fertilidad química de los suelos de los municipios de Granada y Silvania para la producción de uchuva en Cundinamarca. Rev. Corpoica. Ciencia y Tecnología Agropecuaria13 (2):179-188. [ Links ]
Rengifo S., E. and G. Vargas A. 2013. Physalis angulata L. (Bolsa Mullaca): A Review of its traditional uses, chemistry and pharmacology. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 12 (5):431-445. [ Links ]
Statistical Analysis Software (SAS). 2002. SAS/GRAPH Software: Reference. Volume1, Version 8. SAS Institute. Cary, NC, USA. s/p. [ Links ]
Secretaría del Medio Ambiente y Recursos Naturales (Semarnat) 2002. Norma Oficial Mexicana Nom-021-Recnat-2000. Especificaciones de fertilidad, salinidad y clasificación de suelos, estudio, muestreo y análisis, Diario Oficial de la Federación, 31 de diciembre de 2002. México, D.F., México. 85 p. [ Links ]
Valdivia M., L E. 2014. Caracterización morfo-agronómica de tres especies silvestres de tomate (Physalis, Solanaceae) nativas de México. Tesis de Maestría, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara. Zapopan, Jal., México. 77 p. [ Links ]
Vargas P., O., M. Martínez y P. Dávila. 2003. La Familia Solanaceae en Jalisco: El género Physalis. Colección Flora de Jalisco. Instituto de Botánica, Departamento de Botánica y Zoología, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara. Zapopan, Jal., México. Núm. 16. 126 p. [ Links ]
Williams, D. E. 1993. Lycianthes moziniana (Solanaceae): An underutilized Mexican food plant with "new" crop potential. Economic Botany. 47 (4): 387-400. [ Links ]
Yu-Zhou, G., S. Si-Ming, Z. Wei, L. Jian-Guang, and K. Ling-Yi. 2014. Withanolides from Physalis minima and their inhibitory effects on nitric oxide production. Steroids 82: 38–43. [ Links ]
Zamora T., P., O. Vargas P., J. Sánchez and D. Cabrera T. 2015. Diversity and genetic structure of the husk tomato (Physalis philadelphica Lam.) in Western Mexico. Genetic Resource and Crop Evolution 62(15): 151-153 [ Links ]
Zeiger, E. 1998. Solanine and chaconine. Review of Toxicological Literature. USA: Integrated Laboratory Systems. Raleigh, NC, USA. 96 p. [ Links ]














