Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias forestales
versão impressa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.6 no.27 México Jan./Fev. 2015
Artículos
Actividad antimicrobiana in vitro de extractos de hoja de Guazuma ulmifolia Lam. contra fitopatógenos
Antimicrobial activity in vitro of extracts leaf Guazuma ulmifolia Lam. over phytopathogens
Hilda Elisa Ramírez Salcedo1, Gil Virgen-Calleros2, José de Jesús Vargas-Radillo1, Eduardo Salcedo- Pérez1 y Lucía Barrientos-Ramírez1
1 Departamento de Madera, Celulosa y Papel, CUCEI, Universidad de Guadalajara, Correo e: lbarrien@dmcyp.cucei.udg.mx
2 Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara
Fecha de recepción: 4 de mayo de 2014;
Fecha de aceptación: 23 de junio de 2014.
Resumen
Ante el interés actual por el control natural de microorganismos fitopatógenos con sustancias derivadas de plantas, se evaluó el rendimiento, la actividad antifúngica y antibacteriana de péptidos y metabolitos de las hojas de guácima (Guazuma ulmifolia), a partir de sus propiedades curativas y plaguicidas. Los péptidos fueron extraídos con los buffers: B1 (pH 7.0) KCl, EDTA; B2 (pH 5.2) KCl, CH3COONa, β-mercaptoetanol; B3 (pH 7.0) KCl, EDTA, fluoruro de fenilmetilsulfonilo (PMSF), polivinilpirrolidona, tiourea, mientras que los metabolitos fueron extraídos con hexano, metanol y diclorometano. La concentración de péptidos se realizó mediante el método de Bradford y su peso molecular se determinó por electroforesis en gel de poliacrilamida. Se aplicó cromatografía de capa fina (TLC)-columna empacada para separar los compuestos y analizarlos. Paralelamente se aislaron los hongos Sclerotium cepivorum, de cebolla. Fusarium oxysporum, de melón, así como las bacterias Xanthomonas campestris, de jitomate, y se incubó Pseudomona saeruginosa (cepario registro 0693-P). La actividad antifúngica se midió por inhibición del desarrollo micelial in vitro, mientras que la antibacteriana fue evaluada por la formación de colonias (UFC mL-1). Buffer 2 (B2) mostró el mayor valor (15.7 %) en los rendimientos de extractos, en tanto que, los de hexano (3.9 %), metanol (3.0 %) y diclorometano (2.2 %) fueron inferiores en este parámetro. El peso molecular aproximado de los péptidos fue de 24.9 kDa. Asimismo, el extracto con diclorometano fue el de mayor inhibición sobre Sclerotium (88.4 %), B2 sobre Xantomonas (86.5 %), y los extractos en hexano sobre Xantomonas (84.0 %).
Palabras clave: Bioactividad, extractos, Guazuma ulmifolia Lam., metabolitos, microorganismos patógenos, péptidos bioactivos.
Abstract
Currently it is looking for a biological control of pathogens microorganisms, with plant-derived substances. The (Guazuma ulmifolia) is a tree with pesticide properties and healing effects. Yield, antifungal and antibacterial activity of extracts obtained with buffering solutions (peptides) and organic solvents (metabolites) from guacima leaves were evaluated. The peptides were extracted with buffers: B1 (pH 7.0) KCl, EDTA; B2 (pH 5.2) KCl, CH3COONa, β-mercaptoethanol; and B3 (pH 7.0) KCl, EDTA, phenylmethylsulfonyl fluoride (PMSF), polyvinylpyrrolidone, thiourea, while metabolites were extracted with hexane, methanol and dichloromethane. Protein concentration was made by the Bradford method and the molecular weight by polyacrylamide gel electrophoresis. Thin layer chromatography (TLC)-Packed column, were sequentially applied to separate the compounds and bio-testing them later. In parallel fungus Sclerotium cepivorum of onion and Fusarium oxysporum of melon, as well as the bacteria Xanthomonas campestris of tomato were isolated, and Pseudomonas aeruginosa was inoculated (registry number 0693-P). Antifungal activity was measured by inhibition of in vitro mycelial growth of microorganisms while the antibacterial activity was evaluated by inhibition of colony formation (CFUmL-1). Relative to extracts yields, buffer 2 (B2) showed the highest value (15.7 %), while extracts in hexane (3.9 %), methanol (3.0 %) and dichloromethane (2.2 %) were lower in this parameter. Furthermore the approximate molecular protein weight was of 24.9 kDa. Also, dichloromethane extract showed the greatest inhibition over Sclerotium (88.4 %), B2 over Fusarium (86.5 %) and hexane extracts also on Xantomonas (84.0 %).
Key words: Bioactivity, extracts, Guazuma ulmifolia Lam., metabolites, pathogens, bioactive peptides.
Introducción
La guácima (Guazuma ulmifolia Lam.), de la familia Sterculiaceae, es un árbol que alcanza hasta 15 m de altura y 70 cm de diámetro, con hojas rasposas en el haz y sedosas en el envés, flores amarillas y fruto de color café oscuro (Conabio, 2014). Es nativa de América Tropical y posee un alto potencial forrajero; es común en áreas de pastizales de zonas tropicales y subtropicales (Weaver, 1990) y en bosques disturbados. Se le atribuyen propiedades medicinales para padecimientos como la tos y la bronquitis, y tiene acción antioxidante, antifúngica y antibacteriana (Conabio, 2014). En México crece a lo largo de la costa del océano Pacífico desde los 27° de latitud hacia el sur, hasta el Istmo de Tehuantepec y a lo largo de la costa del Golfo de México, incluida la Península de Yucatán. Se le ha consignado también en América Central y América del Sur (Pennington y Sarukhán, 2005).
Las plantas tienen una capacidad casi ilimitada para sintetizar péptidos y metabolitos secundarios. En muchos casos, estas sustancias sirven como mecanismos de defensa frente a la depredación por microorganismos, insectos o herbívoros (Jamil et al., 2007). Existen diversos microorganismos fitopatógenos que las atacan como virus, hongos, bacterias, fitoplasmas y viroides, que causan alteraciones en el ciclo de vida de los vegetales (Celis et al., 2008) y pérdidas económicas cuantiosas, del orden de 5-25 % en países desarrollados y de 20-50 % en aquéllos que están en proceso de estarlo (Juárez et al., 2010); destacan los hongos por su gran número (8 000 especies) y potencial reproductivo, como vectores etiológicos de diversas enfermedades (Juárez et al., 2010).
En estudios previos se ha señalado el uso de extractos vegetales para inhibir la actividad de microorganismos fitopatógenos. Por ejemplo, Ramírez et al. (2000) utilizaron dos cepas silvestres de Sclerotium cepivorum Berk. y Sclerotium rolfsii Sacc., para evaluar la actividad antifúngica de la afinina (alcamida) obtenida a partir de la purificación del extracto crudo de raíces de Heliopsis longipes A. Gray Blake. Observaron una actividad inhibitoria del crecimiento del micelio. Los resultados mostraron que no había diferencia significativa en cuanto a la afinina purificada y el extracto crudo con respecto a las cepas. Jabeen et al. (2008) evaluaron la actividad antimicrobiana del extracto de las semillas de Moringa oleifera Lam., para ello usaron dos bacterias (Bacillus subtilis (Ehrenberg, 1835) Cohn, 1872 y Staphylococcus aureus Rosenbach, 1884), además de un hongo (Fusarium solani (Mart.) Sacc.); este extracto tuvo una fuerte actividad antibacterial, pero mínima en el caso del hongo.
No existen registros bibliográficos de los efectos de guácima sobre microorganismos fitopatógenos, aunque sí sobre patógenos causantes de enfermedades infecciosas y otros problemas relacionadas con la salud humana. Al respecto, Camporese et al. (2003) describen la actividad de los extractos en hexano y metanol de la corteza de guácima contra Escherichia coli (Migula, 1895) Castellani and Calmers, 1919 (ATCC25922) y Pseudomonas aeruginosa (Schroeter) Migula, 1900 (ATCC 27853), respectivamente. Violante et al. (2012) refieren que extractos crudos en etanol (125 ppm) de guácima inhibieron el crecimiento in vitro de S. aureus, mientras que las fracciones hidrometanólicas (1 000 ppm) y en acetato de etilo (250 ppm) fueron activas contra Enterococcus faecalis (Andrewes and Horder, 1906) Schleifer and Kilpper-Bälz, 1984.
Los productos naturales (extractos de plantas), inocuos, gozan de amplia aceptación como una alternativa al uso indiscriminado de los plaguicidas, los cuales son peligrosos para el medio ambiente y para el hombre (Juárez et al., 2010), aunque todavía hace falta mayor investigación sobre el particular. Es por ello que el objetivo principal de este trabajo fue evaluar la actividad antifúngica y antibacteriana de péptidos bioactivos y metabolitos secundarios obtenidos a partir de extractos acuosos y orgánicos de las hoja de guácima sobre algunos microorganismos fitopatógenos como Sclerotium cepivorum, Fusarium oxysporum Schlecht. emend. Snyder & Hansen, Xanthomonas campestris (Pammel, 1895) Dowson, 1939 y Pseudomonas aeruginosa.
Materiales y Métodos
Recolección y preparación del material vegetal
La recolección del material vegetal (hojas) libre de plagas y enfermedades se realizó en el mes de junio de 2012, en el bosque escuela de la Universidad de Guadalajara, municipio Tala, Jalisco, ubicado al centro poniente del estado. La identificación botánica se llevó a cabo en el herbario del Instituto de Botánica del Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA) de la Universidad de Guadalajara (IBUG).
Las hojas fueron lavadas con agua destilada y secadas a temperatura ambiente durante una semana. Se pulverizó finamente el material en un molino de cuchillas, Restsch-GNBH modelo 5657, para obtener mayor área de contacto con los sistemas de extracción utilizados, y con ello hacer el proceso más eficiente. Posteriormente, se tamizó por una malla de Núm. 60. La muestra molida fue deslipidizada para evitar posibles interferencias de las grasas con los extractos; para lo cual, 400 g de muestra se trataron con hexano (1:3 w/v), en un baño María a 4 °C, con agitación durante dos horas. Se centrifugó por 20 minutos a 1 000 rpm y la muestra libre de lípidos fue secada a temperatura ambiente. Se guardó en refrigeración para su posterior uso.
Extracción de metabolitos secundarios (Extractos crudos)
El material molido y deslipidizado de guácima (500 g) fue colocado durante 5 días a 130 rpm en un agitador orbital (Hinotek serie wsz) y sometido a extracciones sucesivas con 1 000 mL de los solventes de diferente polaridad: hexano, diclorometano y metanol. Esto con el propósito de obtener los extractos de mayor actividad y rendimiento en función de la polaridad del solvente utilizado (Domínguez, 1973). Después de cada extracción, se procedió a filtrar y a secar la fracción sólida (material vegetal) a temperatura ambiente, mientras que la fracción líquida (filtrado) se concentró y secó en un rotaevaporador a temperatura menor de 50 °C. La fracción líquida seca obtenida corresponde el material extraído (ME) y contiene los metabolitos bioactivos. El rendimiento por extracción se calculó por medio de la fórmula:

Donde:
ME = Extracto
Mi = Material inicial tratado
Extracción de péptidos bioactivos
Se tomaron 100 g del material vegetal previamente deslipidizado, al que se le agregó 600 mL de tres sistemas de extracción, o buffers, señalados como Buffer 1 (B1), Buffer 2 (B2) y Buffer 3 (B3) (Jamil et al., 2007): B1 (pH 7) es una mezcla de 10 mM K2HPO4, 100 mM KH2PO4, 100 mM KCl y 2 mM EDTA (Turrini et al., 2004). B2 (pH 5.2) es una solución de 100 mM CH3COONa, 100 mM KCl, 0.1 % β-mercaptoetanol (Regente et al., 1997); B3 (pH 7) es una solución de 10 mM Na2HPO4, 15 mM NaH2PO4,100 mM KCl, 2 mM EDTA, 1.5 % polivinilpirrolidona (PVPP), 1 mM fluoruro de fenilmetilsulfonilo (PMSF) y 2 mM tiourea (Terras et al., 1992). Los tres buffers se agitaron durante dos horas a 4 °C y después se centrifugaron por 20 min a 10 000 rpm. El rendimiento de los extractos se calculó de la forma descrita para los metabolitos secundarios.
Concentración y peso molecular de los péptidos extraídos
La concentración de los extractos bufferizados se hizo por medio del método de Bradford (1976). Para ello se preparó una curva de calibración por triplicado, con diferentes concentraciones del estándar albúmina suero bovina (BSA) y lecturas en espectrofotómetro UV-vis, a una absorbencia de 595 nm (A595), para obtener líneas cercanas a una recta (r2 = 1). La muestra problema se procesó bajo las mismas condiciones que la curva de calibración; se añadió muestra problema en lugar de BSA, para evaluar su concentración. A continuación se determinó el peso molecular de péptidos, mediante electroforesis de gel de poliacrilamida SDS-PAGE (Laemmli, 1970), bajo condiciones de corrida de 100 volts y dos h. Se inyectaron 10 mL de los extractos por evaluar y 10mL de marcador de peso molecular conocido de 170 a 5.7 kDa como referencia (Bio-Rad, 2014). Después de la electroforesis, el gel obtenido se tiñó con azul brillante de Coomassie R-250, que se lavó con agua desionizada y se observaron las bandas.
Bioensayos antifúngicos y antibacteriales
Aislamiento de hongos y bacterias
Se utilizaron cepas silvestres de dos especies de hongos: Sclerotium cepivorum y Fusarium oxysporum, además de dos bacterias: Xanthomonas campestris y Pseudomonas aeruginosa. Se eligieron estos microorganismos porque son fitopatógenos de las plantas, problema que aborda esta investigación. Sclerotium cepivorum se aisló de cebolla infectada. Se depositaron los esclerocios en medio de cultivo agar papa dextrosa (PDA) e incubaron durante 10 días a una temperatura de 18–20 °C. Fusarium oxysporum se obtuvo a partir de pequeños trozos del tejido infectado de melón. Dicho material fue sembrado en PDA, incubado 6 días a 28 °C. Para el aislamiento de Xanthomonas campestris, se cortaron pequeños trozos del tejido infectado de jitomate y se sembró en cajas Petri con agar nutritivo (AN) y se mantuvieron a 28 °C por 24 h. Pseudomonas aeruginosa, proveniente de cepario (número de registro 0693-P), se inoculó por 24 h a 60 °C, en tubos de ensaye (previamente esterilizados a 15 Lb durante 20 min) que contenían 10 mL del medio de cultivo Mueller Hinton agar. En todos los casos, previo a la inoculación, el material se lavó con agua-hipoclorito de sodio (1:1) por 30 s; enseguida se lavó tres veces con agua destilada para eliminar el exceso de hipoclorito de sodio y se dejó secar a temperatura ambiente.
Actividad antifúngica de los extractos crudos
Se evaluó por la capacidad de inhibición del desarrollo micelial en condiciones in vitro, por medio de la medición del crecimiento micelial. Se probaron cinco concentraciones del extracto crudo: 10 000, 1 000, 100, 10, y 1 ppm (mg L-1) contra cepas de Sclerotium cepivorum y Fusarium oxysporum. Se hicieron cuatro repeticiones para cada concentración, y dos testigos, el primero sin extracto crudo, y el segundo consistió en una emulsión de dimetil sulfóxido (DMSO) al 1 % y monooleato de polioxietilenosorbitol (comercialmente Tween 20, un surfactante), ya que para el bioensayo de los extractos de hexano y diclorometano fue necesario preparar una emulsión con estos dos compuestos químicos.
En el caso de los péptidos bioactivos, previamente purificados por filtración a través de una membrana amicon ultra 0.5 mL, se probaron seis concentraciones: 200, 50, 12.5, 3.12, 0.78 y 0.195 ppm contra los dos organismos citados, dos testigos, el primero sin extracto crudo, y el segundo con contripsina (antibiótico que inhibe el crecimiento micelial).
Las diferentes alícuotas de los extractos crudos se incorporaron al medio PDA, previamente pasteurizado y esterilizado, en cajas Petri. A continuación se depositó un disco de micelio de 0.3 mm de diámetro del hongo por evaluar, y se incubaron en la oscuridad a 18 °C ± 2 °C, para S. cepivorum y a 28 °C ± 2 °C para F. oxysporum, hasta que el primer testigo se cubrió totalmente con micelios.
Actividad antibacteriana de los extractos crudos
Se determinó mediante el método de dilución en caldo de cultivo, en tubos con medio de cultivo tripticasa de soya (Mueller y Hinton, 1941), que consiste en calcular la inhibición del microorganismo por medio del conteo de Unidades Formadoras de Colonias por mL (UFC mL-1). Para los metabolitos secundarios se probaron ocho concentraciones de extracto: 5 000, 2 500, 625, 156.25, 39.06, 9.76, 2.44 ppm y 0.61 ppm, con dos testigos: sin extracto, y con una emulsión de DMSO al 1 % y Tween 20. Los tratamientos se hicieron por duplicado. En el caso de los péptidos bioactivos, previamente purificados por filtración a través de membrana amicon ultra 0.5 mL, se valoraron seis concentraciones: 200, 50, 12.5, 3.12, 0.78 y 0.195 ppm, más un testigo sin extracto. Además, las bacterias utilizadas se ajustaron a la concentración equivalente a la escala 0.5 de McFarland (1907) que corresponde a 1x108 Unidades Formadoras de Colonias por mililitro (UFC mL-1). A partir de aquí, se diluyó nuevamente a concentración de 1x104 UFC mL-1. Para ejecutar la prueba, se adicionó 1 mL de suspensión del microorganismo en las diferentes concentraciones del extracto y se incubaron por 24 h a 37 °C para Pseudomonas aeruginosa y 28 °C para Xanthomonas campestris. Posteriormente, las muestras se diluyeron a un volumen final de 10 mL con agua destilada esterilizada; se hizo una segunda dilución a partir de 10 mL de esta, llevados a un aforo de 10 mL. De aquí se tomaron 10 mL. que se inocularon en cajas Petri con agar nutritivo, que se incubaron por 24 h a 37 °C para Pseudomonas aeruginosa, y a 28 °C para Xanthomonas campestris. Finalmente se realizó el recuento de colonias (UFC mL-1).
Fraccionamiento y separación de los extractos
Se aplicó la técnica recomendada por Alltech Associates Inc. (1998). Se corrió el extracto crudo obtenido con hexano y diclorometano en placas cromatográficas de vidrio de 5 X 10 cm con gel de sílice 60 F254, tamaño de partícula 2-2.5 mm, con diferentes sistemas eluyentes para encontrar un sistema óptimo y utilizarlo como fase móvil en la cromatografía de columna. Con el sistema eluyente óptimo se fraccionaron las muestras por columna empacada (vidrio, 60 cm de longitud, 20 mmϕ, gel de sílice tamaño de partícula 0.063-0.200 mm, 70-230 mesh ASTM). Se eluyeron dos gramos de extracto crudo de hexano y diclorometano, en lo que se trabajó como fase móvil, tolueno-acetato de etilo (80:20), a partir de lo cual se colectaron 21 fracciones para el extracto de hexano y 18 fracciones para diclorometano. Con ellas se hizo una cromatografía de capa fina, en la que la fase móvil fue con tolueno-acetato de etilo (85:25). Se observó la fluorescencia de las placas con luz UV a una longitud de onda de 254 nm y 365 nm. Las fracciones que mostraron similitud en manchas se mezclaron para los bioensayos.
Resultados y Discusión
Rendimiento de los extractos
Los extractos orgánicos (con hexano, diclorometano y metanol) revelaron un rendimiento de 2.2 % a 3.9 %, el mejor de los cuales corresponde al diclorometano. Respecto a los extractos peptídicos, el de mayor rendimiento fue el obtenido con el Buffer 2 (15.7 %) (Cuadro 1).
Cuadro 1. Rendimiento de extractos orgánicos y bufferizados.
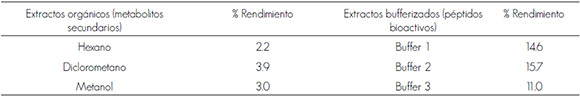
Haga clic para agrandar
Concentración y peso molecular de los péptidos extraídos
El buffer 1 presentó la mayor concentración con 1.17 mg mL-1 (ppm), el buffer 2, 0.94 mg mL-1, y el buffer 3, 0.84 mg mL-1. Con el marcador utilizado se observaron 10 bandas que van de 170 kDa a 5.7 kDa, lo que hizo posible determinar el peso molecular de los péptidos, que fue de aproximadamente 24.9 kDa.
Actividad antifúngica y antibacterial de los extractos y péptidos
En la Figura 1 se muestra el crecimiento micelial durante los tratamientos antifúngicos.

Figura 1. Crecimiento radial de Fusarium oxysporum Schlecht. emend.
Snyder & Hansen.
Para el Sclerotium cepivorum, el porcentaje de inhibición del crecimiento micelial de los extractos bufferizados fue de 8.6 a 30.8, con diferencia estadística significativa respecto al testigo, mientras que en los extractos orgánicos fue de 54.5 % a 88.4 %, excepto el extracto con metanol. Para Fusarium oxysporum, igualmente, los extractos referidos, a excepción del metanol, inhibieron el crecimiento de 10.0 a 22.0 % y los bufferizados, menos el del buffer 3, tuvieron el mismo efecto, de 2.0 % a 60.0 %.
Respecto a la actividad antibacteriana, los extractos bufferizados mostraron inhibición de 18.9 % a 86.5 % para Xanthomonas campestris, mientras que para Pseudomonas aeruginosa, de 4.4 % a 42.2 % En el Cuadro 2 se resumen los principales porcentajes de inhibición.
Cuadro 2. Condiciones y efecto antifúngico y antibacterial de los extractos crudos probados.

Haga clic para agrandar
En el Cuadro 2 se aprecia que el extracto bufferizado que presenta mayor inhibición es el buffer 2, con 86.5 % de Xantomonas campestris cuando se aplica a una concentración de 78 ppm, mientras que el extracto orgánico, la misma reacción se obtuvo con diclorometano, con 88.4 % sobre Sclerotium a 10 000 ppm, seguido de los extractos en hexano, con 84.0 % para Sclerotium a igual concentración. Asimismo, el agregar tripsina a los extractos bufferizados no ocasiona respuesta significativa, puesto que el comportamiento fue muy similar y los porcentajes de inhibición variaron de 3 a 4 %, lo que se puede atribuir al tipo de péptidos extraídos. Estos resultados coinciden con los datos publicados para otros géneros. Por ejemplo, péptidos derivados de pimienta a concentraciones de 70 y 150 ppm inhibieron la actividad de los hongos fitopatógenos Cylindrocarpon musae C. Booth & R. H. Stover, 1974 y F. oxysporum de 70 a 100 % y actuaron contra las levaduras Saccharomyces cerevisiae Meyen ex E. C. Hansen, 1838, Schizosaccharomyces pombe Lindner, 1893 y Candida albicans (C. P. Robin) Berkhout, 1923 (Diz et al., 2006).
Purificación parcial del extracto hexano y diclorometano
Los extractos de hexano y diclorometano que arrojaron los resultados de inhibición del crecimiento microbiano de los extractos de tipo orgánico más importantes fueron fraccionados, primero mediante cromatografía de capa fina, lo que reveló que el sistema tolueno-acetato de etilo (85:35) provoca la mejor separación (Figura 2). Las fracciones que mostraron similitud en manchas se mezclaron para los bioensayos.

Figura 2. Cromatografía de capa fina para extractos crudos de hexano y diclorometano
A continuación, estas fracciones mezcladas fueron eluidas en columna empacada con gel de sílice. Las fracciones en hexano 7 y 8; 9 y 10 se juntaron; así como de la 11 a la 15; de la 16 a la 18; 19 y 20, mientras que en diclorometano se unieron la 7, 8 y 9; de la 10 a la 15; de la 16 a la 18; y quedaron unitarias las 11, 12, 13, 14, 15, 16. Esto se hizo con el propósito de ensayarlas y elucidarlas por medio de cromatografía de gases-espectrometría de masas (GC-MS), en un estudio posterior.
Conclusiones
Los extractos bufferizados de la hoja de Guazuma ulmifolia presentaron mayor rendimiento de material extraíble, de los cuales el buffer 2 registró el valor más alto. En relación al efecto inhibitorio, los extractos con los mayores porcentajes de inhibición antifúngica fueron, en forma decreciente, diclorometano, hexano y buffer 2, mientras que los de mayor actividad antibacteriana fueron buffer 2, hexano y metanol.
El peso molecular de los péptidos fue de aproximadamente 24.9 kDa. De los extractos crudos se obtuvo un total de 21 fracciones para el extracto de hexano y 18 para el diclorometano. Los extractos de productos naturales son una importante fuente alternativa para sustituir los agroquímicos sintéticos para un control de las plagas.
Conflicto de Intereses
Los autores declaran no tener conflicto de intereses.
Contribución por Autor
Sergio Rosales Mata: establecimiento de ensayo en vivero, muestreo de planta, toma de base de datos, captura y análisis estadístico de bases de datos, estructuración del manuscrito; José Ángel Prieto Ruíz: diseño y establecimiento del experimento, consecusión de recursos, estructuración y revisión del manuscrito; José Leonardo García Rodríguez: revisión de literatura, análisis bases de datos, estructuración y revisión del manuscrito; Rosa Elvira Madrid Aispuro: muestreo de planta, captura de datos, revisión de literatura, mantenimiento del ensayo; José Angel Sigala Rodríguez: análisis estadístico, concentrado de base de datos, revisión de manuscrito.
Referencias
Alltech Associates Inc. 1998. TLC Plate Preparation and Adsorbent Powders. Data sheet D16030. Newark, DE, USA. pp.1-2 [ Links ]
Bio-Rad. 2014. Standards for electrophoresis and blotting, a wide range for all applications. http://www.docstoc.com/docs/159440772/Standards-for-Electrophoresis-and-Blotting-Bio-Rad. (15 de febrero de 2014) [ Links ]
Bradford, M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemmistry 72 (1-2): 248-254. [ Links ]
Camporese, A., M. J. Balick, R. Arvigo, R. G. Espósito, N. Morsellino, F. de Simone and A. Tubaro. 2003. Screening for anti-bacterial activity of medicinal plants from Belize (Central America). Journal of Ethnopharmacology 87:103-107. [ Links ]
Celis, Á., C. Mendoza, M. Pachón, J. Cardona, W. Delgado and L. E. Cuca. 2008. Plant extracts used as biocontrol with emphasis on Piperaceae family. A review. Agronomía Colombiana 26(1):97-106. [ Links ]
Comisión nacional para el conocimiento y uso de la biodiversidad (Conabio). 2014. Guazuma ulmifolia Lam. http://www.conabio.gob.mx/conocimiento/info_especies/arboles/doctos/66-sterc1m.pdf. (15 de enero de 2014). [ Links ]
Diz, M. S., A. O. Carvalho, R. Rodrigues, A. G. Neves-Ferreira, M. Da Cunha, E. W. Alves, A. L. Okorokova-Façanha, M. A. Oliveira, J. Perales, O. L. Machado, and V. M. Gomes. 2006. Antimicrobial peptides from chilli pepper seeds causes yeast plasma membrane permeabilization and inhibits the acidification of the medium by yeast cells. Biochimica et Biophysica Acta 1760(9):1323–1332. [ Links ]
Domínguez, X. A.1973. Métodos de Investigación Fotoquímica. Limusa. México, D.F., México. 281 p. [ Links ]
Jabeen, R., M. Shahid, A. Jamil and M. Ashraf. 2008. Microscopic evaluation of the antimicrobial activity of seed extracts of Moringa oleifera. Pakistan Journal of Botany 40(4):1349-58. [ Links ]
Jamil A, M. Shahid, K. M. Masud-Ul-Haq and M. Ashraf. 2007. Screening of some medicinal plants for isolation of antifungal proteins and peptides. Pakistan Journal of Botany 39(1):211-221. [ Links ]
Juárez B., G. P., M. E. Sosa M. y A. López M. 2010. Hongos fitopatógenos de alta importancia económica y métodos de control. Temas selectos de Ingeniería de Alimentos 4(2):14-23. [ Links ]
Laemmli, U. K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227 (5259): 680–685. [ Links ]
McFarland, J. 1907. The nephelometer: an instrument for estimating the numbers of bacteria in suspensions used for calculating the opsonic index and for vaccines. Journal of the American Medical Association 49:1176-1178. [ Links ]
Mueller, H. J. and J. Hinton. 1941. A protein-free medium for primary isolation of the Gonococcus and Meningococcus. Proceedings of the Society for Experimental Biology and Medicine 48: 330-333. [ Links ]
Pennington T. D. y J. Sarukhán. 2005. Árboles tropicalesde México. Manual para la identificación de las principales especies. 3a. ed. Universidad Nacional Autónoma de MéxicoFondo de Cultura Económica. México, D.F., México. 523 p. [ Links ]
Ramírez-Chávez, E., L. L. Valdez, G. V. Calleros y J. M. Torres. 2000. Actividad fungicida de la afinina y del extracto crudo de raíces de Heliopsislongipes en dos especies de Sclerotium. Agrociencia 34(2):207-215. [ Links ]
Regente, M. C., C. R. Oliva, M. Feldman, A. Castagnaro and L. De la Canal. 1997. A sunflower leaf antifungal peptide active against Sclerotiniasclerotiorum. Phytologia Plantarum 100:178-182. [ Links ]
Terras, F. R. G., H. M. Schoofs, M. F. De Bolle, F. V. Leuven, S. B. Rees, J. Vanderleyden, B. P. Cammue and W. F. Broekaert. 1992. Analysis of two novel classes of plants antifungal proteins from radish (Raphanussativus) seeds. Journal of Biological Chemistry 265:15301-15309. [ Links ]
Turrini, A., C. Sbrana, L. Pitto, C. M. Ruffini, L. Giorgetti, R. Briganti, T. Bracci, M. P. Nuti and M. Giovanneti. 2004. The antifungal Dm-AMP1 protein from Dahlia Merckii expressed in Solanummelongena is released in root exudates and differentially affects pathogenic fungi and mycorrhizal symbiosis. New phytologist 163:393-403. [ Links ]
Violante, I. M. P., L. Hamerski, W. Silva G., A. L. Batista, M. Rodrigues C., V. J. Pott and F. Rodrigues G. 2012. Antimicrobial activity of some medicinal plants from the cerrado of the central-western region of Brazil. Brazilian Journal of Microbiology 43(4): 1302-1308. [ Links ]
Weaver, P. L. 1990. Tree diameter growth rates in Cinnamon Bay Watershed, St. John, U.S. Virgin Islands. Caribbean Journal of Science 26(1-2):1-6. [ Links ]















