Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias forestales
versión impresa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.4 no.18 México jul./ago. 2013
Artículo
Variación genética de dos áreas semilleras de pino establecidas en el estado de Michoacán
Genetic variation in two pine seed natural stands established in Michoacán State
Patricia Delgado Valerio1, Joaquín Núñez Medrano1,Ma. Carmen Rocha Granados1 y H. Jesús Muñoz Flores2
1Facultad de Agrobiología "Presidente Juárez", Universidad Michoacana de San Nicolás de Hidalgo. Correo-e: dvalerio@umich.mx
2Campo Experimental Uruapan. Centro de Investigación Regional Pacífico Sur. INIFAP.
Fecha de recepción: 30 de octubre de 2012;
Fecha de aceptación: 13 de mayo de 2013.
Resumen
En México se han establecido más de 200 áreas semilleras; sin embargo, muchas de ellas están abandonadas o sin manejo. El conocimiento genético de árboles productores de semillas es esencial en la obtención de planta de mejor calidad para las actividades de reforestación y conservación de los recursos. El objetivo central del presente trabajo fue evaluar los niveles de variación genética en dos áreas semilleras de Pinus montezumae y Pinus pseudostrobus establecidas en el estado de Michoacán, con base en el uso de cinco microsatélites nucleares. Los resultados indican que P. pseudostrobus contiene un mayor número de alelos (A= 19) que P. montezumae (A= 18). En el primero, el promedio de la heterocigosis observada fue superior a la esperada (Ho= 0.290, He= 0.277); por el contario, en P. montezumae la heterocigosis promedio resultó más alta (Ho= 0.246, He= 0.274). Para ambas especies ninguno de los valores se desvió significativamente del equilibrio Hardy-Weinberg. P. pseudostrobus presentó el tamaño efectivo más grande (Ne= 805) que P. montezumae (Ne= 492), con un nivel de endogamia no significativo (F = -0.031 en P. pseudostrobus y F= 0.103 en P. montezumae). Por tanto, se considera que no existe ningún efecto importante de consanguinidad entre los árboles de cada área semillera y que contienen individuos con el acervo genético representativo de los dos taxa. Finalmente, se plantea una propuesta para recolectar semillas de árboles específicos para cada taxon.
Palabras clave: Áreas semilleras, endogamia, heterocigosis, microsatélites nucleares, Pinus, variación genética.
Abstract
More than 200 seed natural stands have been established in Mexico. However, nowadays many of them are abandoned or do not have a proper management. Genetic knowledge at the molecular level of seed trees is essential for the production of better plant quality, to ensure success in reforestation and conservation of genetic resources. The central objective of this study was to assess the levels of genetic variation in two seed stands of Pinus montezumae and Pinus pseudostrobus established in the state of Michoacán, screened with five nuclear microsatellite molecular markers. Results show that P. pseudostrobus contains a greater number of alleles (A= 19) than P. montezumae (A= 18). In P. pseudostrobus, the average observed heterozygosity was higher than the expected heterozygosity (Ho= 0.290, He= 0.277), whereas in P. montezumae the expected heterozygosity was higher (Ho = 0.246, He= 0.274). However, none of the values deviate significantly from the Hardy-Weinberg equilibrium. The effective size of P. pseudostrobus was higher (Ne= 805) than that of P. montezumae (Ne= 492), with a non-significant inbreeding level (F= -0031 in P. pseudostrobus; F= 0.103 in P. montezumae). Therefore, it can be considered that there is no significant effect of consanguinity between the trees of each seed stand and those containing individuals with the gene pool representative of the two species. Finally, a proposal to obtain seeds of particular trees to each species is presented here.
Key words: Seed stand, inbreeding, heterozygosity, nuclear microsatellites, Pinus, genetic variation.
Introducción
En el estado de Michoacán los bosques de coníferas ocupan más de 1 355,739 millones de hectáreas (Conafor, 2005), las cuales se conforman por 26 especies que corresponden a seis de los nueve géneros de coníferas existentes en México: Pinus, Abies, Junipperus, Podocarpus, Cupressus y Taxodium (Madrigal-Sánchez, 1982; Farjon y Styles, 1997). El estado el género Pinus cuenta con 17 especies, tres variedades y dos formas (Madrigal-Sánchez, 1982). No obstante, en la actualidad P. pseudostrobus Lindl, P. montezumae Lamb, P. pseudostrobus Lindl. subsp. protuberans Martínez (Silba), P. michoacana f. procera Martínez; P. ayacahuite var. veichtii Shaw, Pinus herrerae Martínez están amenazadas de extinción local (COFOM, 2012; Delgado, 2002); mientras que P. rzedowskii Madrigal & M. Caball. y P. martinezii Larsen (Delgado et al., 1999; CITES, 2002) lo están de manera total , debido a diferentes factores relacionados con la sobrexplotación de los bosques, el cambio de uso de suelo, los incendios forestales y el incremento de los asentamientos urbanos. En consecuencia, el desarrollo de programas para su manejo y conservación se torna prioritario.
En los criterios empleados para la conservación in situ de los recursos genéticos se incluye a las áreas productoras de semillas, las cuales se definen como rodales superiores que de forma obligatoria son aclareados y mejorados a través de la remoción de los árboles indeseables, y cuyo manejo está dirigido a una producción abundante y pronta de semillas (Snyder, 1972). Así, además de actuar como reservorios naturales de material genético nativo permiten un manejo y uso sustentable del recurso.
En México se han establecido más de 200, algunas de ellas tienen registro de Unidades Productoras de Germoplasma (Conafor, 2012). La mayoría corresponden a coníferas, en particular al género Pinus (Plancarte y Eguiluz, 1991; Clausen et al., 1994; Flores, 2000; Aguilera, 2001). En dichas áreas están representadas las especies de mayor importancia económica, cuya distribución comprende las sierras Madre Occidental, Oriental y el Eje Neovolcánico Transversal; sin embargo, por problemas de continuidad en los programas, actualmente están abandonadas (Mesén, 2003).
En el estado de Michoacán uno de los principales esfuerzos de manejo y recolección de semillas forestales lo ha realizado la Comisión Forestal del Estado (COFOM), mediante la implementación, desde la década de 1970, de programas orientados a la recolección de semillas de coníferas con fines de producción de planta para reforestación, en diferentes localidades o rodales semilleros para varios taxa de pinos (Guzmán et al., 1979). No obstante, los criterios de recolección se han basado, en gran medida, en los árboles que presentan la mayor cantidad de conos, en características dasonómicas generales: edad, altura y diámetro copa, y no en normas de selección fundamentadas en aspectos genéticos o fisiológicos (Wang y Beardmore, 1997). Por lo tanto, no existe algún estudio que indique si los árboles de las áreas y rodales semilleros poseen la variabilidad genética necesaria para no generar procesos de endogamia o consanguinidad en las semillas que, eventualmente, serán usadas en la producción de planta para reforestación.
En la presente investigación se utilizaron herramientas moleculares (microsatélites nucleares) y teóricas de la genética de poblaciones como criterios centrales para la evaluación de dos áreas semilleras de P. montezumae Lamb y P. pseudostrobus Lindl, localizadas en el estado de Michoacán. Se seleccionó a los microsatélites nucleares por ser altamente polimórficos, codominantes y compatibles con la teoría de la genética de poblaciones (Schaal et al., 1998; Petit et al., 2005). Además, las estimaciones de la variación genética que se han obtenido para seis pinos mexicanos: P. montezumae, P. pseudostrobus (Delgado, 2002); P. oocarpa Schiede ex Schlecht, P. tecunummani Eguiluz & Perry, P. patula Schiede & Deppe. (Dvorak et al., 2009); P. caribaea var. hondurensis (Sénécl.) W.H.G. (Delgado et al., 2011); con esos marcadores se han obtenido valores superiores a las determinados con isoenzimas, por lo que son recomendables para efectuar análisis de diversidad genética intrapoblacional. Aunque existen investigaciones que la han evaluado en huertos semilleros de diferentes coníferas en Estados Unidos de América y Europa, tales como Pinus contorta Dougl. var. latifolia Engelm. (Stoehr y Newton, 2002); P. radiata D. Don. (Devey et al., 2002; Bell et al., 2004); Pinus pinaster Ait. (Fernandes et al., 2008) y P. sylvestris L. (Torimaru et al., 2012), no existen registros formales de su empleo en áreas semilleras naturales. En este contexto el presente trabajo constituye el primer esfuerzo en el que se abordan dos de las especies de pino (P. montezumae y P. pseudostrobus) de mayor importancia económica en México, las cuales han sido muy explotadas para la comercialización de productos maderables y sus derivados, dentro y fuera del país (Eguiluz, 1978; Niembro, 1986; Zamora et al., 2007), y en el desarrollo de plantaciones (Stead, 1983; FAO, 2002), así como en el cultivo masivo de plantas con fines de reforestación (Pronare, 2000; Probosque, 2011).
El objetivo del análisis fue estimar los niveles de variación genética, de endogamia, y el tamaño efectivo de dos áreas semilleras de P. montezumae y P. pseudostrobus establecidas en el estado de Michoacán. Con los resultados se plantea una propuesta de recolecta de semillas para cada especie.
Materiales y Métodos
Áreas de estudio
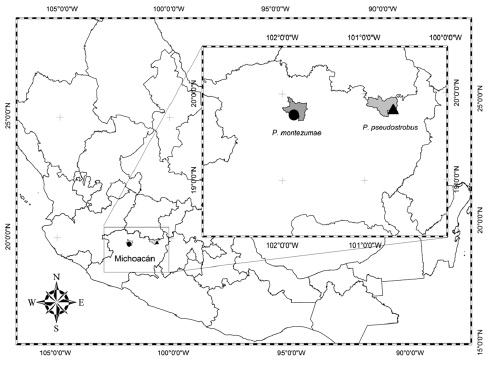
Las dos áreas semilleras estudiadas, establecidas en 2004, contienen árboles superiores seleccionados fenotípicamente (Muñoz et al., 2008); la de P. pseudostrobus se ubica en la comunidad indígena de Santa Rosa, municipio Zinapécuaro (19°49’27" latitud norte y 100°3’49" longitud oeste, 900 msnm), y está conformada por un total de 244 árboles adultos (61 árboles ha-1) de 55 años en promedio y 35 m de altura (Figura 1). El área semillera de P. montezumae está en Lázaro Cárdenas, municipio Zacapu (19°45’26" latitud norte y 101°51’19" longitud oeste, 2600 msnm), y reune 60 árboles adultos (16 árboles ha-1) de 53 años en promedio y 34 m de altura (Figura 1).
Figura 1. Ubicación geográfica de las áreas semilleras de P. pseudostrobus Lindl. y P. montezumae Lamb.
Figure 1. Geographic location of of P. pseudostrobus Lindl. and P. montezumae Lamb.
Recolecta de material biológico
El material biológico en cada área se obtuvo a partir de un muestreo al azar, en el que se procuró que los individuos estuvieran a una distancia de 12 m como mínimo (Muñoz et al., 2008). Se recolectaron ramillas tiernas de 37 árboles de P. pseudostrobus y 27 de P. montezumae, que se guardaron en bolsas de plástico etiquetadas (fecha, número de individuo y clave de registro del árbol) y después se almacenaron] a 4 °C hasta su procesamiento para la obtención de ADN.
Extracción de ADN y obtención de fragmentos
Se extrajo ADN total a partir de acículas primarias con el método de CTAB-miniprep desarrollado para pinos (Delgado, 2002). Se probaron nueve microsatélites nucleares (nSSR) aislados en P. taeda L. (Karhu et al., 2000), de los cuales cinco fueron polimórficos y reproducibles (PtTX3025, PtTX3029, PtTX2123, PtTX3013 y PtTx2037). Las reacciones de PCR se efectuaron con la metodología propuesta por Elsik et al. (2000), en la que se modificó la concentración de MgCl (4.0 mμ). Los fragmentos se separaron en geles de poliacrilamida al 6% (7M de Urea) y se corrieron a 55 W durante 1.5 a 3.5 h, en función del tamaño de los fragmentos. Los polimorfismos se visualizaron con el método de tinción de nitrato de plata propuesto por Echt et al., (1996); mientras que la determinación del tamaño de los fragmentos se realizó mediante un marcador de 10 pares de bases (Invitrogen) como referencia.
Análisis molecular
A partir de las frecuencias alélicas se obtuvieron los estimadores de la variación genética: promedio de alelos por locus (A), heterocigosis observada (Ho) y esperada (He), con la siguiente fórmula (Nei, 1987):
He= 1- Σpi2
Donde:
pi = Frecuencia promedio del alelo p para todos los loci.
Para verificar si la heterocigosis observada estaba en equilibrio Hardy-Weinberg, se hizo un análisis no paramétrico (10 000 permutaciones) basado en la reconstrucción de tablas de contingencia K x K (Guo y Thomson, 1992). El contenido de la tabla lo conforman las frecuencias alélicas observadas y K representa el número de alelos.
El índice de endogamia o de fijación (F) se determinó de acuerdo con Wright (1965):
F = He-Ho / He
Donde:
Ho = Proporción de heterócigos observados.
He= Proporción de heterócigos esperados.
Su confiablidad estadística se valoró con 1 000 permutaciones no paramétricas (Excoffier y Lischer, 2010).
El tamaño efectivo histórico (Ne) de las poblaciones se alcanzó con el parámetro θ= 4Neu, igual a cuatro veces el tamaño efectivo por la tasa de mutación (Otha y Kimura, 1973). El valor de θ se determinó a través del modelo de mutación de alelos infinitos (MAI) (Weir, 1996) y se asumió una tasa de mutación de 1x10-3 (Boys et al., 2005). Todas las estimaciones se hicieron con los programas Arlequin ver. 3.5.3.1 (Excoffier y Lischer, 2010) y GENEPOP (Rousset, 2008).
Resultados y Discusión
Variación genética
Pinus pseudostrobus presentó 19 alelos y P. montezumae 18, para un total de 23 alelos para las dos especies con un promedio de 4.6 alelos por locus (Cuadro 1 y Figura 2). El alelo con mayor frecuencia para el locus PtTX3025 fue el 268 en ambos taxa, seguido del 256 para P. montezumae y del 260 en P. pseudostrobus. Para el locus PtTX3029 fue el alelo 227 para las dos especies, el 235 y del 217 que solo se registró en P. montezumae.
Cuadro 1. Frecuencias alélicas obtenidas para dos áreas semilleras de P. pseudostrobus Lindl. y P. montezumae Lamb en Michoacán, México.
Table 1. Allele frequencies for two areas seed obtained from P. pseudostrobus Lindl. and P. montezumae Lamb. in Michoacán, México.
Figura 2. Distribución de las frecuencias alélicas obtenidas para las áreas semilleras de P. pseudostrobus Lindl. y P. montezumae Lamb.
Figure 2. Distribution of allele frequencies obtained for seed areas of P. pseudostrobus Lindl. and P. montezumae Lamb.
Para el locus PtTX3013 fue el alelo 135 y para el PtTX2037 correspondió el 149 para los dos pinos. En total se presentaron cinco alelos únicos en P. pseudostrobus y cuatro en P. montezumae. Aunque el número de alelos por locus en P. pseudostrobus fue relativamente mayor al de P. montezumae, sus frecuencias resultaron menores. P. pseudostrobus tuvo 10 alelos con frecuencias menores a 0.05 y P. montezumae, ocho.
Estos resultados son relativamente similares a los consignados por Delgado (2002) para los mismos taxa en otras poblaciones a través de su área de distribución natural, pero con el uso de tres nSSR (cinco alelos en promedio para cada taxon). Asimismo, son semejantes a los alcanzados en P. caribaea var. hondurensis con cuatro alelos (Delgado et al., 2011); P. oocarpa, P. patula y P. tecunumanii , cinco alelos (Dvorak et al., 2009) y P. radiata con seis alelos (Smith y Devey, 1994). En consecuencia, se puede considerar que ambas áreas semilleras contienen la mayoría de los alelos logrados hasta ahora para especies del subgénero Pinus.
El promedio de la heterocigosis fue superior en P. pseudostrobus (Ho=0.290) con respecto a P. montezumae (Ho= 0.246,); en tanto que la heterocigosis esperada fue similar (He = 0.277, He = 0.274, respectivamente). El locus PtTX2037 presentó el valor más alto de heterocigosis en P. pseudostrobus y el locus PtTX2123 en P. montezumae (cuadros 2 y 3). Sin embargo, las diferencias entre los dos estimadores (He y Ho) no resultaron significativas estadísticamente (p= 0.833 en P. pseudostrobus; p= 0.800 en P. montezumae), por lo que las dos áreas semilleras están en equilibrio Hardy-Weinberg. Lo anterior sugiere que] los genotipos obtenidos en cada una de las áreas están formados por uniones aleatorias de gametos, y que no existe fuerza evolutiva alguna que accione de manera significativa dentro de ellas: mutación, selección, deriva genética o migración (Wright, 1965; Hedrick 1983).
Cuadro 2. Estimadores de la variación genética obtenidos con cinco microsatélites polimórficos para el área semillera de P. pseudostrobus Lindl. en Zinapécuaro, Michoacán.
Table 2. Estimators of the genetic variation obtained with five polymorphic microsatellite for the seed area of P. pseudostrobus Lindl. in Zinapécuaro, Michoacán.
Cuadro 3. Estimadores de la variación genética obtenidos con cinco microsatélites polimórficos para el área semillero de P. montezumae Lamb en Zacapu, Michoacán.
Table 3. Estimators of the genetic variation obtained with five polymorphic microsatellite for the seed area of P. montezumae Lamb. in Zinapécuaro, Michoacán.
Los valores de heterocigosis en las dos especies fueron inferiores a los señalados para otros pinos que se han analizado con los mismos marcadores (P. radiata Ho= 0.625, Smith y Devey, 1994; P. taeda Linn., Ho= 0.559, Williams et al., 2000, y P. caribaea var. hondurensis Ho= 0.422 y He= 0.465, Delgado et al., 2011), pero semejantes a los resultados logrados por Delgado (2002) en poblaciones naturales de las mismas especies (Ho= 0.206 y He = 0.256 en P. pseudostrobus, y Ho= 0.219 y He = 0.273 en P. montezumae); de tal forma, que se puede considerar que ambas áreas semilleras contienen buenos niveles de variación genética. El área semillera de P. pseudostrobus se conforma por más variantes alélicas representativas del taxon y genotipos heterócigos que la de P. montezumae.
Tamaño efectivo
El tamaño efectivo fue mayor para el área semillera de P. pseudostrobus (Ne= 805.50) que para la de P. montezumae (Ne= 492.50), lo cual indica que han contribuido históricamente más individuos a la reproducción o transmisión de genes de una generación a otra en la primera especie que en P. montezumae. En la actualidad, no existe información sobre el estimado de Ne en otras especies de pino mexicanas que se haya realizado con el mismo parámetro (θ= 4Neu) y marcador genético, así como con la misma tasa de mutación (1x10-3).
Sólo se ha registrado una estimación del Ne con la misma aproximación en P. resinosa Ait, taxon distribuido en Estados Unidos de América, para la que se obtuvieron valores de Ne de 62 a 222 individuos (Boys et al., 2005). Dichos valores son inferiores a los derivados en este estudio; por lo tanto, el Ne estimado ha sido suficiente para impedir que la diversidad genética disminuya por procesos de endogamia o deriva genética (Hartl y Clark, 1997).
Sin embargo, estas estimaciones de Ne no son comparables con las que se aprecian en este trabajo, pues, además de extraerse de una región de ADN haploide (cloroplasto) y de obtenerse valores de heterocigosis esperada más altos (HT de 0.6 para P. cembroides y de 0.95 en P. maximartinezii), el Ne se valoró con otra tasa de mutación (5.5 x 10-5, Provan et al., 1999), con otro modelo de mutación (SMM) y con mayor número de poblaciones e individuos más alto, lo cual, probablemente, generó tamaños efectivos más grandes.
Índice de fijación (F)
No se observó un valor significativo de endogamia; en P. pseudostrobus el estimador resultó ser negativo, aunque no fue significativo estadísticamente (F= -0.031, P= 0.643), y en P. montezumae fue relativamente alto pero no significativo (F= 0.103, P= 0.087). Este último valor de F se produjo debido a que las frecuencias genotípicas de uno de los loci (PtTX3027) se desviaron del equilibrio Hardy-Weinberg (p = 0.005), mas no tuvieron un efecto significativo a nivel de la población. Al respecto, en el estudio de Delgado (2002) en cinco poblaciones de P. montezumae distribuidas en México y Guatemala se registró un valor de endogamia significativo (F= 0.139, p= 0.000), lo cual sugiere que la especie tiende a tener más individuos homócigos que P. pseudostrobus y, por lo tanto, el valor de F que se estimó podría aumentar en muy pocas generaciones y alterar o desviar las frecuencias alélicas de manera significativa.
En general, los valores de F calculados son similares a los citados para algunos pinos analizadas con nSSR, en los que la endogamia no es la fuerza evolutiva que moldea la variación genética (P. pseudostrobus, F= 0.038, Delgado 2002; P. densata Mast., F= 0.021, Wang et al., 2001). Desafortunadamente, todos esos trabajos se realizaron con poblaciones naturales sin ningún tipo de manejo forestal y no existen registros formales sobre otras áreas semilleras evaluadas a nivel molecular que permitan hacer una comparación más fina. Pese a ello, se puede considerar que los individuos seleccionados por sus características fenotípicas deseables (altura, diámetro y cobertura de copa de los árboles) para la formación de las dos áreas semilleras fueron las adecuadas, lo que ligeramente se refleja a nivel molecular por los valores bajos de endogamia, y por la presencia de un número alto de variantes alélicas en las dos poblaciones. Por lo tanto, ambas áreas semilleras contienen individuos con una calidad genética suficiente para garantizar la producción de planta para la reforestación exitosa en las zonas cercanas.
Propuesta de Manejo
Con base en la información generada se sugiere el siguiente esquema de manejo para la obtención de semillas de árboles particulares. Para el área semillera de P. pseudostrobus se propone la recolecta en los árboles muestreados al azar, dado que la selección de los individuos efectuada para la conformación del área semillera indica, a nivel molecular, que está en equilibrio Hardy Weinberg. El muestreo al azar permitirá que el valor de F se mantenga y no se altere el equilibrio genético de la población. Para P. montezumae la estrategia es un poco diferente, pues como en esta área se estimó un valor de endogamia importante (F= 0.103), y, aunque, en la actualidad la población no se desvía del equilibrio Hardy Weinberg, si sólo se recolectaran semillas de árboles elegidos al azar, en el futuro podría existir una mayor probabilidad de que se recolectaran simientes en condición homóciga y se originara la perdida de alelos y niveles significativos de endogamia en las áreas de reforestación. En consecuencia, para este caso se propone llevar a cabo la recolecta del germoplasma tanto de los árboles con mayor número de alelos y de heterócigos para los cinco loci analizados (individuos 06, 13, 17, 20, 57, 23, 46, 29, 39, 58, 18 y 42), así como de individuos seleccionados al azar. Ambas estrategias permitirán, a corto plazo, que más cantidad de plantas logren establecerse y sobrevivir en las zonas de plantación, y producir, a mediano y largo plazo, semillas que genéticamente contengan proporciones alélicas y genotípicas similares, a fin de mantener el equilibrio genético a través de las generaciones.
Conclusiones
El uso de los marcadores moleculares nSSR permitió reconocer que los niveles de variación genética contenida en las dos áreas semilleras están dentro del intervalo señalado para pinos con equilibrio Hardy- Weinberg, y que no presentan niveles de endogamia o consanguinidad significativos. Se recomienda comparar la diversidad hallada en estas áreas con las zonas que se pretende reforestar, a fin de no disminuir la variación genética existente. Asimismo, se sugiere emprender estudios en otras áreas semilleras de las especies estudiadas con marcadores nucleares y de cloroplasto para conocer el movimiento de sus genes (semillas y polen) y proponer con certeza los límites geográficos de reforestación.
Agradecimientos
Los autores desean expresar su agradecimiento a los dueños de las áreas semilleras de Gerahuaro y Zacapu, por el apoyo en el trabajo de campo. Al Dr. Ignacio Vidales, por facilitar el desarrollo del trabajo de laboratorio en el Campo Experimental de Uruapan, Centro de Investigación Regional Pacífico Sur, INIFAP, y a dos revisores por sus invaluables comentarios que enriquecieron el manuscrito. Este trabajo fue financiado por la Coordinación de la Investigación Científica de la Universidad Michoacana de San Nicolás de Hidalgo, Proy-226 y por la Comisión Nacional Forestal, Proy-176167.
Referencias
Aguilera, R., M. 2001. Unidades productoras de germoplasma forestal: Resumen de fuentes que se han identificado en el país. Gaceta de la Red Mexicana de Germoplasma Forestal: SEMARNAP. México, D.F. México. pp. 90-100. [ Links ]
Bell, J., M. Powell, M. Devey and G. Moran. 2004. DNA Profiling, Pedigree Lineage Analysis and Monitoring in the Australian Breeding Program of Radiata Pine. Silvae Genetica. 53:130-134. [ Links ]
Boys, J., M. Cherry and S. Dayanandan. 2005. Microsatellite analysis reveals genetically distinct populations of red pine (Pinus resinosa, Pinaceae). American Journal of Botany. 92:833-841. [ Links ]
Clausen, K., E., L. C. Flores y J. Vargas H. 1994. Avances del Programa de Mejoramiento Genético Forestal en Chihuahua. Nota Técnica No. 8. Centro de Genética Forestal, A.C.. Chapingo, Edo.de Mex. México. 13 p. [ Links ]
Comisión Forestal del Estado de Michoacán (COFOM). 2012. Programa de Desarrollo Forestal Sustentable del Estado de Michoacán 2030. Tomo I. Gobierno del estado de Michoacán. http://www.cofom.michoacan.gob.mx (7 de mayo, 2013). [ Links ]
Convention on International Trade in Endangered Species of Wild Fauna and Flora (CITES). 2002. Convention on International Trade in Endangered Species of Wild Fauna and Flora, Appendix II. http://www.cites.org/resources/species.html. (10 de septiembre 2012). [ Links ]
Comisión Nacional Forestal (Conafor). 2005. Secretaria de Medio Ambiente y Recursos Naturales: Programa Nacional de reforestación. http://www.conafor.gob.mx/programas_nacionales_forestales/pronare (6 de marzo de 2012). [ Links ]
Comisión Nacional Forestal (Conafor). 2012. Secretaria de Medio Ambiente y Recursos Naturales: Unidades Productoras de Germoplasma Forestal. Fichas Técnicas. http://www.conafor.gob.mx/portal/index.php/temas-forestales/germoplasma-forestal/upgf (14 de marzo de 2012). [ Links ]
Delgado, P., D. Piñero, A. Chaos, N. Pérez-Nasser and E. Alvarez-Buylla. 1999. High levels of variation and structure genetic in very rare pine specie (Pinus rzedowskii), endemic of Michoacán, México. American Journal of Botaniy, 86: 669-676. [ Links ]
Delgado, P. 2002. Dinámica histórica de la hibridización introgresiva en poblaciones naturales de Pinus montezumae Lamb y P. pseudostrobus Lindl (Pinaceae). Tesis Doctoral. Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D.F. México. 110 p. [ Links ]
Delgado, P., D. Piñero, L. Jardón, V. Rebolledo and F. Chi-May. 2011. Genetic variation and demographic contraction of the remnant populations of Mexican Caribbean pine (Pinus caribaea var. hondurensis: Pinaceae). Annals of Forest Science. 68:121-128. [ Links ]
Devey, M., J. Bell, T. Uren and G. Moran. 2002. A set of microsatellite markers for fingerprinting and breeding applications in Pinus radiata. Genome 45:984-989. [ Links ]
Dvorak, W. S., K. M. Potter, V. D. Hipkins and G. R. Hodge. 2009. Genetic diversity and gene exchange in Pinus oocarpa, a Mesoamerican pine with resistance to the pitch canker fungus (Fusarium circinatum). International Journal of Plant Science. 170:609-626. [ Links ]
Echt, C. S., P. May-Marquardt, M. Hseih and R. Zahorchak. 1996. Characterization of microsatellite markers in eastern white pine. Genome. 39:1102-1108. [ Links ]
Elsik, C. G., V. T. Minihan, S. E. Hall, A. M. Scarpa and C. G. Williams. 2000. Low-copy microsatellite markers for Pinus taeda L. Genome. 43:550-555. [ Links ]
Eguiluz P., T. 1978. Ensayo de integración de los conocimientos sobre el genero Pinus en Mexico. Tesis de Maestría. Universidad Autónoma de Chapingo, Chapingo, Edo. de Mex. México. 623 p. [ Links ]
Excoffier, L. and H. E. L. Lischer. 2010. Arlequin suite ver. 3.5: A new series of programs to perform population genetics analyses under Linux and Window. Molecular Ecology Resources. 10:564-567. [ Links ]
Farjon, A. T. and B. Styles 1997. Pinus (Pinaceae). Flora Neotropical, Monograph 75. New York Botanical Garden. New York, USA. 246 p. [ Links ]
Fernandes, L., M. Rocheta, J. Cordeiro, S. Pereira, S. Gerber, M. Oliveira and M. Ribeiro M. 2008. Genetic variation, mating patterns and gene flow in a Pinus pinaster Aiton clonal seed orchard. Annals of Forest Science. 65: 706-706. [ Links ]
Flores, L., C. 2000. Análisis y perspectivas del mejoramiento genético de los bosques del estado de Chihuahua. Gaceta de la Red Mexicana de Germoplasma Forestal. SEMARNAP. México, D.F. México. pp 81-88. [ Links ]
Guzmán, M., A., M. O. Barrera y R. Moncayo F. 1979. Manejo de semillas de pino en la Comisión Forestal del Estado de Michoacán. Técnica Reforestación. No. 19. 49 p. [ Links ]
Guo, S. and E. Thompson. 1992. Performing the exact test of Hardy-Weinberg proportion for multiple alleles. Biometrics. 48:361-372. [ Links ]
Hedrick, P. W.1983. Genetics of populations. Science Books International. Boston, MA USA.278 p. [ Links ]
Hartl, D. L. and A. G. Clark.1997. Principles of population genetics. 2da edition. Sinauer Associates. Sunderland, UK. 682 p. [ Links ]
Karhu, A., J-H. Dietrich and O. Savolainen. 2000. Rapid expansion of microsatellite sequences in pines. Molecular Biology and Evolution 17:259-265. [ Links ]
Madrigal-Sánchez, X. 1982. Claves para la identificación de las Coníferas silvestres del estado de Michoacán. Boletín Divulgativo No. 58. INIF-SARH. México, D.F. México. 100 p. [ Links ]
Mesén, F. 2003. Estado de los Recursos Genéticos Forestales en América Central, Cuba y México, y Plan de Acción Regional para su Conservación y Uso Sostenible. Documentos de Trabajo: Recursos Genéticos Forestales. FGR/52S Servicio de Desarrollo de Recursos Forestales, Dirección de Recursos Forestales, FAO. Roma, Italia. 85 p. http://www.fao.org/docrep/ag046s/ag045s00.html. (3 de febrero 2011). [ Links ]
Muñoz, F., J., R. Toledo B., T. Sáenz R., F. J. Villaseñor, J. García S. y J. García M. 2008. Establecimiento y manejo de dos áreas semilleras de coníferas nativas en el estado de Michoacán. Rev. Mex. Cien. For. 33: 79-102. [ Links ]
Nei, M. 1987. Molecular evolutionary genetics. Columbia Univ. Press. New York, USA. 512 p. [ Links ]
Niembro, A. 1986. Árboles y Arbustos Útiles de México. Limusa. México, D.F. México. 206 p. [ Links ]
Otha, T. and M. Kimura. 1973: A model of mutation appropriate to estimate the number of electrophoretically detectable alleles in a finite population. Genetics Research 22: 201-204. [ Links ]
Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) 2002. Evaluación de los Recursos Forestales Mundiales 2000. Informe principal. Estudio Monte FAO 140. Roma, Italia. pp. 1-81. [ Links ]
Petit, J. R., J. Duminil, S. FineschI, A Hampe, D. Salvini and G. G. 2005. Comparative organization of chloroplast, mitochondrial and nuclear diversity in plant populations. Molecular Ecology. 14:689-701. [ Links ]
Plancarte, B., A. y T. Eguiluz P. 1991. Avances de investigación en 1990. Centro de Genética Forestal A.C. Universidad Autónoma Chapingo. Chapingo, Edo. de Mex. México. 9 p. [ Links ]
Protectora de bosques del Estado de México (Probosque). 2011. Secretaría del Medio Ambiente. Viveros Forestales. http://www.edomex.gob.mx/portal/page/portal/probosque/viverosforestales/ (9 de enero de 2012). [ Links ]
Programa Nacional de Reforestación (Pronare). 2000. Evaluación de la reforestación 1999. SEMARNAT. México, D.F. México. s/p. [ Links ]
Provan, J. N., N, J. Soranzo, D. Wilson, B. Golnstein and W. Powel. 1999. A low mutation rates for chloroplast microsatellites. Genetics. 153:943-947. [ Links ]
Rousset, F. 2008. Genepop’007: A complete reimplementation of the Genepop software for Windows and Linux. Molecular Ecology Resources. 8:103-106. [ Links ]
Schaal, B., A., D. A. Hayworth, K. M. Olsen, J. T. Rauscher and W. Smith A. 1998. Phylogeographic studies in plants: problems and prospects. Molecular Ecology. 7:465-474. [ Links ]
Smith, D., N. and M. Devey E. 1994. Ocurrence and inheritance of microsatellites in Pinus radiata. Genome. 37:977-983. [ Links ]
Snyder, F .B. 1972. Glossary for forest tree improvement works. USDA Forest Service. Southern Forest Experiment Station. New Orleans, LA USA. 22 p. [ Links ]
Stead, J., W.1983. A study of variation and taxonomy of the Pinus pseudostrobus complex, Commonw. Forestry Review. 62:26-36. [ Links ]
Stoehr, M. U. and C. Newton H. 2002. Evaluation of mating dynamics in a lodgepole pine seed orchard using chloroplast DNA markers. Canadian Journal of Forest Research. 32:469-476. [ Links ]
Torimaru, T., U. Wennström, D. Lindgren and X-R. Wang. 2012. Effects of male fecundity, interindividual distance and anisotropic pollen dispersal on mating success in a Scots pine (Pinus sylvestris) seed orchard. Heredity. 108:312-321. [ Links ]
Wang, B. S., P. y T. Beardmore. 1997. Almacenamiento y manejo de germoplasma. In: Vargas, J., J., B. Bermejo y F. Ledig T. (Eds.). Manejo de Recursos Genéticos Forestales. Colegio de Postgraduados. Montecillo, Edo. De Méx. México. pp. 107-140. [ Links ]
Wang, X-R., A. E. Szmidt and O. Savolainen. 2001. Genetic composition and diploid hybrid speciation of high mountains pine, Pinus densata native to the Tibetan plateau. Genetics. 159:337-346. [ Links ]
Weir, B. S. 1996. Genetic data analysis II. Sinauer Associates, Sunderland. Sunderland, MA USA. 445 p. [ Links ]
Williams, C. G., C. G. Elsik and D. Richard B. 2000. Microsatellite analysis of Pinus taeda L. in Zimbabwe. Heredity. 84:261-268. [ Links ]
Wright, S. 1965. The interpretation of population structure by F-statistics with special regard to systems of mating. Evolution. 19:395-420. [ Links ]
Zamora-Campos, E. M., O. G. Vázquez-Cuecuecha, A. Pérez A., R. Cano F., A. Aparicio R. y P. Fernández E. 2007. Variación natural de la densidad de la madera en Pinus montezumae Lamb, en tres altitudes del Parque Nacional La Malinche Tlaxcala, México. Foresta Veracruzana. 9 (2):33-37. [ Links ]