Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias forestales
versão impressa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.3 no.10 México Mar./Abr. 2012
Artículo
Regeneración de plantas de Paulownia elongata Steud. Por organogénesis directa
Regeneration of Paulownia elongata Steud. Plants by direct organogenesis
Carlos R. Castillo-Martínez1, Ma. Alejandra Gutiérrez-Espinosa2,Marco T. Buenrostro-Nava2, Víctor Manuel Cetina Alcalá2 y Jorge Cadena Iñiguez2
1Centro Nacional de Recursos Genéticos. INIFAP. Correo e-: castillo.carlos@inifap.gob.mx
2Especialidad de Genética, Colegio de Postgraduados
Recibido el 27 de abril de 2010
Aceptado el 9 de abril de 2012.
Resumen
Paulownia elongata es una especie forestal de origen oriental y rápido crecimiento, que fue introducida en México a finales de 1998 para ser incorporada en plantaciones comerciales maderables, pues su madera es ligera, por lo cual se emplea en la manufactura de muebles, artesanías, instrumentos musicales y en el acabado de interiores. El objetivo de este trabajo fue determinar las mejores condiciones de cultivo in vitro, para la regeneración de plántulas de P. elongata a partir de diversos tipos de explantes de segmentos internodales, foliares y peciolares, lo que derivó en un protocolo para organogénesis directa apto para usarse en sistemas de transformación genética. En todos los casos el medio Murashige y Skoog (MS) fue adicionado con 6-benciladenina (BA) y ácido naftalenacético (ANA), en distintas concentraciones. Se obtuvo respuesta en la totalidad de los explantes con la combinación de 5 mg L-1 de BA y 1.0 mg L-1 de ANA; sin embargo, los segmentos internodales mostraron una mejor inducción de brotes: 83% de explantes con brotes y 1.52 brotes por explante con la combinación de 4 mg L-1 de BA y 0.2 mg L-1 de ANA, a diferencia de los segmentos de pecíolo que produjeron sus mejores resultados de 53% de explantes con brote y 0.62 brotes por explante, con una mezcla de 7 mg L-1 de BA y 0.2 mg L-1 de ANA.
Palabras clave: 6-Benciladenina, ácido naftalenacético, explantes, micropropagación, Paulownia elongata Steud., plantaciones forestales.
Abstract
Paulownia elongata is an oriental fast-growing forest species that was introduced in Mexico at the end of 1998, as an option for wood commercial plantations, since its timber is light, which favours its use in furniture manufacturing, handicrafts, music instruments and in interior finish. The aim of this work was to determine the best in vitro culture conditions for plant regeneration of Paulownia elongata through several types of explants from steam segments (internode), leaves and petiole, which resulted in a protocol for direct organogenesis that can be used in genetic transformation systems. In all cases, to the basal MS medium were added 6-benzyladenine (BA) from 5 mg L-1 to 1.0 mg L-1 and naphtalenacetic acid (NAA) at different concentrations. Response was obtained in all of the explants with the 5 mg L-1 BA and 1.0 mg L-1 NAA combination; however internodal segments showed a better bud induction, by producing 83% explants with shoots and 1.52 shoots per explant with the 4 mg L-1 BA and 0.2 mg L-1 NAA combination, in contrast to those of petiole segments that produced their best results as 53% explants with shoots and 0.62 shoots per explant, with a 7 mg -1 BA and 0.2 mg L-1 NAA mix.
Key words: 6-Benciladenine, naphtalenacetic acid, explants, micropropagation, Paulownia elongate Steud., forest plantations.
Introducción
Paulownia elongata Steud. es una especie forestal de procedencia oriental (China, Laos y Vietnam) de rápido crecimiento que fue introducida en México a finales de 1998 como una alternativa para el establecimiento de plantaciones comerciales. Desde una perspectiva económica, el género Paulownia, de la familia Scrophulariaceae, es importante en su lugar de origen, de donde se extendió a Japón, Australia, Brasil y Estados Unidos de América. Su madera posee densidad baja que le proporciona ligereza, razón por la cual se emplea en la manufactura de muebles, artesanías, instrumentos musicales y en el acabado de interiores (Zhu et al., 1986).
Todas las especies de Paulownia tienen un gran potencial para la reforestación y el mejoramiento de suelos pobres (Zhu et al., 1986; Melhuish et al., 1990); así como otras características relacionadas con su rápido crecimiento que son ideales para los programas de agrosilvicultura (Wang y Shogren, 1992), incluido el uso de sus hojas como forraje (Zhu et al.,1986). Existen algunas especies tolerantes a períodos de sequía y adaptables a diferentes tipos de suelos, lo que favorece su cultivo en diversas condiciones y, que a su vez, incrementa su potencial económico (Tang et al.,1980).
Pawlonia spp. se reproduce a través de semillas y esquejes de tallo y raíz. En cuanto a la primera forma, uno de los principales problemas es que pueden presentar dormancia; además de que el crecimiento de las plántulas es menor que las derivadas de esquejes o multiplicadas in vitro (Bergmann y Moon,1997). Respecto a la segunda, los esquejes de tallo, en general, son más difíciles de obtener; no obstante, en los de raíz el daño físico causado a la epidermis y al cortex provoca el ataque de patógenos (Tang et al.,1980). Lo anterior sugiere la necesidad de definir métodos de regeneración por cultivo de tejidos, a partir de material libre de organismos nocivos y de manera aséptica; al: respecto, Bergmann y Moon (1997) consignan la regeneración a escala con material proveniente de brotes adventicios de segmentos apicales de P. elongata.
La propagación vegetativa es esencial para la reproducción clonal eficiente en taxa de Paulownia y, en algunos aspectos, aventaja a la sexual (semillas), ya que para este tipo de reproducción asexual se pueden utilizar diversos tipos de tejidos con objetivos distintos, como por ejemplo, los segmentos foliares e internodales usados como explantes para la embriogénesis somática indirecta. En P. elongata se ha documentado la obtención de un promedio de 50.7 embriones somáticos por cada 100 mg de callo embriogénico, mediante la combinación de los reguladores de crecimiento TDZ y cinetina, después de cuatro semanas de cultivo (Ipecki y Gozukirmizi, 2004). Por otra parte, Song et al. (1991) usaron segmentos de hoja y de pecíolo para desarrollar embriones somáticos de P. catalpifolia Steud. con más de 65% de explantes que formaron callo, después de cuatro semanas. De manera similar, se han empleado pecíolos y segmentos foliares para la regeneración de brotes adventicios en otras especies maderables como sándalo (Santalum album L.) (Rao y Bapat, 1992).
Los tejidos usados de manera frecuente como explantes para la multiplicación clonal son los ápices o yemas axilares, como se ha realizado en la propagación de P. catalpifolia (Song et al., 1990), P. tomentosa (Thunb.) Steud. (Rout et al., 2001) y P. fortunei (Seem.) Hemsl. (Sharma et al., 2003).
El avance en la micropropagación de diversas especies del género Paulownia es amplio; sin embargo, es necesario un protocolo de propagación in vitro enfocado en la organogénesis directa a partir de una gran cantidad de explantes capaces de constituir individuos procedentes de células o tejidos, para sistemas de transformación genética mediada por Agrobacterium tumefaciens Smith & Townsend, 1907 o por aceleración de partículas.
Materiales y Métodos
Material vegetal
El material inicial fue recolectado de árboles de dos años de edad con una altura promedio de 5.5 m, en la localidad de El Aguaje, municipio Aguililla, estado de Michoacán, ubicada a 18° 44" latitud norte y 102° 47" longitud oeste.
Se disectaron brotes adventicios no mayores de 5 cm, a partir del segundo tercio de la base de los árboles, los cuales se colocaron en bolsas de polipapel para su transporte en una hielera hermética Coleman® (45 x 60 x 20 cm) al Laboratorio de Biotecnología e Ingeniería Genética del Programa de Recursos Genéticos y Productividad del Colegio de Postgraduados. De manera inmediata a su llegada, se lavaron con jabón líquido Dial® y se enjuagaron con agua corriente para eliminar el polvo y otros elementos contaminantes. Las hojas se retiraron y los brotes fueron divididos en yemas axilares y apicales. En ambos casos, se dio un tratamiento de inmersión por 30 segundos en una solución de alcohol al 70% v/v y posteriormente en una de hipoclorito de sodio (Cloralex® ) al 0.4 % v/v, durante 10 minutos. Por último, se aplicaron tres enjuagues con agua destilada esterilizada en campana de flujo laminar.
Una vez desinfectado, el material se cortó con bisturí. Todas las yemas se transfirieron a cajas Petri con papel absorbente estéril, para eliminar el exceso de humedad, y se introdujeron a un medio Murashige y Skoog (MS) (1962) sin reguladores de crecimiento para su adaptación in vitro. Después de 30 días se generaron brotes mayores de 4 cm que fueron empleados para la separación de los explantes iniciales (hojas, tallos y pecíolos). Los segmentos foliares, que median en promedio 1 cm2 y los internodales y de pecíolo de 1 cm de largo, fueron colocados en diferentes tratamientos.
Medio y condiciones de cultivo
Los medios y tratamientos establecidos, un total de 13, incluyeron las siguientes combinaciones de reguladores de crecimiento: ácido naftalenacético (ANA) (0.2, 0.5 y 1 mg L-1) y 6-benciladenina (BA) (4, 5, 7 y 10 mg L-1), más el testigo: medio MS sin reguladores. Todos se elaboraron con las sales inorgánicas y vitaminas del medio propuesto por MS, adicionado con 3% (p/v) de sacarosa y 7% (p/v) de agar (Merck®) y el pH se ajustó a 5.8. Se agregaron 25 mL de este medio en cajas de Petri de 100 x 15 mm y se sellaron con parafilm.
En cada caja de Petri se colocaron 20 explantes: los segmentos foliares fueron de 1 cm2, y los internodales y de pecíolo tuvieron una longitud aproximada de 0.5 cm. Las condiciones de cultivo en el cuarto de incubación de 2.50 x 3.10 m con temperatura e iluminación controlada fueron las siguientes: temperatura de 28 °C± 2 e intensidad lumínica de 70 μmol m2 s-1 generada mediante lámparas fluorescentes y con fotoperiodo de 16/8 horas luz y oscuridad.
Enraizamiento y adaptación de plántulas
Para obtener plantas completas se enraizaron los brotes que presentaron una longitud promedio de 3 a 4 cm y se depositaron en frascos Gerber® transparentes (7.7 X 3.5 cm), cuyo contenido era un medio MS suplementado con 0.4 mg L-1 de ácido indol butírico (AIB). Encada uno de ellos se dispusieron cuatro brotes, los cuales permanecieron durante cuatro semanas hasta formar las raíces e incrementar su longitud a 8 cm. Las plantas se aclimataron dentro del invernadero en macetas de 1 L, con una mezcla de agrolita, turba y vermiculita, en una proporción de 1:2:1 al 70% de sombra durante tres semanas.
Variables evaluadas
Las variables consideradas fueron el número de explantes con respuesta positiva para la formación de brotes y los brotes por explante generados durante cuatro semanas de incubación. Se determinó la acumulación de materia seca por tratamiento a partir del peso de las muestras obtenido en una balanza analítica de 110 a 310 g Ohaus Discovery®, después de 48 horas de secado a 72 °C. La evaluación del área foliar se realizó mediante el escaneo del total de hojas formadas junto con un objeto de referencia de 1 cm2, para ser analizadas con el programa UTHSCSA (2002).
Análisis estadístico
El diseño experimental fue un factorial completamente al azar con un solo medio de cultivo y dos reguladores diferentes de crecimiento con tres (ANA) y cuatro (BA) niveles de concentración. Al existir condiciones ambientales controladas, la variación de las repuestas se originó por esto último. La unidad experimental fue el explante, a razón de 20 por caja de Petri, con cuatro de ellas por tratamiento. Los datos se examinaron a través del análisis de varianza, mientras que la comparación de medias fue con la prueba de Duncan utilizando el paquete estadístico Statistical Analysis System (SAS 9.2), 2009.
Resultados y Discusión
Formación de brotes
Se detectaron respuestas diferenciales en los tratamientos de tejidos según el tipo de explante y medio de cultivo, después de cuatro semanas; no obstante, se generaron brotes adventicios en todos los tejidos, a excepción del testigo, donde no se observó respuesta alguna organogénica (Cuadro 1). Resultados similares fueron descritos por Bergmann y Moon (1997) en la valoración de hojas y tallos.
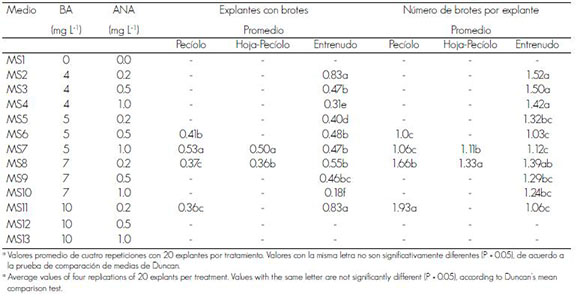
Cuadro 1. Efecto de diferentes combinaciones de reguladores de crecimiento en la formación de brotes de tres tipos de explantes de Paulownia elongata, después de cuatro semanas de cultivo.
Table 1. Effect of the different combinations of growth regulators in bud formation of three explant types of Paulownia elongata after four weeks of cultivation.
El mayor número de explantes con brote se originó de los segmentos internodales (83%) en el medio MS2, seguido por los de pecíolo y de hoja en el MS7, con 53 y 50%, porcentajes similares a los obtenidos en el medio MS11; sin embargo, la concentración de benciladenina fue de 10 mg L-1, es decir, el doble de lo contenido en el MS7. Al respecto, Ipecki y Gozukirmizi (2004) generaron callo embriogénico a partir de segmentos internodales de P. elongata; de ahí que se infiera que este tipo de tejido tiene posibilidades para utilizarse en el sistema de regeneración por embriogénesis y organogénesis directa.
La formación de brotes por explante se alcanzó con el tratamiento MS2 en segmentos internodales, cuyo promedio fue el mayor (1.52); no obstante, cifras cercanas (1.24) se lograron en presencia de concentraciones altas de BA, como las del medio MS10. Los valores de pecíolos y hojas fueron menores y se generaron en el medio MS8, con 7 mg L-1 de BA y 0.2mg L-1 de ANA. Así, para los primeros se formó 37% de explantes con brotes y 1.66 de brotes por explante, mientras que para los segundos, 36% y 1.33.
Los resultados señalan que, para la organogénesis directa, los segmentos internodales probaron ser el tejido ideal, cuando se busca esta ruta, y que el medio que produjo la mejor respuesta de promedio de explantes con brote, fue el mismo que originó el mayor número de brotes por explante, que en el caso de los internodales fue el tratamiento MS2 y para los de pecíolo y foliares, el MS7. Aun cuando todos los tipos de tejido evaluados lograron formar brotes, se observó una preeminencia de los segmentos internodales (Figura 1, A-G).
Figura 1. Regeneración de brotes de Paulownia elongata a partir de diferentes tipos de explantes. (A) = Segmentos foliares; (B) = Segmentos de hoja y-pecíolo; (C) = Segmentos de pecíolo; (D) = Segmentos internodales de tallo; (E) = Brotes desarrollados; (F) = Brotes en medio de enraizamiento; (G) = Plantas adaptadas; (H) = Hojas disectadas y escaneadas para medición de área foliar por análisis de imágenes.
Figure 1. Bud regeneration of Paulownia elongata from different types of explants. (A) = Foliar segments; (B) = Leave and petiole segments; (C) = Petiole segments; (D) = Internode stem segments; (E) = Developed buds; (F) = Buds in a rooting medium; (G) = Adapted plants; (H) = Dissected and scanned leaves for foliar area measurement by image analysis.
Este comportamiento también se ha observado en especies como neem (Azardirachta indica A. Juss), con la cual se ensayaron diferentes tipos de tejido y órganos procedentes de plántulas producidas por semilla (segmentos de cotiledón, hipocotilo, epicotilo, raíces y entrenudos) como explantes para iniciar su micropropagación. Al final se obtuvo una respuesta diferencial en cada órgano evaluado para la formación de los brotes (Neeta et al., 2001).
Al comparar los resultados de la organogénesis directa con los de la embriogénesis somática, en los que se utilizaron segmentos foliares e internodales como explantes iniciales, los primeros fueron los mejores en Paulownia elongata (Ipecki y Gozukirmizi, 2004); en cuanto a P. fortunei y P. tomentosa, Fan et al. (2001) presentaron una inducción de callo favorable en este tipo de tejidos.
Otra forma de producir plantas in vitro a gran escala es a través del uso de yemas apicales para la proliferación de yemas axilares en sistemas de micropropagación clonal, método que se ha comprobado en P. fortunei (Venkateswarlu et al., 2001) y P. elongata (Ipecki et al., 2001). Sin embargo, no se parte de una respuesta de organogénesis directa, lo que se considera inadecuado cuando se pretende establecer sistemas de transformación genética que requieren la formación de brotes a partir de tejidos usados para ese fin (Mohri et al., 2003).
Medición del área foliar y peso seco
La mayor área foliar se generó a partir de segmentos de pecíolo en el medio MS6 (Cuadro 2), ya que al lograrse un bajo número de brotes por explante, la competencia por el medio disminuyó y los brotes crecieron de forma más vigorosa y sin limitaciones dentro de los recipientes, lo cual favoreció el desarrollo del sistema foliar. Dicha respuesta es importante para los interesados en los sistemas fotoautotróficos, donde el área foliar es un componente necesario (Kozai y Kubota, 2001).
Cuadro 2. Respuesta diferencial del área foliar medida por análisis de imágenes en cm2 y de materia seca en diferentes explantes de Paulownia elongata.
Table 2. Differential response of the foliar area measured by image analysis in cm2 and dry matter in different explants of Paulownia elongata.
El tipo de recipiente utilizado puede estar involucrado en estas respuestas, como lo indican estudios con otras especies forestales tropicales micropropagadas en lo que se demuestra la posible interacción entre el tipo de envase y el desarrollo de las plántulas: en aquellos de espacio reducido, se presenta mayor competencia por la luz y los nutrimentos del medio (Kozai y Nguyen, 2003).
a Valores promedio de cuatro repeticiones con 20 explantes por tratamiento. Valores acompañados de la misma letra no son significativamente diferentes con una P = 0.05 de acuerdo a la prueba de comparación de medias de Duncan.
a Average values of four replications of 20 explants per treatment. Values with the same letter are not significantly different (P = 0.05), according to Duncan's mean comparison test.
Los tratamientos que registtraron un menor número de brotes por explante formaron los brotes más vigorosos y, por lo tanto, una mayor acumulación de materia seca. Esto se observa en los brotes del medio MS8 para segmentos internodales, en el MS7 para los foliares y en el MS6 para los de pecíolo. Lo anterior sugiere que cuando el objetivo es incrementar la biomasa, se debe reducir la competencia; con ello se favorece una mayor extracción de compuestos derivados del incremento en la biomasa obtenida en este tipo de sistemas (Shrutika et al., 2005; Jain et al., 2005).
Otros estudios también han demostrado la influencia de los tipos de explante y recipiente, así como del medio empleado para la micropropagación, lo cual tiene un efecto directo en la generación de biomasa y en consecuencia del área foliar (Islam et al., 2005).
Conclusiones
Se determinó un protocolo para la regeneración in vitro de Paulownia elongata vía organogénesis directa, a partir de segmentos internodales de tallo con una combinación de 4mg L-1 BA y 0.2mg L-1 ANA.
La combinación de BA y ANA en concentraciones altas permite generar brotes de tejidos como pecíolo y hojas, con menores tasas de multiplicación.
Los resultados que aquí se documentan pueden usarse como base para la obtención de brotes derivados de pequeños segmentos de tejidos susceptibles de utilizarse en los procesos de transformación genética.
Referencias
Bergmann, B. A. and H. K. Moon. 1997. In vitro adventitious shoot production in Paulownia. Plant Cell Rep. 16(5): 315-318. [ Links ]
Fan, G., Z. Xiao Q., Z. Cui J. and B. Hui T. 2001. Callus induction from leaves of different Paulownia species and its plantlet regeneration. Journal of Forestry Research. 12 (4):209-214. [ Links ]
Ipecki, Z., A. Atinkut, K. Kazan, K. Bajrovic and N. Gozukirmizi. 2001. High frequency plant regeneration from nodal explants of Paulownia elongata. Plant Biol. 3(2):113-115. [ Links ]
Ipecki, Z. and N. Gozukirmizi. 2004. Indirect somatic embryogenesis and plant regeneration from leaf and internodal explants of Paulownia elongata. Plant Cell Tissue and Organ Culture. 79(3):341-345. [ Links ]
Islam, M. T., D. P. Dembele and E. R. J. Keller. 2005. Influence of explant, temperature and different culture vessels on in vitro culture for germ plasm maintenance of four mint accessions. Plant Cell Tissue Organ Cult. 81 (2):123-130. [ Links ]
Jain, A. K., P. K. Dubek and A. C. Rana. 2005. In vitro callus induction and biomass production of Catharanthus roseus. Plant Archives 5 (1):55-60. [ Links ]
Kozai, T. and C. Kubota. 2001. Developing a photoautotrophic micropropagation system for wo ody plants. Journal of Plant Research. 114 (1116):525-537. [ Links ]
Kozai, T. and Q. T. Nguyen. 2003. Photoautotrophic micropropagation of woody and tropical plants. Kluwer Academic Publishers. Dordrecht, The Netherlands. 271p. [ Links ]
Melhuish, J. H., C. E Gentry and P. R. Beckjord. 1990. Paulownia tomentosa seedling growth at different levels of pH, nitrogen and phosphorus. Journal of Environmental Horticulture. 8(4):205-207. [ Links ]
Mohri, T., T. Igasaki and K. Shinohara. 2003. Agrobacterium-mediated transformation of paulownia (Paulownia fortunei). Plant Biotechnology. 20 (1):87-91. [ Links ]
Murashige, I. and F. Skoog. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Phys. Plant 15:473-497. [ Links ]
Neeta, D., H. Singh, S. Tivarekar and S. Eapen. 2001. Plant regeneration from different explants of neem. Plant Cell, Tissue and Organ Culture. 65(2):159-162. [ Links ]
Rao, P. S. and V. A. Bapat. 1992. Micropropagation of Sandalwood (Santalum album L.). In: Bajaj, Y. P. S. (ed.). Biotechnology in Agriculture and Forestry. Springer-Verlag, Berlin, Heidelberg, Germany. pp. 193-210. [ Links ]
Rout, G. R., G. M. Reddy and P. Das. 2001. Studies on in vitro clonal propagation of Paulownia tomentosa Steud and evaluation of genetic fidelity through RAPD marker. Silvae Genetica. 50:208-212. [ Links ]
Sharma, S. K., S. Charan and R. C. Dihman. 2003. Regeneration and multiplication of Paulownia fortunei (CO20 clone) through shoot tip culture. Indian Journal of Soil Conservation. 31:276-280. [ Links ]
Shrutika, D., T. R. Ganapathi, S. Bhargava and V. A. Bapat. 2005. Induction of hairy roots in Gmelina arborea Roxb and production of verbascoside in hairy roots. Plant Science 169 (5):812-818. [ Links ]
Song, S. L., T. Sato, K. Ishii, A. Saito and K. Ohba. 1990. In vitro mass propagation by meristem culture of two mature trees of Paulownia catalpifolia. Journal of the Japanese Forestry Society. 72 (6):495-498. [ Links ]
Song, S. L., K. Suda, K. Ishii, A. Saito and K. Ohba. 1991. Plantlet regeneration from leaf and petiole explants of in vitro cultured Paulownia catalpifolia. Journal of the Japanese Forestry Society. 73 (1):60-63. [ Links ]
Statistical Analysis System (SAS). 2009. (Versión 9.2) Raleigh, NC USA s/p. [ Links ]
Tang, R. C., S. P Carpenter, R. F Wittwer and P. H. Graves. 1980. Paulownia, a crop tree for wood products and reclamation of surface mind land. Journal of Applied Forestry 4:19-24. [ Links ]
University of Texas Health Science Center at San Antonio Image Tool (UTHSCSA Image Tool). 2000. The University of Texas Health Science Center at San Antonio. San Antonio TX USA. s/p. (http://compdent.uthscsa.edu/dig). (enero de 2010). [ Links ]
Venkateswarlu, B., J. Mukhopadhyay, E. Sreenivasan and V. M. Kumar. 2001. Micropropagation of Paulownia fortunei through in vitro axillary shoot proliferation. Indian Journal of Experimental Biology. 39 (6):594-599. [ Links ]
Wang, Q. and J. F. Shogren. 1992. Characteristics of the crop-Paulownia system in China. Agriculture, Ecosystems and Environment. 39:145-152. [ Links ]
Zhu, Z. H., C. J. Chao, X. Y. Lu and D. Y. Xiong. 1986. Paulownia in China: cultivation and utilization. Asian Network of Biological Sciences. International Development Research Cente. Singapore. pp.1-65. [ Links ]