Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias forestales
versión impresa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.2 no.5 México may./jun. 2011
Ensayo
El cambio climático y el estado simbiótico de los árboles del bosque
Climatic change and the symbiotic state of the forest trees
María Valdés Ramírez1
1 Escuela Nacional de Ciencias Biológicas, IPN. Correo-e: mvaldesr@ipn.mx
Fecha de recepción: 28 de febrero de 2011
Fecha de aceptación: 25 de marzo 2011
Resumen
El acuerdo unánime mundial para reducir las emisiones de los gases de efecto invernadero hacia la atmósfera conduce a considerar las formas de contribuir con bases científicas para ello. El Programa Especial de Cambio Climático de México indica que 30% puede lograrse evitando la deforestación y la degradación de los bosques y la recuperación de áreas forestales. Diferentes ecosistemas terrestres capturan carbono a través de las plantas y del suelo. La biomasa microbiana en la rizosfera es hasta 10 veces mayor que la del suelo; estos microorganismos transforman la materia orgánica en humus, que es el carbono más estable. La biomasa de la raíz es muy superior en presencia de simbiontes (hongos ectomicorrízicos y micorrízico-arbusculares, bacterias fijadoras de nitrógeno); estos hongos en la raíz de las plantas son fundamentales para la biodiversidad y el ecosistema. El elevado CO2 y O3 atmosféricos afectan la simbiosis de los árboles así como el ciclo del nitrógeno alterado (exceso), la temperatura y precipitación modificadas, las especies invasivas y los fitopatógenos. Los factores en el cambio global interactúan e inciden en la micorriza, directa e indirectamente. Tienen efecto sobre la biota edáfica, al impactar la composición de la comunidad de los hongos micorrízicos, las bacterias estimuladoras de la micorrización, las plantas que actúan como reservorio de los simbiontes, la invasión de plantas no micorrizógenas, etc. Las micorrizas son clave en la interfase planta-suelo y por su influencia en la fisiología de la planta y sus comunidades, deben incluirse en los estudios ecológicos de cambio climático.
Palabras clave: Cambio climático, captura de carbono, deforestación, efecto invernadero, ectomicorriza, hongos micorrízicos.
ABSTRACT
The unanimous world agreement to reduce the greenhouse effect gas emissions to the atmosphere leads to consider the forms to contribute to the above mentioned labor with scientific arguments. Mexico's Special Program for Climatic Change points out that 30% could succeed with the prevention of deforestation and woodland degradation and the recovery of forest areas. Different terrestrial ecosystems have the ability to sequestrate carbon through plants and soil. The microbial biomass in the rhizosphere is up to 10 times higher than that of soil; these microorganisms transform the organic matter into humus, which is the most stable C. Root biomass is higher with the presence of symbiotic microorganisms (ectomycorrhizal, arbuscural-mycorrhyzal, nitrogen-fixing); root symbiotic fungi are a main factor in maintaining the biodiversity and the ecosystem. High CO2 and atmospheric O3, affect symbiosis of trees as well as the altered nitrogen cycle (excess), temperature and modified precipitation, invasive species and the phytophatogens presence. The factors that participate in global change interact and have an impact on the mycorrhiza, direct and indirectly. They have an effect upon edaphic biota, as they impact the composition of the mycorryzal fungi community, on the stimulating bacteria of mycorrhization, on the plants that act as reservoir for symbionts, the invasion of non-mycorryzal plants, etc. Mycorrhiza are crucial in the soil - plant interphase, and by their influence in plant physiology and their communities, they must be included in the ecological studies about climate change.
Key words: Climatic change, carbon sequestration, deforestation, greenhouse effect, ectomhicorrizae, micorrhizal fungi.
INTRODUCCIÓN
A pesar del gran fracaso de la cumbre de Copenhague para detener el incremento de las emisiones a la atmósfera de los gases de efecto invernadero, destaca el acuerdo unánime para iniciar, cuanto antes, los esfuerzos para reducir estas emisiones por deforestación y degradación de los bosques del planeta.
Los bosques de México son el eje central del diseño institucional que debe enfrentar el país para hacer frente a sus compromisos sobre el cambio climático. Para ello, el Programa Especial de México sobre 2009-2012 (PECC) presentado en Copenhague, estima que 30% de la reducción de las emisiones de CO2 puede lograrse si se evitan la deforestación, la degradación de los bosques y se alcanza la recuperación de las áreas forestales. Desgraciadamente, la primera etapa de este Programa (2008 al 2012) sólo contempla una "evaluación de la vulnerabilidad del país por sectores y regiones, así como la valoración económica de las medidas prioritarias" (SEMARNAT, 2009).
Diferentes ecosistemas terrestres tienen la capacidad de llevar a cabo el secuestro de carbono a través de las plantas y del suelo. Parte importante de un ecosistema en este sentido (lignina, celulosa, etc.) es la mitad escondida de las plantas, la raíz. Este órgano desempeña un papel fundamental en la conservación y restauración del suelo a través de la retención del mismo y de la estimulación de la formación de grandes masas microbianas con diferentes funciones (oxidaciones, reducciones, mineralizaciones, síntesis de glomalina, formación de humus, etc.).
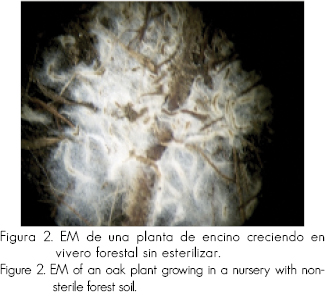
La biomasa microbiana en la rizosfera de las plantas es hasta 10 veces superior a la del suelo y son los microorganismos los que transforman a la materia orgánica en humus, que es el C más estable. Además, la biomasa de la raíz es mucho mayor en presencia de microorganismos simbiontes (hongos ectomicorrízicos, micorrízico-arbusculares, fijadores de nitrógeno) los que, además de proveerles nutrientes y agua, tienen impactos no nutricionales sobre las plantas, como capacidad para excluir iones tóxicos, influencia sobre la fotosíntesis y actividad hidráulica de la planta y control de patógenos (como base al aumento de idoneidad). La micorriza no solo tiene importancia en la alimentación de la planta, sino va más allá de la absorción haciendo mayores contribuciones en su aptitud de adaptación a diferentes condiciones edáficas y como requisito para completar el ciclo de vida de las plantas (Read, 1997), sino también en la formación y mantenimiento de la estructura del suelo, crucial para la infiltración de agua, procesos de reciclaje de nutrientes y resistencia contra la erosión del suelo (Read, 1998). Las figuras 1 y 2 muestra las ectomicorrizas (EM) de una plántula de pino y una planta de encino respectivamente, donde se ilustra la razón de los enunciados anteriores.


El funcionamiento y estabilidad de los ecosistemas terrestres están determinados por la biodiversidad de las plantas y la composición de las especies (Van der Heijden et al., 1998) y se ha demostrado que los hongos simbiontes de la raíz de las plantas son un factor principal para mantener la biodiversidad y el funcionamiento del ecosistema (Tilman and Downing, 1994; Klironomos et al., 2000).
Los cambios globales no ocurren aislados y son multifactoriales (Vitousek, 1994). El cambio climático incluye una gama completa de procesos naturales acelerados por actividades antropogénicas en el ambiente del planeta.
Los cambios por actividades humanas que más afectan la simbiosis de los árboles son el elevado CO2 y O3 atmosféricos, el ciclo del nitrógeno (exceso), la temperatura y la precipitación alterados, las especies invasivas y la invasión de fitopatógenos (Rilling et al., 2003). Los factores presentes en el cambio global interactúan entre sí y afectan la micorriza directa e indirectamente a través de la planta (Figura 4).
Ozono
El O3 troposférico es un contaminante del aire mayor que tiene efectos adversos en el crecimiento y salud de las plantas (Sandermann, 1996). El daño por ozono en las coníferas de México se ha visto en Pinus hartwegii Lindl. en el Ajusco, D. F. y en el Parque Desierto de los Leones (Bauer y Hernández, 1986; Bauer y Krupa, 1990). Las reducciones continuas de la capa protectora de ozono del planeta debidas a actividades humanas conducirá seguramente a incrementos en radiación ultravioleta que produce fuertes consecuencias en los organismos vivos puesto que se absorbe por moléculas como las proteínas y los ácidos nucleicos afectando así a las plantas y sus interacciones ecológicas (Caldwell et al., 1989; Rousseaux et al ., 1998).
CO2
La liberación de CO2 a la atmósfera es uno de los factores del cambio climático más estudiado. Los hongos micorrízicos (microorganismos heterótrofos) que reciben su carbono de las plantas, están muy influenciados por los niveles incrementados de CO2. Estos s niveles altos han favorecido incrementos en la producción de micelio externo en algunas simbiosis entre hongos EM y ciertas especies de pinos, lo que se puede explicar por una mayor trasferencia de carbono por parte de la planta al haber aumentado su fotosíntesis. Varios estudios confirman una interacción significativa micorriza-CO2; por ejemplo, la altura de plántulas de Quercus robur L. no micorrizado se aumenta en un 26% cuando el CO2 está al doble de lo normal y un 56% cuando está micorrizado por Laccaria lacata (Scop.) Cooke (Sigmuller y Renenberg, 1994) Las plántulas de Pinus silvestris L. responden de una manera diferente en términos de biomasa radical y razón tallo-raíz según el hongo que forma su micorriza, ya sea Suillus bovinus (L: Fr.) O. Kuntze o Laccaria bicolor (Maire) P.D. Orson (Gorissen y Kuyper, 2000).
Exceso de N
La toma de nitrógeno del suelo por las plantas se lleva a cabo por intermediación de los hongos micorrízicos, por lo que la respuesta de los mismos ha sido tema de varios artículos de revisión y estudios recientes (Vitousek et al ., 1997). Se sabe que la relación carbohidratos-nitrógeno afecta la formación de los cuerpos fructíferos, micelio externo y raicillas finas (sitio de formación de las micorrizas) (Wallander, 1995), por lo que si esta razón baja la formación de ectomicorriza puede bajar también. La producción de cuerpos fructíferos de los hongos ectomicorrízicos en Europa ha bajado en Europa y se supone que es debido en parte por el exceso de nitrógeno en el suelo del bosque. Se sabe desde 1983 que el hongo ectomicorrízico Cenococcum geophilum Fr. de distribución mundial y un hongo dominante en muchos bosques, disminuye la formación de micorrizas cuando a las plántulas se le adiciona NH4 SO4 (Alexander y Farley, 1983).
Temperatura
Se ha demostrado que la ectomicorrización de plántulas de Piloderma croceum J. Erikss. et Hjortstam por Paxillus involutus (Batsch) Fr. se afecta significativamente por cambios en la temperatura (Erland y Finlay, 1992). Las altas temperaturas del suelo en lugares que fueron minas influye en el establecimiento y subsecuente desarrollo tanto de las plantas como de los hongos; las especies de hongos EM Scleroderma spp y Pisolithus arhizus (Scop.) Rauschert son excelentes colonizadores radicales bajo estas condiciones y se supone que esta capacidad está ligada a su tolerancia a las altas temperaturas (Danielson, 1985).
En este sentido las temperaturas elevadas por el fuego son un factor de disturbio importante en la comunidad de hongos EM. En un estudio de la aplicación de diferentes métodos silvícolas con un tratamiento con fuego en rodales de pino, se mostró que la abundancia fúngica fue poco afectada, pero la composición de la especies fue diferente; los cuerpos fructíferos de Laccaria laccata, Lactarius crysorrheus Fr., Russula emetica (Schaeff.) Pers. y Cenoccocum geophilum fueron abundantes en todos los rodales, lo que sugiere que estas especies son tolerantes a los disturbios (fuego) causados por estas prácticas silvícolas. Sin embargo, L. laccata y L. chrysorrheus se encontraron solo en el interior de la raíces de los pinos del rodal tratado con fuego (Valdés et al ., 2009).
Precipitación alterada
En un estudio conducido con el objeto de conocer el efecto del fenómeno El Niño sobre las raicillas finas y el estado simbiótico de los pinos bajo gradientes de disturbio originados por diferentes métodos silvícolas (Árboles Padre y Árboles Padre más Fuego) para regeneración del pino en los bosques de pino-encino de Ixtlán de Juárez, Oaxaca, México, se mostró una reducción de las raicillas finas de los pinos (<2 μ) y de las raíces ectomicorrizadas de 60% en el año de El Niño (año seco). Las estaciones seca y húmeda no mostraron diferencia estadística significativa (Valdés et al ., 2006) (Cuadro 1).
Especies vegetales invasivas
Los cambios globales en los bosques ocasionados por las actividades antropogénicas pueden conducir al establecimiento de especies invasivas que romperían el equilibrio del ecosistema.
En algunas ocasiones el disturbio ocasionado por la apertura del dosel favorece el desarrollo de arbustos actinorrízicos fijadores de nitrógeno como Ceanothus coeruleus Lag y Cercocarpus macrophyllum C. K. Schneid. (Valdes et al., 2003). Este hecho confirma el papel de las plantas actinorrízicas como pioneras en las primeras etapas de la sucesión vegetal después de diferentes disturbios (Dawson, 1990).
Invasión de fitopatógenos
Otro factor importante cuando hay disturbio que afecta la salud de los árboles es la invasión por fitopatógenos. En áreas donde los árboles han sido cortados como parte del manejo del bosque, las plántulas de pino son afectados por el hongo fitopatógeno Armillaria mellea (Vahl.:Fr.) Karsten, conduciéndolas con frecuencia a su muerte. Este hongo frecuentemente mata árboles estresados por sequía, por insectos, por patógenos o por condiciones ambientales desfavorables; también, bajo ciertas circunstancias, puede incluso conducir a árboles vigorosos a la muerte (USDA Forest Service, 1979). El daño causado por esta especie ocasiona una enfermedad severa sobre todo en plantaciones (Morrison, 1981). Una gran población del hongo parásito A. mellea fue detectada en rodales de pino con tratamiento silvícola con y sin fuego; ninguno en la parcela testigo. El número de ejemplares de este hongo fue de más del doble en la parcela tratada con fuego que en la parcela tratada sin él (Valdés et al., 2004) (Cuadro 2, Figura 5).

El estudio de las respuestas al cambio climático de la simbiosis micorrízica tiene que enfrentarse a un reto adicional, pues se trata de dos tipos de organismos que viven en una asociación estrecha con una biología parcialmente independiente. Por otro lado, además de la interacción microorganismo-planta, hay que considerar la interacción de la simbiosis con el ecosistema suelo como es la modificación del pH, de la temperatura, de nutrientes y contenido de humedad.
Los factores del cambio climático que tienen repercusiones sobre los otros habitantes del suelo potencialmente pueden tener efectos indirectos en la composición de la comunidad de los hongos micorrízicos como son otros habitantes de las raíces (también benéficos), bacterias estimuladoras de la micorrización, la desaparición de plantas que actúan como reservorio de los simbiontes, la invasión de plantas no micorrizógenas, etc.
Las micorrizas tienen un papel clave dada su ubicación en la interfase planta-suelo y debido a su influencia en la fisiología de la planta y en las comunidades vegetales deben tomarse en cuenta en los estudios del impacto del cambio climático sobre los ecosistemas. En el manejo de las prácticas forestales se deberían considerar los efectos del cambio climático, por ejemplo, en la reducción de las especies de pino para mantener suficientes niveles de ectomicorriza que puedan conducir a una mejor salud y resiliencia de los bosques y de esta manera disminuir su vulnerabilidad al estrés producido por las actividades antropogénicas.
Javier Nava Vega (2007). San Nicolas Totolapan, Delegación Magdalena Contreras, D.F.
REFERENCIAS
Alexander, I. J. and R. I. Fairley. 1983. Effect of N fertilization on fine roots and mycorrhizas in spruce humus. Plant Soil 71:49-53. [ Links ]
Bauer, L. I. de y T. Hernández T. 1986. Contaminación: una amenaza para la vegetación en México. Colegio de Postgraduados. Montecillo, Edo. de Méx., México. 78 p. [ Links ]
Bauer, L. I. de and S. V. Krupa. 1990. The Valley of Mexico: Summary of observation studies on its air quality. Environ. Pollut. 65: 100-118. [ Links ]
Caldwell, M. M., A. H. Teramura and M. Tevini. 1989. The changing solar ultraviolet climate and the ecological consequences for higher plants. Trends Ecol. Evol. 4:363-367. [ Links ]
Danielson, R. M. 1985. Mycorrhizae and reclamation of stressed terrestrial environments. In : L. T. Robert and D. A. Klein (Eds.). Soil reclamation processes. Decker. New York, NY. USA. pp 173-201. [ Links ]
Dawson, J.O. 1990. Interactions among actinorrhizal and associated plant species. In Schwintzer, C.R. and J.D.Tjepkema (Eds.). The biology of Frankia and actinorrhizal plants. Academic Press. San Diego, CA USA. pp 299-316. [ Links ]
Erland, S. and R. D. Finlay. 1992. Effects of temperature and incubation time on the ability of three ecto-mycorrhizal fungi to colonize Pinus silvestris roots. Mycol. Res. 96:270-272. [ Links ]
Gorissen, A. and T. W. Kuyper. 2000. Fungal species-specific responses to ectomycorrhizal Scots pine ( Pinus silvestris ) to elevated [CO2]. New Phytol. 146:163-168. [ Links ]
Klironomos, J. N., J. McCune, M. Hart and J. Neville. 2000. The influence of arbuscular micorrizae on the relationship between plant diversity and productivity. Ecology Letters 3:137-141. [ Links ]
Morrison, D. J.1981. Armillaria Root Disease: A guide to disease diagnosis development and management in British Columbia, Victoria, BC. Canada. 15p. [ Links ]
Read, D. J. 1991. The role of the mycorrhizal symbiosis in the nutrition of plant communities. In : Ecophysiology of ectomycorrhizas of forest trees. Symposium Proc. Marcus Wallenberg Foundation. Stockholm, Sweden. pp. 27-53. [ Links ]
Read, D. J. 1997. The ties that bind. Nature 388:517-518. [ Links ]
Read, D. J. 1998. Mycorrhiza-the State of the Art. In : A.Varma and B. Hock (Eds.). Mycorrhiza: structure, function, molecular biology and biotechnology. Springer, Berlin, Heidelberg, New York. NY. USA. pp. 3-34. [ Links ]
Rilling, M. C., K. K. Treseder, M. F. Allen. 2003. Global change and mycorrhizal fungi. In: M.G.A. Van der Heijden and I. Sanders (Eds.). Mycorrizal Ecology. Springer-Verlag, Heidelberg. pp. 135-160. [ Links ]
Rousseaux, M. C., C. L. Ballare, A. L. Scopel, P. S. Searles, M. M. Caldwell. 1998. Sola ultraviolet B radiation affects plant insect interactions in a natural ecosystem of Tierra del Fuego (Southern Argentina). Oecologia 116:528-535. [ Links ]
Sandermann, H. 1996. Ozone and plant health. Annu. Rev. Phytopathol. 34:347-366. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales, SEMARNAT. 2009. PECC. Dirección General de Políticas de Cambio Climático [ Links ]
Tilman, D. and J. A. Downing. 1994. Biodiversity and stability in grasslands. Nature 367:363-365. [ Links ]
United States Department of Agriculture Forest Service. 1979. A guide to common insects and diseases of forest trees in Northeastern United States. Broomall, PA. USA. 127 p. [ Links ]
Valdés, M., J. Córdova, R. Valenzuela and A. M. Fierros. 2003. Understory vegetation and ectomycorrhizal sporocarp diversity response to pine regeneration methods in Oaxaca, Mexico. Western Journal of Applied Forestry. 18(2): 101-108. [ Links ]
Valdés, M., J. Córdova, R. Valenzuela, A. M. Fierros. 2004. Incremento del fitopatógeno Armillaria mellea (Vahl.: Fr.) Karsten en bosque de pino-encino, en relación al grado de disturbio por tratamiento silvícola. Rev Chapingo Serie: Ciencias Forestales y del Ambiente 10: 99-103. [ Links ]
Valdés, M., H. Asbjornsen, M. Gómez-Cárdenas, M. Juárez and K. Vogt.2006. Drought effect on fine-root and ectomycorrhizal-root biomass in managed Pinus oaxacana Mirov stands in Oaxaca, Mexico. Mycorrhiza 16:117-124. [ Links ]
Valdés, M., V. Pereda, P. Ramírez, R. Valenzuela and R. M. Pineda. 2009. The ectomycorrhizal community in a Pinus oaxacana forest under different silvicultural treatment. Journal of Trop. For. Sci. 21:88-97. [ Links ]
Van der Heijden, M. G. A., J. N. Klironomos, M. Ursic, P. Moutoglis, R. Streitwolf-Engel, T. Boller, A. Wiermken and I. R. Sanders. 1998. Mycorrhizal fungi diversity determines plant biodiversity, ecosystem variability and productivity. Nature 396:69-72. [ Links ]
Vitouseck, P. M. 1994. Beyond global warming. Ecology and global change. Ecology 75:1851-1876. [ Links ]
Vitousek, P. M., J. D. Aber, R. W. Howarth, G. E. Likens, P. A. Matson, D. W. Shindler, W. H. Schlesinger and D. G. Timan. 1997. Human alteration of the global nitrogen cycle: sources and consequences. Ecol. Appl. 7:737-759. [ Links ]
Wallander, H. 1995. A new hypothesis to explain allocation of dry matter between mycorrhizal fungi and pine seedlings in relation to nutrient supply. Plant Soil 169:243-248. [ Links ]














