Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias forestales
versão impressa ISSN 2007-1132
Rev. mex. de cienc. forestales vol.1 no.2 México Jul./Dez. 2010
Artículo
Inoculación de plántulas de pinos con diferentes hongos e identificación visual de la ectomicorriza
Pine seedling inoculation with different fungi and visual identification of ectomycorrhizae
María Valdés Ramírez1, Enrique Ambriz Parra1, Alejandro Camacho Vera2 y Aurelio M. Fierros González3
1 Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, IPN.
2 Departamento de Biología, Escuela Nacional de Ciencias Biológicas, IPN.
3 Programa Forestal, Colegio de Postgraduados. Correo-e: mvaldesr@ipn.mx
Fecha de recepción: 08 de marzo de 2010
Fecha de aceptación: 19 de octubre de 2010
Resumen
Dada la necesidad de reforestar grandes áreas del territorio nacional y de contar con microorganismos capaces de inducir el buen crecimiento de los pinos, se desarrolló un ensayo que utiliza un método sencillo de inoculación y de evaluación visual de las ectomicorrizas. Se trabajó con Pinus devoniana y P. pseudostrobus. Los hongos estudiados fueron Pisolithus tinctorius 202 (cepa española), P. tinctorius (PHC) y Scleroderma texense (nativo) La identificación de las micorrizas se logró por el color y forma de las mismas. A los seis meses de la inoculación, las tres especies fúngicas mostraron buena capacidad colonizadora en los dos taxa de Pinus probados; además presentaron una buena formación de micelio externo. Bajo las condiciones experimentales, S. texense fue más invasiva de la raíz. En esta etapa temprana tanto P. devoniana , como P. pseudostrobus al inocularse con S. texense tuvieron significativamente mayor biomasa de la parte aérea que las plantas testigo ( p < 0.05), pero sin diferencias significativas en el volumen. Un año después (a 18 meses de la inoculación), se observó un volumen grande en Pinus devoniana con la de P. tinctorius 202, en tanto que S. texense incidió en el aumento de biomasa con relación a P. tinctorius (PHC) y su impacto en el peso seco de las plantas. En P. pseudostrobus los valores más altos de volumen y biomasa se registraron con P. tinctorius (PHC). En la segunda fase, la colonización micorrícica ya no fue dominada por S. texense y se identificaron otros hongos externos en el sistema radical.
Palabras clave: Ectomicorriza, identificación visual, Pinus devoniana , Pinus pseudostrobus , Pisolithus , Scleroderma .
Abstract
From the urgent need for reforestation of large areas of our country and to find out microorganisms able to stimulate the growth of pines, this study was conducted using a practical inoculation method to allow an easy recognition of ectomycorrhizal colonization by nursery workers. Pinus devoniana and P. pseudostrobus were the tree species used in this experiment. The ectmycorrhizal fungi were Pisolithus tinctorius 202 (a Spanish isolate), P. tinctorius (PHC) and Scleroderma texense (native fungus). Identification of fungi based on form and color was easy Six months after the inoculation the three fungi showed good root colonization; they formed visible external mycelium in both pine species tested. Under the assayed conditions Scleroderma texense appeared as a good root colonizer. At this early stage of growth the dry weight of both P. devoniana and P. pseudostrobus treated with S. texense was significantly different compared to control plants ( p < 0.05); with no statistical differences on volume. After 18 months of inoculation, statistical analysis indicated that the volume of Pinus devoniana inoculated with P. tinctorius 2002 was significantly higher compared to other treatments; plants treated with P. tinctoriu s 202 and with S. texense were different to P tinctorius (commercial strain) in terms of dry matter of the plant. In this stage of seedling growth, root colonization was no longer dominated by S.texense; roots were also colonized by other fungi occurring in the nursery soil.
Key words: Ectomycorrhizae, visual identification, Pinus devoniana , Pinus pseudostrobus , Pisolithus , Scleroderma .
INTRODUCCIÓN
El territorio nacional presenta erosión debido a la alta tasa de deforestación existente entre 75,000 y casi 2 millones de hectáreas por año (Velásquez et al ., 2002), lo que pone en riesgo la biodiversidad de México. Aunado a esto, en los bosques del área metropolitana se observa tal deterioro, que los importantes servicios ambientales que brindan a una de las concentraciones urbanas más grandes y complejas del mundo están muy amenazados, por lo que es prioritario conocer alternativas que permitan contribuir a su restauración, sin perjudicar el medio ambiente.
En la naturaleza la regla es que todas las plantas viven asociadas con hongos cuyo resultado es una nueva estructura llamada micorriza. Diversas especies de Pinus se usan tradicionalmente en programas de reforestación y de regeneración; sin embargo, su establecimiento ha fallado porque en este proceso y durante su crecimiento son dependientes de la ectomicorriza (EM), aún en las condiciones extremas de reforestación, en particular, en sitios con largos períodos de sequía.
Las EM mejoran el estado fisiológico de los fitobiontes a través de un incremento de la absorción de agua y de nutrimentos (Vogt et al., 1998; Read, 1999), pues el micelio que se extiende por el suelo se convierte en un órgano de absorción que llega a tener dimensiones con una razón raíz:micelio de 1:105; también juegan un papel importante en la protección de la planta contra factores ambientales adversos como: sequía, presencia de patógenos y de metales pesados, entre otros (Read, 1992).
Las EM difieren en sus capacidades para transporte así como la absorción de nutrimentos para promover el crecimiento del árbol asociado (Burgess et al., 1994), habilidades que se relacionan con la colonización radical y con el desarrollo del mismo hongo hacia el suelo; es decir, más allá de la raíz (Thomson et al., 1994). En otras palabras, hay especies como Suillus bovinus (L ex Fr.) que pueden formar hifas de hasta 200 m g-1 de suelo seco, en bosques (Read, 1991). Este micelio varía en su organización; Schram (1966) observó rizomorfos del micelio de Pisolithus tinctorius Mich.: Pers interconectando plántulas de pino a una distancia de 42 cm.
Otras funciones del micelio externo son también la de incrementar el volumen de suelo explorado; además de contribuir a la colonización de las raicillas en proceso de formación (Read, 1992, Schram, 1966).
Desde hace tiempo se sabe que el retraso en el establecimiento de las micorrizas o su carencia en la planta producida en los viveros conducen a obtener plántulas enanas y deficientes en nutrimentos (Trappe y Strand, 1969), o en una baja supervivencia durante la repoblación de áreas sin árboles y en la recuperación de sitios marginales (Marx, 1980). Además, los componentes del substrato que se usan en los contenedores, con frecuencia adolecen de propágulos viables de hongos EM. Así mismo, los individuos que crecen en medios con niveles nutrimentales altos, es común que tengan una generación errática y deficiente de EM (Castellano y Molina, 1989).
Esto significa que las plántulas de pino sin micorrizar, aún en substratos artificiales, crecen bien, si se les abastece con suficiente agua y nutrimentos, pero después de que son plantadas, su capacidad para absorber dichos materiales del suelo que les permitan satisfacer las demandas de crecimiento y transpiración, es menor. Las plantas con EM están en mejores condiciones para iniciar la exploración del suelo y por lo tanto, tienen más oportunidades de sobrevivir exitosamente en los sitios de reforestación (Kropp y Langlois, 1990).
La preselección de los hongos EM es una etapa crítica para el establecimiento de programas de inoculación en vivero, los cuales aseguran que las plantas de los contenedores tengan un buen desarrollo. La elección se basa en las diferencias fisiológicas y ecológicas de las especies fúngicas e incluso entre cepas (Marx et al., 1992). Los criterios que se utilizan son los siguientes: a) compatibilidad simbiótica hongo-planta, b) adaptabilidad del hongo EM al sitio de trasplante, c) capacidad del hongo para competir con otros hongos presentes en el vivero y en el sitio de trasplante y, d) facilidad de producción del inóculo.
El inóculo esporal es muy usado por su fácil aplicación y por la gran cantidad de esporas que existen en los esporomas de los hongos; algunos de ellos son particularmente ricos en este tipo de propágulos como Pisolithus y Scleroderma . Además, no se requiere de un cultivo puro (cuyo proceso necesita de varios meses en el laboratorio) y las esporas toleran períodos largos de almacenamiento (Rincón et al. 2001). Aunado a esto, en diferentes taxa han mostrado ser un inóculo eficiente (Marx, 1980; Parladé et al. , 1996; Rincón et al., 2001). También se ha tenido éxito cuando se aplica en plantaciones de coníferas a raíz desnuda (Castellano y Trappe, 1985; Marx 1991).
En este ensayo, se propuso usar el inóculo esporal de dos taxa EM comunes en los bosques de México, que forman abundantes esporas y que son eficientes en la formación de micorrizas con varias especies de pino producidas en contenedores de viveros (Marx, 1991; Parladé et al. , 1996; Rincón et al., 2001). Así mismo, se han considerado en programas de reforestación con otros árboles y en suelos con diversas condiciones de estrés (Valdés, 1986), incluso en suelos salinos (Chen et al., 2001). El objetivo fue generar información que conduzca a un método sencillo de inoculación y de identificación visual de la EM a partir de hongos capaces de promover un buen crecimiento de los pinos en su etapa inicial.
Las especies de pino estudiadas son de crecimiento rápido, Pinus devoniana Lindl. y P. pseudostrobus Lindl.
MATERIALES Y MÉTODOS
Se montó un ensayo con Pinus devoniana y P. pseudostrobus que fueron seleccionadas por la Comisión Nacional Forestal (CONAFOR), misma que proporcionó la semilla y se utilizaron con tres hongos ectomicorrícicos de diferente procedencia. En la primera etapa, de seis meses de duración, el material vegetal se mantuvo en cámara de crecimiento y en la segunda, 12 meses adicionales, se continuó el proceso en vivero. Las plántulas de pino se inocularon individualmente con cada uno de los taxa fúngicos y se dejaron individuos sin inocular, como testigos.
Producción de inóculo
Los hongos EM con los que se trabajó fueron Pisolithus tinctorius 202 Mich.: Pers, P. tinctorius comercial (PHC) y Scleroderma texense Berk, los que se seleccionaron porque producen ectomicorrizas muy definidas que se distinguen fácilmente por su color.
Las esporas de la primera cepa fueron donadas por el Dr. Xavier Parladé del Instituto de Investigación y Tecnología Agroalimentarios de Barcelona, España. El inoculante comercial, lo donó la compañía PHC. Los esporomas de S. texense se recolectaron en un bosque de pino-encino de la localidad Cañadas de Nanchititla, municipio Tejupilco, Estado de México.
El inóculo se hizo a base de esporas de los tres Sclerodermatáceos. Los inoculantes se prepararon con vermiculita como sustrato, con base en la característica hidrófoba de las esporas. Los esporomas de S. texense se tamizaron en una malla de 0.5 mm para liberar las esporas, su número se cuantificó con una cámara cuadriculada de Petroff-Hausser. Un gramo de P. tinctorius (Pt) tuvo 16x108 y uno de Scleroderma (St) 5x108 (Rincón et al. , 2001).
Inoculación y condiciones de cultivo.
Se utilizaron contenedores de 175 mL y el substrato consistió en una mezcla de turba:vermiculita (grado 2), v: v, el cual se esterilizó en autoclave durante 60 min a 120°C y su pH se ajustó a 5.5. Las esporas se colocaron en el substrato en cantidades de 107 de Pt y de 106 de St. La cantidad de inoculante comercial se definió de acuerdo a las indicaciones del fabricante, que consistió en 106 esporas.
Las semillas de los pinos se lavaron por 12 h con agua corriente, se desinfectaron con H2O2 por 30 min y se escarificaron por 30 días a 5°C. Se pusieron dos semillas en cada contenedor y después de la germinación se dejó una sola plántula, lo que dio un total de 50 individuos por tratamiento; de ellos, se evaluaron 20 en cada etapa de crecimiento.
En la primera fase del ensayo, el material vegetal se colocó en una cámara de crecimiento a una temperatura de 25-30°C y 50% de humedad relativa (HR), con 16 h de fotoperíodo. El riego se aplicó cuando fue necesario y se fertilizó cada tres semanas con 10 mL/plántula con una solución de 17N-6P-17K. La segunda fase se llevó a cabo en condiciones de vivero.
Evaluación del crecimiento.
Después de seis meses de la inoculación, se determinaron las siguientes variables de la parte aérea y radical de las plántulas: volumen (D2H) (Ruehle et al., 1984) y biomasa total. Para ello se seleccionaron al azar y se cosecharon 20 plántulas de cada tratamiento. Para obtener la biomasa se secaron las raíces y los tallos de cada planta a 60ºC durante 48 h. El diámetro de la corona se midió con un calibrador electrónico digital marca Truper.
Evaluación de la micorrización
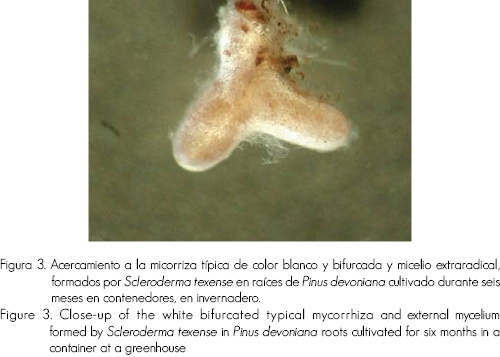
Se identificó el tipo de micorriza de acuerdo a su morfología y color. Las especies fúngicas inoculadas se distinguen por el color de la EM que forman: la de Pt (PHC) es color ámbar, la cepa Pt 202 color amarillo y St color blanco. En estos tres casos la EM es bifurcada y coraloide.
En la primera etapa de crecimiento las variables de la raíz, volumen y número de bifurcaciones, se evaluaron con el sistema WinRhizo (Régent Instruments Inc., Canadá). A los 18 meses de edad, se hizo visualmente.
A todos los datos se les aplicó un análisis de varianza y las diferencias entre los tratamientos se obtuvieron con la prueba de rango múltiple de Ryan-Einot-Gabriel-Welsh (Schlotzhauer y Littell, 1987).
RESULTADOS Y DISCUSIÓN
El inóculo esporal probado fue efectivo para la micorrización de plántulas de Pinus devoniana y P. pseudostrobus . La gran cantidad de esporas que pueden obtenerse de un basidioma y la facilidad de uso de este tipo de inóculo hacen que el método propuesto sea apropiado para la inoculación en gran escala de plántulas en contenedores, lo cual coincide con lo planteado por Brundrett et al . (1996).
A los seis meses de la inoculación
El hongo nativo S. texense se mostró como un colonizador agresivo de las raíces de los pinos en esta etapa del crecimiento, cubrió las raíces de plántulas de otros tratamientos, aún aquellos en los que no se utilizó esta especie, incluso los individuos testigo. Su micelio es blanco y extensivo (Figura 1); en tanto que, la micorriza presenta ramificaciones bifurcadas y blancas ( figuras 2 y 3).


La micorriza formada por P. tinctorius 202 es de color amarillo canario (Figura 4) y la de P. tinctorius (PHC) amarillo ámbar (Figura 5).


Los hongos inoculados mostraron ser compatibles con los pinos en estudio. En algunos casos las plántulas de este tipo de coníferas responden a la inoculación durante los primeros meses de su desarrollo con tasas bajas de crecimiento, atribuidas a la gran demanda de carbohidratos del hongo (Stenström y Ek, 1990). Sin embargo, en el presente experimento se produjo una significativa mayor cantidad de biomasa en relación a las plántulas testigo. Tanto para P. devoniana , como para P. pseudostrobus con la aplicación de S. texense se obtuvieron diferencias estadísticas con respecto a las plantas no inoculadas; las plantas de las dos especies de Pinus en las que se usó P. tinctorius (PHC) fueron diferentes a las inoculadas con S. texense. No se observaron diferencias significantivas en cuanto al volumen de las plántulas (Cuadro 1).
Las variables de la raíz, volumen y bifurcaciones no tuvieron diferencias significativas en ninguno de los tratamientos (Cuadro 2).
A los 18 meses de la inoculación
S. texense dejó de ser el colonizador dominante en las raíces de los pinos. Se determinaron diferencias estadísticas significativas en las variables de crecimiento tanto en volumen, como en peso seco de la parte aérea. El mayor volumen de Pinus devoniana se logró con P. tinctorius (202) y el valor superior de biomasa se registró con P. tinctoriu s (202) y S. texense (Cuadro 3)
Los datos analizados de las plantas inoculadas de P. pseudostrobus mostraron diferencias significativas en volumen y biomasa. Los valores más altos se obtuvieron cuando se inocularon con P. tinctorius (PCH) (Cuadro 3).
De las tres especies de hongos ensayadas, S. texense tuvo una gran capacidad de colonización de las raíces, con incrementos en el desarrollo de las plántulas de los dos taxa de Pinus en su primera etapa. Se ha visto que algunos aislamientos de Scleroderma son competitivos ante los hongos micorrízicos nativos presentes en contenedores de vivero (Long Chen et al., 2006), además de ser efectivos con diferentes especies de pinos (Parladé et al ., 1996).
En la segunda etapa de crecimiento, a los 18 meses de edad, las plantas de P. devoniana inoculadas con P. tinctoriu s (202) y S. texense produjeron la mayor biomasa; mientras que las de P. pseudostrobus incrementaron su volumen y la biomasa con P. tinctorius (PHC). Lo anterior sugiere la importancia de seleccionar los hongos ectomicorrícicos en función de las especies de pinos.
CONCLUSIONES
Las tres especies de hongos ectomicorrícicos formaron ectomicorrizas en P. devoniana y P. pseudostrobus . La identificación de las mismas fue fácil, a partir de su diferente color y forma.
Se observó la gran capacidad colonizadora de S. texense , en la primera etapa de crecimiento de los pinos. Los efectos de la micorrización parecen acrecentarse conforme aumenta la edad de las plántulas y es mayor en las características aéreas de las mismas, que en las de las raíces.
AGRADECIMIENTOS
Este trabajo fue llevado a cabo con fondos del Proyecto CONAFOR "Inoculación y persistencia de hongos micorrízicos inoculados a pinos, con fines de reforestación" y del Proyecto IPN 20061576.
REFERENCIAS
Brundrett, M., N. Bougher, B. Dell, T. Grove and N. Malajcsuk. 1996. Working with mycorrhizas in forestry and agriculture. ACIAR Monograph 32, Canberra, Australia. 374 p. [ Links ]
Burgess, T. I., B. Dell and N. Malajcsuk. 1994. Variation in mycorrhizal development and growth stimulation by 20 isolates inoculated on to Eucalyptus grandis. New Phytol. 127:731-739. [ Links ]
Castellano, M. A. and J. M. Trappe. 1985. Ectomycorrhizal formation and plantation performance of Douglas fir nursery stock inoculated with Rhizopogon spores. Can. J. For. Res.15:613-617. [ Links ]
Castellano, M. A. and R. Molina. 1989. Mycorrhizas. In : The container tree manual. The biological component: nursery pests and mycorrhizas. USDA Forest Service Handbook 674. Washington, DC. USA. pp:101-167 [ Links ]
Chen, D. M., S. Ellul, K. Herdman and J. W. G. Cairney. 2001. Influence of salinity on biomass production by Australian Pisolithus spp. isolates. Mycorrhiza 11:231-236. [ Links ]
Kropp, B. R. and C. G. Langlois. 1990. Ectomycorrhizas in reforestation. Can. J. For. Res. 20:438-451. [ Links ]
Long Chen, Y., L. Hua Kang, N. Malajczuc and B. Dell. 2006. Selecting ectomycorrhizal fungi for inoculating plantations in South China: effect of Scleroderma on colonization and growth of exotic Eucaliptus globulus, E. urophyla, and Pinus radiata . Mycorrhiza 16:251-259. [ Links ]
Marx, D. H. 1980. Ectomycorrhizal fungus inoculation practices: a tool for improving forestation practices. In: P. Mykola (Ed.). Tropical Mycorrhiza Research. Oxford University Press. London, UK. pp. 13-71. [ Links ]
Marx, D. H. 1991. The practical significance of ectomycorrhizas in forest establishment. In : Ecophysiology of ectomycorrhizas of forest trees. Symposium Proc. Marcus Wallenberg Foundation. Stocolm, Sweden. pp: 54-90. [ Links ]
Marx, D. H., S. B. Maul and C. E. Cordell. 1992. Application of specific ectomycorrhizal fungi in world forestry. In : Leatham. G. F. (Ed.) Frontiers in industrial mycology. Chapman and Hall,. New York, pp 78-98. [ Links ]
Parladé, J., J. Pêra and I. Alvarez. 1996. Inoculation of containerized Pseudotsuga menziesii and Pinus pinaster seedlings with spores of five species of ectomycorrhizal fungi. Mycorrhiza 6:237-245. [ Links ]
Read, D. J. 1991. The role of the mycorrhizal symbiosis in the nutrition of plant communities. In : Ecophysiology of ectomycorrhizas of forest trees. Symposium Proc. Marcus Wallenberg Foundation. Estocolmo, Suecia. pp. 27-53. [ Links ]
Read, D. J. 1999. Mycorrhiza: the state of the art. In : Varma A. and B. Hock (Eds.). Mycorrhiza. Structure, Function, Molecular Biology and Biotechnology. Springer-Verlag, Berlin, Heidelberg. New York, NY. USA. pp. 3-34. [ Links ]
Rincón, A., I. Alvarez and J. Pera. 2001. Inoculation of containerized Pinus pinea seedlings with seven ectomycorrhizal fungi. Mycorrhiza 11:265-277. [ Links ]
Ruehle, J. L., D. H. Marx and H. D. Muse. 1984. Calculated nondestructive indices of growth response for young pine seedlings. For. Sci. 30:469-474. [ Links ]
Schlotzhauer, S. D. and R. C. Littell. 1987. SAS System for Elementary Statistical Analysis. SAS Institute Inc. Cary, NC. USA. pp. 232-242. [ Links ]
Schram, J. M. 1966. Plant colonization studies on black wastes from anthracite mining in Pennsylvania. Trans. Am. Philos. Soc. 56:1-194. [ Links ]
Strentröm, E. and M. Ek. 1990. Field growth of Pinus silvestris following nursery inoculation with mycorrhizal fungi. Can. J. For. Res. 20:914-918. [ Links ]
Thomson, B. D., T. S. Grove, N. Malajcsu and G. E. S. Hardy. 1994. The effectiveness of ectomycorrhizal fungi increasing the growth of Eucalyptus globulus in relation of root colonization and hyphal development in soil. New Phytol. 125:516-524. [ Links ]
Trappe, J. M. and R. F. Strand, 1969. Mycorrhizal deficiency in a Douglas-fir region nursery. For. Sc. 15:381Vogt, K., H. Asbjornsen, A. Ercelawn, [ Links ]
Valdés, M. 1986. Survival and growth of pines with specific ectomycorrhizae after three years on a highly eroded site. Can. J. Bot. 64:885-888. [ Links ]
Velázquez, A., J. F. Mass, J. R. Díaz-Gallegos, R. Mayorga-Saucedo, P. C. Alcántara, R. Castro, T. Fernández, G. Bocco, E. Ezcurra y J. L. Palacio. 2002. Patrones y tasas de cambio de uso del suelo en México. INE, Gaceta Ecológica 62:21-37. [ Links ]
Vogt, K., H. Asbjornsen, A. Ercelawn, F. Montagnini and M. Valdés. 1998. Roots and mycorrhizas in plantation ecosystems. In: Nambiar S. and A. Brown (Eds.). Soil, water and nutrients in tropical plantation forests. ACIAR/CSIRO Publications. Canberra, Australia. pp. 247- 296. [ Links ]














