Introducción
Dentro de la familia de las fabáceas, las plantas arvenses conocidas como maleza tienen un enorme valor en los sistemas agrícolas, por la capacidad para asociarse simbióticamente con bacterias que fijan nitrógeno1,2, lo que se convierte en un abastecimiento de N y un mejoramiento de la calidad suelo, además de propiciar la producción de forrajes más ricos en proteína3, entre estas especies se encuentra la alfalfilla o melilotus de olor o color4. Se reportan para México tres especies de Melilotus5, donde la especie Melilotus indica (L.) es la de mayor adaptación o más común como maleza en todo el mundo, en ambientes rústicos como climas templados, además, se desarrolla en áreas moderadamente salinas, donde las leguminosas forrajeras tradicionales no se pueden cultivar exitosamente6,7. Esta maleza es clasificada en la familia de las fabáceas8, su crecimiento es muy común y puede estar presente en los cultivos como trigo, tomate, soya, sorgo, remolacha, nopal, manzana, maíz, lino, garbanzo, frutales, fríjol, espárrago, cítricos, chícharo, centeno, cebada, cártamo, calabaza, avena, algodón, alfalfa, uva y ajo6. El crecimiento de M. indica asociado a ciertos cultivos se le considera peligroso, como en el trigo, ya que es común la presencia de cumarina en casi todas las partes de la planta, lo que hace que se transmita al cereal el olor característico de la misma, a los granos de éste y posteriormente a la harina8. Por esta razón se le considera en la agricultura como maleza nociva. También en esta especie pueden encontrarse semillas como cuerpos extraños en semilla de alfalfa, lino y muchos otros cereales, lo que limita su consumo directo. Por otra parte, la fijación de N por microorganismos del suelo tiene una función importante en la agricultura, ya que puede sustituir o reducir el uso de los fertilizantes químicos de alto costo económico, disminuir la contaminación en el medio ambiente, prevenir pérdidas de la fertilidad del suelo y mejorar los costos de producción. La simbiosis leguminosa-Sinorhizobium ofrece una oportunidad para la biorremediación, así como el mejoramiento y fertilización de suelos sobreexplotados en zonas agrícolas y pecuarias9. La recuperación de semillas de Melilotus y el aislamiento de las bacterias asociadas a esta leguminosa, pudieran beneficiar la posibilidad de regenerar la calidad de los suelos esquilmados o erosionados, al sembrar en ellos esta planta de M. indica inoculada con la bacteria Sinorhizobium meliloti fijadora de nitrógeno. Por lo que este documento presenta una revisión general de la especie de Melilotus spp. y su simbionte Sinorhizobium meliloti como un posible potencial mejorador de la calidad del suelo.
Origen y distribución
El género Melilotus, en la familia de las leguminosas o fabaceaes, incluye diferentes especies, generalmente conocidos como tréboles de olor7. Su origen se encuentra en Europa y Asia10. Durante la conquista se dispersó y adaptó abundantemente en América y Australia, aunque actualmente tiene distribución cosmopolita. Se señala que en México5, en la mayoría de los estados se registra como maleza y se considera como una planta exótica, siendo la especie Melilotus indica (L.) la más ampliamente distribuida8 en comparación con las otras dos especies presentes (M. albus y M. officinalis). Se ha registrado en Aguascalientes, Baja California Norte, Baja California Sur, Distrito Federal, Oaxaca, Querétaro, Sinaloa, Sonora, Tlaxcala, Veracruz, Durango, Guanajuato, Hidalgo, Jalisco, Estado de México, Michoacán, Morelos, Nuevo León, Chiapas, Chihuahua, Coahuila y Colima11.
Características botánicas
La especie Melilotus indica se caracteriza como una planta herbácea, anual o bianual, erecta muy ramificada de 30 a 50 cm de altura con raíz pivotante, con hojas compuestas, trifoliadas, muy similares a las de la tradicional alfalfa, margen ligeramente dentado; con tamaño variable de 1 a 2 cm de largo por 3 a 5 cm de ancho, ápice obtuso o redondeado y base atenuada. Presenta un tallo con estípulas lanceoladas. Inflorescencia dispuesta en racimos de 30 a 70 y flores pequeñas de 3 a 5 mm de largo con pedicelos muy cortos, con corola amarilla o blanca de 1-3 mm de largo, en racimos delgados (Figura 1), que parten de la axila de las hojas superiores y son más largos que éstas, con el estandarte más largo que los otros pétalos, y un grupo de 10 estambres distribuidos en 9 que forman haz y otro libre12,13.

Figura 1 Inflorescencia de dos especies de meliloto en color amarillo (Melilotus indica) y blanco (M. albus)
El fruto es una legumbre subglobosa, de unos 3 mm, apiculada, sin pubescencia, verde amarillento, con arrugas transversales, que contiene una o dos semillas lisas, amarillentas de 1.5 mm de diámetro y superficie globosa (Figura 2). Generalmente la floración ocurre en mayo y puede perdurar todo el verano. La planta posee un sabor ligeramente amargo; cuando se seca emite un intenso aroma a a cumarina13.
En estado de plántula se caracteriza por presentar hipocótilo de 11 a 42 mm, verdoso, liso y cotiledones de lámina oblonga a elíptica de 4 a 8 mm de largo y 2 a 4 mm de ancho, sin pubescencia y sin epicótilo. Hojas alternas, la primera simple y la segunda compuesta (Figura 3).
Taxonomía de Melilotus indicus
La especie Melilotus indicus (L.) All. se ubica en la siguiente taxa: Clase: Equisetopsida; Subclase: Magnoliidae; Superorden: Rosanae; Orden: Fabales; Familia: Fabaceae; Género: Melilotus (L.) Mill; Especie: indicus [Melilotus indicus (L.) All.]. Otros sinónimos dados a la especie son: Sertula indica (L.) Kuntze y Sertula melilotus var. indica (L.) Lunell8.
Generalidades, impacto e importancia de Melilotus indicus sobre los cultivos
Las especies de Melilotus son no deseables, consideradas como malezas cuando crecen junto con el cultivo de cereales, de crecimiento anual, principalmente en ambientes silvestres de climas templados14, dado a la producción de cumarina que le confiere un aroma característico, y de allí la gran diversidad de nombres que se le da como alfalfilla o meliloto de flor pequeña, trébol menor, meliloto oloroso, trébol oloroso, coronilla real, trébol dulce amarillo, coronilla angosta de rey, carretón oloroso15. Además, se señala que esta especie puede considerársele como buena planta forrajera16, así como buena fuente vegetal para la producción e incorporación como abono verde. Se señala también que puede ser una buena opción para el mejoramiento y nitrogenación de suelos, ya que tiene la capacidad para realizar asociaciones simbióticas de manera natural con microorganismos fijadores de nitrógeno.
Por la presencia de cumarina, que se transmite como un olor característico a los cereales o granos y que posteriormente se transmite a la harina durante la molienda, las plantas de Melilotus spp. se le incluye en el listado como maleza (Figura 4), la cual es indeseable encontrarla entre las semillas destinadas al consumo humano, y debido a esta razón se ha declarado como maleza en muchos países incluyendo México, donde es considerada como exótica11.

Campo Experimental “El Bajío”. Universidad Autónoma Agraria Antonio Narro en Buenavista, Saltillo, Coahuila, México
Figura 4 Plantas de cultivo de alfalfilla y su asociación con el cultivo de maíz
Se ha reportado que el contenido de cumarina entre diferentes especies de Melilotus es variable, tanto entre variedades, ecotipos e individuos de la misma especie17. Esta presencia de cumarina varía también a lo largo del ciclo de crecimiento de la planta, donde se menciona que su presencia es máxima en hojas nuevas o yemas, o como respuesta a estrés por plagas y enfermedades (factores bióticos) así como por salinidad, alcalinidad, deficiencias nutricionales en el suelo, etc. (factores abióticos)18. Su relevancia también se debe a su capacidad que tiene para fijar nitrógeno atmosférico simbióticamente, lo que permite ser un almacén proteico, lo cual es otro factor importante que permite su elección como forraje; además, permite disminuir los costos de producción al disminuir el uso por el laboreo de aplicación y compra de fertilizantes, lo que conlleva a una mejora de las propiedades químicas del suelo.
Importancia biológica y ecológica de Melilotus
Las especies pertenecientes al género Melilotus recientemente han recibido particular atención debido a su uso ante la necesidad de una gama más amplia de especies de leguminosas adecuadas para suelos salinos19,20. Se han liberado cultivares que han mostrado potencial considerable tal como Melilotus albus cultivar Jota Medik21. El potencial de M. siculus (Turra) Vitman ex B. D. Jacks. (Sin M. messanensis) como especie forrajera también se ha sido descrito como cultivar22,23.
Como ya se mencionó, Melilotus spp. contribuye indirectamente al proceso de la nutrición de las plantas cultivadas al permitir la simbiosis o asociación con rizobacterias permitiendo ese aprovechamiento en gran medida por la fijación benéfica del nitrógeno atmosférico, además de promover una mayor solubilidad y conductividad de nutrientes24. Esta fijación biológica de nitrógeno es dada por la conversión enzimática de nitrógeno gaseoso a amonio; que es una característica de todos los procariontes, y muy específicamente de los géneros de rizobacterias fijadoras libres de nitrógeno y asociadas a leguminosas25, como lo es el grupo de las especies del género Sinorhizobium que se asocian en su mayoría a leguminosas26.
La relación simbiótica formada por la especie vegetal Medicago sativa y la bacteria benéfica Sinorhizobium meliloti, es un modelo de referencia para conocer y explorar los mecanismos que interactúan en la expresión molecular, a través de los cuales se desarrolla la simbiosis entre leguminosas-rizobios, y cómo estos son regulados, permitiendo sentar las bases para abordar la manipulación y el mejoramiento de las simbiosis con propósitos prácticos en un sentido agroeconómico27.
Relación de Sinorhizobium y Melilotus
Bajo condiciones naturales ocurre una relación simbiótica muy específica entre la especie del género Sinorhizobium que se caracteriza por formar nódulos en algunas leguminosas, estableciéndose dentro sus raíces donde proliferan, se diferencian y fijan nitrógeno28. En este sentido una relación muy específica en simbiosis es dado entre plantas de Melilotus y el género Sinorhizobium meliloti26,29,30, tal y como se muestra en la Figura 5. Actualmente hay descripción escasa de plantas del tipo leguminosas asociadas a un mayor número de especies simbióticas al nitrógeno24.

Figura 5 Plantas de melilotos con nódulos característicos de la bacteria Sinorhizobium bajo condiciones naturales creciendo como maleza silvestre
La asimilación N se lleva a cabo por un proceso enzimático donde ocurre un cambio de nitrógeno atmosférico a amonio. Este proceso es una característica primordial de las procariontes, y se encuentra distribuido en diferentes géneros de bacterias que tienen la misma capacidad para fijar N de forma natural25. Generalmente una incorporación artificial de nitrógeno como fertilizante químico inhibe la formación de los nódulos y la fijación de nitrógeno atmosférico en plantas con presencia de nódulos. Se menciona que el proceso de fijación de nitrógeno es muy costoso energéticamente31. La fijación atmosférica de nitrógeno contribuye anualmente con unos 90 millones de toneladas para cultivos de leguminosas como la soya, el trébol rojo y los guisantes30.
La interacción entre la planta y bacteria se inicia con la señalización o síntesis en las raíces y exudación de flavonoides, que son señales químicas de reconocimiento entre ambos organismos32. Los compuestos de manera fenólica inician la expresión en las bacterias de los genes involucrados en el proceso nodulación, lo que le permite la síntesis y secreción de lipoquitinas llamadas factores de nodulación32,33,34, que al interactuar en la raíz originan en la planta cambios morfológicos acorde al tipo de leguminosa35. La bacteria una vez que invade las células de las raíces de la planta, proliferan y se diferencian como bacteroides (Figura 6), que son los responsables de la fijación de nitrógeno al interior de la célula; dichos bacteroides están englobados por una membrana peribacteroidea de origen vegetal, lo que constituyen un nuevo orgánulo llamado simbiosoma. La planta contribuye con hidratos de carbono al bacteroide para su metabolismo a través del floema y, el bacteroide por su parte aporta amonio a la planta en forma de diferentes aminoácidos36,37. Una verificación de la morfología celular permite observar los bacteroides existentes dentro de las células radiculares y característicos de esta bacteria. Esta forma de bacteroide es debido a la falta de una forma definida (Figura 6), ya que carecen de una pared celular, por lo tanto, son considerados amorfos38.
Características de Sinorhizobium meliloti
Las características de esta bacteria son de forma bacilar, pertenecen al grupo de las Gram negativas, no forma esporas, es heterótrofa y aerobia. La bacteria S. meliloti es muy capaz de prosperar tanto en un medio complejo y competitivo como en la rizósfera, así como intracelularmente una vez instituida la asociación. Por su complejo y gran tamaño de genoma hace que este microorganismo sea de gran versatilidad, que le confiere una gran capacidad metabólica con ventajas para colonizar distintos nichos en la naturaleza39. Generalmente, la célula bacteriana de Sinorhizobium tiene dimensiones entre 0.5-1.0 x 1.2-3.0 µm, con presencia de plásmidos grandes (megaplásmidos) muy común en estas especies, donde se localizan genes simbióticos en algunos casos40. Su uso en sistemas agrícolas aportaría beneficios como: la disminución de costos de la producción al reducir el uso de los fertilizantes químicos, aumento de producción agrícola, además contribuye a la remediación de los suelos sobreexplotados, alcalinos o con bajo contenido de materia orgánica41.
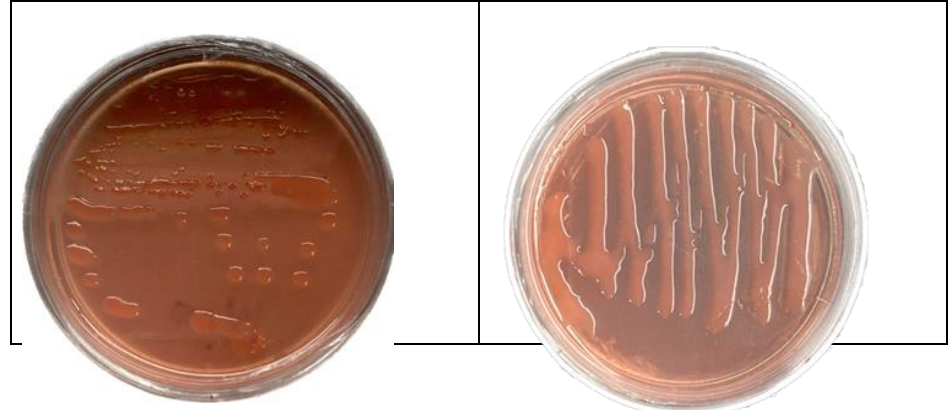
Cuando se desea aislar S. meliloti, se deben colectar nódulos que generalmente son color rojizo, lo que indica que contiene leghemoglobina y presentes en las raíces secundarias de las plantas de alfalfilla, lavarlos con agua y jabón, así como desinfectarlos con cloro y hacerles varios lavados con agua destilada esteril, para posteriormente macerar el nódulo en un tubo estéril y del líquido resultante sembrar al medio de cultivo a travéz de una asa bacteriológica. Para este propósito es frecuente usar el medio de crecimiento a base de Agar Manitol con Extracto de levadura-Rojo Congo e incubarse a 28 °C por dos días hasta observar el crecimiento rojo de las colonias típicas del género. Posteriormente, se purifica por estría en el mismo medio de cultivo hasta obtener colonias aisladas en el cultivo24. La característica principal de las colonias de esta bacteria en agar manitol es del tipo mucoide con una elevación y bordes lisos (Figura 7). Ciertas pruebas ayudan a identificar mejor a la bacteria como la prueba de tinción Gram que deber ser negativa (-), presencia de flagelos, producción de polisacárido (KOH) positiva, crecimiento en cloruro de sodio positivo, producción de indol positivo y crecimiento a pH ácido positivo42.
Diversidad de rhizobacterias simbióticas de nitrógeno
Como grupo las rhizobacterias son muy diversas en cuanto a géneros, especies y de acuerdo a relaciones filogenéticas moleculares. Se señala que incluye seis géneros (Allorhizobium 1 , Azorhizobium 2 , Bradyrhizobium 3 , Mesorhizobium 4 , Rhizobium 5 y Sinorhizobium 6) cada uno con distintas especies, y especies vegetales objetivo, como se describe a continuación en el Cuadro 1 43,44,45.
Cuadro 1 Bacterias fijadoras de nitrógeno y sus especies asociadas
| Rhizobacterias | Cultivo | Rhizobacterias | Cultivo | ||
|---|---|---|---|---|---|
| Género | Especie | Género | Especie | ||
| Allorhizobium | undicola | Neptunia natans | Azorhizobium | caulinodans |
Sesbania rostrata |
| Bradyrhizobium |
Japonicum elkanii liaoningense yuanmingense |
Glycine max Glycine max Glycine max Lespedeza |
Rhizobium |
hainanense hautiense leguminosarum mongolense tropici |
Sesbania herbacea Vicia (chícharo)/ Trifolium (trébol) Medicago ruthenica/ phaseolus vulgaris Phaseolus vulgaris/ Leucaena Neptunia natans |
| Mesorhizobium |
Loti amorphae cicero huakuii mediterraneum plurifarium |
Lotus Amorpha fructicosa Cicer arietinum Astragalus C. mediterranium Leucaena |
Sinorhizobium |
arboris fredii kostiens medicae meliloti saheli terangae xinjiangense |
Acacia senegal/ proposis chilensis Glycinev max Acacia senegal/ Prosopis chilensis Medicago spp Medicago sativa sesbania Sesbania/ Acacia Glicine max |
Respuesta de melilotos a la nodulación
Bioensayos realizados bajo condiciones de invernadero para determinar la eficiencia de formación de nódulos, mostraron que al sembrar semilla de meliloto inoculada con Sinorhizobium meliloti, esta última indujo la formación de nódulos en su mayoría de forma cilíndrica y ramificada (Figura 8), características representativas de los nódulos simbióticos de S. meliloti40. Se reporta que Sinorhizobium meliloti induce la formación de nódulos rosáceos en las plantas de Melilotus spp. generadas a través de semilla, tanto condiciones en macetas como de forma natural46.
Algunas características agroecológicas de plantas de melilotos
Las alfalfillas o melilotos pueden desarrollarse en suelos salitrosos12 pobres en materia orgánica, con pH alcalino en temperaturas desde de templadas a frías, donde se han observado que en algunos áreas de frío ocasional o irregular, soportan temperaturas de al menos 0 oC y logran crecer normalmente durante el inverno en temperaturas menores a los 15 oC, por lo que hace a esta planta de intéres agrómico para la remediación de suelo durante las épocas de invierno. Es una maleza muy competente, logra desarrollarse favorablemente entre las plantas y fructificar antes o después de la formación de frutos de los cultivos, particularmente sobresale en los cultivos de ajo, cebolla, maíz, avena, sorgo y trigo (Figura 9).
Fijación de nitrógeno por Melilotus spp
En términos generales la mayoría de los rizobios que de manera simbiótica en los nódulos de las plantas de la familia Fabaceae, fijan el N2 atmosférico en cantidades de hasta 200 kg ha-1 año-1 de N47, bajo condiciones específicas en cuanto a temperatura, pH, humedad, contenido de N-inorgánico, Fe, Co, Mo y P en el suelo. Entre los géneros más conocidos con esta función están: Azospirillum, Bacillus, Beijerinckia, Azotobacter y Pseudomona. Se reporta la fijación de N2 por bacterias de vida libre en praderas asociadas de ballico (Lolium perenne) y Melilotus albus e inoculación con Rhizobium meliloti (Sinorhizobium meliloti) un contenido similar de N2, tanto en la pradera bajo corte como pastoreo48. Así mismo señalan que la densidad de plantas modifica la cantidad de fijación, siendo mayor en corte, ya que el pastoreo reduce la persistencia de la leguminosa en la pradera. Estos autores reportan una actividad de la nitrogenasa entre 1.83 y 1.36 nmol de C2H4 producidos planta-1 h-1, respectivamente. Al Sherif6, señala que M. indicus es una especie con alto porcentaje de nodulación (68-95 %) y alta actividad nitrogenasa, en promedio 1.81 mmol C2H4 planta-1 h-1 y alto contenido de proteína (21-30 %); concluye que el alto porcentaje de nodulación y una actividad nitrogenada registrada en las plantas de M. indicus da a la especie importancia económica, ya que se puede utilizar para mejorar la fertilidad del suelo. El sistema simbiótico rizobio-leguminosa requiere que no haya limitantes minerales, ya sea por exceso o defecto. Altas concentraciones de nitratos inhiben el proceso de infección, el desarrollo de los nódulos y la expresión de la actividad de la nitrogenasa. A mayor presencia de N en el suelo, menores posibilidades hay para la Fijación Biológica de Nitrógeno (FBN) y, a la inversa, a menor presencia de N del suelo, hay más N de la FBN. La presencia de formas combinadas de nitrógeno limita la FBN. Los suelos fértiles con moderada o alta disponibilidad de formas inorgánicas de N en el momento de la siembra, o importantes tasas de mineralización durante el ciclo del cultivo, afectan al establecimiento de la simbiosis, ya que retardan el inicio de la nodulación o inhiben el funcionamiento del sistema fijador.
Formas de incorporación de Nitrógeno
a) Incorporación como abono verde. El uso de abonos verdes es una práctica que contrarresta los efectos negativos del manejo de suelo inadecuado. Algunos autores49 incorporaron melilotos por un periodo de cuatro años sucesivos, encontrando mejoras en el suelo, como es aumento de la materia organica (MO) que pasó de 0.32 a 0.69 %. Así mismo, Fontana et al50 incorporaron como abono verde a plantas enteras o remanente de Melilotus albus combinado con centeno, siendo este último el testigo; después se determinó el contenido de nitratos, que se comportó como sigue: al año de incorporación los valores de NO3 en ppm fueron 38.0, 39.0 y 44.0 para los tratamientos centeno, centeno + remanente de Melilotus y centeno + planta completa de Melilotus, respectivamente. Para el segundo año los valores de NO3 fueron los siguientes 17.7, 26.0 y 47.4 ppm para la misma secuencia de tratamientos, respectivamente. Donde se observó que solo el tratamiento que incluye la planta de melilotos entera se lograron incrementos de NO3 de forma consecutiva. Estos datos muestran que al finalizar el año dos, se encontró una diferencia de 30 ppm de NO3 entre el tratamiento de incorporación con Melilotus y centeno.
b) Crecimiento y simbiosis con bacterias nitrificantes. Una particularidad común de los microorganismos implicados en la fijación biológica del nitrógeno, es la disposición de enzimas nitrogenasas, las cuales reducen el nitrógeno atmosférico a ion NH4 +, que es la forma asimilable. Esta actividad enzimática es muy susceptible a la concentración de oxígeno en el medio, por lo que, los microrganismos han adecuado los mecanismos de adaptación necesarios como la protección respiratoria, conformacional y la compartamentalización celular51. En estos procesos participa un grupo de familias de proteínas activadoras especializadas, que interactúan con ARN polimerasa (RNAP) que contiene el factor transcripción (sigma σ54), llamadas proteínas de unión potenciadora (EBP), con la finalidad de activar la transcripción desde sitios ascendentes a través del Bucle de ADN. Estas proteínas interactúan con secuencias activadoras aguas arriba similares a las potenciadoras a través de un ADN C-terminal del dominio de unión y el dominio central conservado que pertenece a la familia AAA+, que acopla ATP hidrolisado hasta la activación de la transcripción por σ54 -RNAP. La actividad de las EBP está altamente regulada en respuesta a señales ambientales a través de módulos reguladores amino-terminales y, en algunos casos, mediante interacciones con otras proteínas reguladoras52,53.
c) Mejoramiento de suelos. Fontana et al50 encontraron efectos positivos, de la incorporación del abono verde de M. albus sobre la producción de forraje y PB del cultivo de centeno en ciclos de cultivo subsiguiente (dos años). Además, mencionan que quedó un remanente de nitratos en el suelo, por lo que infieren que la mayor fertilidad no se tradujo totalmente en producción.
Aspectos como forraje:
Es mencionado que tanto M. albus como M. indicus son plantas forrajeras utilizadas para la alimentación de animales por la abundante fuente de proteínas54, aunque su utilización debería aplicar solo para animales mayores (ganado vacuno, equino, caprino y ovino), quienes la consumen como planta entera en forma mixta: (pastoreo y forraje), ya que es tóxica a especies menores, sobre todo la especie M. indicus55. A pesar de que las especies de Melilotus tienen alto contenido de cumarinas y derivados de éste, algunos autores56 reportan que dependiendo de la parte analizada, la cuantificación de la cumarina puede variar; por ejemplo, se cuantifica más en flores seguido de tallos y hojas en plantas antes del rebrote; así mismo observaron que después de varios ciclos fenológicos estos compuestos disminuyen tanto en hojas y tallos (después 2 y 4 ciclos, respectivamente). En este sentido, los melilotos son una fuente de proteína confiable y económica en rumiantes y no rumiantes, porque son independientes del nitrógeno del suelo. Además, los melilotos son una excelente fuente de minerales, y los consumos de melilotos son generalmente mayores que los de las gramíneas de igual digestibilidad55.
Con la finalidad de conocer el comportamiento de densidad de plantación (DP) y efecto de la edad de corte (EC), investigadores56 desarrollaron un trabajo donde reportan diferencias significativas para DP y EC respecto a la producción de M. albus. Ellos observaron un incremento mayor a 100 % cuando DP pasó de 500 a 1,500 semillas (de 333.34 a 736.62 plantas después de emergencia por m-2, respectivamente); lo que representó una mayor producción de materia verde (MV) y seca (MS), con valores entre 1.66 a 2.29 kg m-2 de MV y valores de 0.37 a 0.52 kg m-2 de MS. La edad de corte (antes de brotación [A], brotación [B] y floración completa[C]) tuvo comportamientos similares a los DP; se observó a la MV con valores entre 1.11 y 3.06 kg m-2 y, para MS valores entre 0.18 y 0.80 kg m-2, sin embargo, se apreció una disminución del porcentaje de hojas conforme se incrementó la edad de corte (40 [A] a 19 % [C]); cabe mencionar que en un periodo de evaluación no se encontró diferencias entre años para estas variables. Respecto a las variables de proteína total (PT), grasa cruda (GC), fibra (F) y Cenizas (Cn) no hubo diferencias entre la DP ni en los años evaluados, pero sí se observó respecto a edad de cosecha, que para PT fue de 21.72, 17.08 y 14.81 en las etapas de A-B-C, para GC fue de 2.41, 2.08 y 1.71 en A-B-C, para F fue de 34.55, 40.27 y 42.82 para A-B-C, respectivamente.
Quero, et al57 señalan que la caracterización agronómica de especies de amplia productividad forrajera con fines de desarrollo de cultivares y producción de semillas, sería una de las herramientas para mejorar la productividad y la adaptabilidad de las pasturas a los ambientes. Una de las mayores especies de importancia para ambientes restrictivos destaca Melilotus albus Medik, al poseer gran productividad, amplia variabilidad genética y de amplia adaptación ambiental58.
Aspectos medicinales:
Desde tiempo inmemorial, las plantas medicinales son consumidas por el hombre en todo el mundo para tratar diversos padecimientos o trastornos en su salud o la de sus animales domésticos, en padecimientos agudos y como coadyuvantes en problemas crónicos, debido a que éstas elaboran cientos de sustancias de muy diferente tipo, y algunos con efectos negativos. En este sentido, la cumarina producida por las especies de Melilotus tienen efectos negativos por las hemorragias provocadas en terneros alimentados con esta planta; sin embargo, desde el punto de vista medicinal se identificó como anticoagulante, y los reportes refieren que el ganado padeció severos trastornos hemorrágicos al haber ingerido trébol dulce (sweet clover o Melilotus albus) almacenado en silos59. Se menciona también60 que Melilotus tienen potencial en el manejo de efectos secundarios en el manejo de los diabéticos, ya que Melilotus officinalis se puede utilizar en medicina herbaria; estudios previos han demostrado que es eficaz para reducir el envejecimiento de la piel, induce la microvascularización y tiene efectos antiinflamatorios61,62.
Con todo ello desde un punto de vista ecológico, agrícola y pecuario, los melilotos son un punto de oportunidad para el mejoramiento y reconvención de suelos sobre explotados o improductivos, produción de forraje y cambios sustantivos en la fertilidad del mismo, así como también para favorecer la diversidad especies microbianas en el medio ambiente y amplia utilidad en medicina.
Conclusiones
La alfalfilla o meliloto es una planta que logra crecer como maleza en una gran diversidad de cultivos, donde no es grata su presencia por el olor característico que la planta genera al desarrollarse y especialmente en gramíneas, que suelen ser usadas para producir harinas o pastas. Sin embargo sus características de crecimiento y desarrollo agroecológico la hacen ser una planta deseable para el mejoramiento o remediación de suelos pobres en materia orgánica, salitrosos o alcalinos, en climas de temperaturas templadas hasta muy frios donde se detecta su asociación con bacterias simbióticas fijadoras de nitrógeno del tipo de Sinorhizobium meliloti, con la cual se asocia para lograr obtener nitrógeno, lo que resulta favorable para mejorar la calidad nutritiva del suelo donde crece.











 texto en
texto en