Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias pecuarias
versão On-line ISSN 2448-6698versão impressa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.14 no.1 Mérida Jan./Mar. 2023 Epub 24-Mar-2023
https://doi.org/10.22319/rmcp.v14i1.6241
Artículos
Concentraciones del factor de crecimiento similar a la insulina 1 (IGF-1) en el líquido sinovial de caballos sanos y osteoartríticos, y su correlación con las citoquinas proinflamatorias IL-6 y TNFα
aUniversidad Nacional Autónoma de México. Facultad de Medicina Veterinaria y Zootecnia. Departamento de Medicina, Cirugía y Zootecnia para Équidos. Ciudad de México. México.
bInstituto Nacional de Pediatría. Laboratorio de Bioquímica Genética. Ciudad de México. México.
cInstituto Nacional de Pediatría. Laboratorio de Oncología Experimental. México.
dSEDENA. Centro Ecuestre de Alto Rendimiento. Ciudad México. México.
eUniversidad Nacional Autónoma de México. Departamento de Fisiología. Instituto de Investigaciones Biomédicas. Ciudad de México. México.
fUniversidad Nacional Autónoma de México. Facultad de Medicina. Departamento de Fisiología. Ciudad de México. Mexico.
gUniversidad Nacional Autónoma de México. Facultad de Medicina Veterinaria y Zootecnia. Departamento de Patología. Ciudad de México. México.
El factor de crecimiento similar a la insulina I (IGF-1) es el factor de crecimiento conocido más importante para la reparación del cartílago en caballos. Promueve la mitosis de los condrocitos, la expresión de colágeno II y la producción de matriz extracelular. La osteoartritis (OA) es la condición musculoesquelética más común que causa cojera y bajo rendimiento en caballos deportivos. Se evaluó clínica y radiográficamente un total de 11 caballos cojos, y se confirmó que todos sufrían una cojera metacarpofalángica frontal mediante una prueba de flexión positiva, un bloqueo nervioso en 4 puntos bajos y un bloqueo intraarticular. La proteína total, IGF-1, IL-6 y TNFα se determinaron por ELISA, lo que demostró cambios y diferentes correlaciones entre la condición clínica, los cambios radiográficos y el grado de inflamación. Todos los caballos con dolor asociado a las articulaciones y, por lo tanto, asociado a la cojera, mostraron un aumento significativo de la proteína total (P<0.0001) y la concentración de IGF-1 (P<0.05). Las concentraciones de IL-6 y TNFα entre los controles y los caballos cojos mostraron diferencias significativas (P<0.01 y P<0.001 respectivamente). Los caballos con menos cambios radiográficos mostraron la mayor expresión de IGF-1 en el líquido sinovial, y los caballos con condiciones de OA más crónicas tuvieron niveles de expresión de IGF-1 muy similares a los de las articulaciones de control. En todas las articulaciones cojas, se identificó por medio de Western blot una isoforma de IGF-1 más ligera (~ 7.5 kDa) que estaba relacionada con la inflamación y es el peso molecular del péptido maduro, y todas las articulaciones de control expresaron una isoforma más pesada (~ 12 kDa). Este hallazgo podría conducir a una nueva investigación para secuenciar y apuntar a la isoforma que no se expresa durante un proceso inflamatorio dentro de una articulación, y para tener una mejor comprensión de su papel en la articulación del caballo.
Palabras clave Factor de crecimiento similar a la insulina 1 (IGF-1); Caballo; Osteoartritis (OA); Cojera
Insulin-like growth factor I (IGF-1) is the most important known growth factor for cartilage repair in horses. It promotes mitosis of chondrocytes, collagen II expression, and extra cellular matrix production. Osteoarthritis (OA) is the most common musculoskeletal condition that causes lameness and poor performance in sport horses. A total of 11 lame horses were clinically and radiographically evaluated, and all were confirmed to suffer a front metacarpophalangeal lameness by a positive flexion test, a low-4-point nerve block and an intraarticular block. Total protein, IGF-1, IL-6 and TNF( were determined by ELISA, demonstrating changes and different correlations between clinical condition, radiographic changes and degree of inflammation. All horses with joint associated pain and therefore associated lameness, demonstrated a significant increase of total protein (P<0.0001) and IGF-1 concentration (P<0.05). Concentrations of IL-6 and TNF( between controls and lame horses demonstrated significant differences (P<0.01 and P<0.001 respectively). Horses with less radiographic changes, demonstrated the highest IGF-1 expression in synovial fluid, and horses with more chronic OA conditions had very similar IGF-1 expression levels than control joints. In all lame joints, it was identified by Western blot a lighter isoform of IGF-1 (~7.5 kDa) which was inflammation related and it is the molecular weight of the mature peptide, and all control joints expressed a heavier isoform (~12 kDa). This finding could lead to new research for sequencing and targeting the isoform which is not expressed during an inflammatory process within a joint, and to have a better understanding of its role in the horse’s joint.
Key words Insulin growth factor 1 (IGF-1); Horse; Osteoarthritis (OA); Lame
Introducción
El factor de crecimiento similar a la insulina I (IGF-1, del inglés insulin-like growth factor I) es el factor de crecimiento conocido más importante para la reparación del cartílago en caballos, ya que estimula la síntesis de proteoglicanos y, por lo tanto, la matriz extracelular (MEC), y promueve la mitosis de los condrocitos. Tiene una importante actividad promotora del crecimiento no solo en el cartílago articular, sino en varios tejidos, principalmente en el músculo, los huesos y el cerebro. Activa la vía de las proteínas quinasas activadas por mitógenos (MAPK, del inglés mitogen-activated protein kinase), que tiene varios efectos en la promoción de: la supervivencia, crecimiento, proliferación celular, protección contra la hipoxia, regulación de la inflamación en lesiones musculares y en placas de crecimiento óseo1-4. También tiene un papel clave en el desarrollo del cerebro, junto con el estradiol, regulando una variedad de eventos neuroplásticos y de desarrollo5. En estructura, es muy similar a la insulina. Cuando se instila insulina en una articulación, se mejora la expresión de IGF-1 en el líquido sinovial6.
Las lesiones del cartílago articular normalmente se reparan por sustitución con fibrocartílago, lo que conduce a la pérdida de la función de la articulación que resulta en osteoartritis (OA)7. La cojera es la razón más frecuente por la cual se requieren clínicos equinos por parte de los propietarios de caballos, y la OA representa más del 60 % de todos los casos de cojera en caballos deportivos8. El principal problema en la OA es la inflamación, que condiciona un desequilibrio entre catabolismo y anabolismo en el cartílago articular. En este tejido en particular, el único componente celular está constituido por condrocitos, que son responsables de la síntesis de MEC, con el fin de mantener una función adecuada del cartílago.
Existe evidencia con respecto a la eficacia exógena del IGF-1 in vitro, que mejora la síntesis de proteoglicanos mediante condrocitos estimulados. Otras terapias, como el trasplante de condrocitos de condrocitos maduros y neonatales, las estrategias de terapia génica para aumentar la expresión de IGF-1 por condrocitos transfectados, requieren anestesia general, un procedimiento quirúrgico y, por lo tanto, equipo y personal especializado9.
En un estudio piloto realizado por los autores en el que se obtuvieron 13 muestras de líquido sinovial de diferentes articulaciones (articulaciones interfalángicas distales, articulaciones metacarpofalángicas, articulaciones del hombro, articulaciones tarsometatarsianas y babillas) de caballos con cojera asociada grado AAEP (American Association of Equine Practitioners): 2/5, sin cambios radiográficos, pero una respuesta positiva en la prueba de flexión de 1 min. Por ELISA, se encontró un aumento significativo de IGF-1 y una correlación positiva entre los niveles de proteína total e IGF-1 en el líquido sinovial (datos no mostrados). En este estudio se obtuvieron muestras de líquido sinovial de 21 caballos con diferentes grados de OA (confirmados por bloqueo intraarticular y cambios radiográficos) en la articulación metacarpofalángica (AMCF), donde el IGF-1 y la proteína total se correlacionaron positivamente en caballos con OA aguda, y negativamente en caballos con OA crónica y marcada remodelación ósea. En caballos con cambios leves o no radiográficos (OA aguda), el IGF-1 se correlacionó negativamente con la interleucina-6 (IL-6) y el factor de necrosis tumoral alfa (TNFα, del inglés tumor necrosis factor alpha). Curiosamente, fue posible encontrar por Western blot, al menos dos isoformas funcionales de IGF-1 expresadas en líquido sinovial, una presente solo en caballos de control, y la otra en caballos cojos.
Hasta donde se sabe, no hay información con respecto a las fluctuaciones de IGF-1 en la OA que ocurre de forma natural. No hay estudios in vivo con respecto a los niveles del IGF-1 durante la OA. Tal vez este documento puede ayudar a los clínicos a comprender el papel del IGF-1 para esta condición particular y podría usarse como línea base para estudios adicionales sobre la concentración de IGF-1 y su posible uso como tratamiento alternativo.
Material y métodos
Se obtuvieron muestras de líquido sinovial de caballos Warmblood y Thoroughbred (n=11) de dos disciplinas diferentes: caballos de salto (Warmblood) (n=8) y caballos de carrera (Thoroughbred) (n=3) con una edad media de 10.5 años y un peso medio de 520 kg. Las muestras de control (Ctrl) se obtuvieron de dos caballos castrados, Warmblood de 5 y 7 años. No había más caballos de control disponibles para el estudio, ya que todos estaban sanos, no fue fácil obtener el consentimiento de los propietarios para tomar muestras de sus articulaciones. Se realizó una evaluación completa de cojera y una evaluación radiográfica en todos los caballos de control para ser incluidos en este estudio. Ninguno de ellos mostró signos de cojera en las extremidades delanteras y fueron negativos a las pruebas de flexión pasiva y activa (30 seg). Además, ninguno de ellos presentó cambios radiográficos asociados con patología articular en la articulación metacarpofalángica.
Evaluación de cojera
Se realizó una evaluación clínica en todos los caballos incluidos en este estudio, con el fin de encontrar evidencia de cojera asociada con la articulación metacarpofalángica de las extremidades delanteras. La evaluación consistió en la observación estática, la palpación y la respuesta de flexión pasiva; evaluación dinámica de caminar y trotar en línea recta y lanzarse sobre una superficie dura y blanda. Todos los caballos incluidos mostraron una cojera de 2 y 3/5 (AAEP), con una prueba de flexión positiva (1 min). Adicionalmente, todos los caballos fueron positivos a bloqueo 4 puntos bajos (nervios palmares laterales y mediales y nervios metacarpianos laterales y mediales), utilizando 2 y 1.5 ml respectivamente de mepivacaína al 2 % (Carbocaine, Zoetis Inc.) y bloqueo intraarticular adicional de la articulación metacarpofalángica, utilizando un volumen de 6 ml de mepivacaína al 2 % (Carbocaine, Zoetis Inc.) como se describió anteriormente10. Cualquier caballo negativo a estos bloqueos, fue excluido del estudio.
Recolección de líquido sinovial
Todas las muestras de líquido sinovial se obtuvieron de las articulaciones metacarpofalángicas articulaciones AMCF de caballos cojos, utilizando una técnica aséptica en el abordaje palmaro-lateral como se describió anteriormente y 5 d después del bloqueo intraarticular (IA)10. Se obtuvieron muestras de caballos sanos y se utilizaron como controles (n=4).
Evaluación radiográfica
Todos los caballos seleccionados se evaluaron radiográficamente desde la AMCF, utilizando cuatro vistas estándar (dorso-palmar, latero-medial, dorsolateral palmaro-medial y dorso-medial palmaro-lateral) con el fin de evaluar la condición radiológica de todos los caballos. Se determinaron tres diferentes grados de cambios radiológicos asociados con la condición clínica del caballo (Cuadro 1).
Cuadro 1 Grado de severidad y su relación con los hallazgos clínicos y radiográficos en los caballos incluidos en este estudio
| Grado | Hallazgos radiográficos y clínicos |
|---|---|
| I | De ningún cambio a cambios menores asociados con dolor articular y cojera: irregularidad y pérdida de homogeneidad normal de la cresta sagital de MTCIII. |
| II | Cambios moderados asociados con dolor articular y cojera: sobrehuesos (osteofitos) en P1 y MTCIII. |
| III | Cambios severos asociados con cojera severa y disminución del rango de movimiento: lisis supracondilar o subcondral, osteofitos y formación de hueso nuevo con reacción perióstica y pérdida de espacio articular. |
(Modificado de: Verwilghen D et al., 2009)11.
Determinación de la concentración de proteínas
La concentración de proteína total de todas las muestras de líquido sinovial se obtuvo mediante el uso del kit de ensayo de proteínas BCA (Pierce BCA Protein Assay Kit cat. 23225), de acuerdo con las instrucciones del fabricante. Para cada muestra la concentración final fue de 100 μg/50 μl para el procedimiento de ELISA.
Análisis de concentración de IGF-1
La determinación de la concentración de IGF-1 en muestras de líquido sinovial de los caballos de control y osteoartríticos se realizó con 50 μl utilizando un kit de ELISA comercial (Horse IGF1 ELISA kit, #MBS017382, MyBio-Source®) siguiendo las instrucciones del fabricante.
Concentración de interleucina 6 (IL-6)
Se realizó una determinación cuantitativa de IL-6 en el líquido sinovial de todas las muestras utilizando un kit de ELISA comercial (Horse interleukin-6 ELISA kit, cat. #: CSB-E16634Hs), que es una técnica de inmunoensayo sándwich, donde las placas se recubren con un anticuerpo IL-6 específico de caballo, luego, se agrega un anticuerpo conjugado con biotina específico para IL-6 y luego peroxidasa de rábano picante (HRP, del inglés horseradish peroxidase) conjugada con avidina. El protocolo se realiza siguiendo las instrucciones del fabricante.
Concentración del factor de necrosis tumoral alfa (TNFα)
La determinación de la concentración del TNFα en muestras de líquido sinovial de los caballos de control y osteoartríticos se realizó con 100 μl utilizando un kit de ELISA comercial (Equine TNFα ELISA kit, cat #: ESS0017 Invitrogen) siguiendo las instrucciones del fabricante.
Análisis de Western Blot
Se sometieron cantidades iguales de proteína (100 μg por carril) a un SDS-PAGE al 16 % (90V durante 30 min y 120 V durante 3.5 h). Se utilizó el marcador Precision Plus Protein Dual Color Standards, que contenía diez proteínas recombinantes preteñidas (10 a 250 kD), incluyendo ocho bandas teñidas de azul y dos bandas de referencia rosas (25 y 75 kD). Después de la electroforesis, los geles se transfirieron utilizando un sistema de transferencia semiseco (271mA durante 15 min) a membranas de PVDF (0.45uM) (Bio-Rad), que se bloquearon utilizando leche descremada al 4 % diluida en PBS (pH 7.4) y se incubaron en un agitador a 37 °C, 120 rpm durante 2 h. Después del bloqueo, las membranas se lavaron 3 veces (durante 5 min cada una) utilizando PBS que contenía Tween-20 al 0.05 %. Como anticuerpo primario, se utilizó un anti-IGF-1 policlonal de cabra (1:1000) (Sta. Cruz #Sc-1422), se incubó en un agitador primero a 37 °C, 120 rpm durante 2 h, y se dejó durante la noche a 4 °C; las membranas se lavaron nuevamente como se describió, y como anticuerpo secundario se utilizó un IgG policlonal anti-cabra (1:5000) (Millipore #AP180B), y se incubó en un agitador a 37 °C, 120 rpm durante 2 h y se realizó un lavado final de las membranas. Las proteínas se detectaron mediante el uso de un método de quimioluminiscencia mejorada y se visualizaron utilizando un sistema de imágenes de alta resolución (Bio-Rad ChemiDoc). Las membranas se incubaron a una dilución 1:1 de luminol y peroxidasa utilizando (Merck Millipore, Luminata # WBLUF0500), y se expusieron a varios tiempos, donde el tiempo óptimo de exposición fue de 35 segundos.
Resultados
Se examinó un total de 45 caballos, de los cuales solo se incluyeron 11 caballos (22 muestras) en este estudio y 2 caballos (4 muestras) como testigos. Todos los caballos variaron entre sí en grados de cojera y cambios radiográficos, y todos respondieron positivamente a la prueba de flexión digital, bloqueo de 4 puntos bajos y bloqueo intraarticular (IA) de la articulación del menudillo. Seis articulaciones se calificaron como grado I, cinco articulaciones se calificaron como grado II y 8 articulaciones fueron grado III (Figura 1).
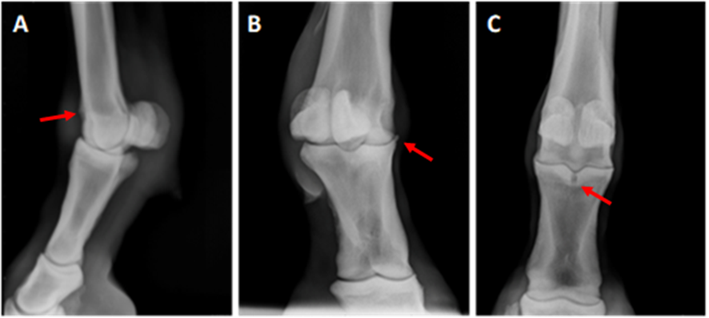
Grado 1 (A) Vista latero-medial con una irregularidad leve del aspecto proximal-dorsal de la cresta sagital (flecha); Grado II (B) Vista oblicua palmaro-medial dorsolateral con un osteofito visible en el aspecto dorso-medial proximal de P1 (flecha); y Grado III (C) Vista dorso-palmar donde un quiste óseo subcondral en el aspecto proximal de la primera falange en el surco sagital con áreas de esclerosis ósea (flecha).
Figura 1 Radiografías representativas de caballos calificados con varios grados
Concentración de IGF-1
Todos los caballos con dolor asociado a las articulaciones, cojera y menos cambios radiográficos, mostraron un aumento significativo de la concentración de IGF-1 (P<0.05) (Figura 2). Todas las muestras se repitieron por pares y se leyeron tres veces en un período de 5, 10 y 15 min sin diferencia entre las mediciones (datos no mostrados) y los valores de regresión lineal y curva estándar fueron: P<0.001; r2=0.9931.
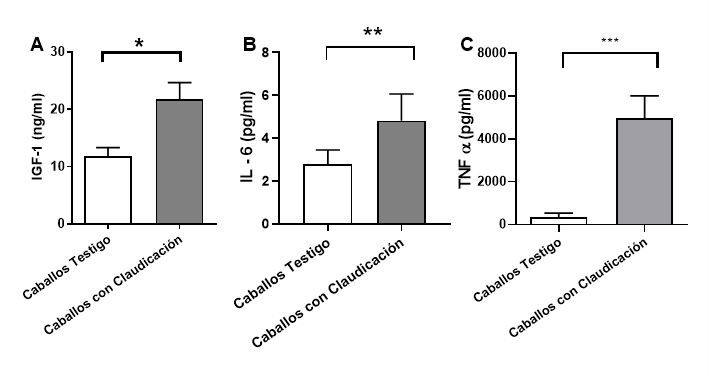
Figura 2 A) Determinación de IGF-1 entre caballos de control (sanos) y cojos, que muestra una diferencia significativa (P<0.05)*. B) Las concentraciones de IL-6 entre los controles y los caballos cojos también mostraron una diferencia significativa (P<0.01)**. C) Concentraciones de TNFα entre los controles y los caballos cojos que muestran diferencias significativas en la concentración (P<0.001)***.
Análisis de IL-6 y TNFα
Las concentraciones de IL-6 entre los controles y los caballos cojos también mostraron una diferencia significativa (P<0.01). Las concentraciones de TNFα entre los controles y los caballos cojos mostraron diferencias aún más significativas en términos de concentración (P<0.001), siendo mayores en los caballos cojos con cambios más severos en las articulaciones afectadas (Grado III). Se realizó un análisis de correlación de Pearson que demostró una correlación positiva entre las concentraciones de proteína total e IGF-1 (r=1), que se observó en caballos de grado I y II, mientras que en el grado III esta correlación es negativa o inversamente proporcional. En otras palabras, cuanto peores fueron los cambios que tuvo una articulación (como se observó en caballos de grado III), se observó menor concentración de IGF-1 en el líquido sinovial.
Análisis de Western blot
Los caballos con menos cambios radiográficos demostraron una mayor concentración de IGF-1 en concordancia con los resultados de ELISA para IGF-1 (Grado I y II). Los caballos con cambios radiográficos más severos y un estado crónico de la condición patológica (Grado III) fueron los que tuvieron las concentraciones más bajas de IGF-1 tanto en ELISA como en el análisis WB. Curiosamente, con este análisis se pudo identificar en todas las muestras dos bandas diferentes, una de ~12 kDa que se observó solo en caballos testigos (normales) sin patología articular, y otra de ~7.5 kDa vista en todos los caballos cojos (Figura 3).
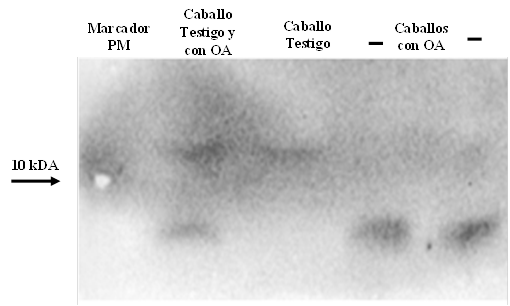
1: Marcador de proteínas (marcando 10 kDa); 2: Muestras de un caballo testigo y un caballo con OA; 3: Caballo testigo; 4 y 5: Dos muestras diferentes de caballos con OA.
Figura 3: Fotografía representativa del análisis Western blot para IGF-1, demostrando una diferencia de peso molecular entre muestras de líquido sinovial que indica la existencia de dos isoformas diferentes presentes en articulaciones normales y durante un proceso inflamatorio
Discusión
Los caballos deportivos están expuestos a cargas excesivas en sus articulaciones y estructuras de tejidos blandos. La articulación que puede experimentar OA traumática depende de la disciplina en la que se desempeñe el caballo. Existe evidencia con respecto a intervenciones como las inyecciones articulares en las fases agudas de la enfermedad que pueden ayudar a modificar su curso y prevenir daños mayores mientras el caballo todavía está desempeñándose12.
Las cargas de impacto debidas al ejercicio son las responsables de dañar el cartílago articular al agrietar primero la superficie, y dependiendo de la fuerza aplicada y del tiempo que se esté aplicando, se produce la profundidad y, por tanto, la severidad del desarrollo de la enfermedad (OA). Se ha comprobado que la caracterización de las consecuencias mecánicas de las lesiones por impacto en el cartílago articular desarrolla daños, al estresar continua y directamente las estructuras articulares13.
Cuando se produce inflamación, los condrocitos migran al sitio de la lesión en un intento de regenerar el defecto formando grupos de células o clústeres con la capacidad de sintetizar MEC de novo. Dado que el componente celular (condrocitos) del cartílago articular es solo el 1-2 % de todo el tejido, no pueden reparar el área dañada, porque su capacidad para sintetizar la MEC es superada por la actividad de la metaloproteasas de la matriz (MMP, del inglés matrix metalloprotease) que degrada la MEC ya dañada agravando la condición al aumentar la necrosis y activando la inflamación local mediante la liberación de componentes intracelulares que actúan como patrones moleculares asociados al daño (DAMP, del inglés damage-associated molecular patterns) y citoquinas proinflamatorias como prostaglandinas (PG), óxido nitroso (NO), interleucina-1 (IL-1), interleucina-6 (IL-6), factor de necrosis tumoral alfa (TNFα) y sustancia P. Particularmente, el TNFα inhibe la expresión de IGF-1 al aumentar el catabolismo de MEC y bloquear la vía AKT a través de la activación de la vía JNK. Si el defecto del cartílago llega al hueso subcondral, el cartílago se repara formando un cartílago articular de baja calidad llamado fibrocartílago2,4,7.
Los factores que contribuyen a la cascada de inflamación, aparte de las citoquinas, incluyen vesículas extracelulares, que desempeñan un papel importante en la promoción de la inflamación articular y también están involucradas en la apoptosis y la degradación de la MEC. Estas vesículas son exosomas, microvesículas y vesículas apoptóticas, que son liberadas a la cavidad articular (en el líquido sinovial), y tienen una relación íntima con la comunicación célula-célula durante el proceso inflamatorio7,8,14.
El objetivo de este estudio fue comparar la concentración de IGF-1 en el líquido sinovial de caballos sanos (testigo) y caballos con diferentes grados de cojera y patología articular (OA) en la AMCF. Se planteó la hipótesis de que entre más severas y crónicas fueran las condiciones de la articulación, se encontrarían niveles más altos de IGF-1 en el líquido sinovial, debido a que la alta demanda de la articulación para reparar el defecto era mayor que en los caballos con cambios leves. La razón detrás de la hipótesis era: que, todavía no había datos disponibles con respecto a las concentraciones de IGF-1 y su correlación con una condición clínica particular en caballos, por lo que se realizó un estudio piloto, donde se recolectaron un total de 13 muestras de líquido sinovial de diferentes articulaciones de diferentes caballos. Todos estos caballos eran caballos saltadores de alto rendimiento con una prueba de flexión positiva de las articulaciones muestreadas (no se realizó ninguna evaluación radiográfica en ninguno de estos caballos). Lo que se encontró fue un aumento significativo de la proteína total, con una correlación positiva (correlación de Pearson, P=0.0229) en los niveles de IGF-1 en el líquido sinovial en comparación con las muestras de testigo (líquido sinovial obtenido de caballos sanos). Esto dio suficiente información para plantear la hipótesis de que los caballos con signos clínicos más severos y una patología articular más crónica tendrían niveles más altos de IGF-1 en comparación con los caballos testigo.
Curiosamente, con los resultados obtenidos, esta hipótesis fue refutada. Se encontró que los caballos con cambios radiográficos más severos y, por lo tanto, las condiciones inflamatorias dentro de la articulación más crónicas fueron los que demostraron una disminución en las concentraciones de IGF-1, muy similar a la que tenían los caballos testigo.
Se observaron resultados similares en estudios en los que las lesiones inducidas experimentalmente en el cartílago articular en caballos producen un pico agudo de expresión de ARNm de igf-1, y a las cuatro semanas tienden a disminuir. Cuando el IGF-1 disminuye, predomina el TGF-β y es responsable de la formación de hueso nuevo y la activación de linfocitos quiescentes a Th177.
El factor de crecimiento similar a la insulina 1 (IGF-1) equino ha sido ampliamente estudiado, existen varios estudios donde su importancia en la proliferación, crecimiento y supervivencia celular, reparación y producción de matriz extracelular está bien documentada, aunque no hay suficientes estudios sobre las diferentes isoformas y su funcionalidad15. Se sabe que el ARNm sufre modificaciones postranscripcionales (empalme alternativo) lo que genera diferentes isoformas junto con modificaciones postraduccionales. Los propéptidos IGF-1 están codificados por múltiples transcripciones empalmadas alternativamente, incluyendo los péptidos de extensión C-terminal llamados péptidos E y los péptidos señal N-terminal. Cuando una proteína inmadura tiene péptido señal, el péptido maduro y el péptido E se llama pre-proIGF-1, y cuando el péptido señal se elimina dejando solo el péptido maduro y el péptido E, se llama pro-IGF-1. Estos péptidos E controlan la biodisponibilidad del IGF-1 maduro, al unirse a la MEC debido a su carga altamente positiva, impidiendo su circulación sistémica y, por lo tanto, su uso local. También modulan la reentrada de IGF-1 maduro a la célula en una línea celular del músculo murino1.
En humanos, se han identificado tres isoformas diferentes de IGF-1 [IGF-1Ea, IGF-1Eb e IGF-1Ec, también conocido como factor de crecimiento mecano o MGF (del inglés mecano-growth factor)], y se ha propuesto que tienen diversas funciones en la reparación muscular16.
Nixon et al17 describieron el gen igf1 que consiste en 5 exones con 4 secuencias de intrones, que sufren modificaciones postranscripcionales y postraslacionales, donde las proteínas traducidas resultantes del empalme alternativo del exón 4 forman una transcripción de propéptidos más pequeña (105 aminoácidos) llamada Pre-proIGF-1A que consiste en péptido señal (codificado por los exones 1 y 2), péptido maduro (codificado por los exones 2 y 3), y un péptido E C-terminal (codificado por los exones 3 y 5); y cuando el exón 4 no se empalma alternativamente, se traduce una transcripción más grande formando Pre-proIGF1B (111 aminoácidos)17. Hasta donde se sabe, éste fue el último trabajo de investigación publicado sobre modificaciones postranscripcionales y postraslacionales y empalme alternativo de ARNm de IGF-1 en caballos. Se realizó un análisis bioinformático del gen igf1 sometido a diferentes tipos de empalme alternativo, que según Le et al18 son: salto de exón, retención de intrones, exones mutuamente excluyentes y sitios alternativos donante 5’ o aceptor 3’. Este análisis reveló que el ARNm de IGF-1 consistía no de 5, sino de 4 exones y 3 intrones, que los transcriptos forman 4 isoformas: variante 1 (exones 1-3), variante 2 (exones 2 y 3), variante 3 (exones 1-3, una retención de intrones de 93 pb y el exón 4) y variante 4 (exones 2-4)18.
El análisis de Western blot demostró la presencia de al menos dos isoformas funcionales diferentes de IGF-1, donde la observada en todos los caballos normales es más pesada (~ 12 kDa) que la observada en todos los caballos con diferentes grados de OA (7.5 kDa). Probablemente la más ligera es la forma madura de IGF-1, aunque las técnicas de secuenciación de aminoácidos deben llevarse a cabo para confirmar esta afirmación. Con este resultado, se puede suponer que la expresión de estas dos diferentes isoformas funcionales depende de la inflamación.
Esto podría conducir a una nueva línea de investigación que puede enfocarse en determinar mediante técnicas avanzadas de secuenciación las isoformas exactas de IGF-1, y en apuntar a la sobreexpresión de la isoforma que no está presente cuando hay un proceso inflamatorio de la articulación, y su papel en la reparación de defectos del cartílago.
El cartílago articular no se regenera por sí mismo, ya que es el único tejido conectivo en mamíferos que no tiene ni vasos sanguíneos y linfáticos, ni nervios19. Por lo tanto, es prácticamente imposible regenerarse después de una lesión, por lo que se repara mediante sustitución con tejido fibroso, lo que genera un cartílago fibroso de baja calidad llamado fibrocartílago. Ha habido varios tratamientos para mejorar la regeneración del cartílago, en humanos, el trasplante de aloinjerto osteocondral ha demostrado ser eficaz en la mejora de la función y la reparación general con la supervivencia del injerto de hasta el 80 % de los pacientes que se habían sometido a tratamiento quirúrgico previo: microfractura, desbridamiento del cartílago, forage, condroplastia de abrasión, injertos osteocondrales y periósticos, reinserción de colgajo del cartílago, entre otros7,17,20.
Los anestésicos locales y los esteroides han sido ampliamente utilizados por los practicantes en el campo, por razones diagnósticas y terapéuticas respectivamente. Sin embargo, se ha demostrado que el uso excesivo de estos componentes daña el cartílago articular. La inyección intraarticular que utiliza anestésicos locales y esteroides ha generado una creciente preocupación sobre la inducción de toxicidad potencial para los condrocitos y sinoviocitos. Sherman et al21 realizaron una comparación interesante de lidocaína, bupivacaína, acetato de betametasona, acetato de metilprednisolona y acetónido de triamcinolona en un modelo canino. Encontraron que in vitro, lidocaína al 1 y 0.5 %, bupivacaína al 0.2 y 0.25 %, acetato de betametasona y acetato de metilprednisolona fueron severamente condrotóxicos y sinoviotóxicos en comparación con bupivacaína y triamcinolona al 0.625 %21.
Conclusiones e implicaciones
Por esta razón, en cuanto al tratamiento, el objetivo principal es tener alternativas que puedan ser utilizadas en campo por los médicos, que puedan proporcionar una alternativa distinta a los esteroides que también pueda mejorar la reparación del cartílago sin la necesidad de poner al caballo bajo anestesia general, y aun así tener un efecto que conduzca a que los caballos tengan una carrera deportiva duradera. Este artículo proporciona información importante que puede servir como base para futuras investigaciones sobre las isoformas de IGF-1 y su papel en la reparación del cartílago.
Agradecimientos
Los autores desean agradecer a todo el personal del CEAR, SEDENA, QFB Alberto Enrique Fernández Molina y MVZ Jorge Rodríguez Lezama. Fernando García Lacy es estudiante de doctorado en el Doctorado en Ciencias de la Producción y Salud Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México y recibió una beca del CONACYT. El trabajo reportado en este manuscrito es parte de su tesis doctoral.
REFERENCIAS
1. Pfeffer LA, Brisson BK, Hanquin L, Barton ER. The Insulin-like Growth Factor (IGF-1) E-peptides modulate cell entry to mature IGF-1 protein. Mol Biol Cel 2009;20:3810-3817. [ Links ]
2. Choukair D, Hügel U, Sander A, Uhlmann L, Tönshoff B. Inhibition of IGF-1-related intracellular signaling pathways by proinflammatory citokines in growth plate chondrocytes. Ped Res 2014;76(3):245-251. [ Links ]
3. Liu Q, Guan JZ, Sun Y, Le Z, Zhang P, Yu D, et al. Insulin-like growth factor 1 receptor-mediated cell survival in hypoxia depends on the promotion of autophagy via supression of the PI3K/Akt/mTOR signaling pathway. Mol Med Rep 2017;15:2136-2142. [ Links ]
4. Tonkin J, Temmerman L, Sampson RD, Gallego-Colon E, Barberi L, Bilbao D, et al. Monocyte/Macrophage-derived IGF-1 orchestrates murine skeletal muscle regeneration and modulates autocrine polarization. Am Soc Gene Cell Ther 2015;23(7):1189-1200. [ Links ]
5. García-Segura LM, Arévalo MA, Azcoitia I. Interactions of estradiol and insulin-like growth factor-I signaling in the nervous system: New advances. Prog Brain Res 2010;181:251-272. [ Links ]
6. García-Lacy F, Gutiérrez-Olvera L, Bernad M, Fortier L, Trigo-Tavera FJ, Gómez-Chavarín M, et al. Pharmacokinetic analysis of intraarticular injection of insulin and its effect on IGF-1 expression in synovial fluid of healthy horses. Rev Mex Cienc Pecu 2022;13(2):391-407. [ Links ]
7. Fortier LA, Balkman CE, Sandell LJ, Ratcliffe A, Nixon A. Insulin-like growth factor-1 gene expression patterns during spontaneous repair of acute articular cartilage injury. J Orth Res 2001;19:720-728. [ Links ]
8. Frisbie D. Future directions in treatment of joint disease in horses. Vet Clin Equine 2005;21:713-724. [ Links ]
9. Aguilar IN, Trippel SB, Shuiliang S, Bonassar LJ. Comparison of efficacy of endogenous and exogenous IGF-I in stimulating matrix production and mature chondrocytes. Cartilage 2015;6(4):264-272. [ Links ]
10. Moyer W, Schumacher J, Schumacher J. A guide to equine joint injection and regional anesthesia. Yardley, PA: Veterinary Learning Systems, USA. 2007. [ Links ]
11. Verwilghen D, Busoni V, Gangl M, Franck T, Lejeune JP, Vanderheyden L, et al. Relationship between biochemical markers and radiographic scores in the evaluation of the osteoarticular status of Warmblood stallions. Res Vet Sci 2009;87(2):319-328. [ Links ]
12. Chu CR, Beynnon BD, Buckwalter JA, Garrett WE Jr, Katz JN, Rodeo SA. Closing the gap between benck and nedside research for early arthritis therapies (EARTH): report from the AOOSSM/NIH U-13 Post-joint injury osteoarthritis conference II. Am J Sports Med 2011;39(7):1569-1578. [ Links ]
13. Bonnevie ED, Delco ML, Fortier LA, Alexander PG, Tuan RS, Bonassar LJ. Characterization of tissue response to impact loads delivered using a hand-held instrument for studying articular cartilage injury. Cartilage 2015;6(4):226-232. [ Links ]
14. Buzas EI, Gyrgöry B, Nagy G, Falus A, Gay S. Emerging role of extracellular vesicles in inflammatory diseases. Nat Rev Reumatol 2014;10(6):3563-3564. [ Links ]
15. www.uniprot.com. . https://www.afternic.com/forsale/uniprot.com?utm_source=TDFS&utm_medium=sn_affiliate_click&utm_campaign=TDFS_Affiliate_namefind_direct8&traffic_type=CL3&traffic_id=Namefind. [ Links ]
16. Phillipou A, Papageorgiou E, Bogdanis G, Halapas A, Sourla A, Maridaki M, et al. Expression fo IGF-1 isoforms after exercise-induced muscle damage in humans: Characterization of the MGF E peptide actions in vitro. In vivo 2009;23:567-576. [ Links ]
17. Nixon AJ, Brower-Toland BD, Sandell LJ. Primary nucleotide structure of predominant and alternate splice forms of equine insulin-like growth factor I and their gene expression patterns in tissues. AJVR 1999;60(10):1234-1241. [ Links ]
18. Le, KQ, Prabhakar B, Hong, WJ. et al. Alternative splicing as a biomarker and potential target for drug discovery. Acta Pharmacol Sin 2015;36:1212-1218. [ Links ]
19. Geneser F. Tejido esquelético. Cap 12, Geneser F. Histología. 3rd ed. Madrid, España: Editorial Médica Panamericana; 2001. [ Links ]
20. Briggs DT, Sadr KN, Pulido PA, Bugbee WD. The use of osteochondral allograft transplantation for primary treatment of cartilage lesions in the knee. Cartilage 2015;6(4):203-207. [ Links ]
21. Sherman SL, Khazai RS, James CH, Stoker AM, Flood DL, Cook JL. In vitro toxicity of local anesthetics and corticosteroids on chondrocyte and synoviocyte viability and metabolism. Catilage 2015;6(4):233-240. [ Links ]
Recibido: 21 de Mayo de 2022; Aprobado: 07 de Septiembre de 2022











 texto em
texto em 


