Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.13 no.4 Mérida oct./dic. 2022 Epub 11-Nov-2022
https://doi.org/10.22319/rmcp.v13i4.5976
Notas de investigación
Producción de antígenos y estandarización de un ELISA casero indirecto para la detección de anticuerpos contra Anaplasma marginale
a Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Centro Nacional de Investigación Disciplinaria en Salud Animal e Inocuidad (CENID-SAI), Carretera Cuernavaca-Cuautla no. 8534, Col. Progreso, 62574, Jiutepec, Morelos, México.
b Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA), Jiutepec, Morelos, México.
Las pruebas serológicas son importantes para la detección de anticuerpos específicos contra agentes infecciosos. Los ELISA indirectos comerciales son costosos y, por lo general, son tan efectivos como los ELISA caseros. En el presente trabajo fue preparado un lote de antígeno crudo de Anaplasma marginale a partir de sangre infectada, y se probó contra controles oficiales de suero positivos y negativos y comparado con un lote viejo de antígeno. El nuevo lote de antígenos mostró una eficiencia similar a la del lote viejo. La sensibilidad de la prueba entre los lotes nuevo y viejo fue comparable. Tanto el lote de antígeno nuevo como el viejo se están utilizando en exceso. El nuevo lote de antígeno es lo suficientemente grande como para ejecutar miles de pruebas a un precio más asequible que el de los kits comerciales.
Palabras clave Anaplasmosis bovina; ELISA indirecto; Diagnósticos serológicos
Serologic tests are important for the detection of specific antibodies against infectious agents. Commercial indirect ELISA are costly and usually as effective as in-house ELISAs. In the present work, it was prepared a batch of Anaplasma marginale crude antigen from infected blood, and tested it against official positive and negative serum controls and compared with an old batch of antigen. The new antigen batch showed an efficiency similar to the old batch. The sensitivity of the test was comparable between the new and old batches. Both, new and old antigen lots are being used at an excess. The new antigen lot is large enough to run thousands of tests at a more affordable price than commercial kits.
Key words Bovine anaplasmosis; Indirect ELISA; Serologic diagnostics
La anaplasmosis, causada por la bacteria Gram-negativa Anaplasma marginale (Rickettsiales; Anaplasmataceae), es una enfermedad infecciosa que afecta al ganado y a los rumiantes silvestres1. La enfermedad tiene una alta prevalencia en zonas tropicales, subtropicales e incluso templadas y causa ictericia, anemia, pérdidas de producción de carne y leche, ineficiencia reproductiva, mortalidad y costos terapéuticos relacionados, así como restricciones comerciales para el traslado de reactores positivos2. La infección por A. marginale induce la producción de anticuerpos que pueden ser detectados por pruebas de laboratorio3,4,5.
Se han desarrollado muchas pruebas serológicas para la detección de anticuerpos anti-A. marginale específicos, incluyendo la prueba de aglutinación en tarjeta6, la prueba de fijación del complemento7, la prueba indirecta del anticuerpo fluorescente8,9 y el ensayo inmunoabsorbente ligado a enzimas (ELISA, por sus siglas en inglés)4,5,10. Las pruebas serológicas no distinguen entre animales infectados y no infectados, pero la presencia de anticuerpos específicos se puede utilizar para la eliminación de reactores positivos al comprar o introducir ganado dentro de un rebaño o área libre de anaplasmosis. La eficiencia de la prueba es de considerable relevancia, y los datos serológicos también pueden ser valiosos en la evaluación de la efectividad de las vacunas4,11.
El Manual Terrestre, Capítulo 3.4.1 de la Organización Mundial de Sanidad Animal (OIE)12 recomienda kits comerciales de ELISA para la detección de anticuerpos de A. marginale. Estos incluyen un ELISA competitivo (ELISAc) basado en una proteína MSP5 recombinante5,13,14 y un kit de ELISA indirecto convencional (ELISAi) también basado en MSP5r15. El Manual Terrestre también recomienda el uso de ELISAi casero y proporciona un protocolo para la preparación del antígeno y el ensayo12.
Se han desarrollado ELISA caseros para el diagnóstico serológico de muchos patógenos16-20. En el INIFAP se desarrolló un kit de ELISAi casero para la detección de anticuerpos contra A. marginale en suero bovino. El ensayo se basa en el uso de cuerpos iniciales extraídos de eritrocitos infectados. Aunque la producción de este antígeno requiere una inversión inicial sustancial, la cantidad, calidad y longevidad del antígeno permite la realización de miles de pruebas durante un largo período. Este ensayo fue estandarizado hace más de 20 años11 y el lote de antígeno preparado entonces todavía está en uso. El procedimiento de producción de antígenos de A. marginale se llevó a cabo nuevamente para determinar la validez del procedimiento y la prueba. Los resultados en el presente estudio son consistentes para el diagnóstico serológico de anaplasmosis en muestras experimentales y de campo y a diferentes concentraciones de antígenos.
Para el presente trabajo se produjo un lote de antígenos siguiendo un protocolo desarrollado originalmente para la preparación de antígeno para la prueba de aglutinación en tarjeta (PAT-Ag), y la prueba de fijación del complemento y adaptado para ELISA9,21,22. El antígeno también se probó para detectar antigenicidad contra muestras de control y de campo.
Para la replicación del microorganismo se utilizaron novillos Black Aberdeen Angus del ganado del Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA). Al inicio del procedimiento todos los animales resultaron negativos en la PCR de punto final para A. marginale23, Babesia bovis y B. bigemina24,25, así como para anticuerpos contra los tres patógenos. Durante el período experimental, los animales se alimentaron con una dieta balanceada de acuerdo con el peso; se proporcionó agua ad libitum. Los animales se mantuvieron en aislamiento y se manejaron en condiciones que proporcionaban seguridad tanto para el ganado como para los operadores. Las cirugías, el tratamiento postquirúrgico y el cuidado del ganado se realizaron por personal veterinario certificado de acuerdo con el protocolo aprobado por el Comité Interno para el Cuidado y Uso de Animales de Experimentación (CICUAE) del CENID-SAI del INIFAP27, con base en la técnica quirúrgica descrita por Alexander28 por personal veterinario certificado.
La cepa mexicana Tizimín MEX-31-096-01 de Anaplasma marginale11,26 se utilizó como fuente del antígeno. Esta cepa se criopreserva en nitrógeno líquido como volumen celular empaquetado al 50 % en PVP-40 al 10 % a 17 % de eritrocitos infectados.
Para el monitoreo se extrajeron muestras de sangre de la vena coccígea utilizando tubos evacuados con heparina como anticoagulante. La temperatura rectal (TR), el volumen celular aglomerado (VCA) estimado mediante la técnica del microhematocrito y el porcentaje de eritrocitos infectados (PEI, cuantificado por observación al microscopio de frotis de sangre) se registraron para su análisis con cada recolección de muestras. La cría 1 se inoculó por vía intramuscular (IM) con 4 ml de la cepa Tizimín recién descongelada. El monitoreo se realizó tres veces a la semana hasta la aparición de eritrocitos infectados en frotis de sangre teñidos con Giemsa, momento en el cual el monitoreo se realizó diariamente. Se extrajo el contenido de una bolsa de sangre CPD. La capa leucocitaria y el plasma se eliminaron por centrifugación y aspiración (Hermle Labortechnik, Modelo: Z 400 K, Serie: 50095021); las células sedimentadas se suspendieron al 50 % en solución salina fisiológica (NaCl al 0.85 %) y se inocularon por vía IM a la segunda cría. El mismo procedimiento se utilizó para la inoculación de la tercera cría. En el pico del PEI, la sangre de la tercera cría se extrajo mediante punción de la vena yugular en bolsas de sangre CPD comerciales equipadas con agujas de 16G (450 ml + 10 % CPDA). Se aplicó xilacina a una dosis adecuada como sedante para evitar el sufrimiento y el animal fue sujetado físicamente con cuerdas.
La sangre se filtró a través de gasa estéril y los eritrocitos se sedimentaron por centrifugación en volúmenes de 500 ml a 2,500 rpm a 4 °C durante 20 min (Hermle Labortechnik, Z 400 K, Serie: 50095021). La capa leucocitaria y el plasma se eliminaron por aspiración. Los eritrocitos (glóbulos rojos o GR) se suspendieron al 50 % en PBS frío pH 7.2 y se lavaron por centrifugación un total de tres veces; en el último lavado, los GR se suspendieron en PBS-antibióticos (PBS-Ab, penicilina 1,000 U/estreptomicina 1 mg/ml). La suspensión de eritrocitos se disgregó en un microfluidizador (Microfluidics, Hc-8000, Serie: 99100) a 7,400 PSI. El lisado se centrifugó a 10,000 xg (Hitachi, RPR 9 12 818 rotor) a 4 °C durante 30 min; el sobrenadante se desechó y el sedimento se suspendió con 30 ml de PBS-Ab y se homogeneizó por sonicación (Omni Sonic Ruptor 400) durante tres ciclos de 2 min al 50 % de potencia en un baño de hielo con pausas de 1 min para evitar sobrecalentamiento. El homogeneizado se procesó en un homogeneizador de alta presión a 1,200 PSI para liberar todos los cuerpos iniciales que permanecían en los GR no lisados y se centrifugó a 16,300 xg, durante 30 min a 4 °C. Para monitorear el proceso, frotis teñidos con Giemsa se hicieron a partir del sedimento de cada etapa para monitorear los núcleos de glóbulos blancos y las membranas de GR. El Ag se ajustó al 4 % p/v en tampón de acetato y se homogeneizó por agitación con un agitador magnético durante 30 min a temperatura ambiente. La proteína en el Ag se cuantificó mediante el método micro-Bradford (BioRad®) utilizando albúmina sérica bovina como estándar.
La antigenicidad de este nuevo lote de antígeno de A. marginale (Ag-2018) se verificó comparándolo con un lote en uso (Ag-2012). Se mezcló suficiente antígeno de cada lote con un volumen igual de SDS al 0.1 % en H2O29 y se incubó durante 30 min a temperatura ambiente (20 a 25 °C). Las mezclas de antígeno-SDS se diluyeron en tampón de carbonato-bicarbonato pH de 9.6 a un volumen final de 25 ml. El Ag-2012 se utilizó rutinariamente a 1.07 μg/200 μl de proteína/pozo. Ambos antígenos se ajustaron a la concentración antes mencionada. Para el propósito de este estudio, los pozos de las placas de microtitulación recibieron volúmenes de 200 μl por pozo de reactivos y soluciones de lavado en cada etapa del procedimiento. Las placas recibieron 1.07 μg de proteína/pozo (concentración 1X) y se incubaron durante la noche a 4 °C, después las placas se lavaron tres veces con PBS pH 7.2-Tween-20 al 0.05 % (PBS-T20) y se corrieron con leche descremada al 5 % en PBS-T20 pH 7.2 durante 30 min. Después de tres lavados con PBS-T20, las muestras de suero de control diluidas 1:100 en PBS-T20 se ejecutaron por duplicado o triplicado. Las placas se incubaron durante 1 h a 37 °C y se lavaron tres veces con PBS-T20. IgG antibovina de conejo conjugada con fosfatasa alcalina (Jackson ImmunoResearch Laboratories, Lote: 112108) diluida 1:10,000 en PBS-T20 se colocó en cada pozo; las placas se incubaron durante 60 min a 37 °C y se lavaron como se describió; se añadió P-nitrofenilfosfato al 0.075 % en tampón Tris pH 9.5 y se dejó incubar durante 30 min a 37 °C. Las placas se leyeron a 405 nm en un lector de absorbancia de microplacas (BioRad, iMark™) y se registraron los valores de densidad óptica (DO). Se utilizaron como blancos dos pozos que contenían todos los componentes, excepto el suero. La absorbancia media de estos pozos blancos se restó de los valores de absorbancia de todos los demás pozos de la placa. También se calculó la media y la desviación estándar de las réplicas y los controles de suero positivos y negativos.
El nuevo antígeno se sometió a tres ensayos para: a) verificar su antigenicidad en comparación con el Ag-2012, contra sueros control conocidos, b) definir el límite de antigenicidad y c) verificar su sensibilidad frente a muestras de suero de campo.
Para verificar la antigenicidad, 12 sueros de control positivos y 10 negativos utilizados rutinariamente para realizar el ELISAi y utilizados oficialmente en el Laboratorio de Hemoparásitos del Centro Nacional de Servicios de Constatación en Salud Animal (CENAPA) se corrieron por duplicado contra cada uno, Ag-2012 y Ag-2018 a la misma concentración de proteína (a 1.07 μg/200 μl, 1X). La media, desviación estándar y el error se calcularon para cada conjunto de réplicas para determinar que el ensayo no tuviera errores.
Para evaluar el límite de antigenicidad, cuatro sueros de control positivos y cuatro negativos se corrieron por duplicado contra cada antígeno a concentraciones de 2X (2.14 μg), 1X (1.07 μg), ½ X (0.535 μg) y ¼ X (0.268 μg). El resto del ensayo se llevó a cabo como se describe.
Para verificar la antigenicidad contra muestras de campo, se probaron veinte (20) sueros problema desconocidos contra ambos lotes de antígenos a una concentración de 1X; todas las muestras se ejecutaron por duplicado. El punto de corte (PC) se calculó como se describe.
Los resultados se expresan como el valor de la DO de la muestra menos el valor de la lectura del blanco. El índice de positividad (IP) para cada muestra de suero se calculó como el cociente de la absorbancia media dividido entre el valor del PC, donde ≥1= positivo; <1= negativo. Los resultados se sometieron a un análisis de varianza (ANOVA) aplicando la prueba t de Student utilizando Social Science Statistics disponible en https://www.socscistatistics.com/tests/anova/Default2.aspx. Para los propósitos de este reporte, se utilizó como error el porcentaje que representa el valor de la desviación estándar (DE) de la media de cada par de repeticiones, con el fin de verificar el desempeño del operador. Siempre que el error era ≥20, el resultado se descartaba y la muestra se repetía. Las medias de las muestras de campo se sometieron a un análisis de χ2 con las herramientas en línea VassarStats, (http://vassarstats.net), y la calculadora de evaluación de pruebas de diagnóstico (https://www.medcalc.org/calc/diagnostic_test.php).
Utilizando el procedimiento descrito, se alcanzó un PEI máximo de 65.7 en la última cría en el día 7 con un VCA del 26 %. De este último animal se extrajeron catorce bolsas de sangre de 500 ml de sangre infectada. La sangre se procesó y el antígeno producido tuvo un rendimiento total de 144.26 mg de proteína en un volumen final de 210 ml, equivalente a 0.687 μg/μl de antígeno. El Ag-2012, que se utiliza rutinariamente en una dilución 1/200, se volvió a cuantificar ya que se utilizó como referencia; este lote tenía 0.494 μg/μl.
Para verificar la antigenicidad, 12 sueros de control positivos y 10 negativos se ejecutaron por duplicado contra cada uno, Ag-2012 y Ag-2018 a la misma concentración de proteína (1.07 μg/pocillo). La media, la desviación estándar y el error se calcularon para cada par para determinar que el ensayo no tuviera errores. El análisis de varianza y la prueba t de Student de los valores medios de cada suero no mostraron diferencias significativas (P≥0.5) con un valor F de 0.99826 entre las muestras de control positivas con cualquiera de los antígenos.
La comparación de los sueros negativos mostró que las lecturas de DO fueron ligeramente mayores cuando se probaron contra Ag-2012 (Figura 1); el análisis de la varianza de las medias negativas de DO mostró una diferencia significativa (P>0.01) entre los resultados para Ag-2018 vs Ag-2012 con un valor F de 33.54294.
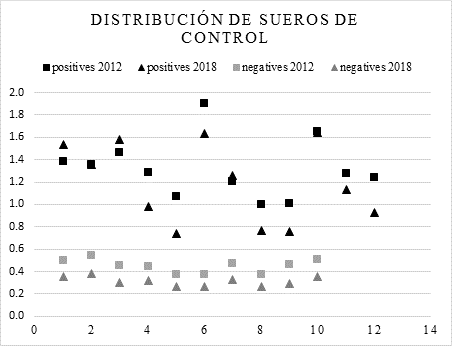
Todas las muestras de suero se diluyeron 1:100 y se probaron por duplicado. Los antígenos se utilizaron a 1.07 (g/pocillo.
Figura 1 Valores de DO de sueros de control. Distribución de dispersión de 12 sueros de control positivos y 10 negativos probados contra Ag-2012 y Ag-2018
A partir de esta primera comparación, el punto de corte calculado para los sueros negativos probados con Ag-2018 fue de 0.40, mientras que para los mismos sueros probados con Ag-2012 fue de 0.570. El índice medio de positividad para todos los sueros positivos probados con Ag-2018 fue de 3.44, mientras que para los mismos sueros probados con Ag-2012 fue de 2.73 (Figura 2).
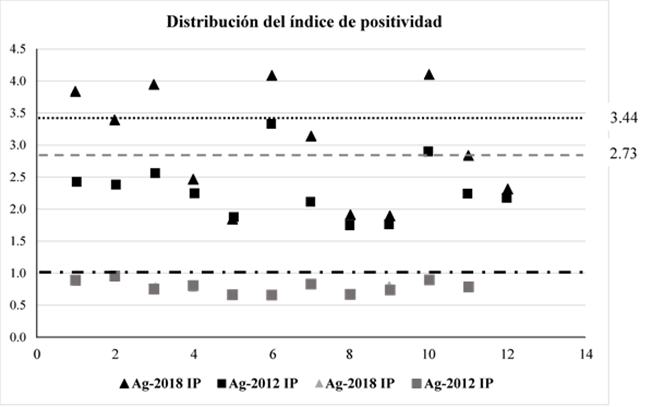
El valor medio del IP para todos los sueros positivos probados con Ag-2018 fue de 3.44 (línea punteada); el IP medio para los mismos sueros probados con Ag-2012 fue de 2.73 (línea discontinua).
Figura 2 Distribución de dispersión del índice de positividad (IP). Valores de IP ≥1= positivo (línea roja); <1= negativo
Los valores del IP para todos los sueros positivos (Figura 2) se calcularon para su respectivo PC. Los índices de positividad fueron de 2.69 y 2.093 con Ag-2018 y Ag-2012, respectivamente. Si dividimos el IP medio (2.69) para Ag-2018 entre el IP de Ag-2012 (2.093), da un cociente de 1.28, este valor indica que el Ag-2018 es 1.28 veces mejor para discriminar sueros positivos que el Ag-2012.
Determinación del límite de antigenicidad. Los dos antígenos se probaron en cuatro concentraciones de proteínas contra cuatro sueros de control positivos y cuatro negativos como se describe. Como se observa, los sueros positivos y negativos mostraron distribuciones similares a concentraciones decrecientes contra Ag-2012 (panel superior) y Ag-2018 (panel inferior, Figura 3). El análisis de varianza dentro de cada antígeno y entre antígenos se realizó tomando como valor independiente la lectura de DO de cada réplica. No se observaron diferencias significativas al comparar los resultados entre antígenos o por concentración contra los sueros positivos; en el caso del Ag 2018, cuando se toman los valores de los sueros positivos, se observa que la prueba F no fue significativa, f= 0.56757 y un valor de P= 0.639377, en P>0.05. Asimismo, cuando los sueros positivos se prueban contra diferentes concentraciones de Ag-2012, tampoco se observa una diferencia significativa, f= 1.66871 y un valor de P= 0.187871, que no es significativo (P>0.05).

Se probaron cuatro sueros de control positivos y cuatro negativos contra concentraciones de antígeno (de izquierda a derecha) de 0.25 X, 0.5 X, 1.0 X y 2.0 X
El panel superior muestra la distribución de la relación de controles positivos y negativos entre las concentraciones utilizadas para Ag-2012, mientras que el panel inferior muestra la respectiva para Ag-2018.
Figura 3 Límite de límite de antigenicidad
Al aplicar el ANOVA a los valores de cada suero positivo para cada concentración entre antígenos, hubo diferencias significativas. Por ejemplo, cuando se compararon los resultados de los sueros a la concentración doble (2.14 μg/pocillo), se obtuvo un valor de F= 18.56523; el valor de P fue de 0.000342, que fue significativo para P>0.05.
Finalmente, con el fin de verificar la eficiencia de los antígenos en la discriminación de muestras de campo, se probaron 20 sueros de casos de campo contra ambos antígenos en paralelo a 1.07 μg de proteína por pocillo. Los sueros se corrieron por duplicado. Además, se corrieron tres sueros de control negativos y tres positivos en la misma placa. El punto de corte para cada antígeno fue de 0.446 y 0.354 para Ag-2012 y Ag-2018 respectivamente. Trece de veinte muestras fueron positivas y 7/20 negativas contra Ag-2012; en contraste con 12/20 positivas y 8/20 negativas cuando se probaron contra Ag-2018. Adicionalmente, dos muestras positivas para Ag-2012 fueron negativas para Ag-2018; por otro lado, una muestra negativa para Ag-2012 fue positiva para Ag-2018, por lo tanto, no hubo una coincidencia del 100 % entre los dos antígenos (Cuadro 1). Sin embargo, cuando los resultados se analizaron mediante la prueba χ 2 , el valor del estadístico de la prueba exacta Fisher fue de 0.2049; por lo tanto, no hubo una diferencia significativa en P>0.05 entre los dos antígenos al discriminar positivos de negativos. Según la calculadora de evaluación de pruebas de diagnóstico (Cuadro 2), hubo 100.00 % de sensibilidad, 87.5 % de especificidad, un valor predictivo positivo de 92.31 % y un valor predictivo negativo de 100.00 % para las dos pruebas (Cuadro 2).
Cuadro 1 Verificación de antigenicidad contra muestras de campo. Ambos antígenos se utilizaron a una proteína de 1.07 μg/pozo
| Ag 2012 | Ag 2018 | ||||
|---|---|---|---|---|---|
| Sueros | Media | IP | Media | IP | |
| 1 | 0.514 | 1.15 | 0.365 | 1.03 | |
| 2 | 0.449 | 1.01 | 0.386 | 1.09 | |
| 3 | 0.466 | 1.05 | 0.386 | 1.09 | |
| 4 | 1.123 | 2.52 | 1.167 | 3.30 | |
| 5 | 0.350 | 0.79 | 0.269 | 0.76 | |
| 6 | 0.397 | 0.89 | 0.310 | 0.87 | |
| 7 | 0.491 | 1.10 | 0.356 | 1.00 | |
| 8 | 0.464 | 1.04 | 0.328 | 0.93 | |
| 9 | 0.967 | 2.17 | 0.937 | 2.65 | |
| 10 | 0.462 | 1.04 | 0.335 | 0.95 | |
| 11 | 0.353 | 0.79 | 0.279 | 0.79 | |
| 12 | 0.509 | 1.14 | 0.435 | 1.23 | |
| 13 | 0.424 | 0.95 | 0.376 | 1.06 | |
| 14 | 0.368 | 0.83 | 0.316 | 0.89 | |
| 15 | 0.414 | 0.93 | 0.319 | 0.90 | |
| 16 | 0.466 | 1.04 | 0.431 | 1.22 | |
| 17 | 0.999 | 2.24 | 0.973 | 2.75 | |
| 18 | 0.691 | 1.55 | 0.583 | 1.65 | |
| 19 | 0.497 | 1.12 | 13.0 | 0.444 | 1.26 |
| 20 | 0.370 | 0.83 | 0.306 | 0.86 | |
| Control negativo | 0.427 | 0.334 | |||
| 0.385 | 0.299 | ||||
| 0.400 | 0.404 | 0.291 | 0.308 | ||
| Control positivo | 1.114 | 1.051 | |||
| 1.125 | 1.023 | ||||
| 1.132 | 1.124 | 1.123 | 1.066 | ||
| Media de los negativos | 0.404 | 0.308 | |||
| DE | 0.021 | 0.023 | |||
| PC | 0.446 | 0.354 | |||
Las muestras de suero se diluyeron 1/100 y se corrieron por duplicado. Las condiciones de prueba fueron las mismas que las utilizadas para el examen de rutina de muestras desconocidas. Las muestras en fondo amarillo son aquellas con un índice de positividad ≥1.
Cuadro 2 Evaluación de pruebas de diagnóstico de MedCalc. El estadístico ( 2 es 7.2. El valor P es 0.00729
| Estadístico | Valor (%) |
IC del 95 % |
|---|---|---|
| Sensibilidad | 100.00 | 73.54 a 100.00 % |
| Especificidad | 87.50 | 47.35 a 99.68 % |
| Razón de verosimilitud positiva | 8 | 1.08 a 43.43 |
| Razón de verosimilitud negativa | 0 | 1.28 a 50.04 |
| Prevalencia de la enfermedad (*) | 60.00 | 36.05 a 80.88 % |
| Valor predictivo positivo (*) | 92.31 | 65.73 a 98.69 % |
| Valor predictivo negativo (*) | 100.00 | |
| Precisión (*) | 95.00 | 75.13 a 99.87 % |
* Este resultado es significativo en P<0.01. El estadístico ( 2 con corrección de Yates es 5. El valor P es 0.025347. No significativo en P<0.01.
La anaplasmosis bovina es una enfermedad infecciosa que se presenta principalmente en regiones tropicales y subtropicales, es de importancia mundial y, en México, se distribuye por todo el territorio nacional30,31, causando pérdidas considerables en el ganado2. El diagnóstico serológico de esta enfermedad es una herramienta útil para las estrategias de profilaxis, tratamiento y control a nivel individual y de rebaño4. Se han adaptado varias técnicas para la detección de anticuerpos contra A. marginale, pero se prefieren los inmunoensayos debido a su escalabilidad, idoneidad para la automatización, objetividad y, a menudo, mayor sensibilidad y especificidad para la identificación de bovinos asintomáticos3.
Cuando se desarrolló una prueba ELISA indirecta para el diagnóstico de anaplasmosis bovina y se comparó con la prueba de fijación del complemento (PFC)8,32, el ensayo mostró varias ventajas sobre la PFC, como la interpretación objetiva y la capacidad de usar suero contaminado con hemoglobina (no ideal pero muy común cuando se trabaja con muestras de campo). Además, el ELISAi se basa en la afinidad anticuerpo-antígeno y no en la concentración de anticuerpos. Sin embargo, desde entonces se han realizado varias adaptaciones a la técnica.
Como la presencia de A. marginale y A. centrale es común en otros países, se ha incorporado el uso de antígenos recombinantes en ELISAi para la detección de anticuerpos contra ambos agentes5. La ausencia de A. centrale en México permite el uso continuo de ELISAi con antígeno crudo para el diagnóstico serológico de rutina de A. marginale. Además, los reportes de una tasa positiva para un ELISA basado en bacterias enteras que fue significativamente mayor que la tasa de seropositividad para un ELISA donde se utilizan antígenos recombinantes16,33,34 llevaron a la hipótesis de que los antígenos nativos crudos permiten la detección de una gama más amplia de anticuerpos, ya que presentan más de un epítopo del patógeno.
En el presente trabajo, se produjo un lote de antígeno crudo de A. marginale a partir de la sangre de un novillo esplenectomizado infectado. La producción de antígenos crudos implica un gran esfuerzo en términos de horas-hombre y costosos animales libres de enfermedades, además, requiere cirugías en los animales de experimentación y cuidados postoperatorios durante la recuperación. Sin embargo, a través de este procedimiento, fue posible alcanzar 65 % de eritrocitos infectados en el último bovino, del cual se exanguinaron aproximadamente 14 L de sangre. Después de un proceso laborioso de extracción y lavado, se obtuvieron 210 ml de antígeno con una concentración final de proteína de 144.26 mg, equivalente a 0.687 μg/μl. Esta concentración es mayor en comparación con las concentraciones de proteína recombinante5 donde el rendimiento fue de 40 mg/L y 60 mg/L de cultivo por cada proteína recombinante utilizada en ese trabajo. Esto apoya el uso de proteínas nativas crudas como el antígeno de recubrimiento para las pruebas ELISAi, ya que su rendimiento implica ahorros económicos y precios más asequibles para los productores.
Para probar la antigenicidad del nuevo lote, se corrieron 12 sueros de control positivos y 10 negativos contra ambos antígenos. Las lecturas medias de DO de sueros positivos ejecutados contra Ag-2012 y Ag-2018 no fueron significativamente diferentes; en contraste, los valores de DO de los sueros negativos fueron más altos cuando se probaron contra Ag-2012 que con Ag-2018 (Figura 1). La media de todos los sueros negativos fue de 0.314 para Ag-2018, mientras que fue de 0.450 cuando se probó con Ag-2012. Cuando la media para los positivos se dividió entre la media de los negativos probados con Ag-2012, el cociente fue 2.93, mientras que ese valor fue de 3.79 para Ag-2018. Dividiendo 3.79 entre 2.93, se obtiene un valor de 1.28. Esto indica que el Ag-2018 es 1.28 veces mejor para discriminar positivos de negativos.
Para la prueba de límite de antigenicidad, los antígenos se ensayaron a una concentración de proteína de 2X, 1X, ½X y ¼X contra un lote de cuatro sueros de control positivos y cuatro negativos. Si bien hubo una disminución gradual en las lecturas de DO correspondientes a la concentración de antígenos, esta disminución no fue estadísticamente significativa, lo que indica que ambos antígenos se estaban utilizando en exceso. Las variaciones observadas entre las concentraciones de Ag-2018 fueron mínimas, mientras que los valores de los mismos sueros a las mismas concentraciones de Ag-2012 fueron más heterogéneos incluso cuando no fueron significativamente diferentes. No sabemos si estas variaciones se deben al envejecimiento o a la presencia de residuos en el lote de antígenos, pero las lecturas con el nuevo lote fueron más consistentes.
En la tercera prueba, la eficiencia del nuevo antígeno se probó contra 20 sueros de campo. Hubo 13 y 12 positivos para Ag-2012 y Ag-2018 respectivamente. Si bien no hubo una coincidencia del 100 % (Cuadro 1), las muestras que no coincidieron fueron diferentes sólo por centésimas de unidad (IP), es decir, cuando fueron positivas para una y negativas para la otra, estaban justo por encima del IP y viceversa, cuando fueron negativas estaban justo por debajo del IP. Esto da una correlación del 80 % entre los antígenos. Sin embargo, el análisis estadístico mostró una sensibilidad del 100 % (una mejora notable con respecto a la reportada previamente para un antígeno similar)32, una especificidad del 87.5 %, un valor predictivo positivo del 92.31 %, un valor predictivo negativo del 100 % y una precisión del 95 % (Cuadro 2). Estos resultados en términos de sensibilidad y especificidad son comparables a los ELISA desarrollados más recientemente3,5,17. Por lo tanto, estos resultados muestran que ambos lotes de antígenos son igualmente confiables para ejecutar rutinariamente el ELISAi casero.
El presente trabajo proporciona evidencia de la reproducibilidad en la producción de un lote de antígeno a otro, incluso muchos años después de haber sido preparado, siempre y cuando se siga el protocolo. La única diferencia en la preparación de estos dos lotes de antígenos fue el uso de tecnología más nueva para la disrupción de los eritrocitos infectados, es decir, un microfluidizador, un dispositivo que facilita el proceso en términos de disgregación de mayores volúmenes y aparentemente menos residuos en la preparación final. Estos dos lotes de antígeno ya están en uso en el Laboratorio del Departamento de Helmintos y Hemoparásitos del SENASICA para el diagnóstico de anaplasmosis bovina en ganado de productores mexicanos.
Se concluye que el nuevo lote de antígeno (Ag-2018) es tan bueno como el lote viejo. Ambos lotes deben titularse para reducir la concentración con el fin de optimizar el uso de cada lote, lo que a su vez reducirá el costo de la prueba haciéndola más asequible para los productores. Los antígenos producidos por un laboratorio gubernamental tienen un estándar de alta calidad y son confiables, ya que están regulados por agencias internacionales e internacionales. La necesidad de kits ELISA disponibles comercialmente se evita cuando se dispone de un ELISAi casero que reduce los costos y los períodos de importación, lo que hace que las pruebas sean más eficientes y rápidas.
Agradecimientos
Los resultados forman parte de las actividades de los proyectos fiscales “Conservación de germoplasma de la rickettsia Anaplasma marginale” (INIFAP 1162734713) y “Establecimiento de cultivo in vitro de cepas mexicanas de Anaplasma marginale en células de garrapata” (INIFAP 13341734501). Se agradece todas las facilidades otorgadas por el SENASICA para la realización de este trabajo.
REFERENCIAS
1. Aubry P, Geale DW. A review of bovine anaplasmosis. Transbound Emerg Dis 2011;58(1):1-30. [ Links ]
2. Rodríguez SD, García-Ortiz MA, Jiménez-Ocampo R, Vega y Murguía CA. Molecular epidemiology of bovine anaplasmosis with a particular focus in Mexico. Infect Genet Evo 2009;9(6):1092-1101. doi: 10.1016/j.meegid.2009.09.007. [ Links ]
3. Primo ME, Thompson CS, Valentini BS, Sarli M, Novoa MB, et al. Development of a novel fusion protein with Anaplasma marginale and A. centrale MSP5 improved performance of Anaplasma antibody detection by cELISA in infected and vaccinated cattle. PLoS One 2019;14(1):e0211149. DOI: 10.1371/journal.pone.0211149 [ Links ]
4. Rodríguez PJL, Forlano RMD, Meléndez MRD. Dinámica de anticuerpos e infección activa por Anaplasma marginale en becerras. Rev Med Vet 2020;(40):35-44. https://doi.org/10.19052/mv.vol1.iss40.4 [ Links ]
5. Sarli M, Thompson CS, Novoa MB, Valentini BS, Mastropaolo M, et al. Development and evaluation of a double-antigen sandwich ELISA to identify Anaplasma marginale-infected and A. centrale-vaccinated cattle. J Vet Diagn Invest 2020;32(1):70-76. doi: 10.1177/1040638719892953. [ Links ]
6. Löhr KF, Ross JP, Meyer H. Studies on homologous and heterologous antibody responses to infections with Anaplasma marginale and A. centrale using the indirect fluorescent antibody and capillary tube agglutination tests. Z Tropenmed Parasitol 1973;24(1):86-95. [ Links ]
7. Price KE, Brock WE, Miller JG. An evaluation of the complement-fixation test for anaplasmosis. Am J Vet Res 1954;15(57):511-516. [ Links ]
8. Gonzalez E, Long R, Todorovic R. Comparisons of the complement-fixation, indirect fluorescent antibody, and card agglutinationtests for the diagnosis of bovine anaplasmosis. Am J Vet Res 1978;39:1538-1541. [ Links ]
9. González BC, Obregón D, Alemán Y, Alfonso P, Vega E, Díaz A, Martínez S. Tendencias en el diagnóstico de la anaplasmosis bovina. Rev Salud Anim 2014;36(2):73-79. [ Links ]
10. Barry DN, Parker RJ, De Vos AJ, Dunster P, Rodwell BJ. A microplate enzyme-linked immunosorbent assay for measuring antibody to Anaplasma marginale in cattle serum. Aust Vet J 1986;63(3):76-79. [ Links ]
11. Rodríguez CSD, García OMA, Cantó AGJ, Hernández SG, Santos CN, et al. Ensayo de un inmunógeno experimental inactivado contra Anaplasma marginale. Tec Pecu Mex 1999;37(1):1-12. [ Links ]
12. OIE. Organización Mundial de Sanidad Animal. Manual de las pruebas de diagnóstico y de las vacunas para los animales terrestres (mamíferos, aves y abejas). 2004, Section 3.4.; Chapter 3.4. Bovine Anaplasmosis. https://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/3.04.01_BOVINE_ANAPLASMOSIS.pdf. [ Links ]
13. Knowles D, Torioni de Echaide S, Palmer G, McGuire T, et al. Antibody against an Anaplasma marginale MSP5 epitope common to tick and erythrocyte stages identifies persistently infected cattle. J Clin Microbiol 1996;34(9):2225-2230. doi: 10.1128/jcm.34.9.2225-2230.1996. [ Links ]
14. Chung C, Wilson C, Bandaranayaka-Mudiyanselage CB, Kang E, Adams DS, et al. Improved diagnostic performance of a commercial Anaplasma antibody competitive enzyme-linked immunosorbent assay using recombinant major surface protein 5-glutathione S-transferase fusion protein as antigen. J Vet Diagn Invest 2014;26(1):61-71. doi: 10.1177/1040638713511813. [ Links ]
15. Morzaria SP, Katende J, Musoke A, Nene V, Skilton R, et al. Development of sero-diagnostic and molecular tools for the control of important tick-borne pathogens of cattle in Africa. Parassitologia 1999;41 Suppl 1:73-80. [ Links ]
16. Ortona E, Riganoa R, Margutti P, Notargiacomo S, Ioppolo S, et al. Native and recombinant antigens in the immunodiagnosis of human cystic echinococcosis. Parasite Immunol 2000;22(11):553-539. doi: 10.1046/j.1365-3024.2000.00336.x. [ Links ]
17. Schweiger A, Grimm F, Tanner I, Müllhaupt B, Bertogg K, et al. Serological diagnosis of echinococcosis: the diagnostic potential of native antigens. Infection 2012;40(2):139-152. doi: 10.1007/s15010-011-0205-6. [ Links ]
18. Galo SS, González K, Téllez Y, García N, Pérez L, et al. Development of in-house serological methods for diagnosis and surveillance of chikungunya. Rev Panam Salud Publica 2017;41:e56. doi: 10.26633/RPSP.2017.56. [ Links ]
19. Alandijany TA, El-Kafrawy SA, Tolah AM, Sohrab SS, Faizo AA, et al. Development and optimization of in-house ELISA for detection of human IgG antibody to SARS-CoV-2 full length spike protein. Pathogens 2020;9(10):803. doi: 10.3390/pathogens9100803. [ Links ]
20. Sil BK, Jahan N, Haq MA, Oishee MJ, Ali T, et al. Development and performance evaluation of a rapid in-house ELISA for retrospective serosurveillance of SARS-CoV-2. PLoS One 2021;16(2):e0246346. doi: 10.1371/journal.pone.0246346. [ Links ]
21. Rogers TE, Hidalgo RJ, Dimopoullos GT. Immunology and serology of Anaplasma marginale. I. Fractionation of the complement-fixing antigen. J Bacteriol 1964;88(1):81-86. doi: 10.1128/jb.88.1.81-86.1964. [ Links ]
22. Amerault TE, Roby TO. A rapid card agglutination test for bovine anaplasmosis. J Am Vet Med Assoc 1968;153(12):1828-1834. [ Links ]
23. Torioni de Echaide S, Knowles DP, McGuire TC, Palmer GH, Suarez CE, et al. Detection of cattle naturally infected with Anaplasma marginale in a region of endemicity by nested PCR and a competitive enzyme-linked immunosorbent assay using recombinant major surface protein 5. J Clin Microbiol 1998;36(3):777-782. doi: 10.1128/JCM.36.3.777-782.1998. [ Links ]
24. Figueroa JV, Chieves LP, Johnson GS, Buening GM. Detection of Babesia bigemina-infected carriers by polymerase reaction amplification. J Clin Microbiol 1992;30:2576-2582. doi: 10.1128/JCM.30.10.2576-2582.1992. [ Links ]
25. Figueroa JV, Chieves LP, Johnson GS, Buening GM. Multiplex polymerase chain reaction-based assay for the detection of Babesia bigemina, Babesia bovis and Anaplasma marginale DNA in bovine blood. Vet Parasitol 1993;50;69-81. doi: 10.1016/0304-4017(93)90008-B. [ Links ]
26. Martínez-Ocampo F, Quiroz-Castañeda RE, Amaro-Estrada I, Cobaxin Cárdenas M, Dantán-González E, et al. Draft genome sequences of Anaplasma marginale strains MEX-15-099-01 and MEX-31-096-01, two Mexican isolates with different degrees of virulence. Microbiol Resour Announc 2019;8(45):e01184-19. doi: 10.1128/MRA.01184-19. [ Links ]
27. Salinas EE, Preciado TJF, Rodríguez CSD, Cobaxin CME, Amaro EI, Quiroz CRE. Esplenectomía experimental en bovinos como apoyo en el estudio de Anaplasma marginale. INIFAP. 2019. Libro Técnico No. 20, ISBN: 978-607-37-1152-4 [ Links ]
28. Alexander A. Técnica quirúrgica en animales y temas de terapéutica quirúrgica, 4th ed. México: Interamericana. 1979:170-172. [ Links ]
29. Winkler GC, Brown GM, Lutz H. Detection of antibodies to Anaplasma marginale by an improved enzyme-linked immunosorbent assay with sodium dodecyl sulfate-disrupted antigen. J Clin Microbiol 1987;25(4):633-636. doi:10.1128/jcm.25.4.633-636.1987. [ Links ]
30. Fragoso Sánchez H. 2do Seminario Internacional de Parasitología Animal. Memorias. 1991:153-160. [ Links ]
31. Preciado TJF, García-Ortiz MA, Hernández-Ortiz R, Rodríguez-Camarillo SD. Anaplasmosis bovina en las cuencas lecheras de México. En: Milian SF, Hernández AL, Hernández OR. Situación epidemiológica de la ganadería lechera en México, CENID Microbiología animal, INIFAP. 2015:51-73. [ Links ]
32. Tello RM, Álvarez MJA, Ramos AJA, Aboytes TR, Cantó AGJ. La prueba de ELISA en el diagnóstico de la anaplasmosis. Téc Pecu Méx 1986;52:45-50. [ Links ]
33. Ito A, Xiao N, Liance M, Sato MO, Sako Y, et al. Evaluation of an enzyme-linked immunosorbent assay (ELISA) with affinity-purified Em18 and an ELISA with recombinant Em18 for differential diagnosis of alveolar echinococcosis: results of a blind test. J Clin Microbiol 2002;40:4161-4165. doi:10.1128/JCM.40.11.4161-4165.2002. [ Links ]
34. Magnarelli LA, Bushmich SL, Sherman BA, Fikrig E. A comparison of serologic tests for the detection of serum antibodies to whole-cell and recombinant Borrelia burgdorferi antigens in cattle. Can Vet J 2004;45(8):667-673. [ Links ]
Recibido: 06 de Abril de 2021; Aprobado: 08 de Marzo de 2022











 texto en
texto en 


