Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.13 no.2 Mérida abr./jun. 2022 Epub 20-Jun-2022
https://doi.org/10.22319/rmcp.v13i2.5789
Revisiones bibliográficas
Ultrasonografía y descripción fisiológica de eventos esenciales para el manejo reproductivo en ganado lechero. Revisión
b Universidad Autónoma de Baja California, Instituto de Ciencias Agrícolas, Carretera a Delta S/N, C.P. 21705, Ejido Nuevo León, Baja California, México.
El ultrasonido permite visualizar el tracto reproductivo femenino y ayuda a comprender algunos de los eventos reproductivos más relevantes como el desarrollo folicular y del cuerpo lúteo, la ovulación, el diagnóstico de gestación, las infecciones uterinas, el crecimiento embrionario y fetal, entre otros. Hoy en día, existe una gran cantidad de información sobre la fisiología y la ultrasonografía de los eventos reproductivos mencionados anteriormente. Sin embargo, el abrumador número de artículos disponibles revisa los aspectos técnicos de la ultrasonografía, la fisiología y el manejo reproductivo por separado. Por lo tanto, el objetivo de la presente revisión es fusionar una descripción fisiológica con el manejo reproductivo y los aspectos técnicos de imágenes de ultrasonido originales de los eventos reproductivos más relevantes en el ganado lechero, para promover el uso de ultrasonido durante el manejo reproductivo del ganado lechero por parte de profesionales e investigadores.
Palabras clave Cuerpo lúteo; Embrión; Folículo; Feto
The ultrasound allows to visualize the female reproductive tract and helps to understand some of the most relevant reproductive events such as follicular and corpus luteum development, ovulation, pregnancy diagnosis, uterine infections, embryo and fetal growth, among others. Nowadays, there is a massive amount of information regarding the physiology and ultrasonography of the reproductive events mentioned above. However, the overwhelming number of available papers review technical aspects of ultrasonography, physiology and reproductive management separately. Therefore, the objective of the present review is to merge a physiological description with reproductive management and technical aspects of original ultrasound pictures of the most relevant reproductive events in dairy cattle to promote ultrasound use during dairy cattle reproductive management by practitioners and researchers.
Key words Corpus luteum; Embryo; Follicle; Fetus
Introducción
El beneficio económico de una granja lechera aumenta a medida que mejora la eficiencia reproductiva y el ultrasonido es una herramienta que ayuda a mejorar la toma de decisiones con respecto al manejo reproductivo en hatos lecheros y de carne1. Las imágenes de ultrasonografía pueden proporcionar información sobre la etapa fisiológica de los principales componentes del tracto reproductivo (ovario, folículo, cuerpo lúteo (CL) y útero) (Figuras 1 a 9), lo cual es valioso para decisiones de trabajo precisas de los profesionales e investigadores de la reproducción animal. Además, el ultrasonido permite diagnosticar condiciones patológicas del tracto reproductivo en tiempo real en condiciones de campo de una manera altamente confiable.
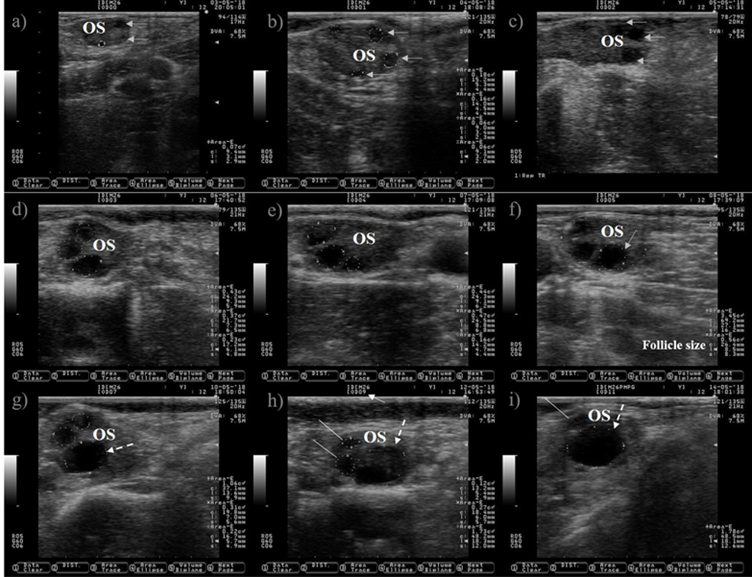
El ultrasonido permite visualizar solo la fase de selección y dominancia de la onda folicular, pero no la fase de reclutamiento, porque tiene lugar en una etapa muy temprana del desarrollo folicular. El folículo preovulatorio en el día cero y el subsecuente cuerpo lúteo se localizaron en el ovario izquierdo, pero solo se muestran imágenes del ovario derecho, porque es donde surgió la onda folicular. a) Un folículo antral pequeño está rodeado con una línea punteada en el día cero (las características anecogénicas del líquido folicular hacen que el folículo aparezca como un círculo oscuro), las flechas grises indican la presencia de otros dos folículos antrales. b) La onda folicular ha surgido, los cuatro folículos están rodeados con líneas punteadas en el día uno, tres de ellos se observaron previamente en el día cero (flechas grises). c) Las flechas grises apuntan a los tres folículos observados desde el día uno, el aumento de su tamaño se observa fácilmente en el día dos. El crecimiento de los tres folículos (líneas punteadas) observados desde el día cero se representa en las imágenes c) y d) (día tres y cuatro). e) El folículo dominante de la onda folicular es seleccionado (la selección del folículo dominante ocurre cuando el folículo más grande alcanza aproximadamente 8.5 mm de diámetro11), esto marca el final de la selección y el comienzo de la fase de dominancia. El crecimiento del folículo dominante (flechas discontinuas) y la atresia de los folículos subordinados (líneas blancas) se representan en las imágenes g) a i). OS: estroma ovárico. Flecha blanca: día del ciclo estral. Las im ágenes se tomaron utilizando una sonda de 7.5 MHz.
Figura 1 Imágenes que representan el crecimiento de ondas foliculares en ganado lechero desde el estro (día 0) hasta el día 11 del ciclo estral
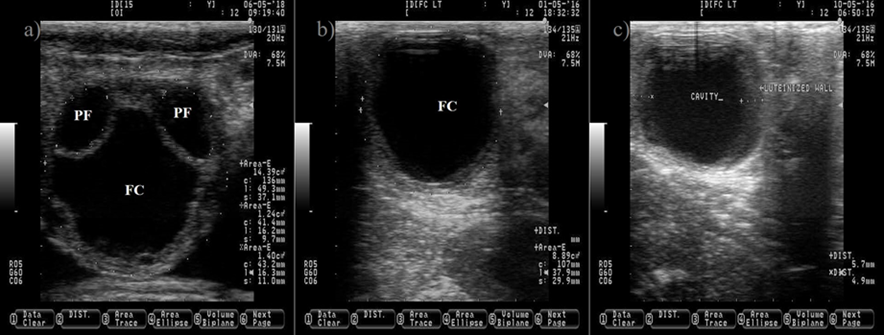
El líquido folicular anecogénico en el PF y FC hace que aparezcan como círculos negros. Las imágenes b y c representan un FC después de la luteinización inducida por inyección de GnRH, nótese el incremento en el grosor de la pared folicular (c). Las imágenes se tomaron utilizando una sonda de 7.5 MHz.
Figura 3 Quiste ovárico en ganado lechero. a) Imagen que representa dos folículos preovulatorios (PF) normales y un quiste folicular (FC) grande
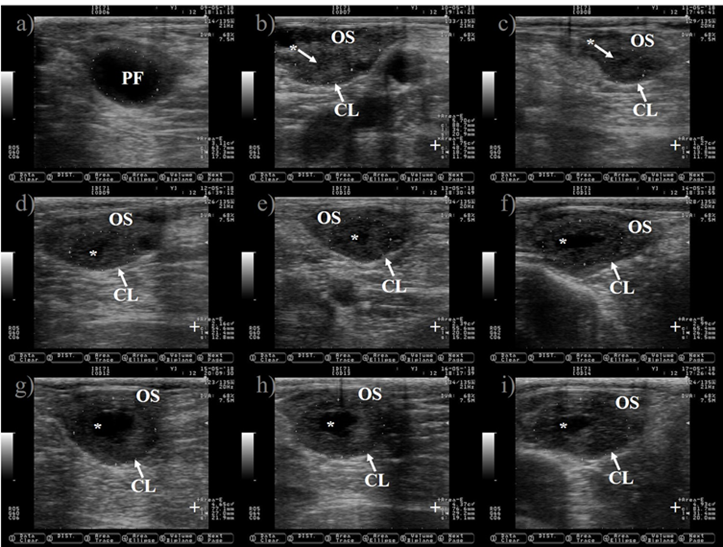
Las imágenes se tomaron aproximadamente cada 24 h desde el día anterior hasta 7 días después de la ovulación. a) Folículo preovulatorio (PF). b) CL temprano después de la ovulación del PF, nótese la presencia de cavidad lútea (*), el CL y el estroma ovárico (OS) son casi isoecogénicos hasta 2 días después de la ovulación (b-d), pero el CL se vuelve más oscuro (hipoecogénico) que el OS a medida que envejece (c-i). e) El CL está bien diferenciado del OS a los 3 días después de la ovulación. f-i) Las imágenes representan un CL en crecimiento, la cavidad lútea se identifica claramente en esta etapa (4-7 días después de la ovulación). i) El CL tiene casi el triple de su área (+) desde el día de la ovulación (b). Las imágenes se tomaron utilizando una sonda de 7.5 MHz.
Figura 4 Crecimiento del cuerpo lúteo (CL) después de la ovulación en ganado lechero Holstein
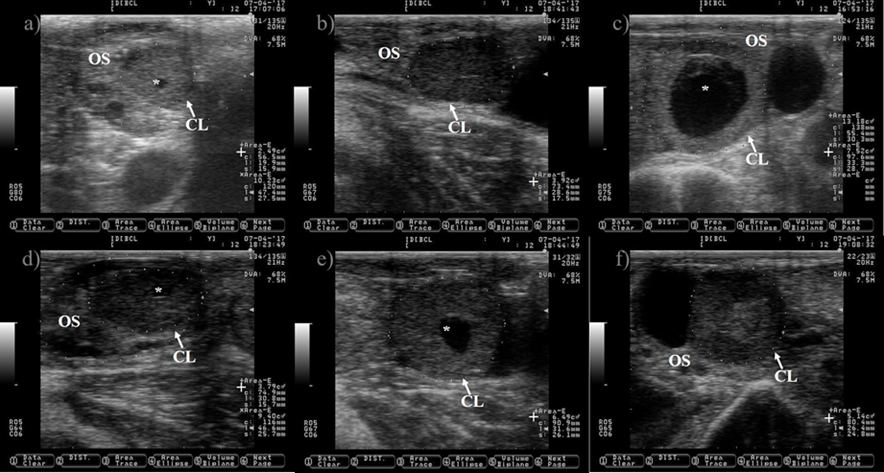
a, c, d y e) CL con cavidad lútea (*) de diferentes tamaños. b y f) CL sin cavidad lútea.
OS= estroma ovárico; += área del cuerpo lúteo. Las imágenes se tomaron utilizando una sonda de 7.5 MHz.
Figura 5 Imágenes que representan diferentes formas del cuerpo lúteo (CL) a los nueve días después del estro en ganado lechero Holstein
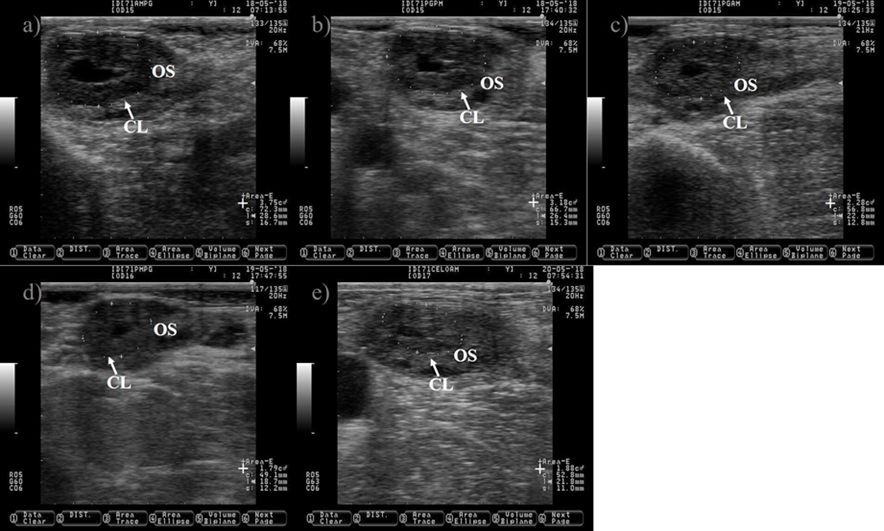
Las imágenes se tomaron a un intervalo de aproximadamente 12 h después de la inyección de prostaglandina hasta la detección del estro, utilizando una sonda de 7.5 MHz. a) CL justo antes de la inyección de prostaglandina. b) CL 10 h después de la inyección de prostaglandina, nótese la reducción de su tamaño (+). c) CL que muestra una reducción del 39 % en su tamaño 25 h después de la inyección de prostaglandina. d) CL que muestra una reducción del 52 % en su tamaño 34 h después de la inyección de prostaglandina. e) Imagen que representa el CL en regresión, 48 h después de la inyección de prostaglandina, nótese que el CL y el estroma ovárico (OS) son casi isoecogénicos. La imagen fue capturada unas horas después de que se detectara a la vaca en estro, el folículo preovulatorio se localizó en el ovario opuesto y no se muestra.
Figura 6 Imágenes que representan la regresión del cuerpo lúteo (CL) después de la inyección de prostaglandina en ganado lechero Holstein
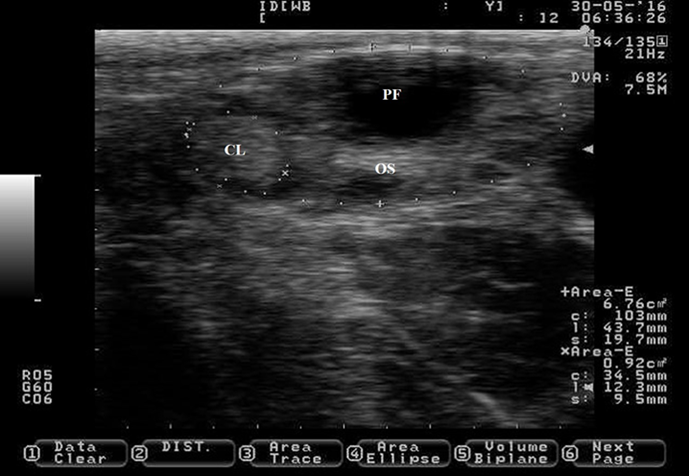
Un ovario y un cuerpo lúteo (CL) no funcional están rodeados por + y x. El folículo preovulatorio (PF) es el círculo negro en el centro superior del ovario. OS= estroma ovárico. Las imágenes se tomaron utilizando una sonda de 7.5 MHz.
Figura 7 Vestigio del cuerpo lúteo al momento del celo en ganado lechero Holstein

La flecha blanca apunta a los días de gestación. a) Embrión de 34 días de edad. b) Embrión de 41 días de edad. c) Embrión de 48 días de edad. e) Embrión de 55 días de edad.
*= embrión; A= amnios; AF= líquido alantoideo; += tamaño del embrión; H= cabeza; L= extremidades. Las imágenes se tomaron utilizando una sonda de 7.5 MHz. Las imágenes corresponden al mismo embrión.
Figura 8 Imágenes que representan el desarrollo embrionario en ganado lechero Holstein de 34 a 55 días de gestación
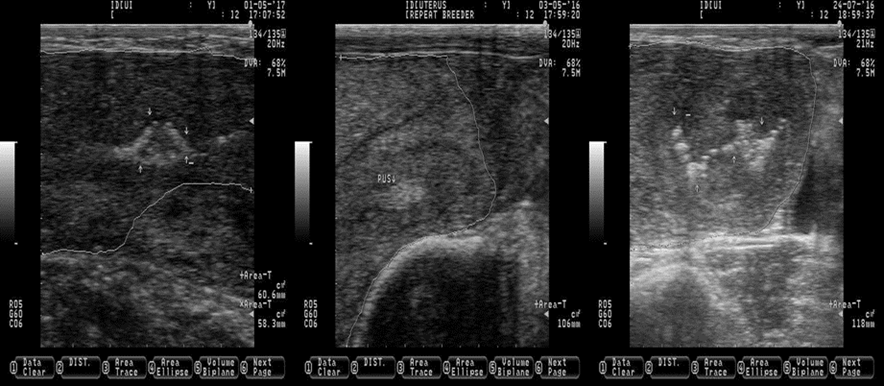
Las flechas blancas indican la ubicación de pus (la pus se observa como manchas brillantes y blancas de diferentes formas y tamaños). Las líneas blancas delimitan los cuernos uterinos. Las imágenes se tomaron utilizando una sonda de 7.5 MHz.
Figura 9 Imágenes que representan la presencia de pus (endometritis subclínica) en el útero de ganado lechero Holstein en etapas aleatorias de lactancia
Existen revisiones sobresalientes que discuten aspectos técnicos y prácticos sobre las aplicaciones del ultrasonido en el manejo reproductivo del ganado lechero2-7. Una búsqueda que incluye solo “México” y utiliza las palabras clave “ganado, folículo y tamaño del cuerpo lúteo” en SCOPUS revela que durante el período de 2015 a 2019 solo nueve artículos científicos fueron escritos por investigadores mexicanos, lo que es inferior a los 95 artículos científicos encontrados cuando la búsqueda se restringió a los Estados Unidos de América, durante el mismo período. Las razones de esto podrían incluir un menor número de investigadores en México que en los Estados Unidos de América, el acceso restringido a información de orientación para empoderar a nuevos profesionales del ultrasonido y la inversión económica necesaria para obtener un ultrasonido6. La orientación profesional siempre se recomienda cuando se adoptan nuevas tecnologías, pero cuando factores como el tiempo y la distancia geográfica limitan el acceso a la experiencia profesional, entonces la autoformación es la mejor opción. Sin embargo, los primeros encuentros con la gran cantidad de literatura científica pueden ser abrumadores para los nuevos profesionales del ultrasonido, porque no solo es obligatoria la revisión de la literatura relacionada con la ultrasonografía, sino que también se debe atender la fisiología y el manejo reproductivo del ganado lechero. A pesar de que los artículos disponibles revisan las aplicaciones de ultrasonido para el manejo reproductivo del ganado lechero, todavía hay espacio para enriquecer la literatura existente mediante la fusión de experiencias de campo realizando ultrasonografía con la fisiología y el manejo reproductivo del ganado.
Por lo tanto, el objetivo es fusionar una descripción fisiológica con el manejo reproductivo y los aspectos técnicos de imágenes de ultrasonido originales de los eventos reproductivos más relevantes en el ganado lechero, para promover el uso de ultrasonido durante el manejo reproductivo del ganado lechero por parte de profesionales e investigadores.
Eventos foliculares
Los folículos ováricos crecen en eventos cíclicos y organizados conocidos como ondas foliculares (Figura 1). Una onda folicular comprende tres etapas fijas (reclutamiento, selección y dominancia) y dos condicionales (atresia u ovulación)8. Durante las etapas fijas, se selecciona un folículo dominante de una cohorte de folículos en crecimiento, mientras que los folículos no seleccionados (subordinados) sufren atresia. Un folículo en crecimiento debe tener acceso a IGF-I, expresar receptores de LH y sintetizar estradiol en condiciones de concentraciones bajas de la FSH, para alcanzar la etapa de dominancia9. Después de la dominancia, el folículo seleccionado sufrirá atresia u ovulación dependiendo del entorno hormonal. La ovulación ocurrirá si el folículo alcanza la etapa de dominancia bajo concentraciones decrecientes de progesterona en sangre, de lo contrario sufrirá atresia y surgirá una nueva onda. La onda folicular emergente se caracteriza por la aparición de varios folículos de entre 3-4 mm10. Comúnmente se observan dos o tres ondas durante el ciclo estral en el ganado11.
El folículo preovulatorio es el folículo dominante que surge naturalmente de la última onda folicular del ciclo estral en vacas cíclicas y, en circunstancias normales, está destinado a ovular. El estradiol sintetizado por el folículo preovulatorio es responsable de los signos característicos del estro en el ganado e induce el aumento de GnRH/LH, que desencadena la ovulación. Los investigadores han tratado de establecer una relación entre el tamaño del folículo preovulatorio y el éxito de la gestación después de la inseminación artificial. En este sentido, los folículos alcanzan la capacidad ovulatoria en respuesta a la GnRH a los 10 mm de tamaño12. Sin embargo, la ovulación inducida por la GnRH en folículos pequeños (≤ 11 mm) o grandes (> 20 mm) afecta negativamente la fertilidad y aumenta la probabilidad de pérdida de la gestación13,14. Las razones explicativas de lo mencionado anteriormente incluyen una competencia ovocitaria reducida y una función lútea deteriorada cuando se induce la ovulación de folículos pequeños o grandes14,15. Por el contrario, el tamaño del folículo preovulatorio no compromete la tasa de preñez cuando la ovulación ocurrió espontáneamente13. Por lo tanto, la medición del folículo, para garantizar un tamaño adecuado, es aconsejable durante los protocolos que implican la inducción de la ovulación. Es común observar una amplia variación dentro y entre los nuevos profesionales de ultrasonido al medir el tamaño del folículo y del CL. Para evitar esta variación, se recomienda explorar siempre todo el ovario y luego capturar la vista más grande de la estructura ovárica deseada. Además, la presión física sobre el folículo preovulatorio debe minimizarse, debido al riesgo de deformación y ruptura de la estructura ovárica, que puede ocurrir cuando el ovario se manipula incorrectamente.
La vaca normalmente ovula un folículo entre 28 y 31 h después del inicio del estro16,17, pero ocasionalmente más de un folículo ovula (Figura 2), aumentando la incidencia de gestaciones gemelares. Las gestaciones con más de un producto no son deseadas, porque esto perjudica el rendimiento reproductivo y reducen la vida productiva de la madre18. Desafortunadamente, la incidencia de gestaciones gemelares ha aumentado a lo largo de los años. La mejora en la nutrición, las prácticas de manejo y el progreso genético para aumentar la producción de leche predisponen al aumento de la incidencia de gestaciones gemelares19. Además, las vacas que portan el alelo Trio son más propensas a tener gemelos20. Afortunadamente, la incidencia de la gestación gemelar puede ser prevenida mediante la rotura/aspiración de múltiples folículos antes de la inseminación artificial, dejando sólo un folículo preovulatorio21.
Se espera que la ovulación ocurra después del estro. Sin embargo, el 3.4 % y el 12.4 % de las vacas no ovularon, después del estro, durante la estación fría y cálida en un estudio realizado en España22. El fracaso de la ovulación (anovulación) bloquea completamente la oportunidad de gestación. Por lo tanto, la desaparición del folículo preovulatorio (ovulación) debe confirmarse mediante ultrasonido después del estro (Figura 4).
Las causas de la condición anovulatoria incluyen una baja frecuencia de pulsos de LH después del estro23 y la formación de quistes foliculares (Figura 3). Un quiste folicular es un folículo grande que no logra ovular y persiste durante un período anormal de tiempo en ausencia de un CL, causando un comportamiento del celo recurrente. Una concentración baja de progesterona24 que permite un aumento de la frecuencia de pulsos de LH para sostener el crecimiento folicular25, pero no para inducir un pico preovulatorio de LH que induzca la ovulación26, favorece la formación de quistes foliculares. Además, la inducción de un pico preovulatorio de LH, sin exposición subsecuente a la progesterona, también es efectiva para inducir la formación de quistes foliculares27.
El quiste folicular aparece como una estructura ovárica grande (> 25 mm de diámetro) con una pared delgada (< 3 mm), un antro no ecogénico, una gran proporción estradiol:progesterona y puede romperse si se manipula incorrectamente durante la palpación (Figura 3). Otro tipo de quiste es el folicular-luteal, también conocido como folículo luteinizado o quiste luteinizado. El quiste folicular luteinizado tiene una pared gruesa (> 3 mm), una cavidad reducida, una proporción estradiol:progesterona pequeña y no se romperá durante la palpación (Figura 3)28,29. Un quiste folicular luteinizado puede aparecer después del tratamiento del quiste folicular con inyecciones de GnRH. La ovulación y la liberación del ovocito del folículo preovulatorio son eventos primordiales que abren la posibilidad de gestación. Después de estos eventos, la siguiente estructura ovárica que se espera que se desarrolle es el CL.
Desarrollo y regresión del cuerpo lúteo
El CL es una glándula ovárica endocrina transitoria que regula la duración del ciclo estral y produce progesterona para crear un ambiente uterino adecuado para la gestación. El CL se origina de la transformación de las células foliculares de la granulosa y la teca en células lúteas grandes y pequeñas, lo cual es desencadenado por el pico preovulatorio de LH30. El seguimiento del crecimiento del CL durante el ciclo estral puede comenzar de 12 a 24 h después de la ovulación (Figura 4)31. El CL alcanza su tamaño máximo entre los días nueve y 10 del ciclo estral32,33. Aparece como una estructura de forma sólida semicircular o con una cavidad central (Figura 5). La cavidad está llena de un trasudado seroso o sangre34. La incidencia de CL con cavidades puede llegar hasta el 79 %31. La ovulación de folículos grandes predispone a la formación de cavidades35, sin comprometer la producción de progesterona ni la tasa de preñez en ganado Holstein35,36.
La medición del CL después de la inseminación es relevante porque la concentración de progesterona en sangre en la fase lútea media depende de su tamaño37 y se ha reportado una asociación positiva entre las concentraciones de progesterona y el área del CL en crecimiento38. Además, el ganado lechero con buen mérito genético para rasgos de fertilidad tiene mayores concentraciones de progesterona en sangre y CL más grande que aquel con bajo mérito genético39,40. El CL crece más rápido en vacas preñadas que en vacas no preñadas, desde el día seis al nueve del ciclo estral41, se desconoce una razón para explicar la diferencia en la tasa de crecimiento del CL. Sin embargo, una tasa de crecimiento más rápida podría estar asociada con un cuerpo lúteo más saludable.
El análisis de las imágenes de ultrasonido del CL se ha realizado para predecir la etapa del ciclo estral y su estado funcional (crecimiento o regresión). Durante el diestro, el CL es más oscuro, y su ecotextura es más homogénea que durante el metaestro y el proestro34. Sin embargo, el estado funcional del CL es difícil de determinar mediante imágenes de ultrasonido33,42. Los cuerpos lúteos en etapa de diestro se identifican fácilmente, pero diferenciar entre aquellos en metaestro (CL en crecimiento) y en proestro (CL en regresión) es difícil debido a sus similitudes morfológicas (Figuras 4 y 7). Además, cuando el área del CL está entre 1.3 y 3.2 cm2, también es difícil determinar si existe un CL funcional43. Por lo tanto, para establecer el estado funcional del CL, es necesario realizar múltiples análisis de concentración de progesterona, revisar el registro reproductivo del animal o realizar más de una medición del CL por ultrasonido con al menos 2 días de diferencia. Además, la evaluación del flujo sanguíneo lúteo mediante ultrasonido doppler puede utilizarse para establecer la funcionalidad del cuerpo lúteo44.
El CL sufre regresión si no se establece la gestación. La regresión del CL está bajo el mando de la prostaglandina uterina (F2α). Se observa una pérdida de la capacidad de síntesis de progesterona y una reducción en el tamaño del CL durante la etapa de regresión (Figura 6). El CL comienza a encogerse después del día 14 del ciclo estral33 o 3.2 días antes del inicio del estro en vacas no preñadas32, pero se vuelve sensible a los efectos luteolíticos de las prostaglandinas en el día 5 del ciclo estral45. La prostaglandina reduce el tamaño del CL (23 a 47 %) en uno a cuatro días46 y disminuye la concentración sanguínea de progesterona dentro de las 4 h posteriores a la inyección al cesar la actividad de las enzimas esteroidogénicas47 e inducir la muerte de las células lúteas48. Además, el CL es colonizada por células inmunes49 que eliminan las células muertas del estroma ovárico durante la regresión48, contribuyendo a la reducción del tamaño del CL en esta etapa. Después de la regresión del CL, aparecerá un folículo preovulatorio y un estro, quedando solo rastro del CL anterior en el ovario (Figura 7). Sin embargo, si se establece la gestación, se bloquea la síntesis de la prostaglandina uterina (F2α). Por lo tanto, la regresión no ocurre y el CL extiende su vida útil hasta el final del siguiente evento reproductivo (gestación).
Diagnósticos de gestación
Un evento trascendental en el camino hacia la gestación es la producción de interferón tau por el conceptus bovino, que previene la regresión del CL inducida por la prostaglandina F2α y promueve el reconocimiento de la gestación50. La presencia de la vesícula embrionaria bovina, CL y líquido uterino son indicaciones de gestación51, pero el estándar de oro para diagnosticar una gestación es mediante la observación de un embrión con latidos cardíacos, que es rápidamente detectable a los 30 días después de la inseminación artificial (Figura 8)52.
Los diagnósticos de gestación deben realizarse con cuidado para evitar daños físicos al embrión. Todo el útero y los cuernos uterinos deben revisarse para dar un diagnóstico preciso. Un error común es diagnosticar a una vaca como preñada solo por la visualización del líquido uterino, que también se observa en las vacas durante la fase del estro.
El objetivo principal del diagnóstico temprano de la gestación (28-30 días después de la inseminación artificial) es diferenciar entre vacas preñadas y no preñadas, lo antes posible después de la inseminación artificial. Después del diagnóstico, las vacas no preñadas son preparadas para volver a inseminarse, mientras que el riesgo de pérdida de la gestación durante los primeros 60 días de gestación obliga a programar a las vacas preñadas para un diagnóstico confirmatorio (40-60 días después de la inseminación artificial) por ultrasonido o palpación rectal53,54. Las causas de la pérdida de la gestación durante este período de tiempo incluyen la selección para aumentar la producción de leche, alteraciones del ambiente uterino, mala calidad de ovocitos y embriones55.
El diagnóstico de la gestación es seguido por dos eventos opcionales, que son la estimación de la edad del feto y el sexado. Las granjas lecheras modernas mantienen registros precisos de las fechas de inseminación artificial, evitando la necesidad de estimar la edad fetal. Sin embargo, la medición de la corona-grupa, la longitud de la cabeza, el diámetro del tronco y el tamaño del placentoma podrían usarse para estimar la edad del feto56,57. El sexo del feto se determina entre los 55 a 111 días de gestación58. Sin embargo, el sexado fetal no es una práctica común en las granjas lecheras, probablemente porque los servicios de ultrasonido se requieren principalmente para el diagnóstico temprano de la gestación. Además, la inseminación artificial de novillas con semen sexado asegura el nacimiento de terneros con el sexo deseado en aproximadamente el 90 % de los animales inseminados.
Eventos reproductivos posparto
Los eventos reproductivos, después del diagnóstico de la gestación, son el parto, el desprendimiento de las membranas fetales, la involución uterina, el establecimiento de la actividad ovárica cíclica, y el diagnóstico de la salud uterina antes de la primera inseminación posparto. A pesar de que todos los eventos mencionados deben ser supervisados, el establecimiento de la actividad ovárica cíclica y el diagnóstico de la salud uterina antes de la primera inseminación podrían ser los más relevantes para los profesionales del ultrasonido.
El logro de una presentación rápida de la ovulación y el estro cíclico después del parto son los objetivos principales para un buen manejo reproductivo. Se recomienda el examen por ultrasonido del tracto reproductivo, al menos cada 2 semanas después de 20 días de lactancia. La presencia de un cuerpo lúteo es el mejor indicador de que la ovulación se ha producido con éxito. Después de la ovulación y la formación del CL, la observación o revisión de datos a partir de programas informáticos para detectar signos de estro es obligatoria. Una vez que se ha logrado la actividad estral cíclica, la erradicación de infecciones uterinas subclínicas es necesaria para establecer un ambiente uterino saludable capaz de albergar una gestación.
Las infecciones uterinas clínicas (metritis y endometritis) se detectan fácilmente mediante la observación, la percepción y la palpación de signos clásicos como útero agrandado, flujo vaginal, olor fétido y decaimiento del animal. Sin embargo, los signos de infección uterina subclínica (endometritis subclínica) están ocultos a la simple observación, olfato o palpación. Una endometritis subclínica es una inflamación del endometrio, sin flujo vaginal purulento y signos externos de enfermedad, y se diagnostica por un mayor número de neutrófilos en el endometrio mediante citología (cytobrush)59.
La endometritis subclínica no compromete la vida de una vaca, pero la fertilidad podría disminuir. Se ha reportado una reducción de la tasa de fertilización y calidad embrionaria en vacas superovuladas y con endometritis subclínica60, lo que explica en parte la baja tasa de preñez encontrada en vacas que padecían la misma enfermedad61. Por el contrario, otros no han logrado establecer una relación entre la endometritis subclínica y el bajo desempeño reproductivo en el ganado62,63. El origen de la controversia entre los estudios no se entiende bien porque todos ellos utilizaron el mismo instrumental (cytobrush) para discernir entre vacas sanas y aquellas con endometritis subclínica. La naturaleza de esta controversia podría estar relacionada con el número y las ubicaciones intrauterinas donde se obtuvieron las muestras para citología. Se recomienda tomar al menos dos muestras en dos ubicaciones intrauterinas diferentes, preferiblemente en los cuernos, para diagnosticar con precisión la endometritis subclínica64. Los estudios mencionados61-63 sólo tomaron una muestra y sólo uno de ellos lo hizo en los cuernos uterinos61. El “cytobrush” es uno de los métodos más comunes para diagnosticar la endometritis subclínica. Sin embargo, el lavado uterino, las tiras de prueba de esterasa leucocitaria y la biopsia uterina han sido utilizados para diagnosticar con éxito la endometritis subclínica en el ganado65,66. La principal desventaja de estos métodos es que consumen mucho tiempo y son invasivos, y requieren una muestra de líquido/células endometriales tomadas de los cuernos uterinos. El ultrasonido es una herramienta alternativa, no invasiva y confiable para diagnosticar la endometritis subclínica, mediante la identificación de líquido uterino a los 20-47 días en lactancia66,67. Sin embargo, la presencia de pus en el útero también podría considerarse como indicación de endometritis subclínica. La pus está compuesto por neutrófilos y es un signo de inflamación68, y es comúnmente observado a lo largo de los cuernos uterinos (Figura 9), normalmente en cantidades tan pequeñas que no se observa como flujo vaginal, lo que cumple con la definición de endometritis subclínica59.
Otras consideraciones y áreas de oportunidad
La razón que justificó el uso del ultrasonido debe conocerse antes de realmente realizar cualquier exploración ultrasonográfica en la vaca. Además, la seguridad del profesional, el animal y el equipo deben garantizarse en todo momento durante el procedimiento. También es recomendable reunir la mayor cantidad de información posible sobre la historia clínica, nutricional, de manejo, productiva y reproductiva de las vacas antes de llevar a cabo cualquier exploración física.
Lo último ayudará a hacer un diagnóstico preciso y a proporcionar el tratamiento más adecuado. La selección de las unidades experimentales durante la investigación reproductiva debe hacerse al menos 21 días antes de que comience el estudio. Su tracto reproductivo debe ser revisado por ultrasonografía para asegurar que todos los animales están en la condición deseada (sano: estado cíclico, sin quistes ováricos y libre de infección uterina; no sano: con infecciones uterinas o quistes ováricos). Sin embargo, si el estado de las unidades experimentales es una limitante para realizar la investigación, entonces habrá al menos 21 días para tratar a las vacas que requieren asistencia reproductiva. La competencia ovocitaria y la calidad del embrión son factores que afectan significativamente las posibilidades de alcanzar el estado de gestación en una vaca, después de la inseminación artificial. Sería ventajoso medir características específicas y predictivas relacionadas con esos factores en condiciones de campo mediante ultrasonografía.
Conclusiones
La aplicación de ultrasonido es obligatoria para comprender mejor algunos de los eventos reproductivos más relevantes y para apoyar la toma de decisiones durante el manejo reproductivo del ganado lechero. Es importante que los estudiantes e investigadores adopten el ultrasonido como una herramienta de rutina para la investigación y el trabajo de campo.
Agradecimientos
Los autores agradecen a la Dra. Ana Laura Lara Rivera, al Dr. Ulises Macias Cruz y al Dr. Lorenzo Buenabad Carrasco por sus comentarios al manuscrito.
REFERENCIAS
1. Cabrera VE. Economics of fertility in high-yielding dairy cows on confined TMR systems. Animal 2014;8(S1):211-221. doi:10.1017/S1751731114000512. [ Links ]
2. Kähn W, Leidl W. In: Taverne MAM, Willemse AH. Diagnostic ultrasound and animal reproduction. Dordrecht, Netherlands; 1989:53-65. [ Links ]
3. Rajamahendran R,Ambrose DJ, Burton B. Clinical and research applications of real-time ultrasonography in bovine reproduction: a review. Can Vet J 1994;35(9):563-572. [ Links ]
4. Ribadu AY, Nakao T. Bovine reproductive ultrasonography: a review. J Reprod Dev; 1994;45:13-28. https://doi.org/10.1262/jrd.45.13. [ Links ]
5. DesCoteaux L, Gnemmi G, Colloton J. Ultrasonography of the bovine female genital tract. Vet Clin Food Anim 2009;25(3):733-752. https://doi.org/10.1016/j.cvfa.2009.07.009. [ Links ]
6. Quintela LA, Barrio M, Peña AL, Becerra JJ, Cainzos J, Herradón PG, Díaz C. Use of ultrasound in the reproductive management of dairy cattle. Reprod Dom Anim 2012; 47(s3):34-44. 10.1111/j.1439-0531.2012.02032.x . [ Links ]
7. Perry GA, Pas, Cushman RA. Use of ultrasonography to make reproductive management decisions. The Prof Anim Sci 2016;32(2):154-161. https://doi.org/10.15232/pas.2015-01446. [ Links ]
8. Fortune JE, Rivera GM, Evans AC, Turzillo AM. Differentiation of dominant versus subordinate follicles in cattle. Biol Reprod 2001;65(3):648-54. https://doi.org/10.1095/biolreprod65.3.648. [ Links ]
9. Gong JG, Campbell BK, Webb R. Defining the gonadotrophin requirement for the selection of a single dominant follicle in cattle. Reprod Fertil Dev 2019;32(3):322-34. 10.1071/RD19060. [ Links ]
10. Adams GP, Jaiswal R, Singh J, Malhi P. Progress in understanding ovarian follicular dynamics in cattle. Theriogenology 2008; 69 (1):72-80. https://doi.org/10.1016/j.theriogenology.2007.09.026. [ Links ]
11. Ginther OJ. The theory of follicle selection in cattle. Domest Anim Endocrinol 2016;57:85-99. 10.1016/j.domaniend.2016.06.002. [ Links ]
12. Sartori R, Fricke PM, Ferreira JC, Ginther OJ, Wiltbank MC. Follicular deviation and acquisition of ovulatory capacity in bovine follicles. Biol Reprod . 2001;65(5):1403-1409. https://doi.org/10.1095/biolreprod65.5.1403. [ Links ]
13. Perry GA, Smith MF, Lucy MC, Green JA, Parks TE, MacNeil MD, et al. Relationship between follicle size at insemination and pregnancy success. Proc. Natl Acad Sci USA. 2005;102(14):5268-5273. https://doi.org/10.1073/pnas.0501700102. [ Links ]
14. Colazo MG, Behrouzi A, Ambrose DJ, Mapletoft RJ. Diameter of the ovulatory follicle at timed artificial insemination as a predictor of pregnancy status in lactating dairy cows subjected to GnRH-based protocols. Theriogenology 2015;84(3):377-383. 10.1016/j.theriogenology.2015.03.034. [ Links ]
15. Mussard ML, Burke CR, Behlke EJ, Gasser CL, Day ML. Influence of premature induction of a luteinizing hormone surge with gonadotropin-releasing hormone on ovulation, luteal function, and fertility in cattle. J Anim Sci 2007;85(3):937-943. 10.2527/jas.2006-592. [ Links ]
16. Colazo MG, Martínez MF, Kastelic JP, Mapletoft RJ. Effects of dose and route of administration of cloprostenol on luteolysis, estrus and ovulation in beef heifers. Anim Reprod Sci 2002(1-2);72:47-62. https://doi.org/10.1016/S0378-4320(02)00087-8. [ Links ]
17. White FJ, Wettemann RP, Looper ML, Prado TM, Morgan GL. Seasonal effects on estrous behavior and time of ovulation in nonlactating beef cows. J Anim Sci 2002; 80(12):3053-3059. https://doi.org/10.2527/2002.80123053x. [ Links ]
18. López-Gatius F, Garcia-Ispierto I, Hunter RHF. Twin pregnancies in dairy cattle: Observations in a large herd of Holstein-Friesian dairy cows. Animals 2020;10(11):1-9. https://doi.org/10.3390/ani10112165. [ Links ]
19. López-Gatius F, Andreu-Vázquez C, Mur-Novales R, Cabrera VE, Hunter RHF. The dilemma of twin pregnancies in dairy cattle. A review of practical prospects. Liv Sci 2017;197:12-16. https://doi.org/10.1016/j.livsci.2017.01.001. [ Links ]
20. García-Guerra A, Kirkpatrick BW, Wiltbank MC. Follicular waves and hormonal profiles during the estrous cycle of carriers and non-carriers of the Trio allele, a major bovine gene for high ovulation and fecundity. Theriogenology 2017;100:100-113. 10.1016/j.theriogenology.2017.05.029. [ Links ]
21. López-Gatius F, Hunter R. Puncture and drainage of the subordinate follicles at timed artificial insemination prevents the risk of twin pregnancy in dairy cows. Reprod Domest Anim 2018;53:213-216. 10.1111/rda.13094. [ Links ]
22. López-Gatius F, López-Béjar M, Fenech M, Hunter RH. Ovulation failure and double ovulation in dairy cattle: risk factors and effects. Theriogenology 2005;63(5):1298-1307. https://doi.org/10.1016/j.theriogenology.2004.06.010. [ Links ]
23. Morris MJ, Kaneko K, Walker SL, Jones DN, Routly JE, Smith RF, Dobson H. Influence of lameness on follicular growth, ovulation, reproductive hormone concentrations and estrus behavior in dairy cows. Theriogenology 2011;76(4):658-668. 10.1016/j.theriogenology.2011.03.019. [ Links ]
24. Hatler TB, Hayes SH, Laranja da Fonseca LF, Silvia WJ. Relationship between endogenous progesterone and follicular dynamics in lactating dairy cows with ovarian follicular cysts. Biol Reprod 2003;69(1):218-223. https://doi.org/10.1095/biolreprod.102.012179. [ Links ]
25. Calder MD, Salfen BE, Bao B, Youngquist RS, Garverick HA. Administration of progesterone to cows with ovarian follicular cyst results in a reduction in mean LH and LH pulses frequency and initiates ovulatory follicular growth. J Anim Sci 1999;77(11):3037-3042. 10.2527/1999.77113037x. [ Links ]
26. Kaneko H, Todoroki J, Noguchi J, Kikuchi K, Mizoshita K, Kubota C. Yamakuchi H. Perturbation of estradiol-feedback control of luteinizing hormone secretion by immunoneutralization induces development of follicular cysts in cattle. Biol Reprod 2002;67(6):1840-1845. https://doi.org/10.1095/biolreprod.102.007591. [ Links ]
27. Gümen A, Sartori R, Costa FM, Wiltbank MC. A GnRH/LH surge without subsequent progesterone exposure can induce development of follicular cysts. J Dairy Sci 2002;85(1):43-50. https://doi.org/10.3168/jds.S0022-0302(02)74051-4. [ Links ]
28. Douthwaite R, Dobson H. Comparison of different methods of diagnosis cyst ovarian disease in cattle and an assessment of its treatment with a progesterone-releasing intravaginal device. Vet Rec 2000;147(13):355-359. http://dx.doi.org/10.1136/vr.147.13.355. [ Links ]
29. Ambrose DJ, Schmitt EJP, Lopes FL, Mattos RC, Thatcher WW. Ovarian and endocrine responses associated with the treatment of cystic ovarian follicles in dairy cows with gonadotropin releasing hormone and prostaglandin F2α, with or without exogenous progesterone. Can Vet J 2004;45(11):931-937. [ Links ]
30. Abedel-Majed MA, Romereim SM, Davis JS, Cupp AS. Perturbations in lineage specification of granulosa and theca cells may alter corpus luteum formation and function. Front Endocrinol 2019;10:1-10. 10.3389/fendo.2019.00832. [ Links ]
31. Kastelic JP, Pierson RA, Ginther OJ. Ultrasonic morphology of corpora lutea and central luteal cavities during the estrous cycle and early pregnancy in heifers. Theriogenology 1990;34(3): 487-498. https://doi.org/10.1016/0093-691X(90)90006-F. [ Links ]
32. Taylor C, Rajamahendran R. Follicular dynamics and corpus luteum growth and function in pregnant versus nonpregnant cows. J Dairy Sci 1991;74(1):115-123. https://doi.org/10.3168/jds.S0022-0302(91)78151-4. [ Links ]
33. Siqueira LG, Torres CA, Amorim LS, Souza ED, Camargo LS, Fernandes CA, Viana JHM. Interrelationships among morphology, echotexture, and function of the bovine corpus luteum during the estrous cycle. Anim Reprod Sci 2009;115(1-4):18-28. https://doi.org/10.1016/j.anireprosci.2008.11.009. [ Links ]
34. Singh J, Pierson RA, Adams GP. Ultrasound image attributes of the bovine corpus luteum: structural and functional correlates. J Reprod Fertil 1997;109(1):35-44. 10.1530/jrf.0.1090035. [ Links ]
35. Perez-Marin C. Formation of corpora lutea and central luteal cavities and their relationship with plasma progesterone levels and other metabolic parameters in dairy cattle. Reprod Domest Anim 2009;44:384-389. 10.1111/j.1439-0531.2007.01021.x [ Links ]
36. Kito S, Okuda K, Miyazawa K, Sato K. Study on the appearance of the cavity in the corpus luteum of cows by using ultrasonic scanning. Theriogenology 1986;25(2):325-333. https://doi.org/10.1016/0093-691X(86)90068-3. [ Links ]
37. Lüttgenau J, Ulbrich SE, Beindorff N, Honnens A, Herzog K, Bollwein H. Plasma progesterone concentrations in the mid-luteal phase are dependent on luteal size, but independent of luteal blood flow and gene expression in lactating dairy cow. Anim Reprod Sci 2011(1-4);125:20-29. https://doi.org/10.1016/j.anireprosci.2011.02.002. [ Links ]
38. Rizos D, Scully S, Kelly AK, Ealy AD, Moros R, Duffy P, Al-Naib A, Forde N, Lonergan P. Effects of human chorionic gonadotrophin administration on day 5 after oestrus on corpus luteum characteristics, circulating progesterone and conceptus elongation in cattle. Reprod Fertil Dev 2012;24(3):472-481. 10.1071/RD11139. [ Links ]
39. Cummins SB, Lonergan P, Evans AC, Butler ST. Genetic merit of fertility traits in Holstein cows: II. Ovarian follicular and corpus luteum dynamics, reproductive hormones, and estrus behavior. J Dairy Sci 2012;95(7):3698-36710. https://doi.org/10.3168/jds.2011-4976. [ Links ]
40. Moore SG, Scully S, Browne JA, Fair T, Butler ST. Genetic merit for fertility traits in Holstein cows: V. Factors affecting circulating progesterone concentrations. J Dairy Sci 2014;97(2-3):5543-5557. https://doi.org/10.3168/jds.2014-8133. [ Links ]
41. Gómez-Seco C, Alegre B, Martínez-Pastor F, Prieto JG, González-Montaña JR, Alonso ME, Domínguez JC. Evolution of the corpus luteum volume determined ultrasonographically and its relation to the plasma progesterone concentration after artificial insemination in pregnant and non-pregnant dairy cows. Vet Res Commun 2017;41(3):183-188. 10.1007/s11259-017-9685-x. [ Links ]
42. Battocchio M, Gabai G, Mollo A, Veronesi MC, Soldano F, Bono G. Cairoli F. Agreement between ultrasonographic classification of the CL and plasma progesterone concentration in dairy cows. Theriogenology 1999;51(6):1059-1069. https://doi.org/10.1016/S0093-691X(99)80011-9. [ Links ]
43. Kaneko K, Takagi N. Accurate ultrasonographic prediction of progesterone concentrations greater than 1 ng/ml in Holstein lactating dairy cows. Reprod Domest Anim .2014;49(6):985-988. https://doi.org/10.1017/S0022029908003610. [ Links ]
44. Hassan M, Arshad U, Bilal M, Sattar A, Avais M, Bollwein H, Ahmad N. Luteal blood flow measured by Doppler ultrasonography during the first three weeks after artificial insemination in pregnant and non-pregnant Bos indicus dairy cows. J Reprod Dev 2019;65(1):29-36. 10.1262/jrd.2018-084. [ Links ]
45. Wenzinger B, Bleul U. Effect of a prostaglandin F2α analogue on the cyclic corpus luteum during its refractory period in cows. BMC Vet Res 2012;8:220. 10.1186/1746-6148-8-220. [ Links ]
46. Répási A, Beckers JF, Sulon J, Perényi Z, Reiczigel J, Szenci O. Effect of different doses of prostaglandin on the area of corpus luteum, the largest follicle and progesterone concentration in the dairy cow. Reprod Domest Anim 2003;38(6):423-428. 10.1046/j.1439-0531.2003.00433.x. [ Links ]
47. Levy N, Kobayashi S, Roth Z, Wolfenson D, Miyamoto A, Meidan R. Administration of prostaglandin F (2 alpha) during the early bovine luteal phase does not alter the expression of ET-1 and of its type A receptor: a possible cause for corpus luteum refractoriness. Biol Reprod 2000;63(2):377-382. 10.1095/biolreprod63.2.377. [ Links ]
48. Yadav VK, Lakshmi G, Medhamurthy R. Prostaglandin F2alpha-mediated activation of apoptotic signaling cascades in the corpus luteum during apoptosis: involvement of caspase-activated DNase. J Biol Chem 2005;280:10357-10367. 10.1074/jbc.M409596200. [ Links ]
49. Pate JL, Landis Keyes P. Immune cells in the corpus luteum: friends or foes?. Reproduction. 2001;122(5):665-676. 10.1530/rep.0.1220665. [ Links ]
50. Bazer FW. Pregnancy recognition signaling mechanisms in ruminants and pigs. J Anim Sci Biotechnol 2013;4(1):23. https://doi.org/10.1186/2049-1891-4-23. [ Links ]
51. Curran S, Pierson RA, Ginther OJ. Ultrasonographic appearance of the bovine conceptus from days 20 through 60. J Am Vet Med Assoc 1986(10);189:1295-1302. [ Links ]
52. Fricke PM, Ricci A, Giordano JO, Carvalho PD. Methods for and implementation of pregnancy diagnosis in dairy cows. Vet Clin North Am Food Anim Prod 2016;32(1):165-180. 10.1016/j.cvfa.2015.09.006. [ Links ]
53. Diskin MG, Waters SM, Parr MH, Kenny DA. Pregnancy losses in cattle: potential for improvement. Reprod Fertil Dev 2016;28(1-2):83-93. 10.1071/RD15366. [ Links ]
54. Wiltbank MC, Baez GM, Garcia-Guerra A, Toledo MZ, Monteiro PL, Melo LF, et al. Pivotal periods for pregnancy loss during the first trimester of gestation in lactating dairy cows. Theriogenology 2016;86(1):239-253. https://doi.org/10.1016/j.theriogenology.2016.04.037. [ Links ]
55. Lonergan P, Fair T, Forde N, Rizos D. Embryo development in dairy cattle. Theriogenology 2016(1);86:270-277. 10.1016/j.theriogenology.2016.04.040. [ Links ]
56. Kramer RW, Smith DR, Rupp GR, Griffin DD, Funston RN. Estimation of calving date in beef cattle with real-time ultrasound. Prof Anim Sci 2016;32(3):322-327. https://doi.org/10.15232/pas.2015-01478. [ Links ]
57. Lawrence KE, Adeyinka FD, Laven RA, Jones G. Assessment of the accuracy of estimation of gestational age in cattle from placentoma size using inverse regression. N Z Vet J 2016;64(4):248-252. 10.1080/00480169.2016.1157050. [ Links ]
58. Quintela LA, Becerra JJ, Pérez-Marín CC, Barrio M, Cainzos J, Prieto A, Díaz C, Herradón PG. Fetal gender determination by first-trimester ultrasound in dairy cows under routine herd management in Northwest Spain. Anim Reprod Sci 2011;125(1-4): 13-9. https://doi.org/10.1016/j.anireprosci.2011.02.022 . [ Links ]
59. Sheldon IM, Williams EJ, Miller AN, Nash DM, Herath S. Uterine diseases in cattle after parturition. Vet J 2008;176(1):115-121. 10.1016/j.tvjl.2007.12.031. [ Links ]
60. Carvalho PD, Souza AH, Sartori R, Hackbart KS, Dresch AR, Vieira LM. et al. Effects of deep-horn AI on fertilization and embryo production in superovulated cows and heifers. Theriogenology 2013;80 (9):1074-1081. 0.1016/j.theriogenology.2013.08.008. [ Links ]
61. Barajas-Merchana JL, Hernández-Ceróna J, García-Alfonso A, Martínez-Bárcenasa E, Juárez-Lópeza NO, Bedolla-Alva AM, de la Sota RL. Subclinical endometritis and pregnancy rate in dairy cows in Mexico. Rev Mex Cien Pecu 2018;9(1):135-146. 10.22319/rmcp.v9i1.4324. [ Links ]
62. Plöntzke J, Madoz LV, de la Sota RL, Drillich M, Heuwieser W. Subclinical endometritis and its impact on reproductive performance in grazing dairy cattle in Argentina. Anim Reprod Sci 2010;122(1-1):52-57. 10.1016/j.anireprosci.2010.07.006. [ Links ]
63. Pothmann H, Prunner I, Wagener K, Jaureguiberry M, de la Sota RL, Erber R, Aurich C, Ehling-Schulz M, Drillich M. The prevalence of subclinical endometritis and intrauterine infections in repeat breeder cows. Theriogenology 2015;83(8):1249-1253. https://doi.org/10.1016/j.theriogenology.2015.01.013. [ Links ]
64. Egberts J, Detterer J, Park A, Meinecke-Tillmann S. Exfoliative endometrial cytology in embryo donor cows-comparison of sampling localizations for the diagnosis of subclinical endometritis. Vet Sci 2016;3(4):35. https://doi.org/10.3390/vetsci3040035. [ Links ]
65. Van Schyndel SJ, Bogado Pascottini O, LeBlanc SJ. Comparison of cow-side diagnostic techniques for subclinical endometritis in dairy cows. Theriogenology 2018;120:117-22. https://doi.org/10.1016/j.theriogenology.2018.08.001. [ Links ]
66. Meira EBS, Henriques LCS, Sá LRM, Gregory L. Comparison of ultrasonography and histopathology for the diagnosis of endometritis in Holstein-Friesian cows. J Dairy Sci 2012;95(12):6969-6973. https://doi.org/10.3168/jds.2011-4950. [ Links ]
67. Kasimanickam R, Duffield TF, Foster RA, Gartley CJ, Leslie KE, Walton JS, Johnson WH. Endometrial cytology and ultrasonography for the detection of subclinical endometritis in postpartum dairy cows. Theriogenology 2004;62(1-2):9-23. https://doi.org/10.1016/j.theriogenology.2003.03.001. [ Links ]
68. Barer MR. The natural history of infection. In: Greenwood D, Slack R, Barer M, Irving W editors. Medical microbiology. 18th ed. USA. Churchill Livingstone; 2012:168-173. https://doi.org/10.1016/B978-0-7020-4089-4.00029-9. [ Links ]
Recibido: 02 de Octubre de 2020; Aprobado: 04 de Agosto de 2021











 texto en
texto en 



