Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias pecuarias
versão On-line ISSN 2448-6698versão impressa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.13 no.2 Mérida Abr./Jun. 2022 Epub 20-Jun-2022
https://doi.org/10.22319/rmcp.v13i2.5942
Artículos
Análisis farmacocinético de la inyección intraarticular de insulina y su efecto sobre la expresión del IGF-1 en el líquido sinovial de caballos sanos
a Universidad Nacional Autónoma de México (UNAM). Facultad de Medicina Veterinaria y Zootecnia (FMVZ), Ciudad de México, México.
b UNAM. FMVZ, Departamento de Fisiología y Farmacología, Ciudad de México, México.
c UNAM. Facultad de Química, Departamento de Farmacia, Ciudad de México, México.
d Cornell University. Ithaca, USA.
e UNAM. FMVZ, Departamento de Patología, Ciudad de México, México.
f UNAM. Depto. Fisiología, Facultad de Medicina, Ciudad de México, México.
g UNAM. FMVZ, Secretario de Medicina, Ciudad de México, México.
La insulina induce la mitosis en los condrocitos equinos in vitro y mejora la producción de colágeno tipo II. La insulina, cuando se administra vía intraarticular, cambia la composición del líquido sinovial, incluyendo las concentraciones de glucosa, insulina y los niveles de glucemia. La concentración de insulina en la articulación se midió mediante cromatografía líquida de alta resolución (HPLC, por sus siglas en inglés), que proporcionó valores farmacocinéticos. A seis caballos de raza mixta se les administraron tres dosis diferentes de insulina en una articulación antebraquiocarpiana (10, 15 y 20 UI) y se administró solución salina isotónica en la articulación contralateral. La concentración de glucosa en sangre cambió significativamente a través del tiempo para las tres dosis (P<0.0001). No se encontraron diferencias significativas en la concentración de proteínas y el recuento celular en el líquido sinovial entre las articulaciones tratadas y de control (P>0.05), no se encontró diferencia significativa en las concentraciones de glucosa sinovial entre las articulaciones tratadas y de control (P>0.05). Los valores obtenidos mediante HPLC se analizaron con PKAnalyst, esto reveló que los valores farmacocinéticos eran dependientes de las dosis, no hubo diferencia significativa en la concentración de glucosa en sangre entre las tres diferentes dosis (P>0.05). ELISA para el IGF-1 (factor de crecimiento similar a la insulina 1) reveló una diferencia significativa entre las articulaciones tratadas y de control (P<0.001). La insulina utilizada en este estudio demostró ser inocua para la articulación equina, no se deben administrar más de 20 UI para un caballo de 350-400 kg.
Palabras clave Insulina; Intraarticular; Caballo; IGF-1; HPLC
Insulin induces mitosis on equine chondrocytes in vitro and enhances production of type II collagen. Insulin, when administered intra-articularly, changes the composition of synovial fluid, including the concentrations of glucose, insulin and glycemia levels. The concentration of insulin in the joint was measured by using high-performance liquid chromatography (HPLC), which provided pharmacokinetic values. Six mixed breed horses were administered three different doses of insulin into one antebrachiocarpal joint (10, 15 and 20 IU) and isotonic saline was administered into the contralateral joint. The blood glucose concentration significantly changed through time for all three doses (P<0.0001). No significant differences in protein concentration and cell count in synovial fluid were found between treated and control joints (P>0.05), no significant difference in synovial glucose concentrations was found between treated and control joints (P>0.05). Values obtained by HPLC analyzed with PkAnalyst program revealed that the pharmacokinetic values were dose dependent, there was no significant difference in concentration of blood glucose between the three different doses (P>0.05). ELISA for IGF-1 (insulin-like growth factor 1) revealed a significant difference between treated and control joints (P<0.001). Insulin used in this study proved to be innocuous to the equine joint, no more than 20 IU for a 350-400 kg horse should be administered.
Key words Insulin; Intraarticular; Horse; IGF-1; HPLC
Introducción
Se han utilizado diferentes opciones terapéuticas para tratar la sinovitis en caballos. Los objetivos del tratamiento intraarticular (IA) para mejorar los signos de osteoartritis son disminuir los mediadores inflamatorios y los procesos bioquímicos de la inflamación, aliviar el dolor, evitar la destrucción de la articulación y normalizar la función de la articulación para permitir que el caballo reanude sus actividades normales. Los médicos han utilizado corticosteroides, glicosoaminoglicanos polisulfatados, antibióticos, ácido hialurónico, DMSO (dimetilsulfóxido) y fármacos parasimpaticolíticos, como la atropina, vía intraarticular con el fin de reducir el dolor y la inflamación articular. Se ha abusado de la administración intraarticular de corticosteroides porque, cuando se administran intraarticularmente, los corticosteroides ofrecen una analgesia rápida y una mejora notable en el rendimiento del caballo. Se puede detectar un corticosteroide en el líquido articular o la membrana sinovial durante al menos 21 días después de la inyección, y, por tanto, este tratamiento, si no es acompañado de un período adecuado de descanso y fisioterapia, puede resultar en daño al cartílago articular, fibrosis y calcificación distrófica de tejidos blandos de la articulación, particularmente la membrana sinovial. Los sinoviocitos son reemplazados por tejido fibroso, resultando en un deterioro de la producción de los elementos normales que componen el líquido sinovial, resultando en un funcionamiento subóptimo de la articulación1-3.
Existe evidencia in vitro de que la insulina, en concentraciones de hasta 50 ng/ml, en cultivos celulares (monocapas de 75 cm2) induce mitosis de condrocitos y producción de colágeno tipo II4. Las dosis de insulina instilada intraarticularmente en este estudio se adaptaron de la superficie de la placa de cultivo celular para ser aplicadas in vivo. Además, la superficie total del cartílago articular de la articulación antebraquiocarpiana de un caballo adulto castrado Warmblood recientemente sacrificado se midió para ayudar a determinar la dosis de insulina a inyectar en esta articulación en particular (92.642 cm2), mediante el uso del software Rhinoceros 4.0® (datos no mostrados). Se determinaron cambios significativos en la composición del líquido sinovial de todos los componentes medibles o en las concentraciones séricas de glucosa. Hasta donde se sabe, no se han realizado estudios farmacocinéticos de insulina instilada en las articulaciones de seres humanos o animales. Existe evidencia in vivo de que los IGF-1 y 2 intraarticulares aumentan la mitosis de los condrocitos y la producción de colágeno tipo II por parte de los condrocitos5.
Anecdóticamente, se han instilado de 20 a 40 UI de insulina en las articulaciones de caballos de 500 kg con osteoartritis sin evidencia de efectos adversos. Se desconoce si estas dosis son efectivas o no para estimular la mitosis de los condrocitos y la producción de colágeno tipo II in vitro.
No hay productos comerciales purificados del IGF-1 que se puedan instilar vía intraarticular para tratar defectos osteocondrales en caballos. Aunque el IGF-1 recombinante está disponible solo para uso in vitro.
Material y métodos
En este estudio se utilizaron seis caballos de raza mixta (3 yeguas, 2 machos castrados y 1 semental) con una edad media de 5.08 años y un peso medio de 361.11 kg. Todos estaban en una condición corporal de moderada a buena6. Los caballos se dividieron aleatoriamente en los Grupos 1, 2 y 3, cada grupo estaba integrado por dos caballos.
Cada caballo fue confinado a un establo individual (4x4 m) durante el estudio, todos fueron alimentados con 7-8 kg de heno de avena tres veces al día, y se proporcionó agua ad libitum. Se realizaron evaluaciones de cojera y radiográficas (MinXray® HFX 90V. Illinois, EE. UU.) de la región carpiana para cada caballo. Cada caballo fue evaluado para detectar signos clínicos de síndrome metabólico equino (SME), como obesidad (condición corporal ≥7/9), depósitos de grasa anormales (cuello crestado), inflamación de la glándula prepucial o mamaria y signos de laminitis, como anillos de crecimiento divergentes en las cápsulas de los cascos.
Para asegurar que ningún caballo sufriera resistencia a la insulina, cada caballo se sometió a una prueba oral de azúcar7. Para realizar esta prueba, los caballos se mantuvieron en ayunas durante 12 h, después de lo cual se midió la concentración basal de glucosa en sangre. Luego, se administró jarabe de maíz (Karo® hecho para ACH Foods México, S. de R. L. de C. V.) por vía oral, utilizando una jeringa de 60 ml, a una dosis de 15 ml/100 kg (150 mg/kg). La concentración de glucosa en sangre se midió a los 60, 75 y 90 minutos después de la administración oral del jarabe de maíz.
Con el fin de determinar la concentración de insulina que es suficiente para inducir mitosis en los condrocitos del cartílago articular, se consideró el área de las placas de cultivo celular (75 cm2) en la que se ha observado la mitosis y luego se extrapoló a toda la superficie articular4. Esto se determinó midiendo la superficie del cartílago de la articulación antebraquiocarpiana de un caballo adulto castrado Warmblood recientemente sacrificado utilizando el software Rhinoceros 7.0.
En este estudio, se instilaron dosis de 10, 15 y 20 UI de insulina recombinante [Humalog Lispro® (100 UI/ml), Eli Lilly and Company. Indianápolis, EE. UU.] en la articulación antebraquiocarpiana. Estas tres dosis se calcularon considerando la dosis sistémica de insulina utilizada para tratar la hipoglucemia en caballos y la concentración necesaria para lograr la mitosis en las placas de cultivo celular; considerando también el volumen normal de líquido sinovial de la articulación antebraquiocarpiana8. Se añadió solución salina estéril al 0.9 % a la insulina para aumentar el volumen inyectado a 1 ml.
La articulación antebraquiocarpiana izquierda de cada caballo se trató con insulina y, al mismo tiempo, se inyectó solución salina al 0.9 % en la articulación antebraquiocarpiana derecha como control. El volumen inyectado en la articulación de control fue idéntico al inyectado en la articulación tratada (esto es, 1 ml). La sinoviocentesis se realizó de forma aséptica utilizando un abordaje dorsal como se describió anteriormente9. Todos los caballos caminaron de la mano durante 10 min dos veces al día, el día de la inyección y durante toda la duración del estudio.
La concentración de glucosa en sangre, obtenida de la vena yugular con una aguja de calibre 25, se midió mediante el uso de un glucómetro portátil (Accu-chek Performa®, Roche Laboratories, EE. UU.). La sangre se recolectó a los 10 y 30 min y luego cada hora hasta las 8 h, y después, cada 6 h hasta las 74 h después de la inyección intraarticular de la insulina y la solución salina isotónica (Figura 1). La concentración de glucosa en al menos 1 ml de líquido sinovial recolectado de la articulación antebraquiocarpiana a las 2, 4 y 6 h después de la inyección intraarticular de insulina se determinó utilizando el mismo glucómetro.

Se tomaron muestras de sangre a los 60, 75 y 90 minutos después de la administración oral de jarabe de maíz.
Figura 1 Resultados de la prueba oral de azúcar que muestran la concentración de glucemia para los 6 caballos
Se evaluó el color del líquido sinovial, la viscosidad de su apariencia, la concentración de proteínas, la calidad de su coágulo de mucina y los tipos de células contenidas en él antes de la inyección intraarticular de insulina y solución salina isotónica y a las 2, 4 y 6 h después de la inyección. Estas muestras se tomaron mediante el uso del análisis ingenuo de datos agrupados10. La concentración de insulina en la articulación se determinó mediante HPLC, en muestras obtenidas a los 30 min, 1, 2, 4, 6, 8 y 12 h después de la inyección. La concentración del IGF-1 en el líquido sinovial se determinó mediante ELISA (Horse IGF1 ELISA kit, #MBS017382, MyBio-Source®) en muestras obtenidas a las 2, 4 y 6 h después de la inyección intraarticular de dos dosis diferentes de insulina, 15 UI y 20 UI. Todos los muestreos para las diferentes evaluaciones hicieron de este un estudio cruzado de un factor (insulina) y tres niveles (dosis).
Cromatografía líquida de alta resolución (HPLC)
El líquido sinovial, al menos 1 ml, obtenido de las articulaciones antebraquiocarpianas a los 30 min, 1, 2, 3, 4 y 6 h después de la inyección intraarticular de insulina y solución salina o solución salina sola se examinó utilizando HPLC. Las muestras se almacenaron en tubos de Eppendorf y se analizaron siguiendo la técnica de HPLC previamente descrita11. Utilizando esta técnica, las muestras se desproteinizaron con acetonitrilo:propanol (1:1); la fase móvil fue con agua y acetonitrilo (1:1) y ácido trifluoroacético al 1%. Se utilizó una columna C18 (5μm 4.6 x 250 mm) que proporcionó una recuperación del 98 % del volumen de elución, con un coeficiente de variación del 5 %. El límite de detección de este análisis fue de 0.39 μg/ml, y el límite de cuantificación fue de 0.39 μg/ml. El tiempo de elución fue de 20 min.
Las relaciones de las concentraciones séricas de insulina vs tiempo se analizaron utilizando farmacocinética compartimental a través del software de PKAnalyst (MicroMath. Scientific Software, Salt Lake City, Utah, EE. UU., 1995). Con los resultados del programa PKAnalyst se realizó una ji cuadrada para establecer si había una diferencia significativa entre las siguientes mediciones: semivida (K AE_half ), tiempo de concentración máxima (T Conc_Max ) y tiempo de residencia (residence_time), para las tres diferentes dosis de insulina.
Resultados
Evaluaciones clínicas antes de la inyección de insulina
Ninguno de los seis caballos utilizados en este estudio presentó signos clínicos de síndrome metabólico equino (SME) o resistencia a la insulina, como deformidades de los cascos o depósitos anormales de tejido adiposo (Cuadro 1).
Cuadro 1 Características físicas de todos los caballos. Las deformidades de los cascos, el cuello crestado y la condición corporal se consideraron signos clínicos del SME.
| Escala de cuello crestado1 |
Condición corporal2 |
Altura (m) | Peso (kg) | Sexo* | |
|---|---|---|---|---|---|
| Grupo 1 | |||||
| Caballo 1 | 1/5 | 4/9 | 1.69 | 465 | Y |
| Caballo 2 | 2/5 | 5/9 | 1.43 | 322.5 | C |
| Grupo 2 | |||||
| Caballo 3 | 2/5 | 6/9 | 1.43 | 323 | C |
| Caballo 4 | 351.2 | 1.46 | 6/9 | 2/5 | Y |
| Grupo 3 | |||||
| Caballo 5 | 2/5 | 5/9 | 1.53 | 388.5 | S |
| Caballo 6 | 2/5 | 5/9 | 1.45 | 316.5 | C |
| Promedio | 1.83/5 | 5.1/9 | 1.49 | 361.11 | |
1Carter RA, et al. 2009, 2Henneke DR, et al. 1983. S= Semental ; Y= yegua; C= Macho castrado.
No se observaron signos de cojera en ningún caballo durante la evaluación, que se realizó con los caballos trotando en línea recta sobre una superficie dura y en círculo sobre una superficie blanda. No se observaron signos de cojera después de flexionar cada carpo durante 1 minuto. No se observó ninguna anomalía patológica durante la evaluación radiográfica de los carpos. Ninguno de los seis caballos mostró una reacción clínicamente evidente a la instilación intraarticular de insulina o solución salina isotónica (Cuadro 2).
Cuadro 2 Evaluación de la circunferencia de los carpos de los 6 caballos, 24 horas después de la inyección de insulina (cm)
| Caballo | Perímetro de la articulación basal |
Perímetro de la articulación |
Perímetro de la articulación basal |
Perímetro de la articulación |
|---|---|---|---|---|
| Testigo | Testigo (24h) |
Tratado | Tratado (24 h) |
|
| 1 | 34.5 | 34.5 | 34.5 | 34.5 |
| 2 | 28.0 | 28.0 | 28.0 | 28.0 |
| 3 | 28.5 | 28.5 | 28.5 | 28.5 |
| 4 | 28.5 | 28.5 | 28.5 | 28.5 |
| 5 | 30.0 | 30.0 | 30.0 | 30.0 |
| 6 | 28.0 | 28.0 | 28.0 | 28.0 |
Se evaluaron los cambios en el color, apariencia, celularidad y concentración de proteínas en el líquido sinovial tanto en las articulaciones tratadas como en las de control, sin cambios visibles entre las diferentes muestras12.
La prueba oral de azúcar reveló que ninguno de los seis caballos tenía una concentración de glucosa en la sangre superior a 115 mg/dl (Figura 1). La concentración de glucosa en la sangre de todos los caballos para las tres dosis fue significativamente diferente (P<0.001) de la concentración previa al tratamiento a los 30 min y 1 h después de la inyección intraarticular de insulina (Figura 2).

A) Círculos negros 10 UI; B) círculos grises 15 UI; C) círculos blancos 20 UI de insulina en la articulación antebraquiocarpiana.
Figura 2 Concentración promedio de glucosa en sangre de los 6 caballos después de que se administró a cada caballo
Se utilizó una prueba post hoc (Holm-Sidak, Tukey) para determinar si la diferencia era significativa para las tres dosis en todas las muestras de sangre tomadas de la muestra de 1 h, porque la concentración sanguínea más baja se observó en ese momento de muestreo en los tres grupos. La prueba oral de azúcar reveló que ninguno de los seis caballos tenía una concentración de glucosa en la sangre superior a 115 mg/dl7.
No hubo asociación significativa entre los cambios observados en la concentración de glucosa en sangre y la dosis de insulina administrada en la articulación antebraquiocarpiana, ni cuando se compararon entre las tres diferentes dosis, 10 vs 15 vs 20 UI (P= 0.372) y tampoco cuando se compararon entre diferentes dosis (pareadas), 10 vs 15 UI (P= 0.369) y 15 vs 20 UI (P= 0.318).
Glucosa sinovial
La concentración de glucosa dentro de la articulación antebraquiocarpiana disminuyó a las 2 y 6 h después de la inyección luego de que se administraran 15 UI de insulina en esa articulación, mientras que la concentración de glucosa dentro de la articulación antebraquiocarpiana no disminuyó a las 2 y 6 h después de administrar solución salina isotónica en esa articulación (Figura 3).

Figura 3 Concentración de glucosa en el líquido sinovial recolectado de articulaciones tratadas con 15 UI y 20 UI de insulina y articulaciones tratadas con solución salina isotónica
La concentración de glucosa dentro de la articulación antebraquiocarpiana disminuyó a las 4 h después de la inyección luego de que se administraran 20 UI de insulina en esa articulación, mientras que la concentración de glucosa dentro de la articulación antebraquiocarpiana no disminuyó a las 4 h después de administrar solución salina isotónica en esa articulación (Figura 3). Sin embargo, las diferencias en la concentración de glucosa en la articulación antebraquiocarpiana tratada no difirieron significativamente de las de la articulación antebraquiocarpiana de control cuando la dosis de insulina inyectada en la articulación de tratamiento fue de 15 UI (P= 0.5945) o 20 UI (P= 0.235).
Cromatografía liquida de alta resolución (HPLC)
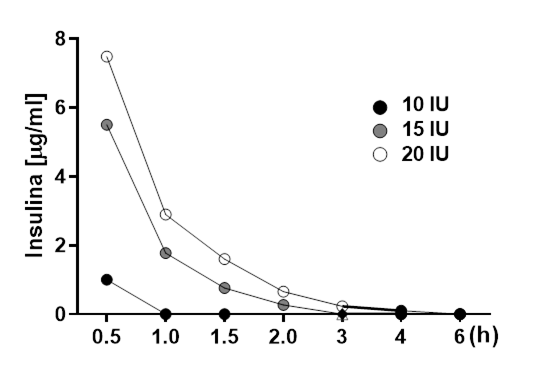
No se pudo detectar insulina en el líquido sinovial en las articulaciones tratadas a las 8 y 12 h después de la inyección. La insulina en el líquido sinovial obtenido a las 2 y 6 h después de la inyección de la articulación antebraquiocarpiana de los seis caballos tratados con 15 UI de insulina y la insulina en el líquido sinovial obtenido a la 1 y 4 h después de la inyección con 20 UI de insulina tomado a los 30 min mostraron un pico de detección a los 16 ± 0.5 min (Figura 4).

Para establecer una curva de eliminación adecuada, el muestreo del líquido sinovial se configuró para obtener 3 dosis de insulina (10, 15 y 20 UI) de 7 muestras en un período de 6 horas, con una línea de tiempo de 0.5, 1, 1.5, 2, 3, 4 y 6 h.
Figura 4 Cromatograma con picos de absorbancia de insulina a los 16 min en cada muestra donde se detectó insulina
La concentración de insulina dentro de la articulación tratada varió a través del tiempo y fue dependiente de la dosis (Figura 5).
Análisis farmacocinéticos
Los resultados obtenidos mediante HPLC se analizaron usando el programa Micromath PKAnalyst®, utilizando la opción del programa para el modelo: #5 un compartimento, y cinética de primer orden. Este modelo proporciona las constantes de retiro, o absorción, que en este caso fueron las mismas, y la relación entre volumen/dosis encontrada en los diferentes muestreos de concentración dentro del compartimento (articulación). También proporciona el área bajo la curva (ABC), la semivida de eliminación (T½β), el tiempo de concentración máxima (T Conc_Max ) y el tiempo de residencia (Residence_Time).
Los valores medios de las variables farmacocinéticas de las concentraciones de insulina en el líquido sinovial de los tres grupos (10, 15 y 20 UI) se compararon mediante un análisis no paramétrico de Kruskall-Wallis, a través del paquete informático JMP (JMP Statistic Mode Visual 1989-1995 SAS Institute). Como los datos mostraron una distribución no normal, los valores farmacocinéticos individuales se compararon utilizando pruebas de Dunn, después de un análisis de Kruskall-Wallis. El grupo de 10 UI no pudo compararse farmacocinéticamente ya que solo tenía un punto de concentración e inmediatamente se encontró por debajo de los límites cuantificables. El grupo se consideró estadísticamente diferente de los otros dos grupos. La variable independiente fue el tiempo y la variable dependiente fue la concentración de insulina. Los valores fueron volumen, dosis y la constante de retiro K AE . Las diferencias en estas variables entre las dosis de 15 y 20 UI fueron ligeras (Cuadro 3).
Cuadro 3 Valores cinéticos calculados para las dosis de insulina de 15 y 20 UI
| Variable | 15 UI de Insulina | 20 UI de insulina | ||
|---|---|---|---|---|
| Resultado | Tiempo (min) |
Resultado | Tiempo (min) |
|
| Semivida de retiro (KAE_half) | 0.199927931* | 11.99 | 0.232681513* | 13.8 |
| Tiempo de concentración máxima (TConc_Max) | 0.288435035* | 17.30 | 0.335688466* | 19.8 |
| Área bajo la curva (ABC) | 5.15211030 | NA** | 7.37122310 | NA** |
| Tiempo de residencia | 0.576870070* | 34.61 | 0.671376931* | 40.2 |
No obstante, una prueba de ji cuadrada reveló que no hubo una diferencia significativa entre la semivida de retiro o absorción (K AE_half ), el tiempo de concentración máxima (T Conc_Max ) y el tiempo de residencia (Residence_Time) para las dosis de 15 y 20 UI (P= 0.9851).
Análisis del líquido sinovial para la concentración de IGF-1
Para determinar si había correlación entre la concentración sinovial de insulina exógena y la concentración sinovial de IGF-1, se midió la concentración de IGF-1 a las 2, 4 y 6 h después de la inyección intraarticular de insulina. Únicamente se evaluaron los grupos de caballos tratados con 15 y 20 UI de insulina y se observaron diferencias significativas entre las concentraciones basales de IGF-1 en los diferentes tiempos de muestreo (P<0.001); el grupo de 10 UI no se consideró para este análisis porque los parámetros de concentración para esta dosis fueron demasiado bajos para ser medidos mediante HPLC (Figura 6).

Los círculos llenos representan caballos tratados intraarticularmente con 20 UI y los círculos en blanco representan caballos tratados intraarticularmente con 15 UI de insulina. *P<0.05; **P<0.01; ***P<0.001.
Figura 6 Concentración de IGF-1 en líquido sinovial de caballos tratados intraarticularmente con A) 15 UI y B) 20 UI de concentración de IGF-1 en el líquido sinovial de caballos tratados intraarticularmente. C) Correlación positiva de los 2 diferentes grupos, entre la concentración de IGF-1 y el tiempo de muestreo del líquido sinovial
Discusión
Evaluación clínica previa
Una evaluación clínica básica sugirió que ninguno de los seis caballos mostró signos clínicos del síndrome metabólico equino (SME) o resistencia a la insulina (RI), cada uno tuvo un puntaje de condición corporal por debajo de lo establecido como un factor de riesgo para estas afecciones, y ninguno tenía una escala de cuello crestado mayor que 2 (siendo un puntaje mayor a 3 un factor de riesgo para SME)6,7,13. Una prueba oral de azúcar proporcionó evidencia objetiva de que ninguno de los caballos tenía SME o RI. Ningún caballo utilizado en este estudio tuvo una concentración de glucosa en la sangre superior a 115 mg/dl, la concentración máxima de normalidad como se describió anteriormente7.
El examen clínico y la prueba oral de azúcar fueron ambos necesarios para eliminar una anomalía metabólica que pudiera alterar el metabolismo de la glucosa y, por lo tanto, alterar el grado de glucemia, causada por la inyección de insulina en una articulación. La concentración de glucosa en el azúcar en la sangre pudo haber sido alterada si el caballo hubiera sido resistente a la insulina. No se realizaron exámenes más específicos para SME o RI, como determinar la concentración de cortisol y/o ACTH en la sangre, la prueba de tolerancia a la glucosa intravenosa y la prueba de respuesta de insulina a la glucosa, y tampoco se analizó la disfunción de la parte intermedia de la pituitaria (DPIP), porque el objetivo de este artículo fue determinar los valores farmacocinéticos de la insulina instilada en la articulación del caballo, sus efectos sistémicos y locales, como el análisis de las variaciones de la concentración de IGF-1 en el líquido sinovial. Los resultados obtenidos de la prueba oral de azúcar, junto con la ausencia de signos clínicos que pudieran sugerir factores de riesgo para RI o SME, fueron considerados, por los autores, como suficientes para incluir a estos caballos en el estudio.
Examen de cojera (clínico y radiográfico)
Examen clínico posterior al tratamiento
La circunferencia del carpo al nivel de la articulación antebraquiocarpiana no difirió entre los carpos de control y los tratados, aunque esta medición se realizó con una cinta métrica escalada en centímetros en lugar de milímetros. Con base en la falla para detectar diferencias en la circunferencia de los carpos tratados y de control y la falla del caballo para quedar cojo en la extremidad tratada, se concluyó que la insulina inyectada en las articulaciones antebraquiocarpianas no causó signos clínicos de inflamación.
Análisis sinoviales (físico/químico)
Se observaron cambios anormales en el líquido sinovial obtenido de las articulaciones tratadas y de control, pero el líquido sinovial de las articulaciones tratadas no difirió en color, apariencia, concentración de proteínas y número de células de las articulaciones de control. Los cambios observados en las articulaciones de tratamiento y de control incluyeron una decoloración rojiza, que fue atribuida a la hemartrosis causada por un traumatismo en la membrana sinovial inflexionada durante la artrocentesis12.
La incidencia de desarrollar sinovitis séptica después de la inyección intrasinovial es bastante alta (34.1 %), sin embargo, si se utiliza una técnica aséptica adecuada, esta es baja. En un estudio retrospectivo de 192 caballos admitidos para el tratamiento de artritis séptica o tenosinovitis, el 22 % de las infecciones fueron causadas por inyección sinovial. En otro estudio retrospectivo de 13 caballos tratados por infección de la articulación tarsocrural, la infección de 9 ocurrió después de la artrocentesis de esa articulación. Debido a que la concentración de proteína en cada articulación tratada fue < 25 g/L y debido a que sólo un pequeño número de células inflamatorias no bacterianas se observaron durante el examen citológico del líquido extraído de la articulación, se concluyó que la instilación de insulina en la articulación no causa ninguna reacción adversa14,15,16.
En general, los caballos con artritis séptica tienen un recuento celular de 30-90 o 100x109/L, y una concentración de proteínas de más de 25 g/L, incluso hasta 60 g/L. Los valores proteicos están asociados a la condición patológica por la que pasa la articulación, podría ser secundaria a traumatismo o infección, donde los valores podrían ser de 20-40 y >40 g/L respectivamente17. Ninguna de las muestras obtenidas en este estudio se acercó a las que se refieren, por lo que no hubo infección o reacción adversa a la insulina inyectada vía intraarticular.
Análisis estadísticos
La cantidad de insulina instilada en la articulación antebraquiocarpiana afectó significativamente la concentración de glucosa en sangre. Para cada una de las tres dosis de insulina administradas, la concentración de glucosa en sangre fue más baja a 1 h. No se encontró asociación entre la dosis de insulina instilada en la articulación y la concentración de glucosa en la sangre. La concentración de glucosa en el líquido sinovial no difirió significativamente entre las articulaciones tratadas y de control cuando se instilaron 15 o 20 UI de insulina en la articulación tratada. Un estudio de potencia para determinar cuántas muestras de líquido articular mostró que al menos 30 muestras tendrían que ser analizadas para producir resultados más confiables.
Cromatografía líquida de alta resolución (HPLC)
Con un ensayo inicial para el muestreo del líquido sinovial mediante HPLC, no fue posible analizar estos resultados con el programa PKAnalyst, porque no se pudo calcular la curva de eliminación de la insulina instilada en la articulación, probablemente porque la concentración de insulina era menor a la que podía ser detectada por el equipo. En consecuencia, se tuvo que modificar los muestreos del líquido sinovial a 30 min, 1 hora, 1.5, 2, 3, 4 y 6 h después de la inyección intraarticular de las tres dosis de insulina para todos los caballos.
La farmacocinética para las dosis de 15 y 20 UI fue lineal, pero no se logró establecer una curva farmacocinética para la dosis de 10 UI, porque la técnica analítica no fue lo suficientemente sensible para detectar la concentración de insulina en el líquido sinovial a 1 h. Las curvas para las dosis de 15 y 20 UI parecían similares, pero se encontraron ligeras diferencias en los valores farmacocinéticos. Por ejemplo, para la dosis de 15 UI, el tiempo de residencia de la insulina, el tiempo de concentración máxima y el área bajo la curva fueron ligeramente, pero no significativamente diferentes de los de la dosis de 20 UI. Para ambas dosis (15 y 20 UI), el tiempo de concentración máxima fue de entre 17-20 min, lo que se correlaciona con la disminución de la concentración de glucosa en la sangre observada a los 30 min después de la inyección intraarticular.
Se necesitan estudios para evaluar el efecto directo de la insulina en los condrocitos, porque la concentración de glucosa en sangre en las articulaciones tratadas no difirió significativamente de la de las articulaciones de control, lo que sugiere que la insulina si se une a su receptor causando que la concentración de glucosa en el líquido sinovial disminuya. Se necesitan estudios para determinar cuándo la concentración sinovial de glucosa vuelve a la normalidad.
El tiempo de acción de la insulina en la articulación o sus efectos farmacocinéticos podrían variar de los observados en este estudio si se realizara un estudio similar utilizando un mayor número de caballos (por ejemplo, n>30), pero el presente estudio proporciona datos para la comparación para futuros estudios.
Con base en los resultados de este estudio, se sugiere que el caballo debe ser observado durante una hora después de inyectar insulina vía intraarticular, para garantizar que la disminución de la concentración de glucosa en sangre no cause signos clínicos de hipoglucemia.
Los cromatogramas obtenidos con HPLC fueron similares a los observados previamente después de instilar insulina en una articulación, se observó un pico de insulina a los 15.8 min11. En este estudio estos picos se observaron a los 16 ± 0.5 min. Debido a que el tiempo de residencia, el tiempo de semivida y el tiempo de concentración máxima fueron mayores con la dosis más alta de insulina (20 UI), se sugiere usar esta dosis cuando se trata la osteoartritis en un caballo instilando insulina intraarticularmente, porque a esta dosis, el efecto de la insulina en la articulación fue más duradero que las dosis más bajas.
Los factores de crecimiento son un grupo de proteínas que desempeñan un papel importante en la reparación de tejidos al mejorar la proliferación, la supervivencia, la división, el crecimiento y la diferenciación celular. El IGF-1 es el factor de crecimiento más importante y poderoso para la reparación del cartílago18.
La insulina y el IGF-1 tienen una estructura muy similar; comparten una secuencia homóloga, tienen una estructura tridimensional similar y tienen una actividad biológica débilmente superpuesta19. El IGF-1 se pliega en dos isómeros de disulfuro termodinámicamente estables (vía deslizamiento de los enlaces de disulfuro), mientras que la insulina se pliega en una estructura terciaria estable única. Esto se debe al procesamiento posterior a la traducción que puede lograr dos estructuras diferentes con la misma secuencia de aminoácidos. El deslizamiento de los enlaces de disulfuro del IGF-1 permite que la proteína cambie su afinidad por la unión del receptor. Parece ser capaz de unir la insulina y su propio receptor19.
Eso plantea la hipótesis de que la insulina puede alterar esta afinidad y en algunos casos unirse al receptor del IGF-1, activando su vía de señalización, ya que este factor de crecimiento tiene funciones autocrinas, paracrinas y endocrinas, sirve como su propia retroalimentación positiva para activar las vías de señalización MAPK/AKT. La instilación de insulina en una articulación, como tratamiento para la osteoartritis de esa articulación, puede ser una opción para los caballos que sufren de osteoartritis, porque el IGF-1 no está disponible comercialmente para uso en articulaciones de caballos18,20.
Conclusiones e implicaciones
No fue posible detectar ninguna reacción adversa local o sistémica a la insulina instilada intraarticularmente. El tiempo de residencia de la insulina dentro de la articulación antebraquiocarpiana fue relativamente corto y proporcional a la dosis. Ninguna de las tres dosis utilizadas en este estudio [estas son, una dosis baja (10 UI), una dosis media (15 UI) y una dosis alta (20 UI)] alteró significativamente la concentración de glucosa en el líquido sinovial y la sangre. La administración intraarticular de insulina exógena mejoró la expresión de IGF-1 en el líquido sinovial, y esta expresión pareció depender de la dosis y el tiempo. Se necesitan estudios para aclarar el mecanismo por el cual esta expresión de IGF-1 se mejora en la articulación equina. Hasta donde se sabe, no existen estudios de insulina utilizada intraarticularmente en medicina humana o veterinaria, por lo que este es el primer estudio in vivo. Este es un estudio descriptivo, y se cree que es el primer estudio in vivo que demuestra que la insulina se puede inyectar de forma segura en una articulación. Este estudio podría ser la base para otros estudios que examinen la eficacia de la insulina para mejorar los signos clínicos de la osteoartritis en caballos.
Literature cited
1. Celeste C, Ionescu M, Poole RA. Repeated intra-articular injections of triamcinolone acetonide alter cartilage matrix metabolism measured by biomarkers in synovial fluid. J Orthop Res 2005;(23):602-610. doi: 10.1016/j.orthres.2004.10.003. [ Links ]
2. Gotoh S, Onaya J, Abe M, Miyazaki K, Hamai A, Horie K, Tokuyasu K. Effects of the molecular weight of hyaluronic acid and its action mechanisms on experimental joint pain in rats. Ann Rheum Dis 1993;(52):817-822. doi: 10.1136/ard.52.11.817. [ Links ]
3. Henson FMD, Davenport C, Butler L, Moran I, Shingleton WD, Jeffcott LB, Schofield PN. Effects of insulin and insulin-like growth factors I and II on the growth of equine fetal and neonatal chondrocytes. Eq Vet J 1997;(29):441-447. doi: 10.1111/j.2042-3306.1997.tb03156.x. [ Links ]
4. Schumacher HR. Aspiration and injection therapies for joints. Arthitis Rheumatol 2003;(49):413-420. doi: 10.1002/art.11056. [ Links ]
5. Davenport C, Boston R, Richardson DW. Effects of insulin-like growth factor-II on the mitogenic and metabolic activities of equine articular cartilage with and without interleukin 1-β. Am Vet Res 2004;(65):238-244. doi: 10.2460/ajvr.2004.65.238. [ Links ]
6. Henneke DR, Potter GD, Kreider JL, Yeates BF. Relationship between condition score, physical measurements and body fat percentage in mares. Eq Vet J 1983;15,371-372. doi: 10.1111/j.2042-3306.1983.tb01826.x [ Links ]
7. Frank N. Equine metabolic syndrome. Vet Clin North Am Equine Pract 2011;(27):73-92. doi: 10.1016/j.cveq.2010.12.004. [ Links ]
8. Smith JS, Ratzlaff MH, Grant BD, Frank FL. The synovial fluid volume of the radiocarpal, intercarpal and tibiotarsal joints of a horse. J Eq Med Surg 1979;(3):479-483. [ Links ]
9. Moyer W, Schumacher J. A guide to equine joint and regional anesthesia. 4th ed . USA: Academic Veterinary Solutions, LLC; 2007. [ Links ]
10. Mahmood I. Naive pooled-data approach for pharmacokinetic studies in pediatrics with a very small sample size. Am J Ther 2014;(21):269-74. doi:10.1097/MJT.0b013e31824ddee3. [ Links ]
11. Hafiz Mohd MJ, Affandi MMR, Ah K, Sepria L. A simple and sensitive method for the determination of insulin in rat plasma and its application in pharmacokinetic study. Int J Pharm Pharm Sci 2013;(5):133-137. [ Links ]
12. Meyer DJ, Harvey JW. Evaluations of fluids: Effusions, synovial fluid, cerebrospinal fluid. In Veterinary laboratory medicine interpretation and diagnosis. 3rd ed. Saunders, USA. 2004;245-250. [ Links ]
13. Carter RA, Geor RJ, Burton SW, Cubbit TA, Harris PA. Apparent adiposity assessed by standardized scoring systems and morphometric measurements in horses and ponies. Vet J 2009;(179):204-210. doi: 10.1016/j.tvjl.2008.02.029. [ Links ]
14. Bertone AL, Cohen JM. Infectious arthritis and fungal infections arthritis. In: Ross MW, Dyson SJ. Diagnosis and management of lameness in the horse. 2nd ed. USA: Saunders; 2011;677-687. [ Links ]
15. Olds AM, Stewart AA, Freeman DE, Schaeffer DJ. Evaluation of the rate of development of septic arthritis after elective arthroscopy in horses: 7 cases. J Am Vet Med Ass 2006;(229):1949-1954. doi: 10.2460/javma.229.12.1949. [ Links ]
16. Adams SB. How to avoid complications following joint injections I: Site preparation and selection of needles. AAEP Proc. 2012;58. [ Links ]
17. Taylor FG, Hillyer MH. Enfermedades musculoesqueléticas. In: Taylor FG, Hillyer MH. Técnicas diagnósticas en medicina equina. Aribia, España. 1997;245-284. [ Links ]
18. Fortier LA, Strauss EJ, Cole BJ. The role of growth factors in cartilage repair. Clin Orthop Relat Res 2011;(469):2706-2715. doi: 10.1007/s11999-011-1857-3. [ Links ]
19. Yun CH, Tang YH, Feng YM, An XM, Chang WR, Liang DC. 1.42 Å crystal structure of mini-IGF-1(2): an analysis of the disulfide isomerization property and receptor binding property of IGF-1 based on the three-dimensional structure. Biochem Biophys Res Commun 2005;(326):52-59. doi: 10.1016/j.bbrc.2004.10.203 [ Links ]
20. National Center for Biotechnology information database. 2020. https://www.ncbi.nlm.nih.gov/ . [ Links ]
Recibido: 15 de Febrero de 2021; Aprobado: 11 de Agosto de 2021











 texto em
texto em