Introducción
Importancia de la producción ovina y caprina nacional
La producción de pequeños rumiantes en México, proporciona un importante aporte de proteína de origen animal para los mexicanos1, genera 50 mil empleos directos e indirectos para aproximadamente 400 mil familias2. No obstante, la mala calidad de los pastos3, los elevados costos de los alimentos4, las sequías e inundaciones y otros desastres derivados del cambio climático5, junto con un grupo de nematodiasis amenazan la salud animal y la economía de los productores.
Nematodosis gastrointestinales en pequeños rumiantes
Los nematodos gastrointestinales (NGI) son gusanos cilíndricos que habitan el tracto digestivo de rumiantes y son considerados como parásitos de gran importancia en la industria ganadera principalmente en sistemas extensivos, tanto de climas tropicales como templados6. Los parásitos adultos copulan y se produce una gran cantidad de huevos que salen al medio junto con las heces en donde desarrollan hasta larvas infectantes (L3) que contaminan los pastos. Los animales se infectan al consumir el pasto contaminado con estas larvas7. Los principales NGI en pequeños rumiantes en México son: Haemonchus contortus, Trichostrongylus colubriformis, T. axei, Teladorsagia (Ostertagia) circumcincta, Cooperia spp., Oesophagostomum, Trichuris ovis, Strongyloides papillosus and Bunostomum spp.8,9. Estos parásitos se presentan generalmente de manera simultánea provocando un cuadro clínico con mayor o menor grado de severidad, dependiendo en gran medida de la edad y del estado nutricional de los animales10. Haemomchus contortus es considerado uno de los nematodos de mayor patogenicidad en rebaños ovinos y caprinos debido a sus hábitos de hematofagia y a su alta prolificidad. La enfermedad causada por este nematodo es conocida como “hemoncosis” y provoca pérdidas de peso, falta de apetito, disminución de la condición corporal, anemia, debilidad, emaciación, edemas de regiones bajas del cuerpo, susceptibilidad a otras enfermedades y la muerte en animales jóvenes11.
Estas enfermedades se presentan en países con climas tropicales y subtropicales11; y también en países con climas templados12. Por otra parte, las nematodosis gastrointestinales en pequeños rumiantes son causantes de importantes repercusiones económicas reflejadas en una disminución del potencial productivo de los animales13. En un estudio realizado en México sobre el impacto económico por NGI en bovinos reportan pérdidas económicas de US$ 445.10 millones de dólares14. Hasta ahora no se cuenta con un estudio sobre las pérdidas económicas que generan los NGI en pequeños rumiantes en México; sin embargo, lo citado anteriormente nos puede dar una idea del impacto negativo que causan estos parásitos en la industria ovicaprina nacional.
Drogas sintéticas o antihelmínticos
Los antihelmínticos (AH) son drogas para el control de parásitos del ganado y se clasifican de acuerdo a su modo de acción en: 1) bencimidazoles (BZ), 2) imidazotiazoles (IMZ) y 3) lactonas macrocíclicas (LM)15. Los BZ se unen a la subunidad alfa de la proteína β-tubulina, evitando la polimerización entre las subunidades alfa y beta, provocando que los micro túbulos no puedan formarse, ocasionando la muerte de los nematodos16,17. Los IMZ actúan selectivamente como agonistas colinérgicos (receptores nicotínicos) de las membranas de las células musculares de los NGI, resultando en contracción muscular y parálisis espástica16. Las moléculas de LM se unen selectiva e irreversiblemente a las subunidades de los canales iónicos de cloro activados por diferentes neurotransmisores (ej. glutamato), provocando la hiperpolarización de la membrana de la célula muscular o neuronal, provocando así la parálisis y expulsión de los NGI18.
Resistencia antihelmíntica
La resistencia antihelmíntica (RA), es la disminución en la susceptibilidad de los parásitos ante una dosis de una droga que eliminaría la mayor parte de los parásitos19. En México, se ha notificado la presencia de RA en rebaños ovinos de Tabasco, Chiapas, Yucatán, Campeche, Tlaxcala, Puebla, y Veracruz, alcanzando también el problema a bovinos20,21,22,23. Así mismo, los NGI han desarrollado mecanismos de detoxificación antihelmíntica24,25. La RA en nematodos puede alterar la proteína diana y el transporte de moléculas xenobióticas como los AH en el nematodo por causa de proteínas transmembranales (P-glicoproteínas, P-gp), con roles de resistencia a múltiples drogas16. En México, se reportaron cambios de expresión relativa de genes P-gp asociados a RA entre un aislado del nematodo H. contortus resistente y susceptible a ivermectina (IVM), sugiriéndolos como germoplasma de referencia para el diseño de estrategias de estudio en el diagnóstico de RA y métodos de control, con la finalidad de preservar la toxicidad de los fármacos utilizados en campo para el control de los NGI. El desarrollo de la RA se debe a una interacción de diferentes factores como: la densidad de población de los NGI, el momento del tratamiento, las condiciones climáticas, entre otros; los cuales influyen en la selección de genes de resistencia17,26.
Consecuencias en el medio ambiente por el uso de drogas antihelmínticas
Los AH se eliminan a través de las heces y la orina y algunos de ellos como las LM, no son biotransformados en su totalidad dentro del animal, y ponen en riesgo a microorganismos no blancos, como artrópodos benéficos27 o escarabajos estercoleros28. Adicionalmente, los AH pueden contaminar los mantos freáticos y ocasionar un importante desequilibrio en el ecosistema acuífero. Algunas LM como la abamectina son extremadamente tóxicas para el crustáceo planctónico Daphnia magna y es altamente tóxico para otros dáfnidos y para peces29 y también son un riesgo en el suelo, contra organismos benéficos como artrópodos, incluyendo moscas30.
Riesgo en salud pública por el uso de drogas antihelmínticas
El uso excesivo de AH en el ganado, implica un riesgo de contaminación de la carne, leche y subproductos originando un riesgo de salud pública31,32) . En Irlanda casi el 60 % de los hatos lecheros utilizan AH de manera preventiva33. En Brasil, se reportó que el 17.8 % de muestras de leche contenía residuos de IVM34. En Minas Geráis, Brasil se demostró la presencia en leche, de amino-bencimidazoles (55.42 %), levamisol (53.57 %), avermectinas (60.24 %), tiabendazol (67.47 %), moxidectina (73.49 %), triclabendazol (45.78 %) y de benzimidazoles (6.02 %)35. En México, es necesario establecer el diagnóstico de residuos de AH en productos diversos para constatar su inocuidad36.
Métodos alternativos de control de las nematodiasis del ganado
Desparasitación selectiva (FAMACHA)
El método FAMACHA es una estrategia de desparasitación selectiva que se basa en el grado de anemia de un animal a través de la palidez de su mucosa ocular utilizando una tarjeta. Esta tarjeta consta de 5 colores que van de rojo intenso hasta pálido o blanco, donde se usa para medir en escala de 1 a 5 la coloración de la mucosa palpebral de los ovinos37. Este método junto con la medición de la condición corporal y con un examen copro-parasitológico, así como del conteo fecal de huevos (CFH) permite formular un criterio de desparasitación38. Este método es una herramienta de gran utilidad para identificar el riesgo parasitario causado por H. contortus en pequeños rumiantes39,40; aunque, debe realizarse por un profesional capacitado, para su uso correcto.
Manejo del pastoreo
El sistema de pastoreo rotacional (PR) se basa en dejar a los animales pastando durante 3.5 días en una área, seguido de periodos de descanso del pastizal de 31 días en condiciones tropicales, reduciendo considerablemente los NGI en ovinos y cabras41. En India, se ha reportado disminución en el CFH de hasta un 55.52 % comparado con un esquema de pastoreo continuo (PC)42. En otro estudio se reportó una reducción de la población de L3 de hasta en un 48.1 % en heces; así como mejores ganancias de pesos en animales bajo un esquema PR, comparado con animales bajo PC43) .
Estrategia nutricional basada una dieta proteica
Se ha comprobado que dietas iso-energéticas e iso-proteicas ayudan a prevenir y controlar algunas parasitosis44. La proteína y energía de ese tipo de dietas contribuyen al control de NGI, al igual que la calidad y cantidad de macro y micronutrientes en la dieta45, fortaleciendo la inmunidad contra los nematodos46.
Uso de plantas con actividad antihelmíntica
Las leguminosas poseen un alto contenido de metabolitos secundarios como taninos condensados e hidrolizables, flavonoides y otros grupos de polifenoles, que representan una alternativa de control de NGI47-50. En México, diferentes leguminosas han dado buenos resultados contra NGI. Por ejemplo, se ha comprobado en estudios in vitro e in vivo que Leucaena leucocephala posee un importante efecto AH contra NGI del ganado51,52. Otras leguminosas como las Acacias poseen derivados del ácido hidroxicinámico en sus hojas, que ejercen una potente actividad ovicida in vitro contra H. contortus, H. placei y Cooperia punctata53,54. Asimismo, en un estudio in vivo con cabras infectadas de forma artificial con H. contortus que recibieron el 10 % de hojas deshidratadas en su dieta redujeron hasta un 70 % de la eliminación de huevos de este nematodo55. Por otro lado, se ha demostrado que las vainas de huizache (A. farnesina) contienen flavonoides como la narigenina 7-O-(6″-galloylglucoside) que son ovicidas y larvicidas contra H. contortus56. Estas dos especies son consideradas como una fuente de forraje rico en proteína para los rumiantes57,58. Caesalpinia coriaria es otra leguminosa con potencial nutracéutico, cuyos frutos secos poseen actividad antimicrobiana y antihelmíntica en salud pública y en rumiantes59,60,61. Recientemente, se logró identificar que el ácido gálico y un derivado de tanino, aislados a partir de frutos de C. coriaria fueron los responsables del efecto AH contra huevos de NGI de bovinos62. Al respecto, los frutos de esta leguminosa se han incluido como parte integral en dietas para ovinos y caprinos, demostrando que no interfiere en su consumo a niveles del 2 % y 10 % respectivamente63,64. En otro estudio biodirigido utilizando la especie arbórea Prosopis laevigata se aisló e identificó al flavonoide isorhamnetin, como potente nematicida in vitro contra H. contortus65.
Vacunación
Los antígenos (ag´s) con potencial inmunoprotector obtenidos a partir de aislamientos autóctonos de los nematodos altamente patógenos, son una alternativa contra las nematodosis en rumiantes bajo condiciones de pastoreo66. El análisis de ag´s de Haemonchus spp., es importante para el desarrollo de vacunas recombinantes contra los principales NGI67. En estudios recientes, se han buscado agentes inmunizantes contra NGI bajo un enfoque de control sustentable68, permitiendo así el desarrollo de la primera vacuna (Barbervax) contra H. contortus derivada de ag´s de superficie del recubrimiento del intestino de los nematodos; sin embargo, esta vacuna solo protege parcialmente contra el nematodo H. contortus. Del mismo modo, se ha propuesto y evaluado la inmunización de corderos con un ag somático recombinante (rHC23) en contra de H. contortus, obteniendo una eficacia en la reducción de huevos entre un 70 y 80 %69. En otro estudio, se evaluó la proteína conocida como “transtiretina”, derivada de productos de excreción y secreción de H. contortus (HcTTR) en cabras infectadas con H. contortus, encontrando que dos dosis de 500 μg de HcTTR recombinante lograron una reducción del CFH del 63.7 %; mientras que la carga parasitaria post-mórtem se redujo en 66.4 % después del desafío comparados con un grupo control70.
Selección genética de animales resistentes
La resistencia genética (RG) es la variación en la respuesta inmune representada por una población de animales con la habilidad de controlar una infección o enfermedad. Es altamente dependiente de la respuesta inmune adaptativa y tiene un origen específico relacionado a un ag71. Se han reportado casos de resistencia ante las infecciones causadas por NGI en varias razas de ovinos; esta resistencia es mediada por la respuesta inmune adaptativa, la cual surge tras la reinfección con un determinado patógeno y está ligada al perfil genético de los animales, siendo un rasgo que puede ser transferido de los padres a su progenie72. Por esta razón, la RG ante los NGI es un rasgo aprovechable en la producción de pequeños rumiantes para el control de este problema, ya que a partir de la evaluación y selección de razas o cruzas de animales resistentes para programas de crianza, basados en el mejoramiento genético, se pueden potenciar los efectos de resistencia y resiliencia involucrados en el fenotipo ante este tipo de infecciones en los miembros de las generaciones futuras71,73,74. Para realizar una selección de animales (SA) con un fenotipo de resistencia en una población, es necesario la evaluación y medición de diversos estándares relacionados con parámetros parasitológicos, inmunológicos y de patogenicidad, dentro de las cuales están la determinación del hpg, condición corporal, porcentaje de hematocrito, la concentración de anticuerpos (IgA, IgE), el grado de eosinofilia en sangre, entre otros71,73,74,75. La SA con fenotipo de resistencia puede dar la pauta para mejorar la resistencia de la progenie en programas de crianza; ya que, al obtenerse una descendencia de animales resistentes, estos presentan menos nematodos adultos y por ende una menor eliminación de huevos al suelo y una menor contaminación del pasto por L373,74. Al disminuir las parasitosis en el rebaño se espera una mejora en la producción ganadera y una menor dependencia del uso de AH, así como el daño a organismos benéficos por los residuos de los antiparasitarios72,76,77. El mejoramiento genético de pequeños rumiantes es una estrategia alternativa de control a mediano plazo de las parasitosis causadas por NGI. La selección de marcadores genéticos e identificación de posiciones genómicas en los cromosomas (locus) ligados al fenotipo son importantes para un mejor entendimiento de los mecanismos de la respuesta inmune asociada a la resistencia a NGI71,76,77,78.
Control biológico
Dentro de los principales enemigos naturales de los nematodos se encuentran los hongos nematófagos (HN). Estos, además de ser saprobios, son parásitos o depredadores facultativos de nematodos79. El HN más promisorio en el control de nematodos del ganado es Duddingtonia flagrans. Este hongo produce una gran cantidad de clamidosporas que pueden ser incorporadas en el alimento, o bien se pueden administrar oralmente en los animales en una suspensión acuosa80,81,82 y una vez que éstas pasan a través del tracto digestivo llegan a las heces fecales donde entran en contacto con las larvas de los nematodos, capturándolas y alimentándose de ellas, reduciendo su población dentro de un rango de entre el 70 y 90 %82-85. Al disminuir la población de larvas en las heces, disminuyen las infecciones y re-infecciones por el ganado86. Los estudios llevados a cabo por el grupo de INIFAP han demostrado una alta efectividad de esta estrategia en la reducción de la población de larvas en heces de bovinos y ovinos bajo distintas condiciones de producción, y en diferentes regiones del país; incluyendo un estudio en una unidad de producción de leche orgánica en la región de Malpaso, Chiapas80. Actualmente, existen dos productos a base de formulaciones de clamidosporas del HN D. flagrans, uno en Australia, bajo el nombre de BioWorma82 y otro en Brasil, con el nombre de Bioverm87. En México, en el CENID-SAI del INIFAP actualmente se trabaja para establecer un acuerdo con una empresa para comercializar un producto a base de clamidosporas de la cepa mexicana del HN para beneficio de la actividad pecuaria.
Método integrado de control
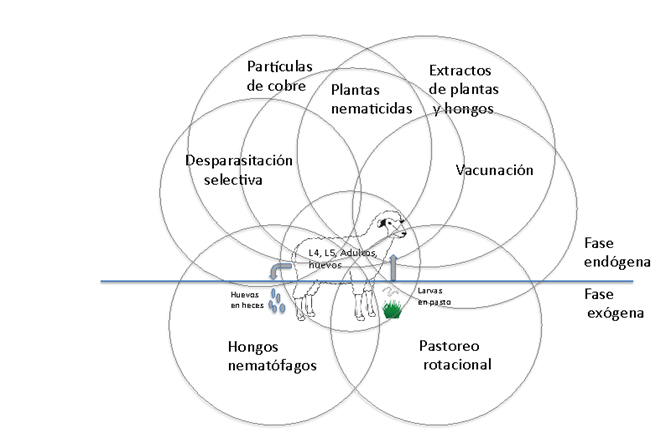
Para lograr un control adecuado de los NGI es importante considerar el blanco de ataque de estos parásitos, basándose en el ciclo de los parásitos, tomando en cuenta que estos pueden ser encontrados básicamente en tres sitios: 1) dentro de los animales, en el tracto digestivo como larvas histiotróficas (L4), como estadios pre-adultos (L5) y como parásitos adultos, junto con los huevos que son producidos por las hembras; 2) en las heces se pueden encontrar a las fases de huevo, y fases larvarias L1 y L2 o pre-infectantes; así como las larvas infectantes (L3); 3) en el suelo y en el pasto, se encuentra a las fases L3. Con base en estos tres sitios donde se encuentran los distintos estadios de desarrollo, se propone una estrategia integral, utilizando como blancos de ataque estos sitios donde se encuentran los parásitos. En la Figura 1, se muestra un esquema representativo de los tres sitios “blanco” donde pueden ir dirigidas las diferentes herramientas de control para que de manera integrada se logre obtener una mayor eficacia en el control de estos parásitos.
Conclusiones
Existen medidas de control probadas científicamente contra las nematodosis del rebaño que deben ser implementadas de manera integrada para mejorar su salud y su productividad, evitando el uso excesivo de AH. El método integrado de control, es una herramienta para disminuir la presentación de la RA, desde una perspectiva sustentable.
Retos y Perspectivas en el control de las nematodosis del ganado en México
La parasitología del futuro, a corto, mediano y largo plazo, enfrenta importantes retos en la búsqueda de estrategias de control diferentes al uso de AH. Es importante considerar que la gran variabilidad en la dinámica de las poblaciones de parásitos en gran medida responde a los cambios climatológicos88. De esta forma, la diseminación de la RA, seguida de la ineficiencia de los AH, son una amenaza constante a los rebaños; por tal motivo se deberán diseñar estrategias para bloquear o revertir los mecanismos genómicos adaptativos de RA89. Nuevos ag´s inmunoprotectores basados en tecnologías recombinantes deberán ser explorados para hacer más eficientes las defensas del organismo69,70,90. El uso de tecnologías sustentables deberán ser consideradas91, como el uso de plantas y sus metabolitos con actividad nematicida92,93. Por otro lado, el uso de HN para el control de parásitos en bovinos y pequeños rumiantes80,81,82, deberá ser implementado en México, llevándolo a nivel de comercialización e implementación en la actividad productiva para beneficio de los productores. De igual manera, el estudio de nanopartículas y de metabolitos de HN también son campos promisorios que deben ser ampliamente explorados94; para encontrar un control adecuado de las nematodiasis del ganado95,96.
Contribuciones al estudio de las nematodosis del ganado
México ha contribuido de forma significativa al quehacer científico particularmente en líneas de investigación tales como Resistencia Antihelmíntica, en la que se ha incluido el estudio del uso de herramientas moleculares para la identificación de genes marcadores de resistencia en parásitos en contra de drogas antihelmínticas17,21,82. Estas investigaciones se han logrado profundizar y se ha incursionado en el estudio de transcriptomas de nematodos, con la finalidad de abrir nuevas perspectivas para una posible reversión de la resistencia en los parásitos hacia los antihelmínticos; además de abordar la detección de animales resistentes a los parásitos, desde una perspectiva genética y molecular78,80. Otra importante línea de investigación que se ha abordado en México es el estudio de plantas y sus metabolitos con actividad nematicida contra parásitos del ganado que ha generado una importante fuente de información que dan la pauta para establecer el uso de plantas con actividad antiparasitaria en beneficio de los productores61,66,72. Por otra parte, se ha generado una importante tecnología sustentable para el control de las nematodiasis en rumiantes; mediante la utilización de una cepa Mexicana (FTHO-8) de un HN de la especie Duddingtonia flagrans que es un enemigo natural de los nematodos. Las esporas de resistencia o clamidosporas de este HN han sido incorporadas en unas “galletas” o “péllets” para el ganado con lo que se consigue que al ser ingeridas por los animales, estas pasen a través del tracto digestivo y lleguen a las heces en donde germinan, colonizan las heces y forman trampas a partir de sus micelios con las que capturan, matan y se alimentan de los nematodos interrumpiendo de esta manera el ciclo biológico de estos parásitos92. Este es un método sustentable que ha sido demostrado de manera exitosa en distintas pruebas y bajo distintas condiciones ambientales y de manejo de los animales87,88,91,93. Finalmente, México ha incursionado en una línea de investigación de vanguardia sobre al estudio de las propiedades antiparasitarias de hongos comestibles y hasta ahora se han logrado importantes resultados incluyendo la identificación de metabolitos bioactivos contra estos parásitos97.











 texto en
texto en