Hoy en día, la seguridad de la calidad e inocuidad alimentaria constituye un factor relevante para muchos países1. La salud y productividad de un animal, junto con la calidad e inocuidad de su leche producida, dependen de la calidad y el manejo del alimento que consumen. Ningún alimento destinado a la nutrición de los animales productores de leche debe presentar algún riesgo de contaminación física, química o microbiológica. Tanto el alimento comercial, como el producido en la granja, deben considerarse como potencial de riesgo para la salud, por lo que antes de proporcionarlo al ganado productor de leche como las cabras, debe ser examinado cuidadosamente para cerciorarse de que no exista presencia de contaminantes (tierra, cuerpos extraños, alambre, hongos, entre otros)2.
La contaminación de alimentos por hongos es un fenómeno muy frecuente, debido a que sus esporas se encuentran ampliamente distribuidas en el ambiente (aire, agua, suelo); de tal modo que la producción agrícola (granos y semillas principalmente) se ve afectada en más de un 25 % con la presencia de algún tipo de micotoxinas3. Los hongos son capaces de desarrollarse en cualquier punto de la cadena alimentaria, en condiciones (pH, humedad relativa, humedad del grano, viabilidad, tiempo de almacenamiento y la presencia de microflora) que favorezcan su desarrollo4, cabe hacer mención que algunas especies de hongos son capaces de colonizar y producir aflatoxinas en diferentes medios como alimentos para humanos y animales.
Las aflatoxinas son sustancias tóxicas producidas en el metabolismo secundario de los hongos Aspergillus flavus, Aspergillus parasiticus y Penicillium puberulum5. Se han identificado 18 tipos de aflatoxinas, de las cuales seis tienen significación como contaminantes de los alimentos: B1, B2, G1, G2, M1 y M2; de ellas la AFB1 es la más carcinogénica y tóxica4. Las aflatoxinas, al encontrarse en forrajes, ensilados y concentrados, estos al ser consumidos por los animales pueden estar presentes en su forma original o metabolizados en sus tejidos. Entre sus metabolitos aparece la aflatoxina M1 (AFM1) que es excretada en la leche6,7.
Los primeros estudios sobre la determinación de AFM1 en México, fueron realizados en el estado de Sonora por Esqueda et al8 en muestras de leche de vaca ultrapasteurizada y comercializada en dicho estado, y por otra parte tampoco se ha informado sobre la presencia de AFB1 en alimentos para cabras lecheras en hatos mexicanos. Algunos de los países en los que se han hecho investigaciones sobre alimentos, leche y derivados lácteos de cabra son: Egipto9,10, Cuba11, Portugal12, España13, Italia14-17, Brasil18, Turquía19,20) Kenia21,22, Sudáfrica23. En la mayoría de las investigaciones se determinó la transferencia de AFB1 de los alimentos a AFM1 en la leche y queso. También evaluaron el contenido de AFM1 en leche y quesos, encontrando hasta un 69 % de muestras positivas con niveles superiores al límite máximo permisible establecido por la Unión Europea (UE) de 0.05 µg/kg para el caso de la leche y hasta un 19 % de muestras positivas con niveles superiores al límite máximo permisible establecido por la UE para el caso de los quesos. En México se desconoce el estado actual de la presencia de AFB1 en alimento para cabras y la aplicación permanente de métodos y técnicas para valorar esa micotoxina considerada como patógena.
El objetivo de este trabajo fue determinar el contenido de AFB1 en alimento para cabras procedentes de cuatro unidades de producción de leche caprina del Altiplano mexicano (APM). La metodología se desarrolló de la siguiente forma: se obtuvieron un total de 47 muestras de concentrados (compuestos principalmente por maíz, sorgo y soya) y 29 muestras de ensilados de maíz procedentes de cuatro unidades de producción de leche caprina (Unidad 1, Unidad 2, Unidad 3 y Unidad 4) del APM. Las muestras se tomaron simultáneamente cada mes durante el periodo comprendido de junio del 2008 a agosto del 2009, de acuerdo con la metodología propuesta por la Norma NOM-188-SSA1-200224. La cantidad mínima para cada una de las muestras fue de un kilogramo, tomándose de distintos puntos del lote. Las muestras se transportaron al laboratorio en recipientes limpios, etiquetados, y protegidos contra la contaminación y deterioro del transporte. Las muestras se analizaron para determinar su contenido de AFB1 por HPLC con detector de fluorescencia de acuerdo con lo establecido en los métodos 968.22 (extracción y columna cromatográfica), 971.22 (preparación de soluciones y determinación de concentración de aflatoxinas) y 990.33 (derivatización) de la AOAC25 e ISO 14718 (método de cromatografía líquida de alta resolución)26.
Para el procesado de las muestras, se molieron 500 g de muestra en un molino y se pasó por un tamiz con una abertura de 1 mm. Posteriormente, se dividió la muestra por el procedimiento de cuarteo, tomando la muestra en forma diagonal, se mezcló y se almacenó en una bolsa de nylon o frasco bien cerrado. Para la extracción, se pesaron 50 g de muestra previamente molida y tamizada con exactitud de 0.1 g y se colocó en un matraz Erlenmeyer con tapa y se le adicionaron 25 g de Celite 545, 25 ml de agua y 250 ml de cloroformo. Se aseguró el tapón y se agitó mecánicamente durante 30 min. Posteriormente, se decantó la solución pasándola por un papel filtro estriado. Se colectaron los primeros 50 ml del filtrado y se almacenaron en un frasco de color ámbar a 4 ºC hasta su análisis.
Para la purificación, se rellenó el fondo de una columna cromatográfica con lana de vidrio, se adicionaron 5 g de sulfato de sodio anhidro (J.T. Baker) y una cantidad suficiente de cloroformo hasta la mitad de la columna. Seguidamente se adicionaron 10 g de sílica gel (J.T. Baker) disuelta en cloroformo deslizándola sobre las paredes de la columna. Se lavaron las paredes de la columna con 20 ml de cloroformo dejando drenar, cuando quedaron entre 5 a 7 cm de cloroformo por encima de la sílica, se adicionaron 15 g de sulfato de sodio anhidro dejando entre 1 a 2 cm de cloroformo por encima del tope del sulfato, se drenó el cloroformo hasta el tope del sulfato, se adicionó la muestra y se drenó hasta que llegó al tope de la columna. Se lavó la misma con 150 ml de hexano y 150 ml de éter dietílico, ambos lavados se descartaron y se eluyeron las aflatoxinas con 150 ml de una mezcla de cloroformo: metanol (97:3 v/v). El eluato cloroformo:metanol se rotoevaporó a casi sequedad bajo presión reducida a una temperatura de 30 ºC. El residuo obtenido se transfirió a un vial recuperándolo con 500 a 1000 μl de cloroformo y se evaporó a sequedad bajo nitrógeno. Al residuo seco se le adicionaron 200 μl de hexano y se agitó con el vortex (ZX4 Advanced IR Vortex Mixer- VELP Scientifica) por 1 min. Posteriormente, se agregaron 50 μl de ácido trifluoroacético, se tapó y se mezcló con el vortex por 1 min y se colocó en baño María a 40 ºC por 30 min. Una vez transcurrido este lapso se evaporó bajo nitrógeno. El residuo se resuspendió en 500 μl de la fase móvil (200 ml de metanol, 200 ml de acetonitrilo y 600 ml de agua; filtrada y desgasificada) antes de someterlo a la cromatografía. Para derivatizar el estándar se tomaron 50 μl de la concentración conocida del estándar, se llevó a sequedad bajo nitrógeno y se procedió de la misma forma anteriormente descrita. Se empleó un cromatógrafo de líquidos de alta resolución Merck-Hitachi con detector de fluorescencia LaCrhom-7480 (longitud de excitación y emisión de 350 nm y 450 nm respectivamente) y una columna de fase reversa C18 Lichrocart 100 (5µm 250 x 0.4 cm). El flujo fue de 1 ml/min. Primero se aplicó fase móvil seguida del estándar para comprobar los tiempos de retención. Posteriormente, se aplicaron 50 μl del eluato de las muestras.
Los cromatogramas se registraron usando una interfase Perkin Elmer NCI 900 y procesados con el software TOTALCHROM versión 6.2. La validación del método se realizó bajo las directrices del Centro Nacional de Metrología27. A partir de la solución de trabajo se preparó una curva patrón con concentraciones conocidas de 0.1, 0.25, 0.5 y 1 µg/ml; con el fin de establecer la linealidad, límite de detección, límite de cuantificación y exactitud del método.
Los resultados fueron los siguientes, en la Figura 1 se presenta el perfil cromatográfico de la AFB1 cuando el estándar es derivatizado con ácido trifluoroacético. El tiempo de retención fue de 5.21 ± 0.10 min. La curva de calibración (y=312869.71x+218056.30) mostró una linealidad significativa (P<0.05) en un intervalo de 0.10-1 µg/ml con un coeficiente de regresión de 0.99. Los límites de detección y cuantificación fueron 0.241 y 0.43 µg/kg respectivamente. El recobrado fue de 87 %. Los resultados obtenidos fueron satisfactorios según los criterios propuestos en la Guía de Laboratorio para la Validación de Métodos27 y muestran que el método fue eficiente para evaluar la presencia de AFB1 en los niveles que exige la UE28 y la NOM-188-SSA1-200224 para 5 y 20 µg/kg respectivamente.
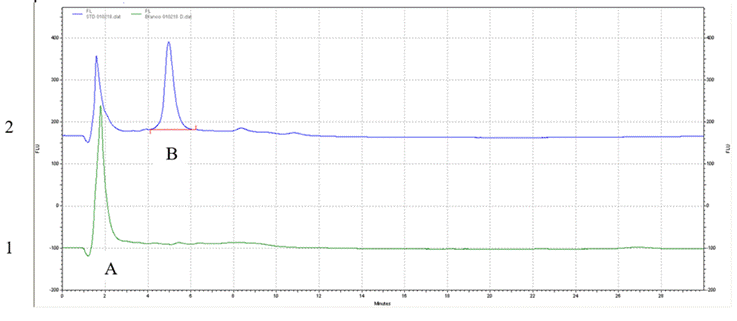
En el cromatograma 1 es del blanco de reactivo donde la señal (A) corresponde precisamente al pico del solvente.
Figura 1 Perfil cromatográfico del estándar de AFB1 (2.19 µg/ml) derivatizado
En el Cuadro 1 se presenta un resumen del número de muestras de concentrados y ensilados en diferentes intervalos de contenidos de AFB1, donde se observa que el 38.29 y 31.0 % de las muestras presentaron niveles de AFB1 superiores al límite máximo permisible establecido por la UE (5 µg/kg) para los concentrados y ensilaje respectivamente28, por otra parte el 29.78 y 10.3 % de las muestras de concentrado y ensilaje respectivamente, sobrepasan el valor establecido en la norma mexicana (NOM-188-SSA1-2002)24.
Cuadro 1 Ocurrencia de aflatoxina B1 en muestras de concentrados y ensilados en cuatro unidades productoras de leche de cabra
| Distribución de frecuencia (%) | |||
|---|---|---|---|
| Matriz | Concentrado | Ensilado | Total |
| Muestras analizadas, No. | 47 | 29 | 76 |
| Muestras positivas que rebasan el LMR establecido por la UE, % | 38.3 | 31 | 69.3 |
| Muestras positivas que rebasan el LMR establecido por la NOM, % | 29.8 | 10.3 | 41.1 |
| nd-5 µg/kg | 29 (61.7%) | 20 (68.9%) | 49 (64.4%) |
| 5-20 µg/kg | 4 (8.5%) | 6 (20.6%) | 10 (13.1%) |
| >20 µg/kg | 14 (29.7%) | 3 (10.3%) | 17 (22.3%) |
LMR= límite máximo permitido; UE= Unión Europea; NOM= Norma Oficial Mexicana.
En la Figura 2 se muestran los intervalos de concentraciones de aflatoxina B1 por unidades para las muestras de concentrados y ensilados, donde el intervalo de concentración osciló entre 0.46-974 µg/kg y 0.44-123.98 µg/kg respectivamente. La unidad 1 para concentrado presentó los mayores valores de aflatoxinas con una mediana de 125 µg/kg, mientras en ensilado la unidad 2 presentó una mediana de 8 µg/kg. El 22.3 % de todas las muestras (concentrados y ensilados) presentaron valores por encima de 20 µg/kg, alcanzando niveles hasta 50 veces por encima del valor permisible, aspecto de gran preocupación por el riesgo que puede presentar en la inocuidad de los productos lácteos29.
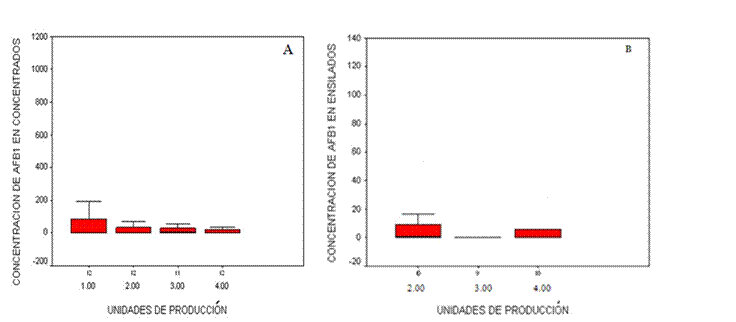
En la gráfica B, en la Unidad 1 no se proporciona el valor de aflatoxina porque no se oferta este producto.
Figura 2 Concentraciones de AFB1 en concentrados (A) y ensilados (B) procedentes de cuatro unidades de producción de leche de cabra en el altiplano mexicano
La presencia de aflatoxinas en maíz en concentraciones altas en orden de miles de µg/kg han sido informada por diversos autores en la región de África30, donde existe un predominio de un clima subtropical y tropical caracterizado por alta temperatura y humedad, que unido a malas prácticas agrícolas y de producción favorece el crecimiento de estas toxinas31. Informes en otras regiones como Asia y América Latina32, también reportan altos valores de aflatoxinas en alimentos, lo que corrobora la problemática global de esta toxina y ha sido alertado por la Organización de las Naciones Unidas para la Alimentación (FAO) en diferentes escenarios, donde se prevé que el riesgo de contaminación por aflatoxinas aumentará en el maíz por el efecto del cambio climático33.
Otro factor que condiciona el nivel y la síntesis de aflatoxinas es el sustrato. De esta manera, alimentos con elevadas concentraciones de hidratos de carbono favorecen la producción de toxinas29. Los hidratos de carbono constituyen la parte más importante de los cereales como el maíz, avena, sorgo y soya, utilizados para la elaboración de los concentrados que se proporcionan como alimento a las cabras, por lo cual, son más susceptibles a la contaminación fúngica y la consiguiente síntesis de aflatoxinas. La presencia de aflatoxina B1 en ensilados también se ha reportado cuando se presenta un deterioro aeróbico durante su proceso, lo que favorece el crecimiento de microorganismos patógenos y la producción de endotoxinas y micotoxinas34,35. Un estudio realizado en Brasil mostró valores de aflatoxina B1 en ensilaje de maíz en un rango 0 -100 µg/g en muestra pre y post fermentada36, superior a lo encontrado a este estudio. Otros estudios también reflejan altos conteos de hongos, lo que podría afectar la palatabilidad de los alimentos y reducir la absorción de nutrientes de los animales37; sin embargo, la mayor preocupación está cuando se consumen estos alimentos por animales en lactación y la presencia de productos metabólicos en los productos lácteos, que eventualmente afectarán la salud humana, principalmente la de los bebés.
La presencia de aflatoxina M1 en leche es debido a la transformación metabólica de la aflatoxina B1, donde una tasa de contaminación de 13.4 % en los materiales de alimentación, se estiman niveles de AFM1 entre 0.22 a 3.47 %38. Un estudio realizado en 17 granjas caprinas del noreste de Italia, mostraron una correlación positiva (0.6) entre la presencia de aflatoxina B1 en el concentrado y la aflatoxina M1 en leche, donde concentraciones de 5 µg/kg de aflatoxina B1 en el alimento presentaron una tasa de conversión de aflatoxina M1 del 0.5 % (25 ng/kg de leche)39. Estos resultados alertan a los organismos reguladores en predecir la presencia de aflatoxina M1 en la leche en estas unidades, si se considera que la mediana de concentración de AFB1 en concentrado y ensilado fue mayor de 20 µg/kg en este estudio y considerando una tasa de conversión del 0.5 % se puede encontrar más de 100 ng de aflatoxina por kilo, estando por encima de LMP por la FDA. Por otra parte, se alerta la necesidad de tener un mayor control de los alimentos que se emplean en las granjas pecuarias que permita minimizar el impacto de la micotoxinas en la industria láctea y en la salud pública. Aspecto que ha sido corroborado en varios estudios cuando existe una mejora continua de las técnicas de alimentación en las granjas lecheras40.
Existió una alta incidencia y concentración de AFB1 en las cuatro unidades de producción de leche caprina del APM, encontrándose por arriba de los límites máximos permisibles establecidos. Por lo tanto, es necesario seguir con las investigaciones y desarrollar un programa de detección permanente en dichas unidades para evitar lotes de alimentos contaminados con AFB1, ya que se debe tener presente que para la industria láctea la ausencia de AFB1 es muy importante, debido a que cuando un animal ingiere un alimento contaminado con AFB1, entre el 1 y 3 % de ésta es metabolizada hacia la leche y derivados lácteos en forma de AFM1, lo que afecta la calidad e inocuidad de la leche y derivados lácteos.
Se reporta por vez primera la presencia de aflatoxina B1 en ensilado en México, aspecto que se debe seguir profundizando para conocer la presencia de otras micotoxinas que también repercuten en la salud pública como son ocratoxina zearalenona y fumonisinas, que han sido reportadas en países del trópico como Brasil. Por otra parte, debido al incremento de la producción de leche de cabra en México en la última década y la poca información en este tema, se debe potencializar los estudios longitudinales con la intención de entender la presencia de AFB1 y AFM1 en la producción caprina, sumando además otras zonas con gran potencial de producción de leche de cabra.











 texto en
texto en 


