Introducción
La leucosis viral bovina (LVB) es una enfermedad neoplásica de origen viral, maligna, sistémica, de alta morbilidad y baja mortalidad, con una acumulación característica de linfocitos neoplásicos en varios órganos, lo que lleva a inmunosupresión y predisposición a patologías secundarias, convirtiéndolo en un animal generador de pérdidas económicas, no sólo por el aumento de enfermedades, sino por el efecto negativo que se ha evidenciado en la producción de leche. La leucosis es causada por un virus de la familia retroviridae tipo “C” ARN, subfamilia Orthoretrovirinae, del género Deltaretrovirus, que causa linfomas, linfosarcomas y leucemia. El virus puede ser trasmitido de forma horizontal o vertical, es decir, entre bovinos o de madre a feto1-3.
Existen reportes de leucosis en varias especies, sin embargo de forma natural solamente se ha reportado en bovinos, búfalos y capibaras4, aunque el caso de los búfalos, es poco estudiado5. Las ovejas se han encontrado muy susceptibles a la inoculación, mostrando tumores rápidamente; otras especies de caprinos, ciervos, conejos, gatos, monos, cerdos y chimpancés han mostrado anticuerpos persistentes después de una inoculación experimental4, lo que parece sugerir que el virus puede pasar la barrera de especie, aunque aún falta más investigación al respecto, sobre todo si se tiene en cuenta que un estudio ha mostrado relación entre la presencia del virus y el cáncer de mama en humanos6.
Los búfalos de agua han sido considerados como una especie resistente a diferentes enfermedades entre ellas las garrapatas, hemoparásitos y algunos nematodos7. Sin embargo, unos pocos reportes sugieren que el virus de la leucosis bovina infecta naturalmente a los búfalos. En la literatura se encuentran reportes de la infección experimental1, pero muy pocos reportes de infección natural y aunque algunos estudios presentan prevalencias, estas son cercanas a cero y realizadas con pruebas que podrían permitir ese porcentaje de falsos positivos1. En Pakistán y Camboya hay reportes de prevalencia de leucosis en búfalos del 0 % evaluados por Western blotting. Otros estudios, han sugerido lo mismo, en los análisis serológicos1,8,9. Incluso, recientemente en el sudeste de Brasil un estudio mostró 0 % de prevalencia mediante inmunodifusión en agar (AGID), PCR y ELISA (ELISA-gp51), lo que refuerza la idea de una posible ausencia de infección natural en los búfalos de agua. En ese mismo estudio, usando un kit de ELISA comercial (ELISA-BLV) en las mismas muestras, el 24.4 % de los animales fueron seropositivos, lo cual muestra los problemas diagnósticos asociados a esta prueba de ELISA que presenta una tasa alta de falsos positivos1,5, a raíz de estos estudios se ha planteado la PCR como una prueba de referencia, a pesar de que AGID es considera la prueba Gold Estándar5.
En un estudio realizado en Filipinas, se encontró una prevalencia del 27 % por PCR, pero con valores del 0 % en un grupo de origen desconocido7. Esto abre nuevamente la incógnita sobre la infección natural de los búfalos, sobre todo en el caso de los animales de producción, porque aunque en el mundo existen múltiples reportes de caso de linfosarcoma en búfalos10,11, muchos de estos casos han sido reportados como negativos al virus de la leucosis bovina5,11, lo que plantea más interrogantes sobre esta enfermedad en los búfalos. Por lo anterior, es necesario aclarar adecuadamente si existe infección natural en los búfalos, en especial si está presente en América, específicamente en Colombia donde no existen reportes de la enfermedad en búfalos12.
Se estima que en el continente americano existen 3’800,000 búfalos; los países americanos con mayor población bufalina son Brasil con 3’500,000 cabezas, Venezuela con 350,000 y Colombia con 308,58013-15. En Colombia es una de las poblaciones de ganado que más ha crecido en los últimos años, debido a la capacidad de los búfalos a adaptarse y mantener su rendimiento en condiciones difíciles en las que los bovinos no podrían14,15. Por este motivo esta actividad económica es cada vez más importante y el estudio sobre las enfermedades que puede padecer constituye un factor importante para la producción, por lo que el objetivo de este trabajo fue caracterizar la producción bufalina en el eje cafetero, determinar la prevalencia del virus de la leucosis bovina por medio de PCR en los búfalos y la presencia del virus en humanos, bovinos y ovejas en contacto o cercanía con los búfalos.
Material y métodos
Tamaño de muestra
De acuerdo con el censo pecuario nacional 2017 del ICA, en el eje cafetero hay 34 predios con aproximadamente 3,105 animales15; con esta información se estimó el tamaño de muestra en 94 animales, teniendo en cuenta una heterogeneidad del 50 %, un margen de error del 10 % y un nivel de confianza del 95 %. Sin embargo, fue posible realizar la evaluación en mayor número de animales, por lo que se obtuvieron 140 muestras de sangre de Búfalos de diferentes razas incluyendo la Murrah, Mediterráneo y Bufalypso, estando la mayoría de los animales en etapa productiva; los búfalos fueron muestreados en ocho hatos del eje cafetero durante los años 2016-2017. También se tomaron muestras de 58 bovinos, 35 ovejas africanas y 9 humanos que estaban en el mismo sistema de producción o muy cerca. En el caso de los humanos fueron personas involucradas con el manejo de los animales. Estas especies fueron tenidas en cuenta porque se han reportado como susceptibles a la infección natural por el VLB4-6.
Toma de información
En los hatos muestreados se tomó información productiva y de factores de riesgo que podrían estar asociados a la presencia de leucosis. Sin embargo, sólo se contó con información productiva de tres hatos porque los demás no llevaban registros o había muy pocos. La información productiva recolectada incluyó peso al nacimiento, peso al destete, ganancia de peso al destete, intervalo entre partos, producción de leche a dos tetas ajustada a 305 días (considerando que dos tetas se dejan para el becerro), producción al pico y días al pico; mientras que los factores de riesgo considerados fueron la raza, el hato y el grupo etario dividido como búfalas en edad productiva (de 3 años o mayores) y no productiva (menores de 3 años)16.
Las fincas en donde se tomaron las muestras de los búfalos estaban ubicadas en la región centro-occidental conocida como región cafetera, integrada principalmente por el departamento de Caldas, Quindío y Risaralda. Las producciones se encontraron en altura promedio entre 917 msnm y 1,575 msnm y una temperatura promedio entre los 18 y 30 °C. El municipio con más animales muestreados fue Marsella con 44, seguido por Chinchiná y Calarcá con 32 cada uno, Pueblo Rico 29, Cerritos 18, Pereira 8 y Cartago 4. Para 47 muestras no se determinó su procedencia exacta porque fueron muestreados en una central de sacrificio. Se incluyó el municipio de Cartago que se sitúa en el norte del departamento del Valle pero es considerado parte de la región cafetera.
Toma de muestras y análisis hematológico
El proyecto fue avalado por el comité de bioética de la Universidad Tecnológica de Pereira en el acta 17 de 2015 (código CBE-SYR-172015). Las muestras de sangre se tomaron con tubos BD vacutainer con EDTA como anticoagulante y agujas número 18, previa desinfección del área con alcohol antiséptico. Los búfalos y ovejas se muestrearon de la vena yugular, los bovinos de la vena coccígea. En el caso de los humanos las muestras se tomaron por un bacteriólogo tras firmar el consentimiento informado. Adicional a las muestras de sangre, se adquirieron 10 muestras de leche de búfalas de venta comercial. Las muestras de leche y sangre se transportaron en neveras portátiles aproximadamente a 4 °C hasta el laboratorio múltiple de Ciencias Animales de la Universidad Tecnológica de Pereira, en donde se realizó el análisis hematológico mediante un analizador automatizado URIT 2900Vet plus (URIT®, Guilin, China) en la opción para búfalos y se tomaron las variables: conteo de glóbulos blancos (En inglés WBC), rojos (RBC), hemoglobina (HGB), hematocrito (HCT) y plaquetas (PLT). Con la cantidad de sangre restante se procedió a la extracción de ADN.
Extracción de ADN de sangre y leche
Para la extracción del ADN de sangre se usó el kit illustra blood genomicPrep Mini Spin Kit de GE® (GE Healthcare Bio-Sciences, Pittsburgh, PA, USA) siguiendo las recomendaciones del fabricante. Una vez obtenidas las muestras se evaluó su pureza mediante análisis de relación de absorbancia a dos longitudes de onda (260/280 nm) usando para esto el Nanodrop 2000c. (Thermo scientific®, Wilmington, USA). Sólo se tuvieron en cuenta las muestras de ADN con relación de absorbancia de 1.8 a 2 y que presentaban una concentración mayor de 10 ng/ml. Las muestras se almacenaron en tubos Eppendorf a -20 °C hasta el momento de los análisis por PCR.
Para la extracción del ADN de las células somáticas de leche se usó el método por Salting out modificado, teniendo en cuenta dos enfoques diferentes, considerando la cantidad de grasa presente en la leche de búfalas. En el primer protocolo, se tomaron muestras de 14 ml de leche cruda en tubos Falcon; se dejaron reposar en el refrigerador a 4 ºC por 1 h y se centrifugaron a 3,500 rpm durante 8 min; luego se rompió y retiró la capa grasa utilizando una pipeta Pasteur y se descartó el sobrenadante sin perturbar el botón de células. Posteriormente se adicionaron 5 ml de solución salina agitando fuerte hasta lograr disolver el botón de células. Se centrifugó nuevamente (de 2 a 3 veces más hasta observar el sobrenadante incoloro) a 3,500 rpm durante 8 min y se descartó el sobrenadante sin perturbar el botón. Después, se adicionaron 5 ml de solución de lisis (10 mM Tris HCl pH 8.2, 400 mM de NaCl, 2 mM de Na2EDTA), 26.5 µl de la enzima proteinasa K (2 mg/ml) y 300 µl de solución SDS y se resuspendió mediante vortex suave durante 1 min; después se llevó a incubar al baño maría a 55 ºC durante 6 h, luego se refrigeraron a 4 ºC por 5 min, se dejó enfriar para luego adicionar 1,5 ml de solución salina saturada (6 M); posterior a esto se usó un vórtex para mezclar y se centrifugó por 10 min a 3,500 rpm; el sobrenadante se llevó a un tubo de 15 ml para agregar etanol al 100% a -20 °C hasta llegar a 14 ml, luego de lo cual el tubo se agitó suavemente por inversión para observar la madeja de ADN. La muestra fue lavada con 1 ml de etanol al 70% y luego se llevó centrifugación a 4,000 rpm; el sobrenadante fue descartado y se invirtió el tubo dejando secar el contenido. Finalmente, el botón fue resuspendido en 300 µl de buffer TE 1X pH 8.0 (Tris HCl 1 M y EDTA 0.5 M), para posteriormente ser almacenado a 4 °C hasta el momento del análisis. El protocolo 2 fue igual al protocolo 1, sólo que en este caso no se rompió la capa de nata, ni se adicionó la solución salina, solo se procedió a pasar directamente de la centrifugación de la leche cruda a la adición del buffer de lisis. Para los dos protocolos se realizó la cuantificación de ADN mediante un nanodrop 2000c (Thermo scientific®, Wilmington, USA) usando 2µl de la muestra resultante de cada protocolo de extracción. Se tuvo en cuenta también las relaciones 260/280 y 260/230 como indicadores de pureza del ADN. Los datos se almacenaron para su posterior análisis estadístico.
Evaluación por PCR
Se evaluó una región altamente conservada del gen env proviral usando la técnica PCR-anidada. Se utilizaron muestras de ADN de bovinos positivos y negativos a leucosis, las cuales fueron aportadas por el grupo de Biodiversidad y genética molecular (BIOGEM) de la Universidad Nacional de Colombia, sede Medellín. Los controles suministrados fueron obtenidos de animales que habían sido previamente confirmados por PCR y ELISA directa para el gen env del provirus. La primera PCR se hizo en un volumen final de 25 µl que contenía aproximadamente 150 ng de ADN, con una concentración final de 0.4 µM de cada oligonucleótido BLV forward (5′-ATGCCCAAAGAACGACGG-3′) y BLV reverse (5′-CGACGGGACTAGGTCTGACCC-3′) 200 µM de cada dNTP, 2.5µl de tampón Top Taq PCR 10X que contiene 15mM de MgCl2 y 1U de Top Taq DNA polimerasa (Qiagen®, Germantown, Alemania). En la segunda reacción de PCR se utilizaron 5µl del producto de PCR de la primera amplificación como ADN molde, con las mismas condiciones que la anterior, pero con los oligonucleótidos Env5032 forward (5′-TCTGTGCCAAGTCTCCCAGATA-3′) y Env5608 Reverse (5′-AACAACAACCTCTGGGAAGGGT-3′). Los iniciadores habían sido reportados previamente17, pero la estandarización se llevó a cabo en un termociclador Labnet TC9610 MultiGene OptiMax Thermal Cycler (Labnet®, Northlake, IL, USA). El perfil de la PCR incluyó una etapa de desnaturalización inicial a 95 °C por 5 min, seguido por 25 ciclos de 95 °C por 30 seg, 60 °C por 30 seg y 72 °C por 1 min, para terminar con una extensión final a 72 °C por 8 min. Para la segunda PCR se tuvo una etapa de desnaturalización a 95 °C por 5 min, seguido por 35 ciclos de 95 °C por 30 seg, 60 °C por 30 seg y 72 °C por 45 seg, para finalizar con una extensión a 72 °C por 10 min18.
Los productos de la segunda PCR se observaron por medio electroforesis en gel de agarosa al 2.5% (Amresco, Cochran Road, OH). Se sirvieron 5 μl del producto de PCR mezclados en 2 μl de tinción EZ vision (AMRESCO, Sidney, Aus). En cada línea de corrido se usaron 2 μl de marcador de peso molecular de 100 pb (low range Fermentas, Glen Burnie, MD), junto con dos 2 μl de EZ-vision. Los geles fueron documentados mediante un fotodocumentador ENDUROTM GDS (Labnet, NJ, USA) para tener evidencia fotográfica. Una banda de 598 bp indicó la presencia del provirus en un individuo. En todos los casos en la PCR se usó un testigo negativo y uno positivo de bovino, también se usaron testigos positivos y negativos de búfalos hallados en este trabajo.
Análisis estadísticos
A partir de la información recolectada en los hatos se realizó estadística descriptiva para resumir la producción y los factores de riesgo en los hatos muestreados. También se realizó un análisis descriptivo de los datos hematológicos, de cuantificación de ADN y de su pureza para las muestras de leche y se realizó una comparación de los protocolos con la prueba t-student para la concentración de ADN, la relación 260/280 y 260/230 de las muestras de leche. Finalmente, se estimaron las prevalencias con su respectivo intervalo de confianza del 95% para cada una de las especies muestreadas. Utilizando la información recolectada para los búfalos se desarrolló un modelo lineal generalizado (GLM) para evaluar el efecto de la infección sobre las características productivas y las variables hematológicas glóbulos blancos, glóbulos rojos, hemoglobina, hematocrito y plaquetas. Posteriormente, se realizó un modelo de regresión logística para determinar si algún factor de riesgo era estadísticamente significativo para la presencia del virus en los individuos.
Resultados
Descripción de los hatos y características productivas
En este estudio, la mayoría de los búfalos muestreados fueron provenientes del departamento de Risaralda (46 %), Quindío (17 %), Caldas (15 %) y otros (22 %). La mayoría de los búfalos fueron de la raza Mediterráneo (29 %), seguido de Murrah (19 %), Bufalypso (13 %) y cruces indeterminados (39 %). De acuerdo al grupo etario tomando en cuenta animales jóvenes en edad no productiva (menores de tres años) y animales adultos en edad productiva (mayores de tres años), se muestrearon 21.6 % de animales jóvenes y 78.4 % de adultos.
En cuanto a los parámetros productivos, se encontró en promedio un peso al nacimiento de 33.39 kg, peso al destete de 202.93 kg, ganancia de peso al destete de 136.27 kg, intervalo entre partos de 491.77 días, leche ajustada a 305 días de 381.59 L, días al pico de 67.29 días (Cuadro 1).
Cuadro 1 Caracterización productiva de los búfalos de agua de la región centro occidental de Colombia
| Característica | Media | Error estándar | Desviación estándar |
|---|---|---|---|
| Peso al nacimiento, kg | 33.89 | 0.17 | 4.31 |
| Peso al destete, kg | 202.93 | 2.22 | 53.43 |
| Ganancia al destete, kg | 136.27 | 3.75 | 96.33 |
| Intervalo entre partos | 491.77 | 5.20 | 63.87 |
| Leche 305 días | 381.59 | 28.79 | 345.49 |
| Días al pico | 76.26 | 6.30 | 62.38 |
| Producción al pico | 2.15 | 0.12 | 3.07 |
Descripción hematológica
Respecto a la evaluación hematológica de las muestras, se encontró que los glóbulos blancos (WBC x 103 µl) fueron más altas en los animales positivos, pero no difirieron estadísticamente de los no infectados; en cuanto a los glóbulos rojos (RBC x 103 µl), estos fueron mayores de forma significativa en los positivos, mientras que la hemoglobina (HGB%) y el hematocrito (HCT%) fueron similares en positivos y negativos. Las plaquetas (PLT x 103 µl) fueron más bajas en las muestras positivas, pero no de forma significativa (Cuadro 2).
Cuadro 2 Descripción de las variables hematológicas en búfalos de agua positivos y negativos a leucosis enzootica bovina
| Característica | Estadístico | Total | Negativos (n=93) | Positivos (n=47) |
|---|---|---|---|---|
| WBCx103µl | Media±EE | 32.94±1.85 | 30.12±3.16 | 33.45±2.80 |
| Desviación estándar | 39.84 | 20.72 | 13.14 | |
| Min | 126 | 78 | 9 | |
| Max | 125 | 77 | 55 | |
| RBCx103µl* | Media±EE | 46.93±3.11 | 66.67±6.06 | 85.64±4.13 |
| Desviación estándar | 26.84 | 39.75 | 19.37 | |
| Min | 80 | 125 | 45 | |
| Max | 79 | 124 | 117 | |
| HGB% | Media±EE | 27.74±1.59 | 20.09±2.47 | 21.82±3.96 |
| Desviación estándar | 22.26 | 16.2 | 18.56 | |
| Min | 68 | 66 | 68 | |
| Max | 67 | 65 | 65 | |
| HCT% | Media±EE | 43.94±2.32 | 46.07±4.39 | 46.77±3.57 |
| Desviación estándar | 32.71 | 28.81 | 16.76 | |
| Min | 97 | 87 | 17 | |
| Max | 96 | 86 | 74 | |
| PLTx103µl | Media±EE | 38.78±2.47 | 45.91±4.89 | 46.32±6.33 |
| Desviación estándar | 32.3 | 32.09 | 29.69 | |
| Min | 99 | 98 | 5 | |
| Max | 98 | 97 | 98 |
WBC= glóbulos blancos; RBC= glóbulos rojos; HGB= hemoglobina; HTC= hematocrito; PLT= plaquetas.
*Diferencia estadísticamente significativa (P<0.05) entre positivos y negativos.
Extracción de ADN
Fue posible establecer un método para extracción de ADN a partir de leche de búfala, con el cual se logró obtener cantidades promedio por encima de 50 ng/µl, que es lo recomendado. Teniendo en cuenta que las muestras de búfalo tienen alta concentración de grasa, se planteó un método con la extracción de ésta. Sin embargo, el protocolo 2 sin eliminación de la grasa fue el que presentó mejores resultados, con una concentración promedio de 165.7 ng/µl frente a 20.5 ng/µl del protocolo 1 (P<0.05). La relación 260/280 del protocolo fue 1.74. Para la extracción de ADN de sangre mediante kit, se obtuvieron concentraciones mayores a 10 ng/ml con una relación 260/280 de 1.8 a 2.
Detección de ADN del VLB
Fue posible la detección exitosa del ADN del VLB mediante la prueba de PCR para leucosis (Figura 1), y de las 140 muestras de búfalo analizadas, se encontró una positividad del 33.6 %. En cuanto a las 58 muestras de bovinos, se encontró una positividad del 3.4 %. Ninguna de las muestras de leche de búfala arrojó resultados positivos (Cuadro 3); tampoco las muestras de ovinos, ni de humanos en contacto con los búfalos fueron positivas, en todos los casos las pruebas fueron validadas con los respectivos controles positivos y negativos mencionados previamente.
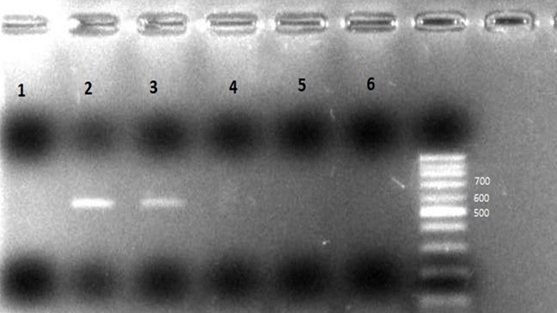
Línea 1= testigo negativo, línea 2= testigo positivo, línea 3= una muestra positiva, líneas 4-6 muestras negativas.
Figura 1 Electroforesis en gel de agarosa para un fragmento del gen Env del provirus de leucosis enzootica bovina en muestras de sangre completa de búfalos
Cuadro 3 Positividad a leucosis en búfalos y otros animales de producción de la región centro occidental de Colombia
| Especie | No. Total/ Positivos |
Prevalencia (%) | Intervalo de confianza 95% |
|---|---|---|---|
| Bufalinos - Sangre | 140/47 | 33.6 | 26 - 42.1 |
| Bufalinos - Leche | 12/0 | 0.0 | 0.0 - 60.4 |
| Bovinos | 58/2 | 3.4 | 0.5 - 12.9 |
| Humanos | 9/0 | 0.0 | 0.0 - 37.1 |
| Ovinos | 35/0 | 0.0 | 0.0 - 12.3 |
Factores de riesgo
Se evaluaron los efectos de factores como municipio, hato, edad y raza sobre la presencia del virus por medio de una regresión logística, pero no se encontró un efecto significativo en ninguno de los casos (P>0.05), por lo que no hay evidencia para suponer que estos son factores de riesgo para la infección con leucosis en búfalos. Finalmente, no se encontraron relaciones de la positividad con la producción de leche, ni los demás parámetros productivos. Aunque es importante aclarar que la información no se logró recolectar de forma homogénea y completa, ya que en las unidades de producción de leche de búfalas no se contaba con suficientes registros.
Discusión
Dadas las características de los búfalos de agua para adaptarse a diferentes climas incluyendo las condiciones tropicales, el clima entre los 18 y 30 °C en donde se encontraban los animales de estudio en la región centro occidental, es propicio para la producción lechera, carne o doble propósito19. En este estudio la raza Mediterráneo fue la más frecuente, similar a Argentina20 y Brasil, aunque la raza lechera más difundida es la Murrah21,22 y en Costa Rica la Bufalypso23. Respecto al sexo, se encontró un mayor número de hembras dado el enfoque lechero de la raza predominante, lo cual concuerda con un estudio previo realizado en la región cafetera de Colombia24 y en Venezuela25.
Respecto al peso al nacimiento, éste fue similar a lo encontrado en otras regiones de Colombia con pesos entre 35 a 40 kg y 30 a 37 kg12,26. El peso al destete de 202.93 kg, también fue similar al peso encontrado en Costa Rica de 160 a 220 kg23 y dentro del rango reportado en Colombia (204.17 -356.45 kg) en hembras Murrah. En cuanto al intervalo entre partos de 491.77 días, fue superior al encontrado en Córdoba (Colombia), el cual fue de 414 días27. La lactancia a los 305 días de 381.59 L a dos tetas, fue inferior a lo reportado en la misma zona, que fue de 1098 L, pero en los cuatro cuartos24. Es importante resaltar que en la zona es una práctica habitual ordeñar dos tetas y dejar las otras dos para el becerro, por lo que las producciones suelen ser menores a las reportadas en otros trabajos. De forma similar fue lo encontrado en la producción al pico fue 2.15 L, valor menor al reportado para la zona de 5.0 L, pero de los cuatro cuartos. Es importante resaltar que la mayoría de los datos productivos de este trabajo fueron obtenidos de un solo hato.
Con respecto a la extracción de ADN de leche de búfala, se encontró que en el protocolo 2 sin extraer la capa de grasa fue el mejor método, ya que permitió obtener concentraciones de ADN mayores con un promedio de 165.78 ng/µl con una relación 260/280 de 1.74 que la permite clasificar como ADN de pureza aceptable; adicionalmente fue encontrada una relación 260/230 de 0.41 lo que hace pensar que con este método quedan algunas contaminaciones con fenoles. Los anteriores resultados coinciden con lo encontrado en un estudio que utilizó seis métodos de extracción en leche de ovejas28, los cuales incluyeron diferentes kits de extracción, fenol-cloroformo y lisis con hidroclorato de guanidina; la relación 260/280 estuvo entre 1.55 a 1.80 y 260/230 entre 1.43 a 1.80 teniendo la mayor contaminación con la solución de lisis. La cantidad obtenida de ADN está dentro del rango obtenido de leche de cabras por el método de “salting out” que fue de 2.12 ng/µl a 610.12 ng/µl, aunque en ese estudio la grasa inicial luego de centrifugar fue descartada28. Finalmente, las muestras fueron tomadas y analizadas por PCR para evaluar posible presencia de BLV; al realizar el análisis de estas 12 muestras de leche, se encontró que ninguna fue positiva para el BLV obteniendo entonces una positividad del 0 %, con la respectiva validación del testigo positivo y negativo mencionado previamente, lo cual es importante si se tiene en cuenta que algunos autores sugieren una relación con el cáncer de mama en humanos6.
El diagnóstico de la leucosis antes del uso de pruebas serológicas y moleculares se basaba en los hallazgos hematológicos, los cuales se respaldaban en la presencia de linfocitosis persistente en la fase preclínica y en la fase leucótica o tumoral, hasta un 30 % de los animales positivos29. En este trabajo, aunque sin diferencia estadísticamente significativa, se encontró un aumento de los glóbulos blancos en los animales positivos comparado con los negativos, pero sin discriminar las líneas celulares, por lo cual no se pueden evidenciar alteraciones específicas en los linfocitos. Similar resultado fue encontrado en Brasil en vacas Holstein en donde la línea blanca fue de 10.3 x 103 µl en negativas y de 27.96 en positivas30. Respecto a la hemoglobina, ésta ha sido reportada como baja en animales positivos, sin embargo, en el presente trabajo no hubo diferencias en este aspecto entre animales positivos y negativos, pero si la hubo respecto a glóbulos rojos, los cuales fueron significativamente más altos en positivos, posiblemente por problemas de desregulación en la diferenciación y maduración de las células sanguíneas tras la infección con el virus. Con respecto a los bovinos muestreados en este trabajo no se encontraron diferencias estadísticamente significativas en ninguno de los parámetros hematológicos evaluados, aunque hay que resaltar que el número de animales era pequeño para tener suficiente potencia estadística.
Aunque se considera al búfalo como una de las especies susceptibles a la infección por el virus de la leucosis bovina, existen pocas evidencias concretas de esto, ya que pocos reportes comprueban la presencia de forma natural, y los que lo hacen han utilizado para el diagnóstico pruebas como la ELISA, AGID y Western blot, los cuales detectan anticuerpos, mas no el ADN proviral, y presentan un porcentaje importante de falsos positivos según algunos reportes de literatura1,5, que ante las bajas prevalencias podrían en duda la verdadera presencia. Por otra parte, se ha considerado susceptible al búfalo por algunos estudios en el que se inocula al animal con el virus para hacer seguimiento de su infección y desarrollo fisiopatológico.
Algunos reportes de linfosarcoma bovino en búfalos han tratado de asociar la presencia de este tipo de lesión con la presencia del virus de la leucosis bovina. Incluso en un caso reportado describen los hallazgos clínicos, hematológicos y celulares atribuyéndole a éste como etiología el VLB, pero sin confirmación con técnicas de laboratorio10. Otro caso en Brasil de linfosarcoma fue reportado en una hembra bufalina a la cual se le realizó prueba de PCR anidada y dió resultado negativo11.
En 2016 se realizó un estudio en búfalos del Amazonas y el sudeste de Brasil, se buscó la presencia del virus por medio de inmunodifusión en agar (AGID), ELISA y PCR. En este estudio se encontró un 24.6 % de animales positivos por ELISA, pero ninguno positivo por AGID que es la prueba considerada como la Gold estándar; tampoco se obtuvieron resultados positivos por medio de PCR, por lo que se concluyó que no había presencia del virus en los animales evaluados; sin embargo, en el año 2000 se encontró en la misma región amazónica la presencia de anticuerpos al VLB en búfalos. Las pruebas que se realizaron fueron AGID y dos tipos de ELISA para detección de antígeno gp51 e inmunoglobulina G. La conclusión de ese estudio fue la presencia natural del virus en búfalos31 con 87, 81 y 69 muestras de suero positivas por cada prueba, respectivamente.
Todo lo anterior hace pensar en los resultados de pruebas no específicas y deja en evidencia los pocos hallazgos la infección natural. Uno de los pocos casos reportados por PCR es en Filipinas, donde se encontró una positividad de 27.6 % para VLB, lo que se convierte en el único reporte confirmatorio del virus en búfalos encontrado en la literatura por este método7. Al igual que en el estudio de Filipinas, en este trabajo se demostró por medio de PCR, la presencia de forma natural del VLB en búfalos de agua en la región del Eje Cafetero de Colombia, siendo este el primer reporte en América por medio de esta técnica y también uno de los primeros a nivel mundial. En el estudio Filipino, se identificó el virus en un total de 272 muestras de la raza Murrah (70 positivos), Carabao Filipino (5 positivos) y raza no determinada (0 positivos). En el presente trabajo, no hubo diferencias significativas entre razas.
En bovinos se encontró una positividad de 3.4 %, inferior a las encontradas en la literatura y aún inferior a la encontrada en búfalos en este estudio que fue de 33.6 %. El análisis de las muestras bovinas también fue realizado por medio de PCR anidada, lo cual puede explicar la diferencia con estudios en Montería con prevalencias de 24 % y Mesa de Los Santos en Colombia con 73 % y en varias regiones de Chile con un 34.7 % en donde el diagnóstico se llevó a cabo por medio de ELISA, con los posibles falsos positivos discutidos anteriormente32-34. A pesar de los resultados encontrados, no se puede descartar la transmisión del virus de VLB entre especies, aunque se tiene que confirmar si los virus que producen la enfermedad en las especies susceptibles, son iguales genéticamente.
Se puede pensar que los factores de riesgo asociados a la presencia de la enfermedad son similares en bovinos y búfalos. Estos factores son la reutilización de agujas en tareas como la vacunación, reutilización de mangas de palpación en chequeos reproductivos, descornado con sierra y falta de control de moscas. En el presente trabajo, no se tuvo acceso a esos datos por lo que otros factores como el hato, la edad de los búfalos y su raza fueron tenidos en cuenta. Ninguno de ellos presentó correlación con la presencia del VLB. En Montería (Colombia) se han encontrado asociaciones positivas en bovinos respecto a la presencia del VLB y la edad, la raza y el tipo de producción, siendo más alto en hembras, ganadería doble propósito y en cruces de cebuinos y Europeos32.
Por otro parte, tras la identificación de la presencia del virus en el humano y su posible asociación con el cáncer mamario, se ha sugerido que la vía de contagio es el consumo de leche cruda y carne de bovinos infectados. En este estudio se analizaron por medio de PCR 12 muestras de leche de búfala adquiridas en el comercio local, de la cuales ninguna fue positiva a la presencia del virus. Algunos estudios en Colombia y Argentina35,36, han demostrado la presencia del virus de la leucosis en leche fresca bovina con 49 y 59 % de positividad respectivamente; sin embargo no existe reporte de hallazgos similares en búfalos.
En cuanto a los resultados de la positividad en la especie ovina, las ovejas han sido consideradas como una de las especies susceptibles a la infección por VLB. Aunque pocos reportes existen al respecto, en Brasil se obtuvo una seropositividad del 0.077 % (2 de 2592). Los animales positivos fueron una hembra de raza Santa Inés y otra hembra de raza desconocida37. En otro caso, ante la aparición de una oveja con linfoma, se realizó prueba con AGID dando resultado negativo38. En otro estudio realizado en Irán en 2015, se evaluaron mediante PCR anidada 95 ovejas con un 7.04 % positivas. En este estudio se analizaron muestras de 35 ovejas africanas (Camuro) mediante PCR anidada y ninguna resultó positiva.
En este estudio también se tomaron nueve muestras de sangre en personal que se encuentra o ha estado en contacto con bovinos y búfalos durante su ejercicio profesional. Ninguna de las muestras fue positiva. Aunque como se mencionó, al parecer el contagio al humano se realiza por medio de alimentos contaminados, no se puede descartar que al igual que en los bovinos, el virus se trasmita por punción con agujas o de alguna otra forma tal como sucede en el caso de otro retrovirus, el del VIH. En el 2003, Buehring y colaboradores detectaron la presencia de anticuerpos al VLB por inmunoblot en humanos obteniendo 39 % positivos de 257 voluntarios. Cabe aclarar que los voluntarios no eran trabajadores del sector agropecuario39.
Conclusiones e implicaciones
Se encontró la presencia del VLB en 33.6 % de los búfalos de la región centro occidental de Colombia, valor mucho mayor que el encontrado en bovinos de la misma zona muestreada (3.4 %); no se encontró presencia del provirus en muestras de leche comerciales de búfala, ni alteraciones hematológicas o productivas en los animales positivos. Dado que éste se constituye en el primer reporte en Colombia de la presencia del VLB en búfalos, no se han establecidos programas de control del mismo para esta especie. Al encontrar casos positivos, los programas podrían ser similares a los utilizados en bovinos, y que están enfocados a la identificación de animales positivos, uso de aguja por animal, cambio de mangas de palpación, desinfección de la tatuadora y descorne químico. Estos sistemas han evitado el sacrificio selectivo de animales positivos40, además el control de la enfermedad disminuye las pérdidas económicas por baja en la producción y atención veterinaria y es fundamental en una posible futura exportación de carme o productos lácteos de búfalo.




![Rendimiento de la planta de frijol caupí [Vigna unguiculata (L.) Walp] y calidad nutricional en los sistemas de cultivo intercalado de frijol caupí y sorgo](/img/pt/prev.gif)






 texto em
texto em 


