Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.12 no.1 Mérida ene./mar. 2021 Epub 20-Sep-2021
https://doi.org/10.22319/rmcp.v12i1.4764
Artículos
Perfil de ácidos grasos de la leche de vacas Holstein x Cebú alimentadas con pasta de licuri
a University of Southwest Bahia State - UESB. D.sc. Nutrition and Ruminant Production. INOVAPEC, Itapetinga, BA, 45700-000, Brazil.
b University of Southwest Bahia State - UESB, Department of Rural and Animal Technology, Itapetinga, BA, Brazil.
c University of Southwest Bahia State - UESB. Nutrition and Ruminant Production. UESB, Itapetinga, BA, Brazil.
El objetivo de este estudio fue evaluar el efecto de dietas suplementadas con diferentes concentraciones de pasta de licuri (PL) en el perfil de ácidos grasos y colesterol de la leche de vacas confinadas. Cuatro vacas con ½ a – de sangre Holstein x Cebú fueron distribuidas en un cuadrado latino 4 x 4, donde los niveles de inclusión de la pasta de licuri en la dieta total fueron 0.0, 5.5, 11.0 y 16.5%, sustituyendo la pasta de soya en la dieta. Los niveles de inclusión de PL ocasionaron una disminución lineal del ácido láurico, elaídico, gamma-linolénico y linoleico conjugado (C18:2cis9trans11; C18:2trans10cis12). La pasta de licuri disminuyó las concentraciones de ácidos grasos poliinsaturados y del ácido linoleico conjugado; además de los ácidos grasos omega 6, que no son relevantes desde el punto de vista de la nutrición humana.
Palabras clave Ácido linoleico conjugado; Biohidrogenación; Subproducto; Cromatografía
The objective was to evaluate the inclusion level of licuri cake (LC) in the diet of confined cows on fatty acid profile and milk cholesterol. Four cows with a blood level of ½ to – Holstein x Zebu blood were used, distributed in a 4 x 4 Latin square, where the inclusion levels of the cake in the total diet were 0.0, 5.5, 11.0 and 16.5%, replacing soybean meal in the diet. There was a linear decreasing effect for the fatty acids Lauric, Elaidic, Gamma-Linolenic and conjugated linoleic acid isomers (C18:2cis9trans11; C18:2trans10cis12) from the inclusion levels of LC. The inclusion of licuri cake negatively influenced the concentrations of polyunsaturated fatty acids and conjugated linoleic acid isomers, in addition to the fatty acids of the Omega-6 series, which is not interesting from the human nutrition point of view.
Key words Conjugated linoleic acid; Biohydrogenation; By-product; Cromatography
Introducción
El licuri (Syagrus coronata) (Martius) Beccari es una palmera característica de las regiones áridas del bioma Caatinga. La pasta es el principal producto que se obtiene después de la extracción de aceite1. Este producto se puede utilizar como una fuente alternativa de bajo costo durante temporadas específicas del año. Sin embargo, la disminución del costo de alimentos depende de diversos factores, como cercanía, disponibilidad del subproducto, características nutricionales y costo del envío. Los ingredientes tradicionales, como el maíz, la soya, el algodón y los subproductos de la elaboración de biodiésel han sido utilizados como fuentes alternativas.
Los componentes de la dieta influyen directamente en la composición de ácidos grasos (AG) de la carne y leche; los ácidos grasos que llegan al duodeno provienen directamente de la dieta o de la biohidrogenación microbiana ruminal de los lípidos2.
Para satisfacer el aumento de la demanda de productos con ciertas grasas saturadas, debido su efecto negativo en la salud humana, la manipulación de los componentes de la leche, especialmente su contenido graso, ha sido estudiado3, ya que algunos ácidos grasos, precursores de colesterol (LDL), han sido asociados con problemas cardiovasculares. Es decir, existe un aumento real en la demanda de alimentos saludables con bajas concentraciones de grasas saturadas y preferiblemente con grasas que beneficien la salud humana.
Sin embargo, la ingesta humana de AG esenciales y ácido linoleico conjugado (ALC) ha disminuido, lo que refleja la baja concentración de estos AG en la leche de rumiantes y el consumo de productos lácteos bajos en grasa4. Por lo que, el objetivo de este estudio fue evaluar el efecto de los niveles de inclusión de pasta de licuri en el perfil de ácidos grasos y colesterol de vacas confinadas.
Material y métodos
Animales y tratamientos
El experimento se realizó en la Fazenda Valeu Boi, localizada en el municipio de Encruzilhada, Bahía, durante el periodo comprendido entre el 3 de mayo y el 22 de agosto de 2016. Este estudio fue aprobado por el Comité de Ética para el Uso de Animales bajo el protocolo número 104/2015 del 15 de abril de 2015.
Se utilizaron cuatro vacas Holstein x Cebú (con ½ a – de sangre H x C) en su tercer o cuarto periodo de lactancia, con una producción de leche promedio de 4,500 a 6,000 kg en la lactancia previa, ajustada para 300 d de lactancia, con un peso corporal promedio de 548 ± 17 kg. Las vacas también se seleccionaron con base a sus días de lactancia, entre 80 y 120 días al inicio del periodo experimental. Las vacas fueron distribuidas en un cuadrado latino 4 x 4 que consistía en cuatro periodos experimentales de 21 días cada uno. Los primeros 16 días correspondieron al periodo de adaptación, y los datos se recopilaron en los últimos 5 días.
La pasta de licuri se compró en Lipe Indústria de Sabão e Velas Ltda, Guanambi, Bahía. Los niveles de inclusión del subproducto en la dieta total fueron 0.0, 5.5, 11.0 y 16.5%; lo que sustituye el 0.0, 25.0, 50.0 y 75.0% de la proteína cruda en la dieta total.
La formulación de la dieta es isoenergética e isoproteica, por lo que aporta los nutrientes necesarios para el mantenimiento de los animales, la ganancia de peso corporal de 0.15 kg d-1 y la producción de 25 kg de leche d-1, ajustada al 3.5% de grasa, de acuerdo con la tabla de requerimientos5 y los datos de composición bromatológica de la caña de azúcar, el maíz, la pasta de soya y la PL, analizada antes de iniciar el periodo experimental.
La fuente a granel utilizada fue la caña de azúcar (Saccharum officinarum) variedad RB 72-454, tratada con una mezcla de urea y sulfato de amonio (9:1) al 1%. El Cuadro 1 muestra la proporción de los ingredientes en los concentrados y la relación fuente a granel: concentrado sobre materia seca.
Cuadro 1 Proporción de los ingredientes sobre materia seca
| Ingredientes | Concentración de pasta de licuri (%MS) | |||
|---|---|---|---|---|
| 0.0 | 5.5 | 11.0 | 16.5 | |
| Caña de azúcar | 49.9 | 49.8 | 50.2 | 50.1 |
| Maíz molido | 35.4 | 32.7 | 29.7 | 27.0 |
| Harina de soya | 12.9 | 10.4 | 7.8 | 5.3 |
| Pasta de licuri | 0.0 | 5.3 | 10.6 | 15.9 |
| Sales minerales1 | 1.0 | 1.0 | 1.0 | 1.0 |
| Piedra caliza | 0.6 | 0.6 | 0.5 | 0.5 |
| Fosfato dicálcico | 0.2 | 0.2 | 0.2 | 0.2 |
| Composición bromatológica | ||||
| Materia seca | 94.2 | 91.7 | 91.1 | 91.7 |
| Proteína cruda | 23.3 | 21.1 | 20.7 | 20.2 |
| Extracto etéreo | 5.81 | 6.2 | 5.9 | 6.6 |
| Fibra detergente neutro2 | 12.4 | 16.2 | 18.4 | 22.9 |
| Fibra detergente ácido | 9.3 | 13.4 | 17.5 | 22.8 |
| Carbohidratos no fibrosos | 53.1 | 51.4 | 50.1 | 45.4 |
| Materia mineral | 5.4 | 6.2 | 6.1 | 6.0 |
| Lignina | 1.5 | 4.2 | 6.8 | 9.1 |
| *NIDN3 | 15.7 | 25.5 | 34.9 | 34.9 |
| *NIDA4 | 15.6 | 18.1 | 19.4 | 25.7 |
| FDNI5 | 1.1 | 5.4 | 9.9 | 13.9 |
1Composición: Calcio 200 g, Cobalto 200 mg, Cobre 1.650 mg, Azufre 12 g, Hierro 560 mg, Flúor (máx.) 1.000 g, Fósforo 100 g, Yodo 195 mg, Magnesio 15 g, Manganeso 1.960 mg, Níquel 40 mg, Selenio 32 mg, Sodio 68 g, Zinc 6.285 mg, 2Corregida para cenizas y proteína; 3Nitrógeno insoluble en detergente neutro; 4Nitrógeno insoluble en detergente ácido; 5Fibra detergente neutro indigestible (FDNi). *Valores en porcentaje de materia seca del nitrógeno total.
Los animales se alojaron en corrales cubiertos individuales de 16 m2 con comederos y bebederos. Las dietas fueron suministradas como dos fracciones diarias de una mezcla completa a las 0700 y 1400 h. Los animales comieron a voluntad y se esperaba un remanente de 5% de la dieta. En cada periodo experimental se evaluó el perfil de ácidos grasos del producto a granel y los suplementos (Cuadro 2). Los lípidos se extrajeron de la muestra siguiendo el procedimiento propuesto6.
Cuadro 2 Perfil lipídico de la caña de azúcar y los concentrados consumidos
| Ácidos grasos1 | Concentración de pasta de licuri (% MS) | ||||
|---|---|---|---|---|---|
| Concentración de ácidos grasos2 (mg g-1) | |||||
| Caña de azúcar | 0.0 | 5.5 | 11.0 | 16.5 | |
| C4:0 | 104.8 | nd* | 0.0 | 0.0 | 0.1 |
| C6:0 | nd* | nd* | 0.02 | 0.05 | 0.1 |
| C8:0 | nd* | nd* | 0.1 | 0.3 | 0.4 |
| C10:0 | nd* | nd* | 2.8 | 5.6 | 8.5 |
| C12:0 | nd* | nd* | 1.7 | 3.4 | 5.1 |
| C13:0 | 2.8 | nd* | nd* | nd* | nd* |
| C14:0 | 11.0 | nd* | 10.2 | 20.3 | 30.7 |
| C16:0 | 10.3 | 14.3 | 15.6 | 16.6 | 18.5 |
| C18:0 | 7.1 | nd* | 1.2 | 2.5 | 3.7 |
| C18:1n9t | nd* | 3.6 | 4.0 | 4.5 | 5.1 |
| C18:1n9c | 14.4 | nd* | 2.0 | 3.9 | 5.9 |
| C18:2n6 | nd* | 35.1 | 32.2 | 28.8 | 27.8 |
| C20:1 | nd* | 0.8 | 0.7 | 0.7 | 0.7 |
| C18:3n6 | nd* | 46.7 | 42.6 | 37.9 | 35.9 |
| C21:0 | nd* | 2,3 | 1,9 | 1,6 | 1,3 |
| C20:3n6 | nd* | 0.2 | 0.2 | 0.1 | 0.1 |
| C20:3n3 | 0,6 | nd* | nd* | nd* | nd* |
| C24:0 | nd* | 0.2 | 0.2 | 0.2 | 0.2 |
| Ácidos grasos totales (mg g-1) | |||||
| AGS3 | 135.9 | 16.8 | 33.8 | 50.6 | 68.6 |
| AGMI4 | 14.4 | 4.3 | 6.7 | 9.1 | 11.7 |
| AGPI5 | 0.6 | 81.8 | 74.9 | 66.8 | 63.9 |
1Nomenclatura común expresada en mg g-1 de grasa. Butírico (C4:0), Capróico (C6:0), Caprílico (C8:0), Cáprico (C10:0), Láurico (C12:0), Tridecanoico (C13:0), Mirístico (C14:0), Palmítico (C16:0), Esteárico (C18:0), Elaidico (C18:1n-9t), Oleico (C18:1n-9c), Gamma-linoleico (C18:2n-6), Eicosenoico (C20:1), Gamma-Linolénico (C18:3n6), Heneicosanoico (C21:0), Dihomo-gamma-linolénico (C20:3n6), Eicosatrienoico (C20:3n3), Lignocérico (C24:0), 3Ácidos grasos saturados, 4Ácidos grasos monoinsaturados, 5Ácidos grasos poliinsaturados y *No detectado.
Análisis de ácidos grasos
Los análisis se realizaron en el Laboratorio de Métodos de Separación Química (LABMESQ) en la Universidad Estatal del Sudoeste de Bahía (UESB). Para extraer los lípidos totales de las muestras de leche fresca, se centrifugaron 50 ml de cada muestra a 12,000 rpm durante 30 min a 4 °C en una microcentrífuga de alta velocidad (Himac CF-16RX II). La capa sólida superior se colectó y almacenó en microtubos para su posterior análisis siguiendo la metodología propuesta7.
Los lípidos extraídos de la leche fresca se utilizaron para preparar ésteres metílicos de ácidos grasos siguiendo el procedimiento descrito modificado8,9. Los ésteres de ácidos grasos se analizaron utilizando un cromatógrafo de gases (GC-2010 Plus Shimadzu) equipado con un detector de ionización de llama (FID, por sus siglas en inglés) y una columna capilar de sílice fundida Rt-2560 (100 m, 0.25 mm d.i). El flujo del gas acarreador (H2) (White Martins) fue de 40 ml min-1; 30 mL min-1 para el gas auxiliar (N2) y 4,000 ml min-1 para la llama de aire sintético. La relación entre el flujo de split y el flujo en columna fue de 90:10. Los parámetros de operación se configuraron después de verificar la mejor resolución. Las temperaturas del inyector y detector fueron 225 °C y 260 °C, respectivamente. La temperatura de la columna se programó a 140 °C durante 5 min, seguida de un aumento de 3 °C min-1 durante 20 min para alcanzar los 245 °C. El tiempo total de análisis fue de 60 min. Las inyecciones se realizaron por duplicado y el volumen de inyección fue de 0.7 μl. Las áreas de los picos correspondientes a los ésteres metílicos de ácidos grasos se determinaron utilizando el software LCSolution®.
Identificación de los ésteres metílicos
Los ésteres metílicos fueron identificados con base a su tiempo de retención, comparándolos con los del estándar con 37 ésteres metílicos de ácidos grasos (189-19 Sigma, EUA) y los tiempos de retención de los estándares de ésteres metílicos de ácidos grasos con los isómeros c9t11 y t10c12 del ácido linoleico (O-5632 Sigma, EUA)9.
Para evaluar la respuesta del detector de ionización de llama, se utilizó una mezcla con concentraciones conocidas de los estándares (Sigma) de los ésteres metílicos de ácidos grasos y la ecuación propuesta por Ackman10. Estos factores se obtuvieron de la media de cuatro replicados:
Donde: FR= factor de respuesta en función del tricosanoato de metilo; A23:0= área del tricosanoato de metilo; C3= concentración de ésteres metílicos de ácidos grasos; Ax= área de ésteres metílicos de ácidos grasos; C23:0= concentración de tricosanoato de metilo.
Los ácidos grasos en las muestras de leche fresca se cuantificaron en mg g-1 de lípidos totales usando el estándar interno de tricosanoato de metilo (23:0) (Sigma, EUA). Después de pesar los lípidos (~ 150 mg) para su transesterificación, se agregaron 1,000 μl de una solución del estándar interno con concentración conocida (1.00 g ml-1) a todas las muestras. La concentración de ácidos grasos en las muestras se calculó con la siguiente ecuación11:
Donde: AX= área de ésteres metílicos de ácidos grasos; A23:0= área del estándar interno; M23:0= masa del estándar interna adicionado a la muestra (en miligramos); MA= masa de la muestra (en gramos); FRT= factor de respuesta teórico de ésteres metílicos de ácidos grasos; FCT= factor de conversión para expresar los resultados de ácidos grasos en mg por g de lípidos totales (LT).
Extracción e identificación del colesterol de la leche
La extracción, detección, identificación y cuantificación del colesterol se realizaron siguiendo la metodología propuesta por Bauer, et al12. Se empleó una columna analítica C18 (250 mm x 4.6mm x 5 µm). La fase móvil fue una mezcla de acetonitrilo:isopropanol (95:5) a un flujo de 2 ml/min; el tiempo de análisis fue de 28 min. Los cromatogramas se corrieron a 202 nm utilizando un equipo de HPLC (Shimadzu) equipado con un desgasificador (DGU - 20 A5R) y dos bombas (LC-20 AR), con un detector UV-Vis (SPD - 20 A). El colesterol se identificó al comparar el tiempo de retención de la muestra con el estándar y se cuantificó en función del área del pico, utilizando un estándar externo de colesterol (Sigma-Aldrich®, código C8667).
Análisis estadístico
Los resultados se evaluaron con un análisis de varianza y regresión utilizando el programa Statistical Analysis System (SAS, 2003). Los modelos estadísticos se seleccionaron con base a la significancia de los coeficientes de regresión utilizando la prueba de F a una probabilidad y coeficiente de determinación del 5%, conforme al siguiente modelo estadístico:
Donde:
Yijk= valor observado de la variable;
µ= promedio general;
li = efecto de la línea i;
cj = efecto de la columna j;
tk(ij) = efecto del tratamiento k;
eijk = error aleatorio (residual).
Resultados
No se observaron diferencias significativas (P>0.05) en las concentraciones de ácidos grasos saturados, butírico (C4:0), capróico (C6:0), caprílico (C8:0), cáprico (C10:0) y hendecanóico (C11:0), en la leche de vacas alimentadas con diferentes concentraciones de PL (Cuadro 3).
Cuadro 3 Composición de ácidos grasos saturados en la leche de vacas alimentadas con diferentes concentraciones de PL
| Ácidos grasos1 | Concentración de pasta de licuri (% MS) | Eq.2 | CV%3 | P4 | |||
|---|---|---|---|---|---|---|---|
| 0.0 | 5.5 | 11.0 | 16.5 | ||||
| C4:0 | 12.6 | 12.9 | 13.6 | 12.9 | 13.0 | 9.6 | 0.7 |
| C6:0 | 12.2 | 11.9 | 12.7 | 11.5 | 12.1 | 8.1 | 0.5 |
| C8:0 | 8.0 | 7.7 | 8.1 | 7.2 | 7.7 | 7.3 | 0.2 |
| C10:0 | 19.1 | 17.8 | 19.2 | 17.1 | 18.3 | 6.1 | 0.1 |
| C11:0 | 3.1 | 2.8 | 2.9 | 2.5 | 2.8 | 11.5 | 0.1 |
| C12:0 | 24.2 | 25.7 | 30.4 | 32.4 | 5 | 7.4 | 0.0 |
| C13:0 | 0.4 | 0.4 | 0.4 | 0.4 | 0.4 | 13.1 | 0.6 |
| C14:0 | 71.4 | 72.1 | 76.9 | 74.1 | 73.6 | 4.4 | 0.2 |
| C15:0 | 8.7 | 6.9 | 6.8 | 6.1 | 7.1 | 17.7 | 0.1 |
| C16:0 | 227.7 | 242.6 | 233.7 | 222.5 | 231.6 | 8.3 | 0.5 |
| C17:0 | 16.1 | 15.7 | 15.3 | 13.9 | 15.3 | 10.8 | 0.4 |
| C18:0 | 36.7 | 33.8 | 34.9 | 35.7 | 35.3 | 10.1 | 0.7 |
| C20:0 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 8.8 | 0.9 |
| C21:0 | 0.7 | 0.6 | 0.6 | 0.6 | 0.6 | 12.2 | 0.4 |
1Nomenclatura común expresada en mg g-1 de grasa. Butírico (C4:0), Capróico (C6:0), Caprílico (C8:0), Cáprico (C10:0), Hendecanóico (C11:0), Láurico (C12:0), Tridecanoico (C13:0), Mirístico (C14:0), Pentadecanoico (C15:0), Palmítico (C16:0), Margárico (C17:0), Esteárico (C18:0), Araquídico (C20:0), Heneicosanoico (C21:0); 2Ecuaciones de regresión; 3Coeficiente de variación; 4Probabilidad de error; 5Y= 0.5316x + 23.804, R² = 0,96.
Se observaron diferencias significativas (P<0.05) en el contenido de ácido láurico (C12:0) con los diferentes niveles de inclusión de PL. La concentración de ácido láurico en las muestras de leche aumentó de forma lineal con los diferentes niveles de inclusión de PL, esto resultó del subproducto (Cuadro 2), que aportó 0.0, 1.5, 2.7 y 3.6% entre los tratamientos.
Los ácidos grasos saturados representan más del 80 % de la composición de ácidos grasos de la leche, lo que demuestra la capacidad de biohidrogenación del ganado en la transformación de ácidos grasos monoinsaturados y poliinsaturados en ácidos grasos saturados; incluso con dietas que contribuyen más del 52 % de ácidos grasos monoinsaturados y poliinsaturados (Cuadro 2). Entre los ácidos grasos saturados, los más abundantes fueron el ácido palmítico (C16:0), mirístico (C14:0) y esteárico (C18:0). El ácido palmítico presentó la concentración media más alta, 231.60 mg g-1.
El Cuadro 4 muestra los ácidos grasos monoinsaturados y poliinsaturados en las muestras de leche. Los diferentes niveles de inclusión de PL no ocasionaron diferencias significativas (P>0.05) en el contenido de ácido miristoleico, pentadecanoico, palmitoleico, 10-heptadecanoico, oleico, linoleico, eicosatrienoico y araquidónico. De estos ácidos grasos, el miristoleico (C14:1) y oleico (C18:1n9c) presentaron las concentraciones medias más elevadas, 10.2 y 78.1 mg g-1, respectivamente. En los ácidos elaídico y gamma-linolénico se observó un efecto lineal decreciente (P<0.05), con una reducción de 0.1 y 0.2, respectivamente, por cada unidad (mg g-1) de PL adicionada a la dieta.
Cuadro 4 Composición de ácidos grasos monoinsaturados y poliinsaturados en la leche de vacas alimentadas con diferentes concentraciones de pasta de licuri
| Ácidos grasos1 | Concentración de pasta de licuri (% MS) |
Eq.2 | CV%3 | P4 | |||
|---|---|---|---|---|---|---|---|
| 0.0 | 5.5 | 11.0 | 16.5 | ||||
| C14:1 | 10.3 | 10.4 | 10.5 | 9.7 | 10.2 | 7.4 | 0.5 |
| C15:1 | 0.9 | 0.9 | 0.9 | 0.9 | 0.9 | 25.5 | 0.9 |
| C16:1 | 2.9 | 2.7 | 2.7 | 2.7 | 2.7 | 4.8 | 0.1 |
| C17:1 | 1.4 | 1.2 | 1.1 | 1.1 | 1.2 | 11.5 | 0.2 |
| C18:1n9t | 5.2 | 4.7 | 3.9 | 3.6 | 5 | 15.0 | 0.0 |
| C18:1n9c | 90.6 | 86.0 | 51.7 | 84.2 | 78.1 | 8.8 | 0.5 |
| C18:2n6 | 2.1 | 1.8 | 1.7 | 1.9 | 1.9 | 18.6 | 0.6 |
| C18:3n6 | 9.4 | 8.2 | 7.0 | 5.9 | 6 | 9.2 | 0.0 |
| C20:3n3 | 0.5 | 0.4 | 0.4 | 0.4 | 0.4 | 8.9 | 0.6 |
| C20:4n6 | 1.1 | 1.0 | 1.0 | 1.0 | 1.0 | 8.2 | 0.3 |
1Nomenclatura común expresada en mg g-1 de grasa. Miristoleico (C14:1), Pentadecanoico (C15:1), Palmitoleico (C16:1), 10-Heptadecanoico (C17:1), Elaídico (C18:1n9t), Oleico (C18:1n9c), Gamma-linoleico (C18:2n6), Gamma-linolénico (C18:3n6), Eicosatrienoico (C20:3n3), Araquidónico (C20:4n6); 2Ecuaciones de regresión; 3Coeficiente de variación; 4Probabilidad de error. 5Y = -0.1042x + 5.197, R² = 0.97 y 6Y = -0.214x + 9,378, R² = 0,99.
Los diferentes niveles de inclusión de PL afectaron (P<0.05) la concentración de ALC (C18:2cis9trans11 y C18:2trans10cis12) en la leche; en el tratamiento con 16.5% (Cuadro 5) de PL, los niveles de ALC disminuyeron 0.01 y 0.03 mg g-1 de grasa, respectivamente.
Cuadro 5 Composición de ácido linoleico conjugado y grasa en la leche de vacas alimentadas con diferentes concentraciones de pasta de licuri
| Ácidos grasos1 | Concentración de pasta de licuri (% MS) |
Eq.2 | CV%3 | P4 | |||
|---|---|---|---|---|---|---|---|
| 0.0 | 5.5 | 11.0 | 16.5 | ||||
| ALC C18:2c9t11 | 0.5 | 0.5 | 0.4 | 0.3 | 5 | 7.8 | 0,0 |
| ALC C18:2t10c12 | 2.1 | 1.7 | 1.6 | 1.4 | 6 | 7.8 | 0.0 |
| Composición (%) | |||||||
| Grasa | 4.4 | 5.0 | 4.9 | 4.9 | 4.8 | 8.2 | 0.2 |
1Nomenclatura común expresada en mg g-1 de grasa. Ácido linoleico conjugado (ALCcis9trans11 y ALCtrans10cis12); 2Ecuaciones de regresión; 3Coeficiente de variación; 4Probabilidad de error. 5Y = -0.0147x + 0.534, R² = 0.99; 6Y = -0.0347x + 1.954, R² = 0,94.
No se observaron diferencias significativas (P>0.05) con los diferentes niveles de inclusión de PL en la concentración de ácidos grasos saturados, monoinsaturados, omega 3 y la proporción omega 6/omega 3 (Cuadro 6). La suma de ácidos grasos poliinsaturados y omega 6 disminuyó (P<0.05). En cuanto a la proporción de ácidos grasos poliinsaturados/saturados, se observó una disminución lineal (P<0.05). No se observaron diferencias significativas (P>0.05) en la concentración de colesterol con los diferentes tratamientos evaluados, con una concentración media de 2.1 mg 100 ml-1, como se observa en el Cuadro 6. Se observó un resultado similar en la composición de grasa de la leche (Cuadro 5).
Cuadro 6: Suma de ácidos grasos y colesterol en la leche de vacas alimentadas con diferentes concentraciones de pasta de licuri
| Ácidos grasos1 | Concentración de pasta de licuri (% MS) |
Eq.2 | CV%3 | P4 | |||
|---|---|---|---|---|---|---|---|
| 0.0 | 5.5 | 11.0 | 16.5 | ||||
| Saturados | 441.5 | 451.2 | 455.9 | 437.3 | 446.5 | 5.8 | 0.7 |
| Monoinsaturados | 111.3 | 105.9 | 100.7 | 102.3 | 105.0 | 7.4 | 0.3 |
| Poliinsaturados | 15.5 | 13.5 | 12.1 | 10.9 | 5 | 8.1 | 0.0 |
| AGPI / AGS8 | 0.3 | 0.2 | 0.1 | 0.0 | 6 | 9.3 | 0.0 |
| n-39 | 0.5 | 0.4 | 0.4 | 0.4 | 0.4 | 8.9 | 0.6 |
| n-610 | 12.5 | 10.9 | 9.7 | 8.8 | 7 | 9.8 | 0.1 |
| n-6 / n-311 | 27.9 | 26.1 | 22.1 | 21.4 | 24.4 | 15.6 | 0.2 |
| Colesterol (mg 100 ml-1) | 2.3 | 2.1 | 1.9 | 2.2 | 2.1 | 14.1 | 0.4 |
1Nomenclatura común expresada en mg g-1 de grasa. 2Ecuaciones de regresión; 3Coeficiente de variación; 4Probabilidad de error; 5Y = -0.2793x + 15.309, R² = 0.99, 6Y = -0.0006x + 0,0338, R² 0.91, 7Y = -0.2278x + 12.382, R² = 0.99, 8Proporción de ácidos grasos poliinsaturados/saturados; 9Total de omega 3: 20:3n3, 10Total de omega 6: 18:2n6, 18:3n6, 20:4n6; 11Proporción de omega 6 y omega 3.
Discusión
Las concentraciones de los ácidos grasos C4:0, C6:0, C8:0, C10:0 y C11:0 no fueron afectadas, probablemente debido a la síntesis de novo y al reducido número de acetato y precursores de la síntesis de β-hidroxibutirato, productos de la fermentación ruminal, la principal ruta metabólica de la acetil-CoA carboxilasa13.
El aumento de la concentración de ácido láurico en la PL fue suficiente para alterar las concentraciones de este lípido en las muestras de leche. El mayor aporte de ácido láurico en la leche puede estar asociado con la inclusión de alimentos derivados del coco14, los cuales tienen una concentración importante de (C12:0); esto explicaría los resultados reportados en este estudio y corroboraría otros resultados15, donde evaluaron la inclusión de pasta de palma en vacas lecheras confinadas. En un estudio previo16, los autores reportaron que el ácido láurico es el responsable de los efectos adversos en la salud humana, ya que es un ácido graso presente en la leche de animales alimentados con dietas que contienen coco o sus subproductos.
Entre los ácidos saturados, los más abundantes fueron el palmítico y el mirístico; estos ácidos grasos se encuentran en altos porcentajes en la PL. Los ácidos palmítico y mirístico tienen el potencial de generar efectos adversos en la salud humana, debido a que pueden incorporarse rápidamente a los triglicéridos celulares, aumentando la colesterolemia17. Los rumiantes pueden convertir el ácido esteárico a un ácido graso monoinsaturado o poliinsaturado18,19. Los ácidos grasos saturados aumentan los niveles de LDL (lipoproteínas de baja densidad, por sus siglas en inglés) en la sangre humana20.
La ausencia de significancia entre los ácidos grasos monoinsaturados y poliinsaturados puede estar relacionada con la actividad enzimática de la Δ9-desaturasa en la glándula mamaria. Según algunos autores21, la Δ9-desaturasa convierte los ácidos grasos saturados a ácidos grasos monoinsaturados.
La concentración del ácido elaídico y alfa-linolénico reportada en este estudio demuestra que el perfil de estos ácidos grasos en la leche puede ser modificado por cambios en el patrón de fermentación microbiana ruminal, principalmente por Butyrovibrio fibrisolvens y Anaerovibrio lipolytica, que hidrolizan los enlaces éster22 y minimizan los efectos tóxicos de los ácidos grasos. Incluso con el aumento de la concentración del subproducto en la dieta (Cuadro 2), la disminución de C18:1n9t demuestra que la capacidad de biohidrogenación de los rumiantes actúa como un mecanismo de defensa.
La reducción del ALC con la inclusión de la PL en la leche obtenida de vacas alimentadas con una dieta a base de caña de azúcar y suplementada con PL indica que el aumento en la partición de subproductos afecta negativamente la concentración del ácido linoleico conjugado. Los isómeros trans-10 cis-12 del ALC son los principales responsables del síndrome de depresión de grasa láctea. En este estudio, las concentraciones de estos isómeros no fueron los suficientemente altas en las muestras evaluadas, por lo que no ejercen efectos adversos en la síntesis de novo de los ácidos grasos y, por lo tanto, no influyen en la composición grasa de la leche20.
Esta disminución en el contenido de ALC en las muestras de leche fue más evidente con los niveles de inclusión del subproducto, aun cuando contenía 44.9 % de ácidos grasos poliinsaturados (Cuadro 2), esta concentración no fue suficiente para aumentar la concentración de ALC en la leche. Así, las bajas concentraciones de C18:2n-6 y C18:3n-6 en la dieta disminuyen el flujo duodenal y, en consecuencia, disminuyen las concentraciones de ALC en la leche. El ácido linoleico conjugado es resultado de la biohidrogenación incompleta del ácido linoleico y linolénico en el rumen23. Anteriormente, se ha demostrado que los isómeros cis-9, trans-11 y trans-10, cis-1224 del ALC benefician la salud humana.
La disminución de los ácidos grasos poliinsaturados y el omega-6 refleja el consumo de ácidos grasos poliinsaturados (Cuadro 2); los rumiantes no sintetizan C18:2 ni sus isómeros25, especialmente aquellos de la familia de omega-6 y omega-3, que obtienen de la dieta.
Está disminución fue menor a la proporción recomendada por Wood et al26, quienes establecen que la proporción de ácidos grasos poliinsaturados y ácidos grasos saturados debe estar por encima de 0.4. Por lo tanto, se requieren más estudios enfocados en mejorar la proporción de AGPI:AGS en la leche. Aunque el balance dietético entre los AGPI (omega-3) está conformado por el ácido alfa-linolénico (C18:3) y el omega-6 por el ácido linoleico (C18:2)27, estos son considerados esenciales para los humanos, aunados al ALC9.
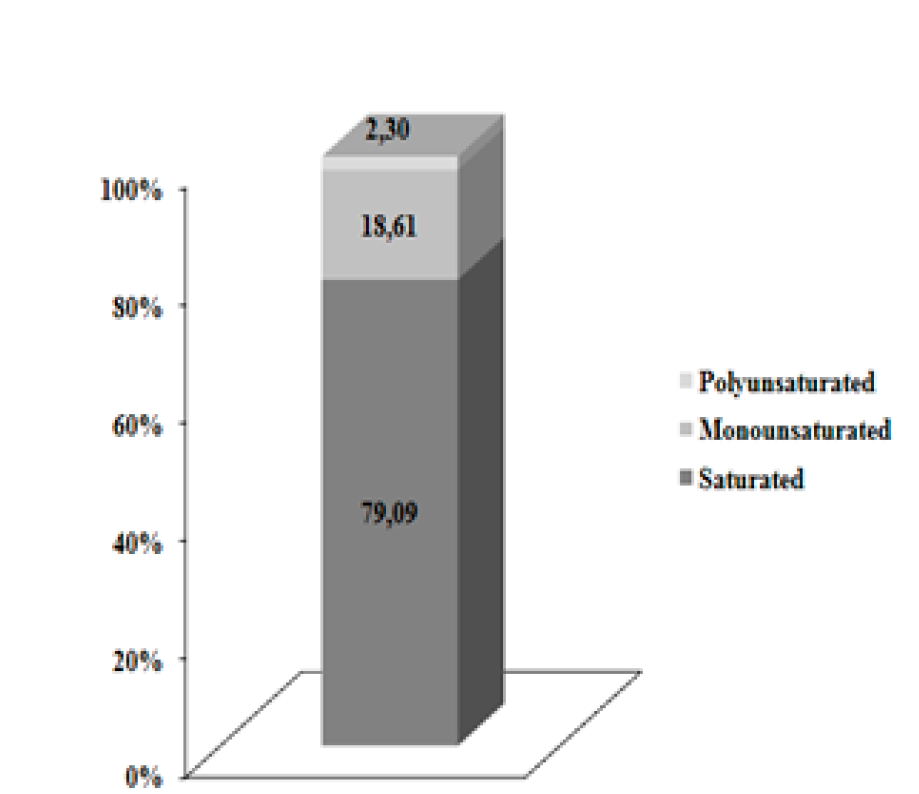
Las altas concentraciones de ácidos grasos en las muestras de leche (Figura 1) se podrían deber a la importante reducción del consumo de AGPI provenientes de la PL (Cuadro 2) y al proceso de biohidrogenación. En un estudio previo se reportaron resultados diferentes28, el estudio comparativo reportó 74.2 y 75.3 % de ácidos grasos saturados en la leche de bovinos y búfalos.
Conclusiones e implicaciones
Los diferentes niveles de inclusión de PL modificaron el perfil lipídico de la leche, principalmente las concentraciones de ácidos grasos poliinsaturados, isómeros del ALC y omega-6, lo cual no es relevante desde el punto de vista de la nutrición humana. La inclusión de PL no afectó la concentración de colesterol.
Agradecimientos
Los autores agradecen a la Coordinación para el Mejoramiento del Personal de la Educación Superior (CAPES) y al Programa de Posgrado en Ciencia Animal (UESB) por su apoyo. Gracias al Research Support Foundation of the State of Bahia (FAPESB), Pronex Project PNX0004 / 2014.
REFERENCIAS
1. Borja MS, Oliveira RL, Ribeiro CVDM, Bagaldo AR, Carvalho GGP, Silva TM, et al. Effects of feeding licury (Syagrus coronate) cake to growing goats. Asian-Aust J Anim Sci 2010;23(11):1436-1444. [ Links ]
2. Buccioni A, Decandia M, Minieri S, Molle G, Cabiddu A. Lipid metabolism in the rumen: New insights on lipolysis and biohydrogenation with an emphasis on the role of endogenous plant factors. Anim Feed Sci Technol 2012;174:1-2. [ Links ]
3. Eifert EC, Lana RP, Lanna DPD, Leopoldino WM, Arcuri PB, Leão MI, et al. Perfil de ácidos graxos do leite de vacas alimentadas com óleo de soja e monensina no início da lactação. Rev Bras Zootec 2006;35:219-228. [ Links ]
4. Elgersma A, Tamminga S, Ellen G. Modifying milk composition through forage. Anim Feed Sci Technol 2006;131:207-225. [ Links ]
5. NRC - National Research Council. Nutrient requirements of dairy cattle. 7 ed. Washington, D.C.: National Academy Press; 2001. [ Links ]
6. Bligh EG, Dyer WJ. Rapid method of total extraction and purification. Can J Biochem Physiol 1959;37(3):911-917. [ Links ]
7. Folch J, Lees M, Stanley GHS. A simple method for the isolation and purification of total lipids from animal tissues. J Biol Chem 1957;226(1):497-509. [ Links ]
8. Bannon CD, Breen GJ, Craske JD, Hai NT, Harper NL, Orourke KL. Analysis of fatty acid methyl esters with high accuracy and reliability. J Chromatog 1982;247:71-89. [ Links ]
9. Simionato JI, Garcia JC, Santos GT, Oliveira CC, Visentainer JV, Souza NE. Validation of the determination of fatty acids in milk by gas chromatography. J Braz Chem Soc 2010;21(3):520-524. [ Links ]
10. Ackman RG. The analyses of fatty acids and related materials by gas-liquid chromatography. Prog Chem Fats Other Lipids 1972;12:165-284. [ Links ]
11. Visentainer JV, Franco MRB. Ácidos Graxos em óleos e gorduras: identificação e quantificação. São Paulo: Varela, 2006. [ Links ]
12. Bauer LC, Santana DA, Macedo MS, Torres AG, Souza NE, Simionato JIJ. Method validation for simultaneous determination of cholesterol and cholesterol oxides in milk by RP-HPLC-DAD. J Braz Chem Soc 2014; 25(1):161-168. [ Links ]
13. Chilliard Y, Ferlay A, Mansbridge RM, Doreau MA. Ruminant milk fat plasticity: nutritional control of saturated, polyunsaturated, trans and conjugated fatty acids. Ann Zootec 2000;49:181-205. [ Links ]
14. Machado GC, Chaves JBP, Antoniassi R. Composição em ácidos graxos e caracterização física e química de óleos hidrogenados de coco babaçu. Ceres 2006;53(308):463-470. [ Links ]
15. Pimentel LR, Silva FF, Robério RS, Rodrigues ESO, Meneses MA, Porto Junior AF, et al. Perfil de ácidos graxos do leite de vacas alimentadas com torta de dendê. Sem Cienc Agr 2016;37(4):2773-2784. [ Links ]
16. Ribeiro CGS, Lopes FCF, Gama MAS, Morenz MJF, Rodrigues NM. Desempenho produtivo e perfil de ácidos graxos do leite de vacas que receberam níveis crescentes de óleo de girassol em dietas à base de capim-elefante. Arq Bras Med Vet Zootec 2014;66(5):1513-1521. [ Links ]
17. Lottenberg AMP. Importância da gordura alimentar na prevenção e no controle de distúrbios metabólicos e da doença cardiovascular. Arq Bras Endocrinol 2009;53(5):595-607. [ Links ]
18. Shaefer EJ. Lipoproteins, nutrition, and heart disease. Amer Soc Clin Nutr 2002;75:191-212. [ Links ]
19. Tsiplakou E, Kominakis A, Zervas G. The interaction between breed and diet on CLA and fatty acids content of milk fat of four sheep breeds kept indoors or at grass. Small Ruminant Res 2008;74:179-187. [ Links ]
20. Oliveira RL, Ladeira MM, Barbosa MAA, Matsushita M, Santos GT, Bagaldo AR, Oliveira RL. Composição química e perfil de ácidos graxos do leite e muçarela de búfalas alimentadas com diferentes fontes de lipídeos. Arq Bras Med Vet Zootec 2009;61(3):736-744. [ Links ]
21. Malau-Aduli AEO Siebert BD, Bottema CDK, Pitchford WSA. Comparison of the fatty acid composition of triacylglycerols in adipose tissue from Limousin and Jersey cattle. Aust J Agri Res 1997;48:715-722. [ Links ]
22. Parodi PW. Conjugated linoleic acid and other anticarcinogenic agents of bovine milk fat. J Dairy Sci 1999;82:1339-1349. [ Links ]
23. Holanda MAC, Holanda MCR, Mendoça Júnior AF. Suplementação dietética de lipídios na concentração de ácido linoléico conjugado na gordura do leite. Acta Vet Bras 2011;5(3):221-229. [ Links ]
24. Bhattacharyaa A, Banua J, Rahmana M, Causeyb J, Fernandes GJ. Biological effects of conjugated linoleic acids in health and disease. J Nutr Biochem 2006;17:789-810. [ Links ]
25. Martin CA, Almeida VV, Ruiz MR, Visentainer JEL, Matshushita M, Souza NE, Visentainer JV. Ácidos graxos poliinsaturados ômega-3 e ômega-6: importânica e ocorrência em alimentos. Rev Nutr 2006;19(6):761-770. [ Links ]
26. Wood JD, Richardson RI, Nute GR, Fisher AV, Compo MM, Kasapidou E, Sheard PR, Enser M. Effects of fatty acids on meat quality: a review. Meat Sci 2003;66:21-32. [ Links ]
27. Williams CM. Dietary fatty acids and human health. Ann Zootech 2000;49:165-180. [ Links ]
28. Pignata MC, Fernandes SAA, Ferrão SPB, Faleiro AS, Conceição DG. Estudo comparativo da composição química, ácidos graxos e colesterol de leites de búfala e vaca. Rev Caatinga 2014;27(4):226-233. [ Links ]
Recibido: 08 de Febrero de 2018; Aprobado: 03 de Diciembre de 2019











 texto en
texto en