Introducción
Los lípidos de la leche se encuentran físicamente en forma de glóbulos formando una emulsión con la fase acuosa. En el interior de estos glóbulos se encuentran los triacilglicéridos (TG), que consisten en moléculas de glicerol esterificadas cada una con tres ácidos grasos (AG). Los TG, al ser los más abundantes (más del 95 % de los lípidos totales), son los principales responsables de las propiedades de los lípidos de la leche, y sus características varían en función de la composición de AG. Aunque la grasa de leche contiene más de 400 AG diferentes1, apenas 30 o 40 están presentes en concentraciones superiores al 0.1 %. El perfil de AG de la leche y los productos lácteos siendo el principal relacionado con factores dietéticos, seguido por la especie de rumiante, y en menor grado, factores genéticos, rendimiento lechero y el estado de lactación.
Considerando su estructura, los AG se dividen en saturados o insaturados. La mayor parte de los AG saturados contienen un número par de átomos de C, con longitudes que van de 4 hasta 20C. Aunque los más abundantes son los que tienen una longitud de cadena de 10 a 20 átomos de C, la grasa de leche de rumiante se caracteriza por la presencia de cantidades importantes de AG de cadena corta, especialmente el 4:0 y el ácido caproico (6:0). Dentro del grupo de insaturados, los cuales pueden tener de uno a cuatro enlaces, el más abundante (15 a 20 %) es el ácido oleico (cis-9 18:1). La presencia de pequeñas cantidades de ácidos linoleico (2 %) y α-linolénico (0.5 %) en la leche es originaria de la dieta ya que ambos no son sintetizados en los tejidos, por lo que se les da un carácter de AG esenciales.
La leche de rumiantes contiene además AG de número impar de átomos de carbono y los de cadena metil-ramificada (AGCIR). Los de número impar de átomos de C representan 2 % del total de AG, siendo 15:0 y 17:0 los más abundantes y representativos (Cuadro 1). Los de cadena ramificada se encuentran en una proporción similar y engloban a un mayor número de moléculas, clasificadas como iso y anteiso, con concentraciones variables en productos lácteos. Aunque en conjunto los niveles en grasa láctea de AGCIR no suelen superar el 5 %, su presencia tiene gran interés porque se utilizan como indicadores de funcionamiento ruminal y, en humanos, como indicadores de la ingesta de productos lácteos. En comparación con sus homólogos no ramificados, los AG de cadena ramificada presentan puntos de fusión más bajos, especialmente los anteisos, característica que los permite contribuir a mantener la fluidez de la grasa láctea.
Cuadro 1 Contenido (g/100 de ácidos grasos totales) de ácidos grasos de cadena impar y ramificada en productos lácteos
| Ácido graso | Leche | Mant. | Yogurt | Nata | Queso | ||
|---|---|---|---|---|---|---|---|
| 7 | 58 | 59 | 43 | ||||
| iso 13:0 | 0.04 | ||||||
| iso 14:0 | 0.05-0.13 | 0.09 | 0.17 | 0.12-0.13 | 0.00-0.05 | 0.00-0.22 | |
| iso 15:0 | 0.14-0.22 | 0.22 | 0.10 | 0.14-0.15 | 0.00-0.11 | 0.02-0.42 | |
| iso 16:0 | 0.21 | 0.34 | 0.29-0.30 | 0.24 | 0.00-1.18 | ||
| iso 17:0 | 0.27 | 0.31 | 0.16-0.25 | 0.27-0.30 | 0.05-0.30 | ||
| iso 18:0 | <0.01 | 0.00-0.04 | <0.01 | 0.00-0.09 | |||
| anteiso 13:0 | 0.08 | ||||||
| anteiso 15:0 | 0.32-0.45 | 0.46 | 0.63 | 0.62-0.63 | 0.46-0.49 | 0.38-0.88 | |
| anteiso 17:0 | 0.50 | 0.38 | 0.56-0.59 | 0.36-0.37 | 0.29-0.61 | ||
| 15:0 | 0.84-1.31 | 0.89 | |||||
| 17:0 | 0.45-0.66 | 0.52 | 0.55-0.90 | ||||
Mant= mantequilla; Fievez et al7; O´Donnell-Megaro et al58; Shingfield et al59; Ran-Ressler
et al43.
Aunque una gran proporción de los AGCIR contenidos en la grasa láctea son formados durante los procesos fermentativos en rumen, se ha sugerido recientemente que una pequeña cantidad podría sintetizarse en forma endógena (vgr. tejido mamario). Además, en la última década se han multiplicado las evidencias que apuntan que los AGCIR podrían jugar un papel relevante en la salud humana. Por ello, su presencia en los productos lácteos debería ser contemplada de forma positiva, ya que estos alimentos son casi la única fuente de estos componentes en la dieta. El objetivo de este manuscrito es, por un lado, actualizar la información sobre el origen y la síntesis de estos AG en rumiantes, revisando la influencia del tipo de alimentación sobre su contenido en leche y, por otro, recopilar las evidencias sobre los beneficios nutricionales que la presencia de estos componentes podría reportar en humanos.
Origen de los ácidos grasos de cadena impar y ramificada
Síntesis ruminal de AGCIR
Una de las características de la grasa de leche de rumiantes respecto a la de otros mamíferos es la alta concentración de AGCIR. Vlaeminck et al2 recopilaron datos de numerosos estudios sobre la composición de AGCIR en leche y mostraron que los principales AGCIR son isómeros de los AG tetradecanoico (iso 14:0), pentadecanoico (15:0, iso 15:0 y anteiso 15:0), hexadecanoico (iso 16:0) y heptadecanoico (17:0, iso 17:0 y anteiso 17:0).
Los AGCIR son sintetizados principalmente durante los procesos de fermentación microbiana a nivel ruminal. Las bacterias ruminales contienen entre 50 y 90 g/kg de lípidos en su materia seca, y alrededor de un 5 % de los mismos son AGCIR que se localizan preferentemente en las membranas3. Los protozoos poseen menos AGCIR totales que las bacterias (110 vs 160 g/kg de AG totales), aunque presentan una mayor proporción de iso 16:0 y anteiso 17:04.
Los precursores de la síntesis microbiana de AG ramificados en el rumen son leucina, isoleucina, y valina, aminoácidos de cadena ramificada procedentes de la dieta (Figura 1). Inicialmente la microbiota ruminal transforma estos aminoácidos en ácidos carboxílicos ramificados de cadena corta, isovalérico, 2-metil-butírico e isobutírico, respectivamente, unidos a la coenzima A. A continuación, se produce la elongación de cadena de estos AG gracias a la actividad de la enzima AG sintasa (AGS) de los microorganismos. Los iso de cadena par se originan a partir del ácido isobutírico, mientras que los iso y anteiso de cadena impar se generan a partir de los ácidos isovalérico y 2-metil-butírico, respectivamente. El precursor de los AG impares de cadena media (13:0, 15:0 y 17:0) en el rumen es el ácido propiónico, que procede de la fermentación de ciertos componentes de la ración, aunque los AG 15:0 y 17:0 también pueden originarse por α-oxidación a partir de los AG 16:0 y 18:0 presentes en los lípidos de la dieta.
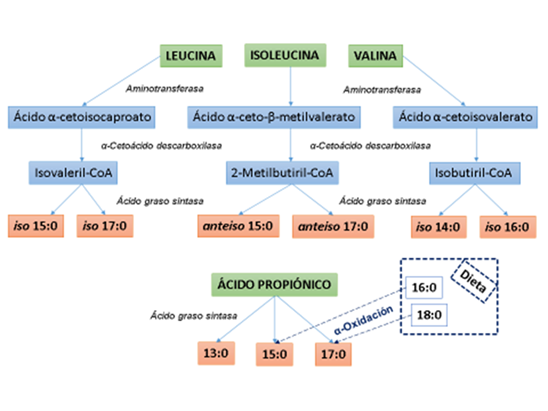
Adaptada de Vlaeminck et al.2
Figura 1 Síntesis de ácidos grasos de número de carbono impar y de cadena ramificada por la microbiota del rumen
El perfil de AGCIR que se origina tras la digestión ruminal está fuertemente ligado a la actividad de los microorganismos presentes en esta cavidad digestiva2. De ahí, que la variación en el perfil de AGCIR sea un reflejo de la abundancia relativa de las distintas especies de microorganismos que conforman el ecosistema ruminal5-6. Las bacterias celulolíticas, es decir, aquellas que poseen enzimas capaces de hidrolizar la celulosa como Ruminococcus flavefaciens, Ruminococcus albus o Butyrivibrio fibrisolvens poseen contenidos destacados de AGCIR iso7. Mayores proporciones de anteiso 15:0 indicarían la presencia de bacterias especializadas en la fermentación de pectina y azúcares8 como Prevotella spp., Lachnospira multiparus y Succinovibrio dextrinosolvens. Las bacterias amilolíticas o digestoras de almidón como Succinivibrio dextrinosolvens, Succinimonas amylolytica, Ruminobacter amylophilus, Selenomonas ruminantium y Streptococcus bovis contienen una menor proporción de AG de cadena ramificada pero destacan por poseer más de cadena impar2.
Transferencia de AGCIR desde el tracto digestivo a la glándula mamaría
Es bien conocido el papel preponderante de los microorganismos ruminales en la presencia de AGCIR en productos lácteos9. Aunque informes recientes2,10 han cuestionado que la correlación entre el contenido de AGCIR en el fluido intestinal y la grasa láctea sea tan estricta. Teóricamente, se podrían producir desajustes durante la transferencia de estos AG desde el aparato digestivo a los tejidos internos, particularmente en la glándula mamaria. Tales desajustes podrían tener lugar durante el proceso de absorción intestinal o durante el transporte a través del torrente sanguíneo. Al igual que otros AG que alcanzan el intestino delgado, los AGCIR son absorbidos en el yeyuno. Aparentemente la absorción intestinal de los AG de origen microbiano sería más alta11, pero los pocos datos de los que se dispone no son suficientes para emitir una conclusión definitiva.
Tras su absorción, tanto los AGCIR como el resto de AG, son esterificados en el glicerol para formar TG y fosfolípidos (FL) por las células epiteliales intestinales y transportados, primero al sistema linfático y posteriormente al torrente sanguíneo, donde entran a formar parte de complejos macromoleculares como quilomicrones y lipoproteínas de muy baja densidad (VLDL). Tanto quilomicrones como VLDL contienen distintas clases de lípidos (TG, FL, ésteres de colesterol (EC) y ácidos grasos libres) pero cada una de ellas difiere en composición puesto que cada tipo de AG se enlaza selectivamente a las distintas fracciones. El acceso de los AG desde el torrente sanguíneo al citoplasma de las células de la glándula mamaria se realiza una vez liberados de dichas macromoléculas, a través de la acción de la enzima lipoproteína lipasa (Figura 2).
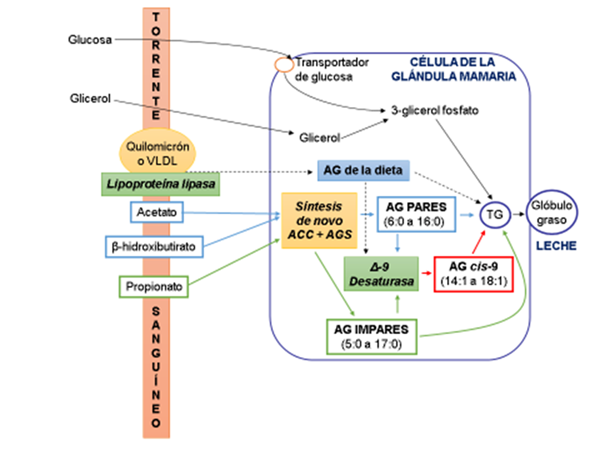
ACC: acetil-CoA carboxilasa; AGS: ácido graso sintasa; AG: ácido graso; TG: triacilglicérido; VLDL: lipoproteínas de muy baja densidad.
Figura 2 Vías metabólicas de síntesis de ácidos grasos en las células de la glándula mamaría de rumiantes
La principal diana de la lipoproteína lipasa son los AG de los TG. Por el contrario, los AG característicos de las fracciones de EC y FL se transfieren más pobremente a la grasa de leche debido a la baja afinidad de dicha enzima por ellas. Fievez et al7 reportaron que los AG de cadena ramificada son más abundantes en los EC y los TG que en los FL o los ácidos grasos libres. Estas dos últimas fracciones, en contraste, son más ricas en AG de cadena impar. Sin embargo, la literatura disponible sobre la distribución de los AGCIR entre los diferentes tipos de lípidos del plasma es aún muy escasa para predecir tendencias o pronosticar comportamientos metabólicos consolidados. Por tanto, merecería la pena explorar en detalle los procesos metabólicos que tienen lugar en las células de la glándula mamaría, para encontrar los mecanismos responsables de las diferencias de los perfiles de AGCIR entre el líquido ruminal y la leche.
Síntesis endógena de AGCIR
La mayor parte de los AG saturados de número par de átomos de C presentes en la grasa láctea se sintetizan de novo en las células epiteliales de la glándula mamaria12. Su síntesis se produce a partir de las moléculas de acetato y β-hidroxibutirato circulantes en el torrente sanguíneo, generadas en el rumen durante la fermentación de los hidratos de carbono de la dieta. Las dos enzimas responsables de esta síntesis de novo en la glándula mamaria son la acetil-CoA carboxilasa (ACC) y la AGS (Figura 2). El primer paso de la síntesis consiste en la activación del acetato a acetil-CoA, seguido de la condensación de dos moléculas de acetil-CoA para formar malonil-CoA. Esta etapa es catalizada por la ACC. A continuación, la AGS regula la elongación de cadena de los AG sintetizados de novo. Si el sustrato inicial en lugar del acetato fuese el propionato, su derivado el metilmalonato, o AG volátiles ramificados (isovalérico, isobutírico y 2-metilbutirico) los productos finales de la síntesis de novo serían potencialmente AG impares, AG metil sustituidos no terminales, o iso y anteiso, respectivamente tal como ocurre en el rumen (Figura 1).
Los primeros trabajos llevados a cabo en este campo demostraron que 15:0 y 17:0 podrían ser sintetizados de novo en la glándula mamaría de rumiantes utilizando propionil-CoA en lugar de acetil-CoA como molécula cebadora o iniciadora13. La elongación de dicha molécula catalizada por la AGS explicaría la presencia en leche de 5:0, 7:0, 9:0 y 11:0 así como el incremento de las cantidades de 13:0, 15:0 y 17:0 respecto a las ya generadas en el rumen y transferidas desde el duodeno. La importancia de esta síntesis endógena se vio confirmada en trabajos posteriores10,14,15. Teóricamente estos AG de cadena impar (13:0, 15:0 y 17:0) podrían a su vez ser metabolizados a cis-monoinsaturados por acción de la enzima delta-9 desaturasa. Sin embargo, únicamente la conversión de 17:0 a cis-9 17:1 parece tener importancia cuantitativa16 (Figura 2).
En contraste a los AG de cadena impar, la síntesis mamaria de los AG iso y anteiso no respondió al aumento de disponibilidad de sus precursores biológicos, los AG isovalérico, 2-metil-butírico e isobutírico13,14. Esta observación sería un indicio de que la enzima AGS podría no ser activa en el proceso de elongación y, por tanto, la síntesis de novo no tendría lugar en tejidos extraruminales. Estos resultados estarían, sin embargo, en aparente contradicción con los incrementos en los contenidos de iso 17:0 e anteiso 17:0 en grasa láctea, respecto a su presencia en el fluido intestinal, reportados por otros investigadores2,10,17.
Fievez et al7 postularon que los valores más bajos que se desprendían de las relaciones iso 15:0/iso 17:0 y anteiso 15:0/anteiso 17:0 en leche comparadas con las de fluido duodenal podrían ser explicados si se demostrase viable la elongación de cadena de las moléculas de iso 15:0 y anteiso 15:0 una vez absorbidos al torrente sanguíneo. Parecía llamativo en este sentido que la secreción en la leche de iso 15:0 + iso 17:0 y anteiso 15:0 + anteiso 17:0 era muy similar a la suma de estos AG en el duodeno7. Tales datos reforzaron la hipótesis sobre la existencia de una actividad elongasa extraruminal sobre los AG iso y anteiso de 15 átomos de C y además apoyó la idea de una transferencia casi completa de los AG de cadena ramificada totales desde el duodeno a la leche. En un estudio posterior Vlaeminck et al15 observaron mayores niveles de iso 17:0 y anteiso 17:0 en grasa de leche, en comparación con sus contenidos en fluido duodenal (Cuadro 2). Este hecho, junto con unas relaciones iso-15:0/iso-17:0 y anteiso 15:0/anteiso 17:0 más bajas en leche descartarían la síntesis de novo postruminal de estos AG y confirmarían el papel predominante de elongasas post-absorción que ejercerían su actividad sobre los AG iso 15:0 y anteiso 15:0. El valor más bajo de la relación iso 15:0/iso 17:0 y anteiso 15:0/anteiso 17:0 en los TG del plasma sanguíneo, respecto a las muestras del fluido duodenal sería además un indicio de que la elongación podría tener lugar en tejidos distintos a la glándula mamaria.
Cuadro 2 Proporción de ácidos grasos del plasma sanguíneo de vacas
| Acido graso | Ensayo | Plasma sanguíneo | P-value | |||
|---|---|---|---|---|---|---|
| Duodeno | Leche | TG | AGL | |||
| g/100 g de ácidos grasos impares y de cadena ramificada totales | ||||||
| iso 15:0 | 1 | 12.87d | 7.20b | 9.13c | 6.22a | <0.001 |
| 2 | 10.45c | 5.42a | 6.80b | 7.54b | <0.001 | |
| anteiso 15:0 | 1 | 26.98d | 14.54b | 19.07c | 12.47a | <0.001 |
| 2 | 33.57c | 13.22a | 15.00ab | 19.06b | <0.001 | |
| iso 17:0 | 1 | 5.76a | 8.85b | 10.02c | 13.45d | <0.001 |
| 2 | 5.79a | 6.64a | 9.54b | 10.09b | <0.001 | |
| anteiso 17:0 | 1 | 7.32a | 13.24b | 14.21bc | 15.50c | <0.001 |
| 2 | 9.90a | 16.18bc | 14.41b | 17.63c | <0.001 | |
| Relaciones C15/C17 | ||||||
|
iso 15:0/iso 17:0 |
1 | 2.28c | 0.83b | 0.92b | 0.48a | <0.001 |
| 2 | 1.82b | 1.18ab | 0.78a | 0.77a | <0.001 | |
|
ant 15:0/ant 17:0 |
1 | 3.98b | 1.10a | 1.37a | 0.82a | <0.001 |
| 2 | 3.73a | 0.84b | 1.10b | 1.13b | <0.001 | |
TG= triacilglicéridos; AGL= ácidos grasos libres.
a-d Valores de una fila con un superíndice distinto son diferentes (P<0.05).
Fuente: Vlaeminck et al15.
La sobreexpresión del gen que codifica la elongasa ELOVL6 en rumiantes está descrita en células epiteliales mamarias18, y, más recientemente, un estudio in vitro ha sido el primero en valorar el papel de esta enzima en la regulación de la elongación de AG19. La sobrerregulación de ELOVL6 aumenta los índices de elongación de 16:0 y 18:0, lo que sugiere un papel importante de este enzima en el control de longitud de cadena de los AG en la glándula mamaría. Sin embargo, sus efectos sobre los AG ramificados todavía quedan pendientes por ser investigados.
Influencia de la dieta del ganado sobre los contenidos de AGCIR en leche
La composición química de la ración, tal como la proporción de almidón y fibra, la relación forraje/concentrado (F/C), así como el perfil lipídico en la dieta ejercen una gran influencia sobre el tipo de poblaciones microbianas ruminales y sobre la síntesis microbiana de AG, por lo tanto, la proporción de AGCIR que llega a intestino delgado es un reflejo de la composición y cantidad de microbiota en rumen2,3,20.
Efectos de la dieta base
Entre los distintos componentes de la dieta, la proporción de almidón y fibra juega un papel relevante en la producción de AGCIR a través de su influencia en el ecosistema microbiano, en particular sobre la proliferación de cepas bacterianas celulolíticas21,22. Un aumento de almidón en las raciones limita el crecimiento de microorganismos celulolíticos, promoviendo la proliferación de bacterias amilolíticas. Como ya se expuso, las bacterias celulolíticas contienen en sus membranas predominantemente AG ramificados iso7 y son sensibles a valores bajos de pH ruminal que son los característicos de alimentos con alto contenido de almidón23. Vlaeminck et al2 observaron que dietas ricas en almidón, caracterizadas por una mayor proliferación de bacterias amilolíticas, disminuían los niveles de iso 14:0, iso 15:0 e iso 16:0 (Cuadro 3).
Cuadro 3 Contenido medio (g/100g de ácidos grasos totales) de ácidos grasos de cadena impar y ramificada en leche de rumiantes alimentados con diversos ingredientes
| Acido graso | Shingfield et al60 | Vlaeminck et al2 | Patel et al24 | Li et al25 | Cívico et al27 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| EP | EM | EP | EM | EPA | EPB | RF | PF | RF | RA | |
| iso 13:0 | 0.03 | 0.04 | 0.02 | 0.01 | ||||||
| iso 14:0 | 0.08 | 0.06 | 0.09 | 0.05 | 0.08 | 0.07 | 0.14 | 0.13 | 0.07 | 0.03 |
| iso 15:0 | 0.21 | 0.18 | 0.24 | 0.17 | 0.21 | 0.18 | 0.32 | 0.23 | 0.17 | 0.14 |
| iso 16:0 | 0.21 | 0.23 | 0.18 | 0.16 | 0.26 | 0.26 | 0.19 | 0.15 | ||
| iso 17:0 | 0.74 | 0.91 | 0.19 | 0.23 | 0.47 | 0.33 | 0.38 | 0.49 | 0.27 | 0.23 |
| iso 18:0 | 0.03 | 0.01 | 0.05 | 0.04 | ||||||
|
anteiso 13:0 |
0.05 | 0.07 | ||||||||
|
anteiso 15:0 |
0.39 | 0.37 | 0.46 | 0.46 | 0.42 | 0.39 | 0.49 | 0.45 | 0.30 | 0.22 |
|
anteiso 17:0 |
0.46 | 0.55 | 0.89 | 0.76 | 0.29 | 0.26 | ||||
| 11:0 | 0.20 | 0.22 | ||||||||
| 13:0 | 0.09 | 0.09 | ||||||||
| 15:0 | 1.22 | 0.78 | 0.95 | 1.21 | 1.06 | 0.94 | 1.00 | 0.98 | 0.82 | 0.62 |
| 17:0 | 0.63 | 0.54 | 0.48 | 0.55 | 0.67 | 0.53 | 0.73 | 0.68 | ||
EP= ensilado de pasto; EM= ensilado de maíz; EPA= ensilado de pasto alto; EPB= ensilado de pasto bajo; RF= rico en fibra; PF= pobre en fibra; RA= rico en almidón.
Estudios posteriores han reforzado la idea de la influencia que la proporción de fibra y almidón tiene sobre el contenido de AGCIR de la leche (Cuadro 3). Patel et al24 reportaron que un aumento de fibra a través de la presencia de ensilados de pasto en las raciones aumentaba los contenidos en leche de iso 15:0, iso 17:0, 15:0 y 17:0 mientras que la sustitución de fibra en detrimento de almidón en la dieta incrementaba la proporción de iso 15:0 tanto en leche25 como en el rumen26. Estas respuestas se asociaron a una mayor abundancia de bacterias celulolíticas frente a las amilolíticas. Por otra parte, Cívico et al27 midieron niveles más elevados de iso 14:0, iso 17:0 y 15:0 en grasa láctea cuando la alimentación estaba enriquecida en fibra y era pobre en almidón (Cuadro 3).
La relación F/C en las raciones podría modificar los contenidos de AGCIR de los productos lácteos. Vlaeminck et al2 concluyeron que una proporción mayor de forraje en la dieta base contribuía a un aumento selectivo de ciertos AGCIR como iso 14:0 e iso 15:0. En contraste, los niveles de anteiso 15:0 fueron menos afectados. Estos resultados se explican por cambios en el ecosistema ruminal inducidos por la variación en la relación F/C de las dietas. Un aumento de concentrado favorecería la proliferación de bacterias amilolíticas, lo cual podría aumentar los anteisos y los de cadena impar. Se han observado10 niveles más bajos de 15:0 y 17:0 en leche de vacas alimentadas con dietas con una elevada relación F/C.
El análisis de fluidos digestivos extraídos de cabras canuladas duodenalmente constató que el aumento de la relación F/C en la ración causaba un aumento de todos los AGCIR sintetizados de novo por las bacterias5. Un experimento similar llevado a cabo en vacuno28 mostró resultados parecidos. Más recientemente, Zhang et al29 confirmaron que los perfiles de AGCIR en fluidos digestivos en bovino son afectados de forma drástica por la relación F/C de la dieta base. Las concentraciones de 11:0, 13:0, iso 15:0, iso 16:0, iso 17:0 y 17:0 eran más altas cuando la proporción de forraje en la ración era mayor. También observaron que sólo los anteiso 15:0 y 15:0 aumentaban con proporciones más elevadas de concentrado.
Efectos de la suplementación lipídica
Los niveles de AGCIR en productos lácteos muestran una disminución significativa cuando proceden de animales cuya dieta ha sido suplementada con fuentes lipídicas. Esta pauta, observada en leche bovina6,30 y de pequeños rumiantes31,32 es característica de la suplementación con semillas de oleaginosas ricas en AG insaturados.
Estos resultados podrían ser explicados por el efecto inhibitorio que los ácidos grasos poliinsaturados (PUFA) ejercen sobre la microbiota intestinal. La severidad del efecto de los AG incorporados de la dieta sobre la viabilidad de las bacterias del rumen es mayor a medida que aumenta el número de insaturaciones de las moléculas. Así mismo los efectos serían más acusados si la configuración geométrica de los dobles enlaces es de tipo cis2,3. Además, no todos los microorganismos se verían afectados de la misma forma por la suplementación lipídica de la dieta. Se ha observado que las bacterias celulolíticas y Gram positivas son más sensibles a los lípidos dietéticos que las bacterias amilolíticas y Gram negativas20,33,34.
Ácidos grasos ramificados como componentes bioactivos
Microbiota intestinal de neonatos
Estudios recientes han destacado el papel de los AG ramificados como componentes bioactivos protectores de la salud. La presencia de AG ramificados es muy escasa en los tejidos humanos de adultos pero, en contraste, son componentes bioactivos esenciales del tracto digestivo en los estadios finales del desarrollo fetal y tras el parto35.
Aproximadamente, 30 % de los AG totales presentes en el vérnix caseoso son AG de cadena ramificada, con una gran variedad de estructuras moleculares entre las que destacan el iso 14:0 y el iso 16:035. El vérnix es un material ceroso con una textura similar al queso que reviste la piel del feto y del recién nacido. Consiste en una mezcla de secreciones grasas originadas a partir de la 18 semana de gestación procedentes de las glándulas sebáceas. El vérnix evita la pérdida de agua, protegiendo la piel del feto de la deshidratación, impidiendo su endurecimiento y disminuyendo las rozaduras y el agrietamiento. Además, contribuye a regular la temperatura del feto al actuar como una capa aislante. No existe otro mamífero terrestre que produzca neonatos cubiertos de vérnix, en contraste a lo que ocurre con los fetos de mamíferos acuáticos que presentan esta misma película grasa compuesta por AG ramificados36.
Una hipótesis complementaria señala el papel del vérnix como agente antibacteriano. Esta idea se basa en que, durante los últimos meses del embarazo, las partículas de vérnix se desprenden de la piel y pasan al líquido amniótico incrementando su turbidez. En el último trimestre de gestación el feto ingiere buena parte del líquido amniótico y, de esta forma, su intestino quedaría impregnado de los AG ramificados presentes en el vérnix35.
Por otra parte, la gran cantidad de AG ramificados detectados en el meconio (las primeras heces fecales del neonato) constituye un indicio suficientemente relevante sobre el tipo de microorganismos que comienzan a colonizar el tracto intestinal del recién nacido y que se vería favorecido por la presencia de estos prebióticos no fermentables35. Como se ha expuesto en párrafos precedentes, los AG ramificados están entre las moléculas más importantes de las membranas de muchos microorganismos, particularmente de la mayoría de las especies del genero bacilli (37. Se ha observado que la sustitución de grasa de la dieta por AG ramificados en crías de ratas neonatas favorece la alteración de su microbioma. Estos cambios se traducen en aumentos de los microorganismos capaces de incorporar AG ramificados en sus membranas y una reducción simultánea de la incidencia de enterocolitis necrotizante38, una de las mayores causas de mortalidad en neonatos prematuros. También se sabe por estudios in vitro que los AG ramificados reducirían la motilidad y presumiblemente la virulencia de patógenos como Pseudomonas aeruginosa39.
La elevada concentración de AG ramificados, como consecuencia de la presencia del vérnix en el lumen intestinal del feto, es probable que juegue además un papel importante en el crecimiento y metabolismo de los enterocitos, así como en la salud y la regulación intestinal. Trabajos recientes han observado que los AG ramificados pueden ser incorporados a los FL de las membranas de los enterocitos, confiriéndoles actividad anti-inflamatoria40,41. Liu et al42 postularon que esta incorporación de los AG ramificados en los FL contribuiría a modular las propiedades biofísicas de las membranas. Los AG ramificados tienen asignadas funciones biofísicas equiparables a los AG monoinsaturados con configuración cis pero tienen la ventaja de presentar una mayor estabilidad oxidativa por la ausencia de dobles enlaces en su estructura. Por otra parte, los menores puntos de fusión de los AG ramificados respecto a sus homólogos lineales estarían relacionados con el mantenimiento de la fluidez de las membranas celulares43.
Otras propiedades bioactivas de los ácidos grasos de cadena ramificada
Además de sus efectos positivos sobre la composición de la microbiota intestinal, la presencia de AG ramificados en la dieta podría redundar beneficiosamente en la prevención de distintas enfermedades. El primer trabajo donde se atribuye actividad anticancerígena a los AG ramificados data de principios de este siglo44. En dicho estudio se describen los efectos inhibitorios de iso 15:0 sobre la proliferación celular y la inducción de la apoptosis en líneas celulares de cáncer de próstata, leucemia y adenocarcinoma. Más recientemente, Cai et al45 dieron cuenta de que el iso 15:0 podría contribuir a la inhibición de linfomas humanos. Estudios desarrollados por otros investigadores46,47 determinaron que los AG ramificados podrían también inducir apoptosis en células de cáncer de mama e inhibir el desarrollo de tumores en cultivos celulares y modelos animales.
Por otro lado, un reciente estudio en humanos con sobrepeso48 ha apuntado por primera vez la posibilidad de que la abundancia de AG ramificados iso en suero sanguíneo pueda correlacionarse inversamente con la presencia de TG y asociarse negativamente con otros indicadores característicos de procesos inflamatorios. En todo caso, los efectos beneficiosos de este grupo de AG precisan más investigaciones que contribuyan a esclarecer los mecanismos que subyacen en la prevención de estas patologías.
Ácidos grasos de cadena impar como componentes bioactivos
Distintos trabajos desarrollados durante estos últimos años han mostrado que 15:0 y 17:0, los AG impares más abundantes en productos lácteos, podrían ejercer efectos saludables en la salud humana49,50. Se ha comprobado, por ejemplo, que existe una asociación inversa entre la concentración de ambos AG en plasma y el riesgo de padecer diabetes tipo 251-53. Este resultado se ha observado también en poblaciones europeas sometidas a distintos regímenes alimentarios54. Incluso varios estudios de prospectiva sobre enfermedades cardiovasculares han comprobado que la concentración en plasma de estos AG estaría asociada con un riesgo más bajo de enfermedades cardiovasculares55-57. Sin embargo, se precisa una investigación más detallada que contribuya a dilucidar las rutas metabólicas implicadas en estos efectos saludables.
Conclusiones
La leche y los productos lácteos son la mayor fuente de AGCIR en la dieta humana. A pesar de sus bajas concentraciones, investigaciones llevadas a cabo durante los últimos años han mostrado su potencialidad como componentes bioactivos y su relevancia nutricional. Aunque su origen reside principalmente en la actividad de la microbiota ruminal, los últimos avances científicos no circunscriben su formación únicamente a los procesos bioquímicos que tienen lugar en el tracto digestivo de los rumiantes. La capacidad de otros tejidos de sintetizar endógenamente ciertos AGCIR debe ser considerada con atención y puede incentivar líneas de investigación muy prometedoras en el futuro.











 texto em
texto em 


