Introducción
En México, la ovinocultura se distribuye en todo el territorio nacional bajo un esquema de tipo regional, condicionada por la disponibilidad de recursos naturales y el mercado1. El Organismo de la Unidad Nacional de Ovinocultores agrupa a los criadores de ovinos especializados y de registro; coordina el registro genealógico de pureza de raza, así como los programas de mejoramiento genético con base en las evaluaciones genéticas2. Sin embargo, la selección con base en el mejor predictor lineal insesgado (BLUP), producto de las evaluaciones genéticas, favorece la selección de animales emparentados y por consiguiente incrementos en la consanguinidad3; además, los niveles de consanguinidad y parentesco están implicados en el proceso de evaluaciones genéticas y las predicciones BLUP4,5.
Los esquemas de selección conllevan al impacto de un reducido número de reproductores o familias selectas, generan cambios en la estructura de las poblaciones, así como incrementos en los niveles de consanguinidad, reducción de la variabilidad genética y posibles efectos de deriva genética6,7. La variabilidad genética determina la capacidad de respuesta a la selección y el progreso genético; identificar los factores que la afectan permite evaluar las acciones realizadas, continuar con el esquema de selección o tomar acciones de corrección8. El análisis del pedigrí, con base en parámetros genéticos poblacionales, describe la dinámica y variabilidad genética de las poblaciones; la estructura genética de una población permite conocer como se ha realizado el flujo de genes, proporciona información de los ancestros fundadores y sus aportaciones a la variabilidad de la población actual9,10.
Con base en lo anterior, el objetivo del presente estudio fue analizar el pedigrí y la estructura de la población en diez razas de ovinos mediante parámetros genéticos poblacionales, tales como: integridad del pedigrí, número de generaciones, parentesco y consanguinidad, ancestros y fundadores, número efectivo, intervalo generacional, entre otros. Los resultados serán de utilidad para desarrollar esquemas de selección, con el objetivo de optimizar la respuesta a la selección limitando la tasa de perdida de variabilidad genética.
Material y métodos
La información analizada correspondió a la base de datos del registro genealógico de las poblaciones nacionales de ovinos Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF); los pedigrí fueron de individuos nacidos en el periodo de 1992 a 2018; en el Cuadro 1 se describe la información genealógica utilizada; los análisis de los pedigrís se realizaron con el software Endog v4.011 y los parámetros genéticos poblacionales evaluados fueron:
Cuadro 1 Estructura del pedigrí, coeficiente de relación promedio (CRP) y niveles de consanguinidad en diez poblaciones de ovinos mexicanos
| Ítem | Pedigrí | Padres (PS) |
Madres (PM) |
SM% (M/S) |
Fi (PFi) |
Fm (PFm) |
βP βF |
CRP |
|---|---|---|---|---|---|---|---|---|
| BBL | 19,695 | 544 (29.7) |
5,847 (2.8) |
32.4 (10.7) |
26.8 (8.4) |
16.9 (9.1) |
5.6x *
-0.29x ns |
0.88 |
| CHA | 5,033 | 266 (17.5) |
1,433 (3.4) |
33.8 (5.4) |
45.8 (8.0) |
36.5 (10.1) |
5.6x *
-0.56x * |
3.06 |
| DOR | 42,171 | 1,571 (24.1) |
12,818 (2.9) |
34.1 (8.2) |
26.9 (6.1) |
17.2 (6.9) |
6.5x *
-0.77x * |
0.66 |
| DOB | 4,213 | 166 (22.7) |
1,287 (2.9) |
34.4 (7.7) |
48.7 (14.6) |
32.3 (14.9) |
5.6x *
-0.59x * |
7.78 |
| DOS | 5,557 | 173 (25.5) |
1,601 (2.8) |
31.9 (9.3) |
12.3 (9.8) |
8.6 (9.9) |
5.5x *
-0.42x ns |
1.00 |
| HAM | 12,210 | 467 (22.9) |
3,687 (2.7) |
33.4 (8.5) |
21.3 (5.9) |
12.6 (6.3) |
4.9x *
-0.54x * |
1.13 |
| KAT | 77,955 | 2,927 (27.3) |
23,844 (3.3) |
34.3 (8.2) |
47.8 (3.9) |
33.5 (4.1) |
6.5x *
-0.01x ns |
1.28 |
| PEL | 42,256 | 1,285 (26.3) |
13,293 (2.6) |
34.5 (10.3) |
22.8 (6.8) |
13.8 (7.7) |
7.7x *
-0.24x * |
0.47 |
| RAM | 11,951 | 291 (37.1) |
3,534 (3.1) |
32.1 (12.1) |
24.9 (7.4) |
15.4 (7.5) |
7.4x *
-0.17x * |
1.21 |
| SUF | 14,099 | 347 (30.2) |
4,006 (2.8) |
30.1 (11.5) |
19.2 (9.2) |
14.2 (9.6) |
1.4x ns -0.53x * |
0.86 |
Pedigrí, total de individuos en el pedigrí. Padres, total de sementales en el pedigrí (PS, promedio de crías por semental). Madres, total de madres en el pedigrí (PM; promedio de crías por madre). Fi, porcentaje de animales consanguíneos (PFi, consanguinidad promedio). Fm, porcentaje de madres consanguíneas (PFm, consanguinidad promedio de las madres). Pendiente para porcentaje de animales (βP) consanguíneos y niveles de consanguinidad (βF);
Poblaciones: Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF).
ns estadísticamente igual a cero (P>0.05); * estadísticamente diferente de cero (P<0.05).
Integridad del pedigrí
El nivel de integridad se evaluó con base en8,12: proporción de ancestros conocidos hasta la tercera generación (padres, abuelos y bisabuelos); número de generaciones completas (NGC), el cual muestra la generación más lejana con dos ancestros conocidos; número de generaciones trazadas (NGT), como indicador del número de generaciones que separan a un individuo de su ancestro más lejano; número de generaciones completas equivalentes (NGE), el cual expresa la suma de todos los ancestros conocidos con base en el número (n) de generaciones que separan al individuo de cada ancestro (NGE = ∑(1/2)n).
Manejo reproductivo
PS, promedio de crías por semental; PM, promedio de crías por madres; SM%, total de sementales y madres, como proporción de la población total del pedigrí; M/S, relación del número de madres / número de sementales.
Consanguinidad (F)
Con la subrutina mtdfnrm del software mtdfreml13 se estimó la consanguinidad de cada individuo (Fi) y de su madre (Fm); con el año de nacimiento de los individuos consanguíneos se generaron las tendencias a través del tiempo, analizando la información de 2010 a 2018. Para el porcentaje de animales consanguíneos (βP) y consanguinidad promedio (βF) se realizó un análisis de regresión lineal en el periodo 2010 a 2018, con base en el modelo ŷ = β0 + βx; donde, ŷ correspondió a la variable analizada en el año x; β0, el intercepto; β, corresponde a la pendiente o tasa de cambio; el análisis se realizó con el software para análisis estadístico SAS14.
Intervalo generacional (IG)
Con el planteamiento de la edad media de un animal reproductor, a la que es reemplazado por un descendiente suyo15; se calculó como la edad promedio de los padres cuando nace su descendencia, a través de las cuatro rutas de selección: padre - hijo, padre - hija, madre - hijo y madre - hija16,17.
Relación genética aditiva promedio (CRP)
El CRP se obtuvo a partir de la matriz de relaciones genéticas aditivas entre todos los individuos del pedigrí; el cálculo corresponde al valor promedio de los coeficientes de cada individuo con el resto del pedigrí9,18.
Número efectivo de fundadores (fe)
Individuo fundador, todo aquel animal con padres desconocidos; el fe se definió como el número de fundadores que, contribuyendo en igual medida, producirían la diversidad genética existente en la población10,19.
Número efectivo de ancestros (fa)
Ancestro, todo individuo fundador o no, que ha contribuido a la variabilidad genética de la población; el fa se definió como el número de ancestros necesarios para explicar la variabilidad genética total de la población; considera la variabilidad genética aportada por un animal, que no se explica por la contribución de alguno de sus hijos19,20.
Tamaño efectivo de la población (Ne)
El Ne realizado se estimó a partir de 1 / 2ΔF; donde, ΔF fue el cambio promedio en consanguinidad y se calculó a partir del número (t) de generaciones completas equivalentes (ΔF = 1 - (1-Fi)1/(t-1)); este Ne considera la cantidad de información genealógica del pedigrí y el traslape generacional21,22. El Ne define el número de reproductores que podrían generar la consanguinidad calculada y/o tasa de cambio en la varianza genética bajo el esquema de población ideal10,23.
Resultados y discusión
La precisión y veracidad en el análisis de la estructura de una población depende de la integridad del pedigrí y el contenido de información genealógica a través de generaciones; con información incompleta, la asignación de individuos a generaciones es aproximada, los cálculos de F y Ne son imprecisos. En el Cuadro 2 se describe el porcentaje de ancestros, donde por la vía materna se observó mayor contenido de información genealógica. A nivel de padres, los valores oscilaron de 76.4 % (SUF) a 95.3 % (KAT), con un promedio general de 86.0 %; los porcentajes de animales con padres desconocidos correspondió al conjunto de animales fundadores. En los pedigrís de las razas Nilagiri, Sandyno24, Santa Inés25 y Malpura17 reportaron integridad y contenido de información genealógica en los niveles del presente estudio; no obstante, para las razas Mehraban12, Guilan26 y Morada Nova8 los pedigrí analizados presentaron porcentajes de padres conocidos por abajo del 60 %, para abuelos los niveles fueron menores al 40 % y para bisabuelos las porcentajes fueron menores al 30 %; en todos los citados casos, el contenido de información genealógica fue superior por la vía materna.
Cuadro 2 Porcentaje de progenitores conocidos a través de las diez poblaciones de ovinos mexicanos
| BBL | CHA | DOR | DOB | DOS | HAM | KAT | PEL | RAM | SUF | |
|---|---|---|---|---|---|---|---|---|---|---|
| Padres | ||||||||||
| S | 82.0 | 92.6 | 89.9 | 89.5 | 79.5 | 82.6 | 95.4 | 80.1 | 90.2 | 74.3 |
| M | 83.2 | 95.5 | 90.1 | 89.5 | 80.1 | 81.2 | 95.1 | 80.4 | 91.2 | 78.5 |
| Abuelos | ||||||||||
| SS | 59.6 | 61.6 | 63.4 | 63.9 | 36.4 | 56.9 | 90.7 | 57.4 | 67.3 | 39.1 |
| MS | 58.9 | 68.0 | 64.6 | 63.7 | 42.7 | 58.2 | 89.9 | 57.9 | 70.4 | 42.3 |
| SM | 59.8 | 81.9 | 74.9 | 76.2 | 46.8 | 57.5 | 89.5 | 53.8 | 60.1 | 48.1 |
| MM | 59.2 | 86.4 | 75.2 | 75.3 | 49.4 | 57.6 | 89.1 | 54.3 | 60.6 | 48.1 |
| Bisabuelos | ||||||||||
| SSS | 37.2 | 31.9 | 37.2 | 32.8 | 14.7 | 27.8 | 79.7 | 39.0 | 43.6 | 20.5 |
| MSS | 38.4 | 38.6 | 37.6 | 32.8 | 15.6 | 30.1 | 78.7 | 38.1 | 43.8 | 19.4 |
| SMS | 39.9 | 49.6 | 47.9 | 35.9 | 18.5 | 40.7 | 79.8 | 38.1 | 28.1 | 30.3 |
| MMS | 38.2 | 57.8 | 46.3 | 34.9 | 20.8 | 41.9 | 79.6 | 38.7 | 27.5 | 27.7 |
| SSM | 38.9 | 38.9 | 46.5 | 42.7 | 21.4 | 33.3 | 79.1 | 36.4 | 42.2 | 26.5 |
| MSM | 38.6 | 46.9 | 47.5 | 42.5 | 24.1 | 33.3 | 77.6 | 36.5 | 42.4 | 27.0 |
| SMM | 38.7 | 66.3 | 55.2 | 55.3 | 29.1 | 35.9 | 77.9 | 32.9 | 31.8 | 29.9 |
| MMM | 39.1 | 71.1 | 55.0 | 54.3 | 30.0 | 35.0 | 77.1 | 33.8 | 31.9 | 28.4 |
Poblaciones: Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF). Progenitores: S, padre; M, madre.
La integridad del pedigrí se relaciona con las estimaciones de NGC, NGT y NGE (Cuadro 3), donde los valores máximos son similares a través de las diez poblaciones; sin embargo, en los promedios dentro de poblaciones hay marcadas diferencias, los máximos fueron para KAT en contraste con DOS, con los promedios más bajos. La estructura de una población es producto de los esquemas de selección y manejo reproductivo adoptados por los criadores; las diferencias observadas a través de las poblaciones analizadas se pueden atribuir al manejo reproductivo con base en los sementales, con posibles implicaciones en el Ne e IG; los valores de PS y PM (Cuadro 1) muestran la magnitud y la extensión en el uso de los reproductores a través de generaciones, y las estimaciones de SM% y M/S están relacionadas con la intensidad y presión de selección.
Cuadro 3 Resultados para el número de generaciones, ancestros fundadores y tamaño efectivo en diez poblaciones de ovinos mexicanas
| Ítem | NGC | NGT | NGE | Anc | Anc% | Fund | Ne | ||
|---|---|---|---|---|---|---|---|---|---|
| BBL | 5.0 (1.66) |
11.0 (3.23) |
7.19 (2.24) |
2,110 (105.0) |
39 (3.3) |
3,425 (182.3) |
36.8 | ||
| CHA | 4.0 (1.67) |
11.0 (4.73) |
5.89 (2.67) |
235 (35.0) |
13 (7.1) |
299 (44.3) |
22.1 | ||
| DOR | 5.0 (1.65) |
12.0 (4.66) |
6.75 (2.55) |
2,836 (173.0) |
74 (3.0) |
4,219 (226.1) |
53.8 | ||
| DOB | 4.0 (1.67) |
10.0 (3.58) |
5.61 (2.31) |
271 (14.0) |
7 (22.3) |
441 (16.9) |
12.2 | ||
| DOS | 4.0 (1.06) |
8.0 (2.4) |
5.0 (1.60) |
735 (86.0) |
32 (4.2) |
1,104 (143.4) |
50.0 | ||
| HAM | 4.0 (1.29) |
10.0 (3.33) |
5.28 (1.97) |
1,380 (74.0) |
28 (4.7) |
2,090 (124.4) |
56.8 | ||
| KAT | 6.0 (2.70) |
13.0 (6.12) |
8.03 (4.02) |
2,578 (109.0) |
48 (3.9) |
3,295 (227.6) |
73.5 | ||
| PEL | 6.0 (1.50) |
11.0 (3.12) |
6.99 (2.10) |
5,296 (196) |
94 (3.6) |
8,348 (349.3) |
51.5 | ||
| RAM | 5.0 (1.60) |
8.0 (2.98) |
5.78 (2.12) |
1,073 (93.0) |
38 (5.6) |
1,111 (147.7) |
53.2 | ||
| SUF | 4.0 (1.09) |
9.0 (2.60) |
5.39 (1.65) |
1,746 (82.0) |
44 (5.1) |
3,332 (159.1) |
34.7 |
Valores máximos (valores promedio) del número de generaciones completas (NGC), número de generaciones trazadas (NGT) y número de generaciones completas equivalentes (NGE). Anc= total de ancestros (tamaño efectivo de los ancestros). Anc%= número de ancestros que explican el 50 % de la variabilidad en el pedigrí (máximo porcentaje que un ancestro explica en la variabilidad del pedigrí). Fund= total de fundadores (tamaño efectivo de fundadores). Ne= tamaño efectivo realizado.
Poblaciones: Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF).
Con relación a la población consanguínea (Cuadro 1; como porcentaje de la población total) los niveles fluctuaron del 12.3 % en DOS al 48.7 % en DOB, con un promedio general de 29.7 %; los niveles de F (como promedio de la población consanguínea) oscilaron de 3.9 % en KAT a 14.6 % en DOB, con un promedio general de 8.0 %. Los niveles y las tendencias de la F, así como sus componentes (CRP, Ne, fe y fa), permiten evaluar la evolución de la variabilidad genética a través del tiempo; los animales consanguíneos son los directamente afectados por los efectos de depresión endogámica y todas las consecuencias que trae consigo el incremento de F. En ovinos, dado la importancia de los efectos maternos27,28 los posibles efectos de la depresión endogámica también se deben de evaluar a través de los niveles de consanguinidad de las madres; en el Cuadro 1, se presenta la proporción de madres consanguíneas y la consanguinidad promedio.
Los escenarios observados en la evolución de F fueron: a) en todas las poblaciones el porcentaje de animales consanguíneos se incrementó a través del tiempo (Cuadro 1; Figura 1), con valores (βP) en el intervalo de 1.4 a 7.7 %; b) sin embargo, los niveles de consanguinidad presentaron tendencias negativas (Cuadro 1; Figura 2), con un valor ( βF) promedio de -0.412 a través de las diez poblaciones; y, c) los niveles del CRP se han mantenido estables (Figura 3). Los esquemas de mejora genética deben de considerar un adecuado equilibrio entre intensidad de selección, consanguinidad y variabilidad genética. Los escenarios en la evolución de la F se pueden atribuir al uso de reproductores emparentados con gran cantidad de la población y bajos niveles de CRP; la selección con base en BLUP aumenta la probabilidad de selección de animales emparentados; avances en tecnologías reproductivas con lleva a una reducción en el número de progenitores para producir la próxima generación de animales reproductores3,4,10.

Figura 1 Tendencias de la proporción (%) de individuos consanguíneos. Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF)

Figura 2 Tendencias de la consanguinidad promedio en la población consanguínea. Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF). Consanguinidad, niveles de homocigosis en los individuos producto de progenitores emparentados
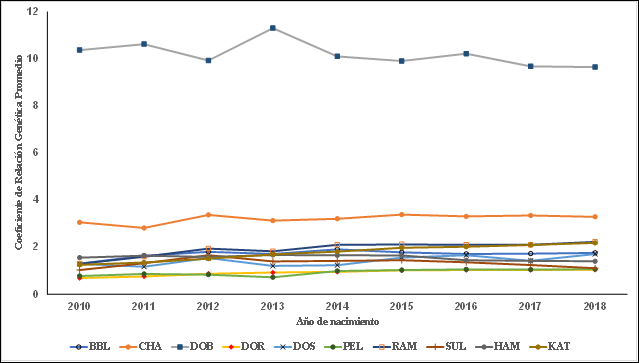
Figura 3 Tendencias del coeficiente de relación promedio. Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF)
Las poblaciones de KAT, PEL y RAM presentaron las más altas tasas de crecimiento en población consanguínea (Cuadro 1; Figura 1); DOB y DOR presentaron las mayores tendencias negativas de F; y, DOB y CHA tienen los niveles más altos del CRP. En estudios afines con resultados diversos, Danchin-Burge et al29 publicaron tendencias de F cercanas a cero en siete poblaciones de ovinos; sin embargo, Stachowicz et al10 reportaron tendencias positivas en los niveles de F en seis razas de ovinos de Canadá; además, Li et al30, Gowane et al17 y Gowane et al18 en ovinos Finnsheep, Merino y Malpura, respectivamente, reportaron tendencias positivas en los niveles de F y CRP.
El concepto de Ne se desarrolló con base en los lineamientos de la población ideal; el Ne realizado refleja la acumulación de relaciones genéticas entre individuos y permite predecir los cambios en los niveles de F; además, como resultado de la deriva genética y cambios en las frecuencias génicas presenta los cambios en la varianza genética31. La estructura de apareamientos y la demografía reproductiva de las poblaciones de ovinos evaluadas difieren a los planteamientos de la población ideal; sin embargo, el Ne realizado tiende a ajustar por algunas de las diferencias32. Bajos Ne se relacionan con disminución de la variabilidad genética, aumento de apareamientos entre individuos emparentados, fijación de alelos y la mayor reducción en respuesta a la selección33. El Ne es un concepto básico para el diseño de programas de conservación y/o mejoramiento genético, un Ne menor a 50 es considerado como de cuidado; para el desarrollo de poblaciones recomiendan Ne igual o mayor a 50, el cual considera aumento en los niveles de F menor o igual al 1 %34; para poblaciones sujetas a mejoramiento genético recomiendan Ne mayores, que permitan optimizar la respuesta a la selección con el mínimo incremento de F35. Seis de las poblaciones evaluadas presentaron estimaciones de Ne en el intervalo de 50 a 73.5 (Cuadro 3), lo cual señala que los incrementos de F serán igual o menores al 1%; por otro lado, cuatro poblaciones presentaron Ne en el intervalo de 12.2 a 36.8, lo cual las coloca en el estatus de cuidado para monitorear la evolución de la F y el CRP, y sus posibles implicaciones en el mejoramiento genético. En otras poblaciones, Leroy et al32 evaluando los métodos de estimación de Ne en 40 razas de ovinos, reportaron Ne realizado en el intervalo de 38 a 675, y un valor promedio de 191; asimismo, diversos investigadores29,30,36,37, que en su conjunto evaluaron el pedigrí de 15 poblaciones de ovinos, reportaron estimaciones de Ne en el intervalo de 55 a 276.
Las relaciones genéticas entre los fundadores y el fe exponen la variabilidad genética inicial; la contribución de los fundadores a la variabilidad del pedigrí exhibe el conjunto de genes que se ha mantenido a través de generaciones38; en DOB, CHA y SUF, 7, 13 y 44 individuos, respectivamente, explican el 50% de la variabilidad del pedigrí (Cuadro 3); un reducido número de ancestros que expliquen la variabilidad del pedigrí está asociado a incrementos en los niveles de CRP y F. El fa comprende las posibles causas de pérdida en la variabilidad genética; por lo general fe > fa, conforme aumenta esa diferencia indica una menor participación de los fundadores a lo largo de generaciones; la relación fe / fa muestra un manejo reproductivo diferencial y considera los posibles cuellos de botella que ha experimentado la población. Conforme se incrementa ese cociente indica que la mayoría de los ancestros fueron fundadores, con ausencia de cuellos de botella39. En el Cuadro 3 se presentan la cantidad de individuos fundadores y ancestros, así como el tamaño efectivo de ambos; la relación fe/fa osciló de 1.2 a 2.0, los cuales coinciden con los resultados publicados por Tahmoorespur y Sheikhloo16, Ghafouri-Kesbi40, Mokhtari et al36, Mokhtari et al37 y McManus et al8 en ovinos Baluchi, Afshari, Kermani, Moghani y Morada Nova, respectivamente.
El CRP puede ser un resumen del manejo reproductivo que ha tenido la población; la F, como consecuencia del apareamiento de animales emparentados, no explica por qué se dieron esos apareamientos; asimismo, el CRP permite diseñar los empadres manteniendo ciertos niveles de F en la progenie. Las Figuras 2 y 3 muestran la relación entre el CRP y F, al mantenerse los niveles de CRP, no se incrementan los niveles de F; sin embargo, la Figura 1 muestra el manejo reproductivo a través del tiempo, los reproductores provienen de un reducido número de familias y tienden a estar relacionados genéticamente, seleccionados dentro de rebaño con poco flujo a través de rebaños. Por otro lado, en la relación de fe y la F, el CRP de un fundador indica el porcentaje de la población originada por él11.
El IG es de suma importancia para validar las pérdidas de variabilidad genética y el progreso genético a través del tiempo; la intensidad de selección, asociada a SM% y M/S, tiende a reducir el IG, pero resulta en pérdidas de variabilidad genética dado la poca contribución de esos reproductores a la población9,38. En el Cuadro 4 se presentan las estimaciones del IG por las cuatro vías, los valores oscilaron de 3.0 a 4.15, con un promedio general de 3.45 años y no se observan diferencias sustanciales a través de vías de estimación; sin embargo, a través de poblaciones, las mayores estimaciones fueron para RAM y SUF, en contraste con BBL y DOR con los IG menores. Danchin-Burge et al29 en siete razas de ovinos de Francia, reportaron estimaciones de IG promedio de 3.5 años, en un intervalo de 1.9 a 5.0; no obstante, en ovinos Xalda19 y en ovinos Somalí41 reportaron IG promedio de 2.9 y 2.1 años, respectivamente.
Cuadro 4 Estimaciones del intervalo generacional (años) en diez poblaciones de ovinos mexicanas
| Ítem | Padre - hijo | Padre - hija | Madre - hijo | Madre - hija | Media |
|---|---|---|---|---|---|
| BBL | 3.15 | 3.12 | 3.06 | 3.02 | 3.09 |
| CHA | 3.77 | 3.64 | 3.55 | 3.29 | 3.56 |
| DOR | 3.04 | 3.13 | 3.02 | 3.08 | 3.07 |
| DOB | 3.70 | 3.55 | 3.00 | 3.30 | 3.39 |
| DOS | 3.28 | 3.69 | 3.97 | 3.79 | 3.68 |
| HAM | 3.23 | 3.33 | 3.31 | 3.64 | 3.37 |
| KAT | 3.47 | 3.25 | 3.53 | 3.29 | 3.38 |
| PEL | 3.31 | 3.09 | 3.46 | 3.36 | 3.30 |
| RAM | 3.55 | 4.15 | 3.89 | 4.06 | 3.91 |
| SUF | 3.86 | 3.59 | 3.84 | 3.58 | 3.71 |
| Media | 3.44 | 3.45 | 3.46 | 3.44 |
Poblaciones: Blackbelly (BBL), Charollais (CHA), Dorper (DOR), Dorper Blanco (DOB), Dorset (DOS), Hampshire (HAM), Katahdin (KAT), Pelibuey (PEL), Rambouillet (RAM) y Suffolk (SUF).
Conclusiones e implicaciones
Estos resultados muestran un resumen del manejo genético y reproductivo que han realizado los criadores; son de utilidad en el diseño de programas de selección previendo la relación entre respuesta a la selección y los incrementos de consanguinidad, con las consecuencias que conlleva. Los resultados con respecto a las tendencias fueron similares a través de las poblaciones evaluadas: los niveles de consanguinidad tienden a disminuir con pendientes negativas diferentes de cero (P<0.05); las relaciones genéticas fueron estables a través del tiempo; sin embargo, el incremento de la población consanguínea fue significativo, con pendientes positivas diferentes de cero (P<0.05). En magnitud, KAT, PEL y RAM con altas tasas de crecimiento en población consanguínea; DOB y DOS, DOB y CHA con los niveles más altos de consanguinidad y relaciones genéticas, respectivamente; BBL, CHA, DOB, y SUF presentaron bajas estimaciones de tamaño efectivo y se debe monitorear la evolución de la consanguinidad y sus posibles implicaciones.











 texto en
texto en 


