Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias pecuarias
versão On-line ISSN 2448-6698versão impressa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.11 no.1 Mérida Jan./Mar. 2020 Epub 11-Jun-2020
https://doi.org/10.22319/rmcp.v11i1.4981
Artículos
Inclusión de concentrado y de aditivos promotores de crecimiento en las dietas de ovinos sobre el consumo, digestibilidad, degradabilidad, variables ruminales y balance de nitrógeno
aUniversidade Federal de Mato Grosso do Sul, Faculdade de Medicina Veterinária e Zootecnia. Campo Grande/MS, Brazil.
El presente estudio evaluó la inclusión de concentrado con monensina, salinomicina y flavomicina en dietas para ovinos, evaluando consumo, digestibilidad, degradabilidad in situ, variables ruminales y balance de nitrógeno. Cinco ovejas, bajo un diseño de cuadrado latino, recibieron cada uno de los tratamientos: HENO (solo heno como tratamiento control), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina) y FLAV (heno + concentrado + flavomicina). HENO fue suministrado ad libitum, mientras que el concentrado fue a 20 g kg-1 de peso corporal (PC) y los aditivos a 0.5 mg kg-1 de PC. Los tratamientos con el concentrado (CONT, MON, SALI y FLAV) mostraron un aumento (P≤0.05) en consumo, digestibilidad, AGV totales, proporciones de propionato y butirato, N-NH3 y balance de nitrógeno, y disminuyeron (P≤0.05) degradabilidad de materia seca y fibra en detergente neutro, proporción de acetato, relación acetato: propionato y pH del rumen comparado con el tratamiento control. La comparación entre los efectos dados por los aditivos con el CONT mostraron que la proporción de acetato y la relación acetato:propionato solo se redujeron en MON (P≤0.05). MON y SALI aumentaron (P≤0.05) el propionato, mientras que el butirato incrementó con la inclusión de FLAV, reduciéndose con MON y SALI. Únicamente MON disminuyó la producción de N-NH3 (P≤0.05). Otras variables no mostraron efectos de los aditivos (P>0.05) en relación con CONT. La inclusión del concentrado en las dietas para ovejas causó alteraciones en el consumo, digestibilidad, variables ruminales (AGV, pH y N-NH3) y balance de nitrógeno, sin embargo, los aditivos solo alteraron las variables ruminales (AGV y N-NH3), observando los mayores efectos con el MON.
Palabras clave Bambermicina; Flavomicina; Monensina; Rumiantes; Salinomicina
This study evaluated the inclusion of concentrate and monensin, salinomycin and flavomycin in sheep diets on intake, digestibility, in situ degradability, ruminal variables and nitrogen balance. Five sheep in a latin square received the treatments: HAY (hay only), CONT (hay + concentrate), MON (hay + concentrate + monensin), SALI (hay + concentrate + salinomycin), and FLAV (hay + concentrate + flavomycin). Hay was offered ad libitum, concentrate, 20 g kg-1 of body weight (BW), and additives, 0.75 mg kg-1 of BW. The treatments with the concentrate (CONT, MON, SALI and FLAV) showed increased (P≤0.05) on intake, digestibility, total VFA, propionate and butyrate proportions, N-NH3, and nitrogen balance, and decreased (P≤0.05) DM and NDF degradability, acetate proportion, acetate:propionate ratio, and rumen pH compared to the HAY. The comparison between the outcome effects from additives with the CONT showed that the acetate proportion and acetate:propionate ratio was only reduced by MON (P≤0.05). MON and SALI increased (P≤0.05) the propionate proportion. The proportion of butyrate was increased with the inclusion of FLAV and reduced with MON 8and SALI. Only MON reduced the production of N-NH3 (P≤0.05). Other variables showed no effects from additives (P>0.05) in relation to the CONT. The inclusion of the concentrate in sheep diets caused alterations on intake, digestibility, ruminal variables (VFA, pH, and N-NH3) and nitrogen balance. However, the additives only altered the ruminal variables (VFA and N-NH3) and the greatest effects were observed with MON.
Key words Bambermycin; Flavomycin; Monensin; Ruminants; Salinomycin
Introducción
La evolución del conocimiento de los requisitos nutricionales de las ovejas para lograr un alto rendimiento productivo ha llevado al uso de dietas de engorda formuladas con altos niveles de concentrado y niveles bajos de ingredientes con fibra1. El suministro de concentrados afecta la fermentación ruminal2, y se han asociado los niveles altos de inclusión con la presencia de trastornos nutricionales, sobre todo acidosis3. Los aditivos que promueven el crecimiento han demostrado tener el potencial de modular la fermentación ruminal, lo cual se refleja en un alto rendimiento productivo, además de reducir el riesgo de trastornos nutricionales.
El uso más común de los ionóforos es como promotores del crecimiento en los animales de interés zootécnico. Si bien más de 120 antibióticos pertenecen a esta clase, la monensina es probablemente el aditivo más ampliamente estudiado y utilizado en las dietas de los rumiantes4. De manera similar, la salinomicina pertenece también a la clase de los ionóforos y se la investiga y utiliza ampliamente. Según Edwards et al.5, otros antibióticos no ionóforos, como la flavomicina, han demostrado ser benéficos por alterar la fermentación ruminal y han sido utilizados como aditivos. La alteración benéfica que los ionóferos causan en el rumen se debe a que actúan sobre as bacterias Gram-positivas, los hongos y los protozoarios, y así permiten mejores condiciones para el desarrollo de las bacterias Gram-negativas6. Estas alteraciones de la microbiología del rumen se reflejan en una menor producción de metano, amoniaco y ácidos acético y butírico. Se incrementa la producción de ácido propiónico, de modo que aumenta la eficiencia energética, y esto se refleja en el aumento de peso o de la eficiencia alimentaria de los rumiantes7.
La flavomicina tiene un mecanismo de acción diferente de los ionóforos, y su selectividad de microorganismos es diferente. No actúa sobre todas las especies de bacterias Gram-positivas, y no tiene efecto en los hongos ni en los protozoarios5. Se ha demostrado que este aditivo es eficiente para incrementar el aumento de peso o la eficiencia alimentaria en los rumiantes8,9; sin embargo no se tiene una comprensión total de su efecto en la fermentación ruminal.
Así, este estudio evaluó los efectos de la inclusión del concentrado y comparó los efectos de adicionar monensina, salinomicina y flavomicina a las dietas de las ovejas sobre la ingesta, la digestibilidad, la degradabilidad in situ, las variables ruminales (pH, N-NH3 y AGV) y el equilibrio de nitrógeno.
Material y métodos
Sitio experimental y cuidado animal
El experimento fue realizado en el Laboratorio de Metabolismo Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Federal de Mato Grosso del Sur (Campo Grande, Mato Grosso do Sul, Brasil). El experimento se realizó de acuerdo con el Comité de Ética de Uso de los Animales de la institución, bajo el caso No. 577/2013.
Animales, manejo y tratamientos
En el estudio se utilizaron cinco ovejas machos (½ Suffolk + ½ Santa Inés) con una cánula permanente insertada en el rumen y con un peso corporal (PC) medio inicial de 46.50 ± 5.45 kg. Las ovejas estaban albergadas en jaulas especiales para estudios metabólicos, adecuadas para ensayos in vivo de digestibilidad. Estas jaulas tenían piso de madera laminada y contenían un comedero, una fuente para beber, y un recipiente de acero galvanizado para la recolección de orina. Las jaulas estaban albergadas en un cobertizo techado con buena ventilación.
Los animales se alimentaron con heno de bermuda cruza-1 (Cynodon dactyon (L.) Pers) picado y con concentrado (Cuadro 1). La fórmula del concentrado contenía maíz finamente molido (700 g kg-1), harina de soya (260 g kg-1) y premezcla de minerales (40 g kg-1). Los tratamientos experimentales incluyeron los aditivos promotores del crecimiento en el concentrado: HENO (heno solo); CONT (heno + concentrado); MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina) y FLAV (heno + concentrado + flavomicina) A las ovejas se les ofreció heno a su antojo, concentrado en la cantidad de 20 g kg-1 del PC, y aditivos en una proporción de 0.75 mg kg-1 of BW.
Cuadro 1 Composición química del concentrado y del heno de bermuda cruza-1 (Cynodon dactylon (L.) Pers.)
| Ítem | MS (g kg-1) | Composición química (g kg-1 de MS)1 | |||||
|---|---|---|---|---|---|---|---|
| MO | PB | aFNDmo | EE | CNE | Cenizas | ||
| Concentrado2 | 870 | 904 | 188 | 214 | 24 | 479 | 96 |
| Heno | 875 | 936 | 69 | 732 | 15 | 119 | 64 |
1MS= materia seca; MO= materia orgánica; PB= proteína bruta, aFDNmo= fibra detergente neutra con amilasa y corregida para cenizas; EE= extracto etéreo; CNE= carbohidratos no estructurales (100- (Cenizas + PB + aFNDmo + EE; Sniffen et al.10.
2La formulación contenía maíz molido fino (700 g kg-1), harina de soya (260 g kg-1) y premezcla de minerales (40 g kg-1).
Los aditivos fueron pesados en una báscula analítica y almacenados en microtubos hasta el momento de utilizarlos. El heno y el concentrado se proporcionaron en comederos separados. Se suministró a las ovejas heno y concentrado en dos comidas al día, a las 0007 y a las 1700 h. La ingesta de heno se ajustó para incluir en el alimento avena forrajera en una proporción de 150 g kg-1. Se suministraron aditivos únicamente en la comida de la mañana, mezclados con el concentrado. La cantidad de heno y de concentrado cumplió con los requisitos nutricionales de las ovejas en crecimiento con un aumento diario de 250 g d-1(1.
El diseño experimental fue un cuadrado latino de 5 x 5. Cinco periodos experimentales de 21 días cada uno constaron de 10 días de adaptación a los tratamientos y 11 días de recolección de datos. En cada periodo experimental se pesó a los animales después de 16 horas de ayuno de alimento sólido para ajustar las cantidades de concentrado y aditivo.
Control de la ingesta y recolección de heces y de orina
El control de la ingesta diaria de pienso y agua se llevó a cabo entre el día 11 y el día 15 de cada periodo experimental pesando las cantidades de pienso y avena forrajera ofrecidos. En el mismo periodo se recolectaron heces y orina. La ingesta de agua se controló midiendo la cantidad proporcionada en la mañana y en la tarde. El agua de avena forrajera se midió en los bebederos únicamente en las mañanas. Un bebedero de control (sin acceso de los animales) también se utilizó para medir la evaporación durante el día para evaluar la ingesta real de agua en los experimentos. Se adaptó a los animales una bolsa de recolección de heces para permitir una recolección total de las mismas. Estas bolsas fueron vaciadas diariamente a la misma hora por la mañana y por la tarde. Las heces fueron pesadas y homogeneizadas, y se almacenaron (a -20 ºC) muestras equivalentes a 100 g kg-1 para un análisis posterior. Con base en esta información, se evaluaron los siguientes parámetros: ingesta (avena forrajera ofrecida), coeficientes de digestibilidad aparente (ingesta de nutrientes - nutriente excretado/ingesta de nutrientes) de MS, MO, PB, fibra detergente neutra corregida para cenizas con el uso de amilasa (aFDNmo), extracto etéreo (EE) y CNE. Los NDT se calcularon mediante la fórmula propuesta por Sniffen et al10: NDT= PB digestible + aFDNmo digestible + EE digestible x 2.25 + CNE digestible.
Además de las heces, se recolectó orina para evaluar el equilibrio de nitrógeno. Se recolectó orina en cubetas con 100 mL de ácido sulfúrico (100 ml L-1) colocada en la parte inferior de recolectores de orina en las jaulas metabólicas. Estas cubetas se vaciaron diariamente a la misma hora en la mañana y en la tarde. Se recolectaron y almacenaron (a -20 °C) muestras de 100 ml L-1. Para el análisis de equilibrio de nitrógeno (N) se calculó el N absorbido mediante la diferencia entre la ingesta de N y el N excretado en las heces, mientras que el N retenido se calculó mediante la diferencia entre la ingesta de N y el N excretado en las heces y en la orina.
Medición de la degradabilidad in situ
La degradabilidad ruminal de la MS y la FDN se determinó desde el día 16 hasta el día 19 de cada periodo, utilizando bolsas de nylon de 5 x 5 con una porosidad de 50 μm, selladas en los bordes y adecuadamente identificadas. Las bolsas se pesaron vacías, se llenaron con 2.5 g de heno (molido y pasado por un cedazo con poros de 2 mm) y atadas con una liga de hule a un aro de metal para mantenerlas cerradas. Estas bolsas fueron remojadas primero en agua durante una hora, y después fueron sujetadas a una cadena y un ancla de metal con un peso aproximado de 100 g. Posteriormente, las bolsas se infundieron en el rumen mediante una cánula a las 0007 h (antes de alimentar a las ovejas) y fueron retiradas después de los tiempos de incubación (a las 3, 8, 16, 24, 48, 72 y 96 h). Se sumergieron las bolsas en agua helada inmediatamente después de ser retiradas del rumen y lavadas en una lavadora durante cinco minutos en tres ciclos, cambiando el agua en cada ciclo. Luego fueron colocadas en un horno de ventilación forzada a 55 ºC durante 72 h y pesadas después de este periodo.
La fracción soluble de MS del heno se determinó con bolsas de nylon, utilizando muestras sin incubación en el rumen. Estas bolsas fueron mantenidas en agua (a 38 °C) durante una hora, lavadas en una lavadora, secadas al horno y pesadas. La diferencia entre el peso inicial y final se consideró como la fracción soluble para cada periodo experimental, que corresponde al valor a las 0 horas en la curva de degradación de la MS. La fracción soluble “a”, la fracción insoluble “b”, la tasa de degradación “c”, y la degradabilidad efectiva (DE) se calcularon de acuerdo con Ørskov y McDonald11 utilizando la ecuación DE = a + (bxc) / (c + k), donde “k” es la tasa estimada de paso de sólidos ruminales, estimada en 0.l02, 0.05 y 0.08 h-1 en el presente estudio.
Recolección de muestras de líquido ruminal y pH
Se recolectaron muestras de líquido ruminal para determinar los AGV, el pH y el N-NH3 desde el día 20 hasta el día 21 en cada periodo experimental. Las muestras se recolectaron al final del periodo experimental después de retirar las bolsas de nylon. En el momento de la recolección se tomaron muestras a las cero horas (antes de la suplementación) y a las 2, 4, 8, 10, 12, 14, 16, 18, 20, 22 y 24 h después del suministro de alimento en la mañana, siempre siguiendo la misma secuencia entre los animales. El líquido ruminal se recolectó con ayuda de una concha de metal insertada en un pañal de tela. Se recolectó una proporción alícuota de aproximadamente 100 ml de líquido ruminal.
El pH se midió inmediatamente después de la recolección del líquido ruminal utilizando un potenciómetro digital (474; Micronal, São Paulo, SP, Brasil). El análisis de los AGV utilizó 4 ml de líquido ruminal acidificado con 1 ml de ácido metafosfórico (25 %) y almacenado a -20 °C. El análisis de N-NH3 usó 50 ml de líquido ruminal acidificado con H2SO4 (50 %) y almacenado a -20 °C.
Análisis químico
El análisis de la composición química de los piensos, avenas forrajeras y heces se realizó de acuerdo con los lineamientos de la Asociación de Químicos Agrícolas Oficiales (AOAC)12 como sigue: MS - método 967,03; PB -método 981,10; Cenizas - método 942,05, y EE - método 920,29. El contenido de FDN fue analizado en un analizador de fibra Tecnal TE-149® (Tecnal, Piracicaba, SP, Brasil) utilizando bolsas de tela no tejida (Tnt) de 5 X 5 cm con porosidad de 100 μm. A estos se añadieron 0.5 g de muestra (de pienso o de heces) y luego fueron sometidos a un análisis de detergente neutro según la metodología de Van Soest et al13 sin sulfito de sodio y utilizando amilasa termoestable (Termamyl 120 L Novozymes A/S, Bagsvaerd, Dinamarca). Posteriormente se corrigió la FDN para las cenizas, y se calculó el contenido de aFDNmo. El mismo procedimiento se utilizó en la FDN para analizar el material resultante de la degradación ruminal in situ, pero sin el uso de amilasa ni corrección para las cenizas. Se calculó el contenido de CNE como lo proponen Sniffen et al10 con la ecuación: CNE= 100 - (PB + cenizas + aFDNmo + EE).
El análisis del contenido de N-NH3 utilizó el sobrenadante de las muestras de líquido ruminal descongeladas a 4 ºC y la destilación con 2N KOH de acuerdo con Ribeiro et al14. La concentración de AGV se determinó mediante cromatografía de gas (Shimadzu GC-2010, Kioto, Japón) según la metodología descrita por Erwin et al15.
Análisis estadístico
Se llevaron a cabo análisis estadísticos utilizando el programa estadístico SAS (SAS Inst., Inc., Cary, NC). Los datos de la ingesta, la aparente digestibilidad y el equilibrio de nitrógeno fueron analizados mediante un ANOVA con un diseño de cuadrado latino de 5 x 5. El modelo estadístico utilizado fue:
Donde:
Yijk= observación del efecto del tratamiento i en el periodo j, en el animal k, donde μ es la media general, Ti= efecto del tratamiento i, donde i= 1 (HENO), 2 (CONT), 3 (MON), 4 (SALI), y 5 (FLAV);
Pj= efecto del periodo j (j= 5 periodos);
Ak= efecto del animal k (k= 5 animales), y eijk= error aleatorio asociado con cada observación.
El modelo para la calcular la tasa de degradación in situ incluía el tratamiento experimental, el tiempo de incubación, el animal, el periodo y el tratamiento × tiempo. El diseño experimental fue el cuadrado latino con casillas subdivididas para los datos de las variables ruminales (AGV, pH y N-NH3), en el cual las casillas fueron para los tratamientos, y las subcasillas, para las muestras de líquido ruminal. El modelo estadístico incluyó los efectos del tratamiento, los tiempos de muestreo, el animal, el periodo y tratamiento × tiempo. El modelo estadístico utilizado fue:
Donde:
Yijkl= observación del efecto del tratamiento i por horas de incubación (tasa de degradación) o tiempo de la recolección (parámetros ruminales) j en el animal k;
μ= media general; Ti= efecto del tratamiento (i = 1 (Heno), 2 (CONT), 3 (MON), 4 (SALI), y 5 (FLAV);
Hj= efecto de las horas de incubación en la degradabilidad (j= 1,....., 7), o de los tiempos de la recolección en los parámetros ruminales (j = 1, ....., 13));
Ak= efecto del animal (k= 1, ..., 5), Pj= efecto del periodo (j= 1, ....., 5);
THij= interacción entre el tratamiento i y el tiempo j; y eijkl= error aleatorio asociado con cada observación.
Cuando se observaron estadísticas F significativas (P≤0.05), las medias fueron separadas utilizando una prueba de comparación múltiple (método de Tukey) y se consideraron las diferencias de P≤0.05 como significativas.
Resultados
El suministro de concentrado con o sin aditivos (CONT, MON, SALI y FLAV) afectó la ingesta (P≤0.05) de MS, MO y nutrientes en kg día-1 o g kg-1 de PC en comparación con el tratamiento HENO (Cuadro 2). Los animales del tratamiento de HENO exhibieron una MS más alta (P≤0.05) y una mayor ingesta de nutrientes del heno; sin embargo, su ingesta total de MS y su ingesta total de nutrientes fue inferior (P≤0.05) a la de los animales que recibieron los tratamientos con el concentrado. La inclusión del concentrado no presentó una diferencia significativa (P>0.05) en la aFNDmo y el EE (g kg-1 del PC). No se observaron efectos de la inclusión de MON, SAL y FLAV en la dieta (P>0.05) sobre la ingesta de MS de heno, MS total o nutrientes en kg d-1 ni g kg-1 de PC. La ingesta de agua se incrementó (P≤0.05) con la adición de concentrado en las dietas; sin embargo, no se observó ningún efecto del uso de aditivos.
Cuadro 2 Efecto de la inclusión de concentrado y de aditivos antimicrobianos promotores del crecimiento en la dieta de las ovejas sobre la ingesta de MS, MO, PB, aFDNmo, EE, CNE y cenizas de heno, y en la dieta total (heno + concentrado)
| Ingesta de1 | Tratamientos2 | SEM | Valor de P | ||||
|---|---|---|---|---|---|---|---|
| HENO | CONT | MON | SALI | FLAV | |||
| Kg día-1 | |||||||
| MS del heno | 1.01a | 0.68b | 0.65b | 0.73b | 0.65b | 0.050 | 0.0018 |
| MS total | 1.01a | 1.56b | 1.57b | 1.62b | 1.54b | 0.070 | 0.0004 |
| MO del heno | 0.95a | 0.64b | 0.61b | 0.68b | 0.62b | 0.047 | 0.0021 |
| MO total | 0.95a | 1.43b | 1.44b | 1.49b | 1.42b | 0.065 | 0.0005 |
| PB del heno | 0.08a | 0.05b | 0.05b | 0.05b | 0.05b | 0.004 | 0.0006 |
| PB total | 0.08a | 0.22b | 0.22b | 0.22b | 0.22b | 0.008 | ≤0.0001 |
| aFDNmo del heno | 0.74a | 0.49b | 0.47b | 0.53b | 0.48b | 0.037 | 0.0023 |
| aFDNmo total | 0.74 | 0.68 | 0.67 | 0.72 | 0.67 | 0.042 | 0.7163 |
| EE del heno | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.002 | 0.5565 |
| EE total | 0.01b | 0.03a | 0.03a | 0.03a | 0.03a | 0.002 | ≤0.0001 |
| CNE del heno | 0.12a | 0.08b | 0.08b | 0.09b | 0.08b | 0.006 | 0.0053 |
| CNE total | 0.12a | 0.50b | 0.52b | 0.51b | 0.51b | 0.019 | ≤0.0001 |
| Cenizas de Heno | 0.06a | 0.04b | 0.04b | 0.05b | 0.04b | 0.003 | 0.0002 |
| Cenizas totales | 0.06a | 0.13b | 0.13b | 0.13b | 0.13b | 0.005 | ≤0.0001 |
| Agua (L día-1) | 2.44a | 3.74b | 4.03b | 4.06b | 3.86b | 0.192 | 0.0003 |
| g kg-1 de PC | |||||||
| MS del heno | 19.23a | 13.44b | 12.45b | 14.69b | 12.93b | 1.209 | 0.0150 |
| MS Total | 19.23a | 30.80b | 29.83b | 32.10b | 30.33b | 1.223 | ≤0.0001 |
| MO del heno | 18.02a | 12.62b | 11.68b | 13.76b | 12.13b | 1.150 | 0.0168 |
| MO total | 18.02a | 28.30b | 27.38b | 29.49b | 27.85b | 1.155 | 0.0001 |
| PB del heno | 1.42a | 1.07b | 0.93b | 1.10b | 0.99b | 0.073 | 0.0056 |
| PB total | 1.42a | 4.33b | 4.2b | 4.37b | 4.27b | 0.073 | ≤0.0001 |
| aFDNmo del heno | 14.07a | 9.75b | 9.08b | 10.65b | 9.37b | 0.905 | 0.0161 |
| aFDNmo total | 14.07 | 13.46 | 12.79 | 14.37 | 13.05 | 0.915 | 0.7349 |
| EE del heno | 0.30 | 0.21 | 0.21 | 0.25 | 0.18 | 0.024 | 0.0533 |
| EE total | 0.30a | 0.61b | 0.62b | 0.66b | 0.59b | 0.028 | ≤0.0001 |
| CNE del heno | 2.23a | 1.59b | 1.45b | 1.76b | 1.58b | 0.164 | 0.0450 |
| CNE total | 2.23a | 9.89b | 9.77b | 10.08b | 9.94b | 0.165 | ≤0.0001 |
| Cenizas del heno | 1.22a | 0.83b | 0.78b | 0.94b | 0.80b | 0.063 | 0.0028 |
| Cenizas totales | 1.22a | 2.49b | 2.45b | 2.61b | 2.48b | 0.070 | ≤0.0001 |
| Agua (ml kg-1 de PC) | 45.35a | 74.77b | 76.11b | 80.06b | 76.37b | 3.166 | ≤0.001 |
1MS= materia seca; MO= materia orgánica; PB= proteína bruta; aFDNmo= fibra detergente neutra con amilasa y corregida para las cenizas; EE= extracto etéreo; CNE= carbohidratos no estructurales (100- (Cenizas + PB + aFDNmo + EE; Sniffen et al10).
2Tratamientos: HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina).
abLas medias seguidas de letras diferentes en la misma fila son significativamente diferentes (Tukey, P≤0.05) .
Los tratamientos con concentrado exhibieron una mayor digestibilidad (P≤0.05) de MS, MO, PB, EE y CNE comparadas con el tratamiento HENO (Cuadro 3). No se observó ninguna diferencia (P>0.05) en la digestibilidad de la aFDNmo que diera como resultado un incremento de los nutrientes digestibles totales (NDT). La inclusión de aditivos (MON, SALI y FLAV) no afectó la digestibilidad de la MS, MO, EE, aFDNmo, CNE, EE, o NDT en comparación con el grupo CONT (P>0.05)
Cuadro 3: Efecto de la inclusión de concentrado y de aditivos antimicrobianos promotores del crecimiento en la dieta de las ovejas sobre los coeficientes aparentes de digestibilidad de MS, MO, PB, EE, aFDNmo y CNE.
| Digeribilidad de1 | Tratamientos2 | SEM | Valor de P | ||||
|---|---|---|---|---|---|---|---|
| HENO | CONT | MON | SALI | FLAV | |||
| MS (fracción 0-1) | 0.54a | 0.67b | 0.67b | 0.64b | 0.66b | 0.028 | 0.0305 |
| Cantidad digestible (g kg MS-1) | |||||||
| MO | 563.69a | 685.58b | 700.04b | 664.79b | 700.15b | 24.418 | 0.0142 |
| PB | 636.25a | 819.29b | 803.30b | 756.69b | 852.49b | 29.610 | 0.0036 |
| EE | 498.05a | 723.88b | 782.96b | 786.39b | 674.80b | 41.600 | 0.0027 |
| aFNDmo | 530.03 | 420.43 | 416.17 | 438.04 | 427.30 | 49.845 | 0.2004 |
| CNE | 507.27a | 883.04b | 877.02b | 871.69b | 888.30b | 23.749 | ≤0.0001 |
| NDT | 519.70a | 618.92b | 616.82b | 610.36b | 628.44b | 24.335 | 0.0197 |
1MS= materia seca; MO= materia orgánica; PB= proteína bruta; aFDNmo= fibra detergente neutra con amilasa y corregida para cenizas; EE= extracto etéreo; CNE= carbohidratos no estructuales (100- (Cenizas + CP + aFDNmo + EE; Sniffen et al10).
2Tratamientos: HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina).
abLas medias seguidas de letras diferentes en la misma fila son significativamente diferentes (Tukey, P≤0.05) .
Las tasas de desaparición in situ de la MS (Figura 1A) y de FDN (Figura 1B) del heno se vieron influidas por los tratamientos experimentales y los tiempos de incubación (P≤0.05). Las tasas de desaparición in situ de MS y FDN a las 3, 8 y 96 h de incubación no mostraron diferencias significativas entre tratamientos. Sin embargo, el tratamiento HENO a sólo 16, 24, 48 y 72 h de incubación mostró tasas de desaparición superiores a las de los tratamientos con el concentrado. Al comparar la influencia de los aditivos en relación con el grupo CONT, no se observaron diferencias en la tasa de desaparición de MS y FDN (P>0.05). El tratamiento HENO presentó una degradación potencial de MS y FDN a las 48 h de incubación. En cambio, ésta se observó a las 72 h en los tratamientos con el concentrado.
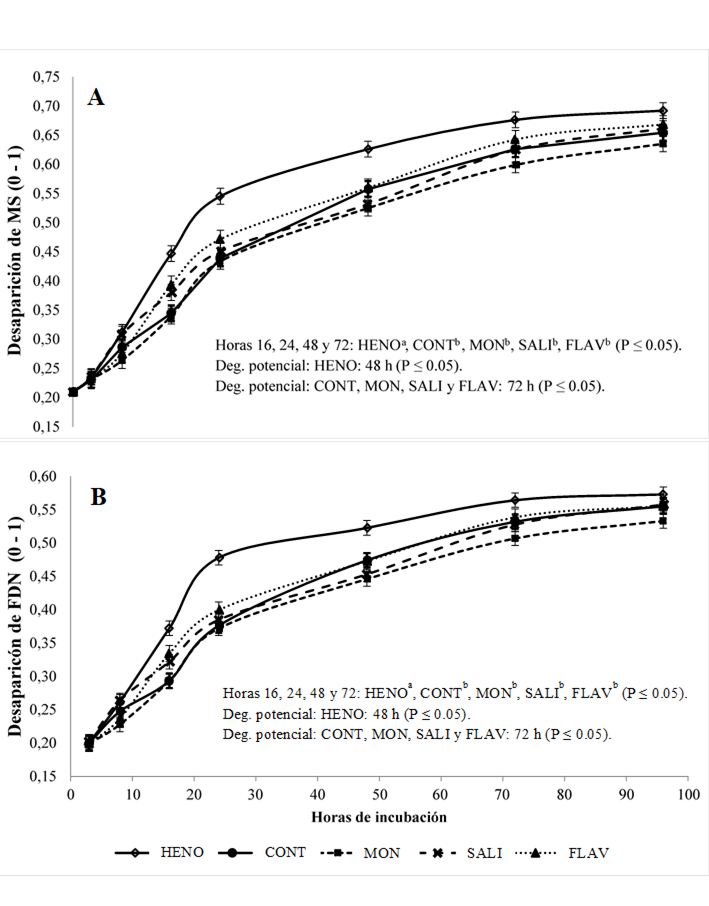
HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina). Las barras verticales representan la desviación estándar; la Degradación potencial (Deg. potencial.) representa el tiempo de incubación del heno que se requiere para lograr una degradación potencial.
Figura 1 Desaparición de materia seca (MS) (figura A) y de fibra detergente neutra (FDN) (figura B) del heno (expresadas como una fracción de 0-1) en el rumen de las ovejas
En el caso de las variables ruminales de la degradación de la MS del heno, la inclusión de concentrado en la dieta redujo (P≤0.05) la fracción “b” y la DE calculada en 0.02 y 0.05 h-1, y no modificó (P>0.05) la fracción “c” ni la DE calculada a las 0.08 h-1 (Tabla 4). La inclusión del concentrado redujo (P≤0.05) la fracción “c” y la DE (calculada a las 0.02, 0.05 8 horas; P≤0.05) y no modificó la fracción “b” en las variables ruminales de la degradación de la FDN del heno. Los aditivos no modificaron estas variables.
Cuadro 4: Efecto de la inclusión de concentrado y de aditivos antimicrobianos promotores del crecimiento en la dieta de las ovejas sobre la estimación de los parámetros ruminales MS y degradación de la FDN del heno (los valores se expresan como la fracción de 0-1)
| Parámetros1 | Tratamientos2 | SEM | Valor de P | ||||
|---|---|---|---|---|---|---|---|
| HENO | CONT | MON | SALI | FLAV | |||
| MS (a=0.210) | |||||||
| b | 0.482a | 0.445ab | 0.426b | 0.452ab | 0.454ab | 0.009 | 0.0112 |
| c | 0.055 | 0.050 | 0.035 | 0.034 | 0.039 | 0.008 | 0.2723 |
| DE (0.02 h-1) | 0.709a | 0.659ab | 0.613b | 0.625b | 0.653ab | 0.019 | 0.0146 |
| DE (0.05 h-1) | 0.565a | 0.521ab | 0.471b | 0.477b | 0.505ab | 0.020 | 0.0456 |
| DE (0.08 h-1) | 0.486 | 0.450 | 0.402 | 0.406 | 0.430 | 0.020 | 0.0679 |
| FDN | |||||||
| b | 0.573 | 0.555 | 0.533 | 0.557 | 0.584 | 0.013 | 0.1810 |
| c | 0.048a | 0.033ab | 0.032ab | 0.028b | 0.032ab | 0.004 | 0.0289 |
| DE (0.02 h-1) | 0.401a | 0.347ab | 0.324b | 0.320b | 0.363ab | 0.017 | 0.0359 |
| DE (0.05 h-1) | 0.277a | 0.223ab | 0.205b | 0.198b | 0.231ab | 0.015 | 0.0277 |
| DE (0.08 h-1) | 0.212a | 0.164ab | 0.150b | 0.143b | 0.169ab | 0.013 | 0.0252 |
1MS= materia seca; a= fracción soluble; b= fracción insoluble potencialmente degradable; c= tasa de degradación (/h); DE= degradación efectiva (considerando una tasa de degradación de 0.02, 0.05 y 0.08 h-1), FDN= fibra detergente neutra.
2Tratamientos: HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina).
abLas medias seguidas de letras diferentes en la misma fila son significativamente diferentes (Tukey, P≤0.05) .
El Cuadro 5 muestra que el tratamiento HENO exhibió una menor producción (P≤0.05) en mmol L-1 de acetato, propionato, butirato y AGV totales y una relación acetato:propionato más alta que los tratamientos con el concentrado (CONT, MON, SAL y FLAV). El tratamiento HENO presentó una proporción más alta (P≤0.05) de acetato y más baja (P≤0.05) de propionato y butirato, evaluadas en 100 mmol -1 que los tratamientos con el concentrado.
Cuadro 5 Efecto de la inclusión de concentrado y aditivos antimicrobianos promotores del crecimiento en la dieta de las ovejas sobre la producción de ácidos grasos de cadena corta en el rumen
| Ítem | Tratamientos1 | SEM | Valor de P | ||||||
|---|---|---|---|---|---|---|---|---|---|
| HENO | CONT | MON | SALI | FLAV | Trat | h | Trat×h | ||
| Ácido graso (mmol L -1 ) | |||||||||
| Acetato | 78.30b | 90.15a | 84.80a | 90.90a | 89.93a | 2.083 | ≤0.001 | ≤0.001 | 0.4278 |
| Propionato | 12.25d | 21.37c | 24.98a | 24.14ab | 21.43bc | 0.759 | ≤0.001 | 0.0002 | 0.9995 |
| Butirato | 4.09d | 10.64b | 9.15c | 9.49bc | 12.08a | 0.333 | ≤0.001 | 0.0262 | 0.9840 |
| AGV total | 94.64b | 122.16a | 118.93a | 124.53a | 123.44a | 2.776 | ≤0.001 | ≤0.001 | 0.6340 |
| Razón acetato/propionato | 6.39a | 4.21b | 3.39c | 3.77b | 4.19b | 0.120 | ≤0.001 | 0.6263 | 0.9993 |
| Ácido graso (mmol 100 mmol -1 ) | |||||||||
| Acetato | 82.61a | 73.94b | 71.26c | 73.15b | 73.02bc | 0.478 | ≤0.001 | 0.9540 | 0.9992 |
| Propionato | 13.06d | 17.35c | 21.01a | 19.14b | 17.36c | 0.422 | ≤0.001 | 0.6102 | 1.0000 |
| Butirato | 4.32d | 8.7b | 7.73c | 7.71c | 9.62a | 0.264 | ≤0.001 | 0.6895 | 0.9996 |
1Tratamientos: HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina).
2Trat= tratamiento.
abLas medias seguidas de letras diferentes en la misma fila son significativamente diferentes (Tukey, P≤0.05) .
Al analizar los efectos de los aditivos (MON, SALI y FLAV) en relación con el tratamiento CONT en mmol L-1, no se alteró la producción de acetato (P>0.05). Los tratamientos MON y SALI incrementaron (P≤0.05) la producción de propionato en relación con la obtenida con CONT, y el tratamiento FLAV no difirió de éstos. El tratamiento FLAV indujo la producción más alta (P≤0.05) de butirato; el MON, la más baja (P≤0.05), y el SALI no difirió del CONT ni del MON. La producción total de la AGV del tratamiento con aditivos no difirió de la obtenida con el CONT. La razón acetato/propionato fue la más baja (P≤0.05) con el tratamiento MON, en comparación con los demás tratamientos. El tratamiento MON presentó una producción de acetato menor (P≤0.05), en mmol 100 mmol-1, que los tratamientos CONT y SALI, pero no que el tratamiento FLAV. Los grupos CONT, SALI y FLAV no difirieron. La proporción más alta (P≤0.05) de propionato se produjo con el tratamiento MON, seguido de SALI, FLAV y CONT. Los últimos dos no difirieron entre sí. La proporción más alta (P≤0.05) de butirato se observó con el tratamiento FLAV, seguido de CONT, MON y SALI. Los últimos dos no difirieron entre sí.
La inclusión de concentrado en las dietas redujo (P≤0.05) el pH ruminal en relación con el tratamiento HENO (Figura 2A) en todos los puntos temporales evaluados. No se observaron diferencias en el pH como resultado de los aditivos. El uso del concentrado provocó una elevada variación del pH a lo largo del día, con valores máximos de 6.46 y mínimos de 5.68. Los valores más bajos se observaron de 2 a 4 h después del suministro de alimento.
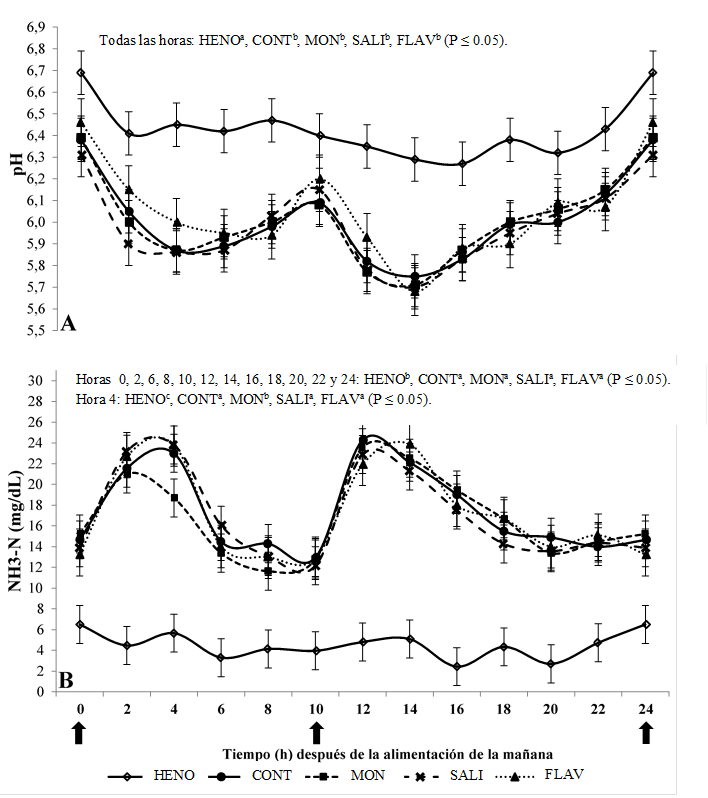
HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina). Las barras verticales representan a la desviación estándar
Figura 2 Valores promedio del pH (Figura A) y nitrógeno amoniacal (NH3-N; Figura B) en el rumen de las ovejas en diferentes momentos de recolección
La inclusión de concentrado en la dieta incrementó la producción de N-NH3 en relación con el tratamiento HENO en todos los puntos temporales evaluados (Figura 2B). MON fue el único aditivo que presentó algún efecto (P≤0.05) comparado con el tratamiento CONT al reducir la concentración de N-NH3 apenas cuatro horas después de la alimentación matutina. No se observaron efectos de los demás aditivos para esta variable.
El uso del concentrado incrementó (P≤0.05) la ingesta de nitrógeno (Cuadro 6) pese a las pérdidas en heces y orina, y la cantidad absorbida y retenida fue más elevada (P≤0.05) que la observada en el tratamiento HENO. No se observaron diferencias significativas en la ingesta de nitrógeno con el uso de aditivos.
Cuadro 6 Efecto de la inclusión de concentrado y de aditivos antimicrobianos promotores del crecimiento en la dieta de las ovejas sobre el equilibrio del nitrógeno
| Ingesta de | Tratamientos1 | SEM | Valor de P | ||||
|---|---|---|---|---|---|---|---|
| HENO | CONT | MON | SALI | FLAV | |||
| g día -1 | |||||||
| Ingesta de N - heno | 12.18a | 8.67b | 7.72b | 8.79b | 7.98b | 0.458 | 0.0001 |
| Ingesta de N - concentrado | 0.00a | 26.57b | 27.76b | 26.73b | 27.32b | 1.153 | ≤0.0001 |
| Ingesta de N - total | 12.18a | 35.24b | 35.48b | 35.51b | 35.30b | 1.193 | ≤0.0001 |
| N fecal | 3.50a | 6.34b | 5.92b | 7.01b | 6.41b | 0.550 | 0.0072 |
| N absorbido | 8.68a | 28.91b | 29.56b | 28.50b | 29.22b | 0.838 | ≤0.0001 |
| N urinario | 3.04a | 11.11b | 14.42b | 12.13b | 12.51b | 1.181 | ≤0.0001 |
| N fecal + urinario | 6.54a | 17.45b | 20.34b | 19.15b | 18.59b | 1.459 | 0.0001 |
| N retenido | 5.65a | 17.80b | 15.14b | 16.37b | 16.70b | 1.444 | ≤0.0001 |
| g kg -1 de ingesta de N | |||||||
| N absorbido | 706.22a | 818.70b | 833.60b | 803.72b | 825.92b | 20.967 | 0.0060 |
| N retenido | 454.82 | 501.56 | 428.58 | 468.36 | 471.22 | 52.691 | 0.7101 |
| g kg -1 de PC | |||||||
| Ingesta de N - heno | 0.23a | 0.17b | 0.15b | 0.18b | 0.16b | 0.011 | 0.0200 |
| Ingesta de N - concentrado | 0.00a | 0.52b | 0.52b | 0.52b | 0.52b | 0.002 | ≤0.0001 |
| Ingesta de N - total | 0.23a | 0.69b | 0.67b | 0.70b | 0.68b | 0.011 | ≤0.0001 |
| N fecal | 0.07a | 0.13b | 0.11b | 0.14b | 0.12b | 0.009 | 0.0012 |
| N absorbido | 0.16a | 0.57b | 0.56b | 0.56b | 0.56b | 0.010 | ≤0.0001 |
| N urinario | 0.06a | 0.22b | 0.27b | 0.23b | 0.24b | 0.016 | ≤0.0001 |
| N fecal + urinario | 0.13a | 0.35b | 0.38b | 0.37b | 0.36b | 0.019 | ≤0.0001 |
| N retenido | 0.10a | 0.35b | 0.29b | 0.33b | 0.32b | 0.020 | ≤0.0001 |
1Tratamientos: HENO (heno solo), CONT (heno + concentrado), MON (heno + concentrado + monensina), SALI (heno + concentrado + salinomicina), FLAV (heno + concentrado + flavomicina).
abLas medias seguidas de letras diferentes en la misma fila son significativamente diferentes (Tukey, P≤0.05) .
Discusión
Efecto del concentrado
La inclusión de concentrado en la dieta incrementó la ingesta de MS y nutrientes (Cuadro 2). La menor ingesta observada en el tratamiento HENO puede haber sido resultado de una limitación ruminal física en las ovejas. La ingesta de heno puede haber causado una mayor saciedad y distensión ruminal, las cuales, según Grovum16, provocan un estímulo neural inhibidor desde el centro del hambre que reduce la ingesta de alimento. Se sabe que la adición de concentrado incrementa la tasa de pasaje, proporcionando nutrientes limitantes como nitrógeno y azufre a los microorganismos ruminales y generando un elevado índice de multiplicación de los microorganismos17, lo cual se refleja en un incremento de la ingesta.
La inclusión de concentrado en la dieta incrementó la digestibilidad de la MS y de otros nutrientes (con la excepción de aFDNmo). Según Hagos y Melaku18, la concentración más baja de PB y el nivel más alto de aFDNmo en el tratamiento HENO pueden haberse reflejado en una baja eficiencia microbiana, lo cual provocó un bajo nivel de fermentación de los nutrientes y, por ende, una baja digestibilidad.
La ausencia de mejora en la digestibilidad de la aFDNmo y la reducción de la degradabilidad de la MS y la FDN debido a la inclusión de concentrado puede haberse debido al hecho de que la inclusión de carbohidratos de fermentación rápida conduce a un descenso del pH ruminal, a un mayor desarrollo de bacterias amilolíticas y a una disminución de desarrollo de las bacterias celulolíticas19,20. Estas alteraciones microbianas reducen la producción de enzimas fibrolíticas y por ende afectan negativamente la degradabilidad y la digestibilidad de la fibra.
La inclusión de concentrado en la dieta aumentó la producción total de AGV y las proporciones de propionato y butirato, y produjo una reducción en la proporción de acetato y de la relación acetato:propionato. La alteración en la producción de AGV en la dieta fue probablemente el resultado de cambios en la población microbiana del rumen, la cual se altera según el tipo de sustrato disponible. De acuerdo con Wanapat y Khampa20, la inclusión de concentrado en la dieta incrementa el número de protozoarios y de bacterias amilolíticas y proteolíticas, y reduce el número de hongos y bacterias celulolíticas. Las alteraciones causan cambios en el tipo y la cantidad de AGV producidos.
El pH ruminal más bajo se observó en los tratamientos que contenían concentrado. Los microorganimsos del rumen fermentan carbohidratos, produciendo AGV y lactato, los cuales tienen un efecto acidogénico. Por ello, la inclusión de carbohidratos de fermentación rápida en la dieta aumenta la tasa de fermentación y la producción de estos compuestos, con lo cual se reduce el pH3,17. Además, la inclusión del concentrado suele asociarse con una menor rumia y masticación, con la consiguiente reducción de la producción de saliva y de la capacidad de tampón de la dieta19,21. El tratamiento HENO presentó una baja variación diaria del pH porque los animales tuvieron una ingesta gradual a lo largo del día. En cambio, los tratamientos con concentrado presentaron una elevada variación del pH durante el día porque el concentrado proporcionado se consumió rápidamente, y esto se reflejó luego en un descenso de los valores del pH, los más bajos de los cuales se observaron unas 2 a 4 horas después del alimento. Los valores más bajos de pH observados en los tratamientos con el concentrado y con el heno fueron 5.68 y 6.27, respectivamente. Según Hover y Stokes22, estos valores se encuentran dentro de un rango adecuado para un máximo crecimiento microbiano y una máxima digestión ruminal de las fibras (entre 5.5 y 7), y el amplio rango de pH para la digestión de fibra va de 6.7 a 7.1.
La mayor concentración de N-NH3 ruminal se observó con la inclusión de concentrado. Según Van Soest19, la degradación de la proteína en el rumen ocurre a través de la acción de las enzimas secretadas por los microorganismos del rumen. Estas bacterias digieren parte de la proteína, y otros microorganismos del rumen utilizan aminoácidos, péptidos y amoniaco para la multiplicación de las células. Cuando la tasa de producción de amoniaco es mayor que la de su uso, el animal lo absorbe a través de la pared del rumen, pasando al torrente sanguíneo y convirtiéndose en urea en el hígado. La urea puede reciclarse o perderse a través de la orina. Se alcanzan valores excesivos mediante una elevada inclusión de concentrado en las dietas, lo cual no es deseable.
El tratamiento HENO presentó una baja variación diaria de N-NH3 (Figura 2B) porque los animales consumieron el alimento gradualmente a lo largo del día. Por otra parte, como se observó en el análisis del pH, los tratamientos con concentrado mostraron una alta variación debido a la rápida ingesta de concentrado que provoca picos de producción de amoniaco entre 2 y 4 horas después de suministrado el alimento. Los niveles incrementados se presentaron como resultado de las elevadas cantidades de PB del concentrado, lo que incrementó la tasa de degradación y produjo picos de N-NH3.
Hubo un incremento de la cantidad de N absorbido y retenido (g d1 o g kg-1 de PB) con la inclusión del concentrado en la dieta. Probablemente esto sucedió debido a la elevada ingesta de N y a la elevada digestibilidad de N contenido en el concentrado en comparación con los del tratamiento con HENO. Sin embargo, cuando se analizó la cantidad de N retenido en g kg-1 del N ingerido, se percibió la ausencia de una mayor eficiencia en el uso del N ingerido con la inclusión del concentrado, misma que probablemente sea resultado de la baja tasa de flujo desplegado en el tratamiento HENO, que mejoró la eficiencia en el uso de N y produjo resultados similares a los de los tratamientos con concentrado. La inclusión de concentrado dio como resultado pérdidas considerables de N, principalmente a través de la orina. Esto puede deberse a una baja eficiencia del ciclo de la urea, la cual es un reflejo de los picos de producción de N-NH3 y la reducción de la producción de saliva con la inclusión del concentrado19. La inclusión de concentrado se refleja en un tiempo menor de masticación y rumia21, por lo que se produce menos saliva y se recicla menos nitrógeno, el cual termina siendo eliminado en la orina.
Efecto de los aditivos
La inclusión de aditivos no alteró la ingesta de MS y nutrientes. Sin embargo, se sabe que los ionóforos tienen un efecto en la MS que conduce a una menor ingesta cuando se los utiliza en dietas con una elevada proporción de concentrado23,24. Este efecto puede presentarse como consecuencia de un incremento en la concentración de ácido propiónico ruminal, que se refleja en un incremento de eficiencia energética, lo que permite satisfacer los requisitos nutricionales con una menor ingesta de pienso7. Esta ingesta también se ve afectada por aspectos patofisiológicos como el pH ruminal. Así, una dieta que induce la acidosis ruminal, con la adición de ionóforos, puede conducir a un menor descenso del pH, con lo cual aumenta la ingesta25. Sin embargo, pese a que en este experimento la ingesta de heno fue elevada (de aproximadamente 430 g kg-1 de la dieta), todas las dietas fueron catiónicas, lo que produjo un efecto alcalinizante que puede haber ocasionado que los aditivos no tuvieran efecto en la ingesta.
La inclusión de aditivos no alteró la digestibilidad de la dieta. No obstante, los ionóforos pueden incrementar la digestibilidad dietaria al aumentar el tiempo de retención de la MS en el rumen como resultado de una menor ingesta voluntaria, estimulando la rumia y mejorando así el ambiente ruminal y permitiendo una mayor digestibilidad26. Pero en este estudio no se observó este efecto porque los aditivos no alteraron la ingesta.
Los aditivos no influyeron en la degradabilidad del heno. Se sabe que los ionóforos alteran la población microbiana del rumen y actúan sobre las bacterias celulolíticas, lo que puede reducir la degradabilidad de la fibra27. Sin embargo, probablemente sea más fácil observar estos efectos en las dietas con mayores proporciones de fibra. Edward et al5 reportan en un experimento in vitro que las bacterias celulolíticas Gram-negativas del género Fibrobacter se cuentan entre las más sensibles a la acción de la flavomicina. Según los mismos autores, normalmente la flavomicina no disminuye la degradación de la fibra en los estudios in vitro e in vivo. Por ello es probable que las actividades celulolíticas de las bacterias del género Ruminococcus, hongos y protozoarios que no se ven afectados por este antibiótico y que pertenecen a la población de microorganismos ruminales compensen la disminución del número de bacterias Fibrobacter que pudiera afectar a degradación de la fibra.
Los aditivos alteraron la producción de AGV. Los ionóforos provocan estas alteraciones al modificar las poblaciones bacterianas del rumen. Las bacterias Gram-positivas que producen acetato, butirato y H2 se ven inhibidas por los ionóforos, y las bacterias Gram-negativas que producen propionato encuentran mejores condiciones para reproducirse28. La producción de butirato se incrementó en el tratamiento FLAV. Así, la respuesta al efecto de la flavomicina en la proporción de AGV difiere de la de los ionóforos, que promueve un incremento de la proporción de propionato. La acción de la flavomicina, que no se da en exactamente los mismos microorganismos, puede reflejarse en estas alteraciones.
Los aditivos no alteraron el pH ruminal. Esto puede haberse debido a la elevada proporción de heno en la dieta (aproximadamente 430 g kg-1 de la dieta), la cual induce un mayor tiempo de ingesta, regurgitación y producción de saliva que produce un pequeño descenso en el pH ruminal y no permite la demostración de estos efectos de los antibióticos.
La reducción de la concentración de N-NH3 durante el primer pico de producción (apenas 4 h después de la alimentación matutina) no se detectó en la dieta adicionada con MON. Esta respuesta se ve asociada a la reducción del número de bacterias que utilizan aminoácidos y péptidos como fuente de energía para su crecimiento, y por ende liberan amoniaco en el ambiente ruminal. La reducción del uso de aminoácidos y péptidos favorece su paso al intestino delgado y su absorción, lo que aumenta la eficiencia en el uso de nitrógeno29.
No se observó ningún efecto de los aditivos en el equlibrio de nitrógeno. Sin embargo, los ionóforos pueden promover una mejor utilización del nitrógeno dietario, como resultado de una menor ingesta de MS, y por ende una reducción de la ingesta de nitrógeno y de la desaminación del rumen30. En este estudio, el uso de aditivos no alteró la ingesta de MS, y la salinomicina y la flavomicina no alteraron la concentración de N-NH3. De ahí que fuera de esperar la ausencia de efecto en el equilibrio total de nitrógeno. Si bien la MON redujo la producción pico de amoniaco después de la alimentación matutina, no fue suficiente para alterar el equilibrio de nitrógeno.
Conclusiones e implicaciones
La adición de concentrado a la dieta de las ovejas ocasionó alteraciones en la ingesta, la digestibilidad, las variables ruminales (AGV, pH y N-NH3) y el balance de nitrógeno. Los aditivos MON, SALI y FLAV alteraron la producción de AGV; sin embargo, sólo MON redujo la producción de N-NH3. Entre los aditivos probados, la monensina produjo los cambios más benéficos en el metabolismo ruminal de las ovejas.
Agradecimientos
Los autores desean expresar su agradecimiento a la compañía Nutract Agrisolutions (Chapecó, SC, Brasil) por haber financiado parcialmente esta investigación, y también a la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) por la beca otorgada al primer autor.
REFERENCIAS
1. NRC. Nutrient requirements of small ruminants: Sheep, goats, cervids, and new world camelids. 1st ed. Washington, DC: National Academy Press; 2007. [ Links ]
2. Ma T, Deng, KD, Tu Y, et al. Effect of dietary forage-to-concentrate ratios on urinary excretion of purine derivatives and microbial nitrogen yields in the rumen of Dorper crossbred sheep. Livestock Sci 2014;160:37-44. [ Links ]
3. Owens FN, Secrist DS, Hill WJ, Gill DR. Acidosis in cattle: a review. J Anim Sci 1998;76:275-86. [ Links ]
4. Nagaraja TG, Newbold CJ, Van Nevel CJ, Demeyer DI. Manipulation of ruminal fermentation. In: Hobson PN, editor. The Rumen Microbial Ecosystem. New York: Blackie; 1997:523-632. [ Links ]
5. Edwards JE, Mcewan NR, Mckain N, Walker N, Wallace RJ. Influence of flavomycin on ruminal fermentations and microbial populations in sheep. J Microbiol 2005;151:717-25. [ Links ]
6. Pressman BC. Biological applications of ionophores. Ann Rev Biochem 1976;45:501-503. [ Links ]
7. Russel JB, Strobel HJ. Effect of ionophores on ruminal fermentation. J Appl Environ Microbiol 1989;55:1-6. [ Links ]
8. Murray PJ, Winslow SG, Rowe JB. Conditions under which flavomycin increases wool growth and liveweight gain in sheep. Aust J Agric Res 1992;43:367-87. [ Links ]
9. Bretschneider G, Elizalde JC, Pérez FA. The effect of feeding antibiotic growth promoters on the performance of beef cattle consuming forage-based diets: A review. Livestock Sci 2008;114:135-49. [ Links ]
10. Sniffen CJ, Connor JD, Van Soest P. A net carbohydrate and protein system for evalution cattle diets. II. Carboydrate and protein availability. J Anim Sci 1992;70:3562-77. [ Links ]
11. Ørskov ER, McDonald I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage. J Agric Sci 1979;92:499-503. [ Links ]
12. Latimer GW; AOAC International. Association of Official Analytical Chemistry. Official methods of analysis. 15th ed. Arlington, VA: AOAC International; 1990. [ Links ]
13. Van Soest PJ, Robertson JB, Lewis BA. Methods for dietary fiber, neutral detergent fiber, and non starch polyssacarides in relation to animal nutrition. J Dairy Sci 1991;74:3583-97. [ Links ]
14. Ribeiro SS, Vasconcelos JT, Morais MG, Ítavo CBCF, Franco GL. Effects of ruminal infusion of a slow-release polymer-coated urea or conventional urea on apparent nutrient digestibility, in situ degradability, and rumen parameters in cattle fed low-quality hay. Anim Feed Sci Technol 2011;164:53-61. [ Links ]
15. Erwin ES, Marco GJ, Emery EM. Volatile fatty acid analyses of blood and rumen fluid by gas chromatography. J Dairy Sci 1961;44:1768-71. [ Links ]
16. Grovum WL. Apetito, sapidez y control del consumo de alimentos. In: Church DC, editor. El rumiante. Fisiología digestiva y nutrición. ed. Acríbia, Zaragoza; 1988:225-242. [ Links ]
17. Dixon RM, Stockdale CR. Associative effects between forages and grains: consequences for feed utilization. Aust J Agric Res 1999;50:757-73. [ Links ]
18. Hagos T, Melaku S. Feed intake, digestibility, body weight and carcass parameters of Afar rams fed tef (Eragrostistef) straw supplemented with graded levels of concentrate mix. Trop Anim Health Prod 2009;41:599-606. [ Links ]
19. Van Soest PJ. Nutritional ecology of the ruminant, 2nd ed. Ithaca, NY, USA: Comstock Publishing Association; 1994. [ Links ]
20. Wanapat M, Khampa S. Effect of levels of supplementation of concentrate containing high levels of cassava chip on rumen ecology, microbial n supply and digestibility of nutrients in beef cattle. AJAS 2007;20:75-81. [ Links ]
21. Kleefisch MT, Zebeli Q, Humer E, Kröger I, Ertl P, Klevenhusen, F. Effects of the replacement of concentrate and fibre-rich hay by high-quality hay on chewing, rumination and nutrient digestibility in non-lactating Holstein cows. Arch Anim Nutr 2016;71:21-36 [ Links ]
22. Hoover WH, Stokes SR. Balancing carbohydrates and proteins for optimum rumen microbial yield. J Dairy Sci 1991;74:3630-44. [ Links ]
23. Gastaldello Jr AL, Pires AV, Susin I, et al. Limestone with different particle size and sodium bicarbonate to feedlot lambs fed high grain diets with or without monensin. Small Ruminant Res 2013;114:80-5. [ Links ]
24. Mirzaei-Alamouti H, Moradi S, Shahalizadeh Z, et al. Both monensin and plant extract alter ruminal fermentation in sheep but only monensin affects the expression of genes involved in acid-base transport of the ruminal epithelium. Anim Feed Sci Technol 2016;219:132-43. [ Links ]
25. Rodrigues PHM, Mattos WRS, Melotti L, Rodrigues RR. Monensin and total tract digestibility in wethers fed different roughage/concentrate ratios. Sci Agric 2001;58:449-55. [ Links ]
26. Ellis WC, Horn GW, Delaney D, Pond KR. Effects of ionophores on grazed forage utilization and their economic value for cattle on wheat pasture. In: National wheat pasture symposium 1983; Stillwater, USA. Stillwater: Agricultural Experimental Station; 1983. [ Links ]
27. Bogaert C, Gomez L. Jouany JP. Effects of lasalocid and cationomycin on the digestion of plant cell walls in sheep. Can J Anim Sci 1991;71:379-88. [ Links ]
28. Bergen WG, Bates DB. Ionophores: Their effect on production efficiency and mode of action. J Anim Sci 1984;58:1465-83. [ Links ]
29. Yang CMJ, Russell JB. The effect of monensin supplementation on ruminal ammonia accumulation in vivo and the numbers of amino acid-fermenting bacteria. J Anim Sci 1993;71:3470-6. [ Links ]
30 . Mcguffey RK, Richardson LF, Wilkinson JID. Ionophores for dairy cattle: current status and future outlook. J Dairy Sci 2001;84:194-203. [ Links ]
Recibido: 11 de Julio de 2018; Aprobado: 06 de Febrero de 2019











 texto em
texto em 


