Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias pecuarias
versão On-line ISSN 2448-6698versão impressa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.11 no.1 Mérida Jan./Mar. 2020 Epub 11-Jun-2020
https://doi.org/10.22319/rmcp.v11i1.5018
Articles
Transmisión de Anaplasma marginale por larvas no alimentadas de garrapata Rhipicephalus microplus bajo condiciones experimentales
a Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP). Centro Nacional de Investigación Disciplinaria en Salud Animal e Inocuidad. Tel: +52 777 3192860 ext. 125, Fax: +52 777 3192850 ext. 129. Carr. Cuernavaca - Cuautla No 8534, Col. Progreso, Jiutepec, Mor. 62550, México.
b Independent Scientist. México.
c INIFAP. Campo Experimental La Posta, Paso del Toro, Veracruz, México.
La descripción actual de la transmisión biológica de Anaplasma marginale por garrapatas Rhipicephalus microplus incluye la transmisión intrastadial y transestadial. Tanto la transmisión transovárica de Anaplasma de las garrapatas ingurgitadas a su progenie como la transmisión de las larvas infectadas no alimentadas al huésped mamífero son temas controvertidos. Para demostrar la transmisión vertical de A. marginale por las garrapatas de R. microplus en condiciones experimentales, hembras ingurgitadas infectadas se incubaron a 18 °C o, 28 °C durante la oviposición. Las larvas eclosionadas de estas garrapatas se usaron para infestar a dos novillos por cada temperatura de incubación. Sólo los novillos infestados con larvas ovipositadas a 28 ºC desarrollaron infección por A. marginale. ADN de larvas utilizadas para la infestación del donador de garrapatas portadoras, ADN de larvas ovipositadas a 28 ºC y ADN de sangre de novillos que desarrollaron la infección, fueron positivos para la amplificación de la región variable de los genes msp5 y msp1α por PCR. Todas las demás muestras de ADN incluyendo el estabilizado original, la sangre del bovino donante, las larvas de garrapatas incubadas a 28 °C y los novillos infestados con estas mismas larvas fueron positivos tanto para msp5 como para msp1α por PCR. Las secuencias de msp1α de todos los productos de PCR fueron las mismas y coincidieron con la secuencia de la cepa Tlapacoyan-2 usada para la infección del bovino donante. La evidencia que se presenta indica que R. microplus es capaz de transmitir A. marginale a su progenie y que estas larvas infectadas pueden transmitir la infección a huéspedes susceptibles.
Palabras clave Anaplasma marginale; Transmisión transovárica; Garrapatas; Rhipicephalus microplus
The current description of biological transmission of Anaplasma marginale by Rhipicephalus microplus ticks, includes of the biological intrastadial and transstadial transmission. Both transovarian transmission of Anaplasma from engorged ticks to their progeny and, transmission from infected unfed larvae to the mammalian host is controversial. In order to demonstrate vertical transmission of A. marginale by R. microplus ticks under experimental conditions, feed-acquisition infected engorged females were incubated at 18 °C or 28 °C for oviposition. Larvae hatched from these ticks were used to infest two steers for each incubation temperature. None of the four steers infested with either lot of larvae developed clinical disease, yet subclinical infection was observed in the steers infested with larvae from engorged ticks incubated at 28 °C for hatching. gDNA from, larvae used for the infection of the carrier tick donor, gDNA from larvae oviposited at 28 ºC, gDNA from blood of A. marginale-positive steers, were positive for amplification of msp5 and msp1α the variable region by PCR. All other DNA samples from the original stabilate, blood from the donor steer, larvae from ticks incubated at 28 °C and blood from steers infested with these same larvae were positive to both, msp5 and msp1α PCR. msp1α sequences of all PCR products were the same and are consistent with previously reported Tlapacoyan-2 sequence. The present evidence indicates that R. microplus is capable of passing A. marginale to its progeny and that these infected larvae can transmit the infection to susceptible hosts.
Key words Anaplasma marginale; Transovarian transmission; Ticks; Rhipicephalus microplus
Introducción
Las garrapatas son ectoparásitos ampliamente extendidos en todo el mundo, y su eco-epidemiología depende de las condiciones ambientales regionales1. Las garrapatas son artrópodos con una gran capacidad de transmisión de patógenos humanos y animales y se considera que son los vectores más importantes de patógenos que ocasionan enfermedades a animales domésticos y salvajes, después de los mosquitos1,2. Hay muchas especies de garrapatas presentes en México3, pero la de mayor importancia económica en la industria ganadera es Rhipicephalus microplus, tanto en México como en el resto de América Latina. R. microplus es responsable de daños directos y de la transmisión de la babesiosis y la anaplasmosis bovinas3,4.
Si bien se ha establecido claramente la transmisión transovárica de babesiosis bovina5, la transmisión transovárica de la anaplasmosis bovina sigue siendo objeto de controversias.
La anaplasmosis bovina es una rickettsiosis transmitida por la garrapata y distribuida en todo el mundo6. Anaplasma marginale, el agente causal, infecta los eritrocitos maduros de diversas especies de rumiantes, pero tiene un mayor impacto en el ganado bovino adulto; el síndrome clínico incluye fiebre, anemia, pérdida de peso y de producción, y muerte si no se aplica un tratamiento oportuno7,8.
En el ganado, A. marginale infecta los eritrocitos maduros las células endoteliales9,10, y pese a la aplicación de un tratamiento específico, los bovinos pueden seguir siendo portadores asintomáticos por el resto de sus vidas11,12. También se ha demostrado que el surgimiento de variantes antigénicas de ciertas proteínas de la membrana de las rickettsias en el huésped mamífero también es fundamental para su permanencia y su transmisión a huéspedes no infectados13.
La transmisión de A. marginale entre el ganado ocurre a nivel mecánico tanto como biológico. La transmisión mecánica se da mediante artrópodos de sangre y procedimientos veterinarios que transfieren sangre infectada de los portadores a huéspedes no infectados14,15. La transmisión biológica ocurre principalmente a través de garrapatas Rhipicephalus y Dermacentor infectadas8; sin embargo, en América Latina, la garrapata del ganado Rhipicephalus microplus es el principal vector biológico4. Las garrapatas pueden transmitir la rickettsia biológicamente en una misma fase (transimsión intraestadial), así como entre una fase y otra (transimsión transestadial). En Rhipicephalus microplus, las larvas, ninfas y garrapatas adultas adquieren la rickettsia al alimentarse en ganado infectado, misma que se replica en las células del intestino16,17,18. Después de un ciclo inicial de replicación, las cepas de Anaplasma transmisibles por la garrapata emigran del estómago medio, a través de la hemolinfa, a otros tejidos, incluyendo las células acinares de las glándulas salivales, donde por último la rickettsia pasa por varios ciclos de replicación logarítmica19. En una segunda ronda de alimentación, y por lo general después de la muda (transmisión transestadial), las garrapatas secretan formas infecciosas de la rickettsia en su saliva mientras se alimentan, y de ese modo la transmiten18. Evidencias anteriores han demostrado que los machos adultos de R. microplus transferidos manualmente transmiten A. marginale4,20. Las ninfas y adultos jóvenes de R. microplus infectadas con A. marginale (larvas y ninfas incubadas en el laboratorio, a las que se permite la muda a la siguiente etapa) y transferidas manualmente a animales susceptibles fueron capaces de transmitir las cepas mexicanas de A. marginale de Aguascalientes y Yucatán, de alta y baja virulencia, respectivamente, en el laboratorio de la presente investigación21.
R. microplus es una garrapata de un solo huésped que pasa toda su vida parasítica en el mismo animal hasta que las hembras ingurgitadas se desprenden para poner sus huevos. Las garrapatas adultas machos pueden migrar de un huésped a otro, a través del contacto físico22,23. Su importancia como vectores de A. marginale entre diferentes animales no ha sido evaluada plenamente. Esta aparente ineficiencia de las garrapatas macho como transmisoras y la presencia de brotes de anaplasmosis al inicio de la temporada de las garrapatas ha llevado a proponer que las larvas de las garrapatas infectadas pueden adquirir la infección a través del ovario (transmisión transovárica). Así, cuando las larvas eclosionan, ya están infectadas y se convierten en vectores potenciales de A. marginale24. Otros esfuerzos experimentales para probar la transmisión transovárica en las garrapatas Dermacentor no han sido concluyentes25. En un esfuerzo por clarificar la transmisión transovárica en R. microplus, Shimada y sus colaboradores26 recolectaron larvas de R. microplus de potreros infectados durante los primeros cinco meses del año en Brasil y descubrieron que 7/50 muestras eran positivas cuando realizaron pruebas de detección de msp5 por PCR anidada (nPCR). En este mismo estudio, las garrapatas hembra ingurgitadas en un portador de A. marginale se incubaron a 18 ºC ó 28 ºC para la oviposición; 11 por ciento de las larvas de las garraptas ingurgitadas incubadas a 18 ºC y ninguna de las incubadas a 28 ºC resultaron positivas cuando se les realizó la prueba de detección de msp5 mediante nPCR. Sin embargo, estos autores no hacen referencia a una infestación de ganado susceptible con larvas con msp5 de ninguno de estos grupos para confirmar la transmisión a través de la alimentación26.
A la luz de estos hallazgos, se planteó la hipótesis de que las larvas de R. microplus pueden adquirir A. marginale de su progenitora ingurgitada con A. marginale (transmisión transovárica) cuando se la incuba a 18 ºC y, al alimentarse, transmiten la infección al ganado no infectado en condiciones de laboratorio.
Material y métodos
Declaración de ética
Este estudio fue aprobado por la rama del CENID-PAVET del Comité de Ética de Experimentación Animal del INIFAP y fue realizado tomando en cuenta los aspectos éticos y metodológicos de acuerdo con las normas mexicanas sobre el uso, alojamiento y transporte de animales para experimentación NOM-062-ZOO-1999.
Cepas de patógenos y de vectores
La cepa Anaplasma marginale Tlapacoyan-2 utilizada en este estudio fue recolectada originalmente en el Municipio de Tlapacoyan, en el estado mexicano de Veracruz, a partir de un brote natural, y se la ha caracterizado en relación con la región variable del gen msp1( y con el gen msp427. Se demostró que esta cepa es transmisible por machos adultos de R. microplus en el laboratorio del CENID-PAVET..
La colonia “Media Joya” de R. microplus se recolectó originalmente en el Municipio de Tapalpa, en el estado de Jalisco, México28,29, y se la mantiene rutinariamente a través de pases en novillos libres de enfermedades transmitidas por garrapatas en el CENID-PAVET. La colonia transmite eficientemente múltiples cepas de A. marginale, incluyendo la cepa Tlapacoyan-221. A fin de asegurarse de que la cepa esté libre de A. marginale, por rutina se somete a las garrapatas de cada generación a una prueba para verificar la ausencia de A. marginale mediante nPCR para detección del gen msp5 (véase abajo).
Se adquirieron cinco novillos de la cruza Bos Taurus de 12 meses de edad de un ganadero local del Municipio de Cuauhtémoc, en la parte oeste-centro del estado de Chihuahua, México, que está clasificada como libre de garrapata por el Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria de México (http://www.gob.mx/senasica/documentos/34495). Estos novillos fueron certificados como libres de tuberculosis y brucelosis por laboratorios certificados a nivel federal. Los animales estaban libres de garrapatas, así como de A. marginale según se certificó mediante una prueba de detección del gen msp5 por nPCR final. El novillo 027 fue el primero en ser adquirido, y los cuatro novillos restantes (1756, 1776, 6963 and 6964) fueron adquiridos posteriormente del mismo ganadero, para garantizar que todos ellos satisficieran las normas sanitarias establecidas por las autoridades mexicanas y las propias de esta investigación en relación con la edad y la ausencia de garrapatas y de enfermedades infecciosas transmitidas o no por las garrapatas.
Los laboratorios y los establos del CENID-PAVET se localizan en las afueras de la pequeña área urbana de Progreso, en el municipio de Jiutepec, Morelos, en el centro de México, dentro de los límites urbanos. Estas instalaciones están libres de garrapatas. Cuando los animales entran en las instalaciones, se exige la aplicación de tratamiento contra garrapatas, y todos los animales albergados en establos al aire libre son rociados periódicamente para controlar las moscas. Todos los animales utilizados en estos experimentos fueron albergados en la Unidad de Aislamiento de Ganado del CENID-PAVET, un establo de confinamiento libre de garrapatas y de moscas.
Infección del animal portador
Se inoculó al novillo 027, por vía intravenosa, una dosis de 8.2 x 109 de eritrocitos infectados con la cepa Tlapacoyan-2 de A. marginale preservada bajo nitrógeno líquido. La infección fue monitoreada, y el animal no requirió tratamiento. El novillo 027 permaneció como portador asintomático según las pruebas realizadas mediante examen al microscopio de láminas con sangre teñida con Giemsa y de detección del gen msp5 por nPCR, durante los 15 meses anteriores a la infestación con R. microplus para este estudio. El novillo 027 fue infestado con (aproximadamente 10,000) larvas maduras de R. microplus Media-Joya eclosionadas de 0.5 g para adquirir la infección mediante la alimentación. Veintiún (21) días después, hembras maduras ingurgitadas fueron recolectadas directamente del novillo 027, enjuagadas con agua destilada para eliminar el detritus, colocadas en cajas de Petri en grupos de diez e incubadas a un 80 % de humedad.
Incubación para la oviposición
Las hembras ingurgitadas fueron divididas en dos lotes diferentes para completar la oviposición como sigue: el primer lote se incubó a 18 ºC para la oviposición en un cuarto climatizada con variaciones máximas de 2 ºC. A fin de evitar las variaciones de temperatura por el uso regular del cuarto, las garrapatas se conservaron dentro de una pequeña hielera portátil, y se proporcionó una humedad del 80% mediante el uso de toallas húmedas controladas por medio de un hidrómetro Traceable( (Fisher Scientific). Se colocaron varias cajas de Petri a 28 ºC para la oviposición en una incubadora marca Nor-Lake Scientific (Nor-Lake LRF201WWW-0). La humedad se mantuvo con una saturación de 80 % como se describe. Una vez que se completó la oviposición, se juntaron masas de huevos de cada temperatura, se pesaron y se dividieron en lotes de 0.25 g y se mantuvieron en viales de vidrio de 5 ml cerrados con tapones de algodón. Ambos lotes de huevos se incubaron a una temperatura de 28 ºC y al 80% de humedad durante dos semanas hasta que las larvas eclosionaron. Se utilizaron (aproximadamente 5,000) larvas maduras de los lotes de huevos de 0.25 g para la transmisión a novillos intactos mediante la alimentación. Otras larvas maduras de los lotes de 0.25 g de las hembras mantenidas a temperaturas de 18 ºC y 28 ºC fueron congeladas para la posterior determinación e identificación del ADN de A. marginale mediante la amplificación de la región variable de los genes msp5 y msp1(.
Infección de novillos no infectados por transmisión durante la alimentación, monitoreo clínico y recolección de muestras
Cuatro novillos a los que no se extirpó el bazo fueron infestados con larvas maduras de lotes de huevos de 0.25 g; los novillos 1756 y 1776 fueron infestados con larvas de hembras ingurgitadas incubadas a una temperatura de 18 ºC, mientras que los novillos 6963 y 6964 fueron infestados con larvas ingurgitadas incubadas a 28 ºC.
Monitoreo clínico
El monitoreo clínico de los animales para experimentación incluyó un registro diario de la temperatura rectal (entre las 8 y las 9 de la mañana), recolección diaria de sangre con anticoagulante mediante venipunción de la vena caudal para el examen de laminillas de sangre teñida con Giemsa y evaluación del volumen de las células concentradas sedimentadas mediante el método microhematocrito y la amplificación del gen msp5 por nPCR y de la región variable del gen por PCR y secuenciación27.
Extracción de ADN, PCR, clonación y secuenciación
Se utilizaron larvas de hembras ingurgitadas incubadas a temperaturas de 18 ºC y 28 ºC para extraer el ADN genómico (ADNg). Se extrajeron larvas de masas de huevos de 100 mg de la manera siguiente: se pulverizaron larvas congeladas (a -70 ºC) utilizando un mortero congelado a -70 ºC. Las larvas pulverizadas fueron solubilizadas en 1M Tris-HCl, 0.5 M EDTA, solución de proteinasa K (1 mg/7 ml) y centrifugadas a 10,000 xg; se separó el sobrenadante del ADN con dos ciclos de alcohol fenol-cloroformo-isoamil y cloroformo. Los sobrenadantes se lavaron por etapas, primero con etanol absoluto y después con etanol al 70%. El ADN se hidrató en agua esterilizada destilada dos veces y desionizada y se mantuvo congelado a -20 ºC hasta su utilización.
Se centrifugaron muestras de sangre de los novillos infectados por transmisión alimentaria a 2,250 xg durante 15 min a 4 °C: se desechó el plasma y la capa leuco-plaquetaria. El ADNg se extrajo por medio de un kit comercial (Kit UltraClean® BloodSpin® para aislamiento de ADN, Laboratorios MO-BIO), siguiendo las instrucciones del fabricante. Se mantuvo el ADNg a -20 ºC hasta su utilización.
Se analizaron muestras de ADN de la sangre y larvas para detector el gen msp5 como un indicador universal de A. marginale mediante PCR anidada utilizando el iniciador directo 5’-GCATAGCCTCCGCGTCTTTC -3’y el iniciador reverso 5’-TCCTCGCCTTGCCCTCAGA-3’ en la primera ronda de amplificación, y el iniciador directo 5’-TACACGTGCCCTACCGACTTA-3’ y el iniciador reverso 5’-TCCTCGCCTTGCCCTCAGA-3’ en la segunda ronda, como se describe30. Se corrió la prueba por nPCR en dos rondas en un volumen final de 25 µl con un kit comercial (muestra maestra de PCR, sistema Promega, Madison, WI, EEUUA) en un Termociclador T-Profesional (Biometra, Alemania), 0.1 - 1 ng de ADN y cebadores (10 pM). Las condiciones de ciclaje para el gen msp5 fueron una etapa de precalentamiento a 95 °C durante 3 min y 35 ciclos de 95 °C durante 30 s, 65 °C durante 58 s, y 72 °C durante 30 s con una última etapa de extensión a 72 °C durante 10 min.
Se analizaron muestras en las que se comprobó la presencia de msp5 en la nPCR para la región variable del gen por PCR (cebador directo: 5’ -GTGCTTATGGCAGACATTTCC-3’ y cebador reverso 5’-CTCAACACTCGCAACCTTGG-3’)27,31 para la verificación de cepas. Para la región variable del gen msp1α las condiciones de ciclaje fueron una etapa de precalentamiento a 95 ºC durante 3 min y 35 ciclos de 60 s, 58 ºC 60 s, 72 ºC 60 s, y una extensión final a 72 ºC durante 10 min. Los productos de la nPCR y la PCR se separaron en gel de agarosa al 2% después de una electroforesis en tampón 1x TAE y tinción con bromuro de etidio al 0.015% a 100 voltios. Se clonaron productos de la PCR de la región variable del gen msp1α en el plásmido pJet1.2 utilizando un kit CloneJet para clonación de PCR (Thermo Fisher Scientific), y se transformaron células competentes TOP10 E. coli con construcciones según las instrucciones del fabricante. Se cultivaron colonias positivas en LB+ampicilina (100 mg/ml) y se aisló el plásmido ADN utilizando el kit Wizard® Plus SV Minipreps (Promega, Madison WI, EEUUA). Se secuenció el plásmido de ADN de al menos tres colonias aisladas para determinar la secuencia consenso. Las secuencias de ADN derivadas de la secuenciación Sanger se analizaron con el editor de plásmido ApE v2.0.47. Las secuencias de consenso se alinearon con ClustalW (http://www.clustal.org/).
Resultados
Infección inicial con Anaplasma marginale y su adquisición mediante la alimentación
La inoculación intravenosa del novillo 027 con la cepa Tlapacoyan-2 de A. marginale dio como resultado frotis sanguíneos positivos y signos clínicos leves de anaplasmosis (temperatura rectal de 39 ºC, depresión, pérdida de apetito y anemia), llegando a una rickettsemia máxima del 3.2 % y a una pérdida del 50 % del volumen celular aglomerado para el día 25. No se requirió quimioterapia, y el novillo 027 regresó a los valores clínicos normales dentro de un periodo de 2 semanas después del inicio de la infección. El novillo 027 permaneció como un portador subclínico durante los 15 meses siguientes, como se corroboró mediante pruebas periódicas de la amplificación del gen msp5 mediante nPCR. El novillo 027 fue infestado con larvas maduras de R. microplus negativas a A. marginale según se ha determinado mediante la PCR para detectar el gen msp5, para fines de infección por adquisición mediante la alimentación. Las hembras ingurgitadas recolectadas en el día 21 e incubadas en a 28 ºC completaron la oviposición para el día 15 periodo que se considera normal. En cambio, las hembras ingurgitadas recolectadas al mismo tiempo, pero incubadas a 18 ºC tardaron más de 30 días en completar la oviposición. Independientemente de la temperatura a la que se incubaron las madres, las larvas de ambos lotes terminaron de eclosionar dentro de un periodo de 15 días después de la oviposición.
Transmisión mediante la alimentación
Los novillos fueron infestados con larvas de R. microplus de hembras ingurgitadas incubadas a 18 ºC (novillos 1756 y 1776) y a 28 ºC (novillos 6963 y 6964), respectivamente. Se permitió a las larvas maduras no alimentadas alimentarse de los novillos designados y alcanzar así la etapa adulta. Ninguno de los cuatro novillos desarrolló signos clínicos de anaplasmosis ni exhibió eritrocitos infectados en la evaluación microscópica de los frotis sanguíneos durante este periodo. Ocho semanas después de la infestación, los cuatro animales fueron sometidos a una esplenectomía experimental para ocasionar la inmunosupresión e inducir una rickettsemia. El novillo 6964 (larvas ovipositadas a 28 ºC) desarrolló un 7.5 % de ricketssemia detectable mediante microscopía registrada 2 días después de la realización de la esplenectomía, momento en el que el animal recibió un tratamiento específico (oxitetraciclina 20 mg/kg durante 10 días consecutivos). A pesar de la esplenectomía, ninguno de los otros tres novillos desarrolló una ricketssemia detectable mediante el microscopio. Amplificación del gen msp5 por nPCR corroboró la presencia A. marginale en los novillos 6964 y 6963, pero no lo amplificó en la sangre de los novillos 1756 y 1776 (Figura 1).
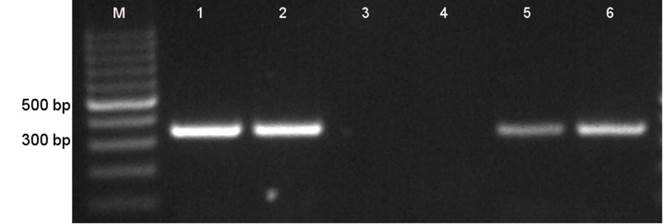
M. Indicador del peso molecular; 1, Cepa original Tlapacoyan-2 congelado; 2, novillo 027; 3, novillo 1756; 4, novillo 1776; 5, novillo 6963; 6, novillo 6964
Figura 1 Detección del gen msp5 de Anaplasma marginale msp5 por nPCR. Los productos de la nPCR fueron separados mediante electroforesis en gel de agarosa al 1%
A fin de corroborar que la cepa Tlapacoyan-2 era el mismo patógeno que infectó a los novillos 027, 6964 y 6963, se analizaron muestras de sangre de éstos, una muestra de la cepa original criopreservada y larvas de garrapatas incubadas a 28 °C para detectar la región variable del gen msp1(. La Figura 2 muestra un producto de PCR amplificado de 750 bp (carril 2) para el estabilato de la cepa Tlapacoyan-2 criopreservado, de acuerdo con la secuencia reportada27; (GenBank, número JN564641.1). Una banda con el mismo peso molecular aparente estuvo presente en todas las demás muestras sometidas a pruebas de detección de la región variable del gen msp1( en las muestras de sangre de los novillos 027 (carril 3, 6964 (carril 5) y 6963 (carril 6) y en las larvas de R. microplus de las garrapatas ingurgitadas incubadas a 28 ºC (carril 4).

Panel A; M, indicador del peso molecular; carril 1, (-) testigo; carril 2(+) sangre infectada con la cepa testigo Mex-31; carril 3, sangre infectada con la cepa Tlapacoyan-1; carril 4, sangre infectada con la cepa Tlapacoyan-2. Panel B: carril 1, estabilato criopreservado de la cepa Tlapacoyan-2; carril 2, muestra de sangre del novillo 027; carril 3, muestra de sangre del novillo 6963 a la semana 9; larvas de garrapatas R. microplus ingurgitadas incubadas a 28º C, y carril 5, muestra de sangre del novillo 6964 a la semana 9.
Figura 2 PCR específica para la región variable del gen msp1(
Todas las secuencias derivadas de la sangre o de larvas fueron idénticas para la región variable del gen msp1( de la cepa Tlapacoyan-2 según se informó27. Este hallazgo es congruente con la hipótesis de que las larvas de garrapatas ingurgitadas adquieren la infección de sus madres y son capaces de transmitirla a huéspedes no infectados. No se demostró (mediante PCR o frotis sanguíneo) la presencia de A. marginale en las larvas de las garrapatas R. microplus ingurgitadas incubadas a 18 ºC ni en los novillos infestados con éstas.
Discusión
La transmisión intraestadial y transestadial de A. marginale durante las etapas parasíticas del vector han sido ampliamente documentadas en las garrapatas Dermacentor y Rhipicephalus4,32,33. También se ha documentado el papel de las garrapatas R. microplus como el vector biológico más importante de Anaplasma marginale en aquellas áreas en que las garrapatas Dermacentor no están presentes4. Sin embargo, los esfuerzos para documentar la transmisión transovárica no han sido exitosos o concluyentes.
En Madagascar se realizaron infestaciones escalonadas en becerros esplenectomizados con larvas no alimentadas de garrapatas ingurgitadas alimentadas con la sangre de ganado infectado con Babesia bovis, B. bigemina, A. marginale y otros patógenos transmitidos a través de la sangre34) . En estos becerros esplenectomizados se demostró una infección patente con B. bovis y B. bigemina, pero no con A. marginale. En dos estudios diferentes realizados en Australia, se utilizaron larvas de garrapatas ingurgitadas infectadas mediante la alimentación solamente durante cuatro días, o a los días cuatro y 15, respectivamente, después de haber eclosionado23,35; en ambos casos, las hembras ingurgitadas fueron incubadas a una temperatura de 28 ºC hasta completar la oviposición. No se corroboró infección con A. marginale en ninguno de estos trabajos. Un estudio realizado en Colombia36 reportó la transmisión de anaplasmosis a becerros no infectados de 6 meses de edad por larvas de garrapatas que adquirieron experimentalmente la infección al alimentarse. Estos autores reportaron que la transmisión también ocurrió cuando se infestó a un novillo no esplenectomizado con larvas de segunda generación. Sin embargo, no se describieron las condiciones de alojamiento del ganado para este estudio. Recientemente se documentó en el Brasil26 la presencia de ADN de A. marginale en la progenie larval de garrapatas ingurgitadas recolectadas de potreros con anaplasmosis endémica y larvas no alimentadas de hembras alimentadas experimentalmente con sangre de becerros infectados de Anaplasma. No obstante, los autores de ese estudio no mostraron evidencias de la infestación de ganado susceptible con larvas con presencia del gen msp5 verificada mediante la PCR.
A fin de determinar la transmisión transovárica de A. marginale se han reportado una serie de condiciones de oviposición, tiempo de maduración de las “larvas infectadas”, valores variables de rickettsemia observable en donadores natural o experimentalmente infectados, uso de receptores intactos y esplenectomizados de larvas no alimentadas e incluso ubicaciones donde se llevaron a cabo los estudios.
Para garantizar que los animales experimentales estuvieran libres de A. marginale, fueron adquiridos de un área libre de garrapatas y fueron sometidos a pruebas de PCR y serológicas en el momento de la compra y justo antes de infectarlos o infestarlos. Las condiciones de alojamiento de los novillos experimentales en este estudio impidieron la transmisión de rickettsia entre ellos o del novillo portador (027) a través de moscas o de garrapatas. En un intento de replicar las condiciones naturales, se alimentó a garrapatas de un portador bovino sin rickettsemia detectable en el momento de la adquisición del patógeno por las garrapatas progenitoras. Se eligieron las temperaturas convencionales de 18 ºC y 28 ºC para la oviposición, dado que según los reportes la transmisión podía darse a cualquiera de estas temperaturas26.
La hipótesis original postulaba que la incubación de garrapatas ingurgitadas a 18 ºC prolongaba el periodo de oviposición de tal manera que permitía al A. marginale alcanzar e infectar el ovario y por ende a la progenie. Como en los resultados anteriores, la incubación a 18 ºC prolongó dos veces el periodo de oviposición en comparación con la incubación a la temperatura convencional de 28º C37.
También se confirmó la presencia de ADN de A. marginale en la progenie de garrapatas infectadas mediante la alimentación incubadas a 28 ºC, pero no en las larvas de garrapatas incubadas a 18 ºC. Como corresponde a la presencia de ADN de A. marginale en estas larvas, se encontró que uno de los dos novillos infestados con larvas de garrapatas incubadas a 28 ºC desarrolló una rickettsemia observable en frotis sanguíneos (6964) dos días después de la esplenectomía. El novillo 6963, también infestado con las mismas larvas, dio positivo en la nPCR para la detección del gen msp5.
Se planteó la hipótesis de que la infestación con larvas de las garrapatas incubadas a 18 ºC transmitiría la rickettsia; sin embargo, estos resultados muestran que estas larvas no indujeron una rickettsemia patente, mientras que las larvas de las garrapatas incubadas a 28 ºC sí lo hicieron. No obstante, los resultados concuerdan con los de otros que utilizaron larvas de garrapatas hembras ingurgitadas alimentadas de la sangre de ganado infectado, las cuales lograron infectar a becerros susceptibles de 6 meses de edad36.
No se sabe por qué la transmisión se logró sólo con las larvas de hembras incubadas a 28 y no de las de las madres incubadas a 18 ; sin embargo, la evidencia de nuestro estudio y de otros en los que no hubo transmisión o se logró infección parecen señalar hacia un fenómeno que puede darse bajo la influencia de muchas variables, incluyendo la cepa de las garrapatas, la cepa de la rickettsia y, muy probablemente, la conformación genética del huésped y no sólo con base en la temperatura a la que las garrapatas ingurgitadas depositan sus huevos.
Este es el primer estudio en el cual se caracterizó la presencia de ADN de A. marginale en las larvas y en el ganado no infectado infestado como lo mismo, lo que indica que ocurrió la transmisión de las larvas no alimentadas al ganado susceptible. La posibilidad de utilizar una cepa 73 β β β γ msp1α facilitó el seguimiento de la infección a lo largo del experimento. Nuestros resultados confirmaron que la cepa Tlapacoyan-2 era el mismo organismo que se encontró en el portador, las larvas y los novillos de este experimento.
A la luz de evidencias anteriores, se considera que estos resultados apoyan el argumento de que el Anaplama marginale se transmite transováricamente a través de las garrapatas R. microplus y que estas larvas fueron capaces de transmitir la rickettsia a un huésped mamífero. Aún hay muchas preguntas que contestar; se tendrán que realizar muchos más estudios para responderlas. Mientras tanto, y según estos resultados, es importante que se considere la transmisión transovárica de Anaplasma marginale dentro del ciclo de vida de este patógeno.
Agradecimientos
Este estudio fue financiado por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), bajo el acuerdo SIGI 1128119998, y por el Consejo Nacional de Ciencia y Tecnología (CONACyT), bajo el acuerdo No. 168167. Las fuentes de financiamiento dieron apoyo financiero para la realización de la investigación y la preparación del manuscrito. Sin embargo, hacemos constar que el contenido de este manuscrito es responsabilidad exclusivamente de los autores. Deseamos expresar nuestro agradecimiento al Dr. Enrique Reynaud Garza, del Instituto de Biotecnología de la Universidad Nacional Autónoma de México, por el uso de su sala climatizada.
REFERENCIAS
1. Brites-Neto J, Duarte KM, Martins TF. Tick-borne infections in human and animal population worldwide. Vet World 2015;8(3):301-15. [ Links ]
2. de la Fuente J, Estrada-Pena A, Venzal JM, Kocan KM, Sonenshine DE. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front Biosci 2008;13:6938-6946. [ Links ]
3. Rodríguez-Vivas RI, Grisi L, Pérez de León AA, Silva-Villela H, Torres-Acosta JF, Fragoso Sánchez H, et al. Potential economic impact assessment for cattle parasites in Mexico. Rev Mex Cienc Pecu 2017;8(1):61-74 [ Links ]
4. Aguirre DH, Gaido AB, Vinabal AE, De Echaide ST, Guglielmone AA. Transmission of Anaplasma marginale with adult Boophilus microplus ticks fed as nymphs on calves with different levels of rickettsaemia. Parasite 1994;1(4):405-407. [ Links ]
5. Mahoney DF, Mirre GB. The selection of larvae of Boophilus microplus infected with Babesia bovis (syn B. argentina). Res Vet Sci 1977;23(1):126-127. [ Links ]
6. Rodríguez SD, García-Ortiz MA, Jiménez-Ocampo R, Vega-y-Murguía CA. Molecular epidemiology of bovine anaplasmosis with a particular focus in Mexico. Infect Genet Evol 2009;9:1092-1101. [ Links ]
7. Aubry P, Geale DW. A review of bovine anaplasmosis. Transbound Emerg Dis 2011;58:1-30. [ Links ]
8. Kocan KM, de la Fuente J, Blouin EF, Coetzee JF, Ewing SA. The natural history of Anaplasma marginale. Vet Parasitol 2010;167(2-4):95-107. [ Links ]
9. Allen PC, Kuttler KL, Amerault TE. Clinical chemistry of anaplasmosis: blood chemical changes in infected mature cows. Am J Vet Res 1981;42(2):326-328. [ Links ]
10. Carreño AD, Alleman AR, Barbet AF, Palmer GH, Noh SM, Johnson CM. In vivo endothelial cell infection by Anaplasma marginale. Vet Pathol 2007;44(1):116-118. Erratum in: Vet Pathol 2007;44(3):427. [ Links ]
11. Magonigle RA, Newby TJ. Elimination of naturally acquired chronic Anaplasma marginale infections with a long-acting oxytetracycline injectable. Am J Vet Res 1982;43(12):2170-2172. [ Links ]
12. Reinbold JB, Coetzee JF, Hollis LC, Nickell JS, Riegel C, Olson KC, et al. The efficacy of three chlortetracycline regimens in the treatment of persistent Anaplasma marginale infection. Vet Microbiol 2010;145:69-75. [ Links ]
13. Palmer GH, Brayton KA. Antigenic variation and transmission fitness as drivers of bacterial strain structure. Cell Microbiol 2013;15(12):1969-1975. [ Links ]
14. Reinbold JB, Coetzee JF, Hollis LC, Nickell JS, Riegel CM, Christopher JA, et al. Comparison of iatrogenic transmission of Anaplasma marginale in Holstein steers via needle and needle-free injection techniques. Am J Vet Res 2010;71:1178-1188. [ Links ]
15. Scoles GA, Broce AB, Lysyk TJ, Palmer GH. Relative efficiency of biological transmission of Anaplasma marginale (Rickettsiales: Anaplasmataceae) by Dermacentor andersoni (Acari: Ixodidae) compared with mechanical transmission by Stomoxys calcitrans (Diptera: Muscidae). J Med Entomol 2005;42(4):668-675. [ Links ]
16. Futse JE, Ueti MW, Knowles DP Jr, Palmer GH. Transmission of Anaplasma marginale by Boophilus microplus: retention of vector competence in the absence of vector-pathogen interaction. J Clin Microbiol 2003;41(8):3829-3834. [ Links ]
17. Kocan KM, Goff WL, Stiller D, Edwards W, Ewing SA, Claypool PL, et al. Development of Anaplasma marginale in salivary glands of male Dermacentor andersoni. Am J Vet Res 1993;54(1):107-112. [ Links ]
18. Ueti MW, Reagan JO Jr, Knowles DP Jr, Scoles GA, Shkap V, Palmer GH. Identification of midgut and salivary glands as specific and distinct barriers to efficient tick-borne transmission of Anaplasma marginale. Infect Immun 2007;75(6):2959-2964. [ Links ]
19. Scoles GA, Ueti MW, Noh SM, Knowles DP, Palmer GH. Conservation of transmission phenotype of Anaplasma marginale (Rickettsiales: Anaplasmataceae) strains among Dermacentor and Rhipicephalus ticks (Acari: Ixodidae). J Med Entomol 2007;44(3):484-491. [ Links ]
20. Dalgliesh RJ, Stewart NP. The use of tick transmission by Boophilus microplus to isolate pure strains of Babesia bovis, Babesia bigemina and Anaplasma marginale from cattle with mixed infections. Vet Parasitol 1983;13(4):317-323. [ Links ]
21. Mora C, Pérez M, García-Ortiz MA, Rojas-Ramírez EE, Preciado-de -la-Torre JF, Hernández R, et al. Evaluación de la transmisión de dos cepas mexicanas de Anaplasma marginale por la garrapata Boophilus microplus, in: XIII Congreso Lationamericano de Buiatría. 2007:241-245. [ Links ]
22. Mason CA, Norval RAI. The transfer of Boophilus microplus (Acarina: Ixodidae) from infested to uninfested cattle under field conditions. Vet Parasitol 1981;8:185-188. [ Links ]
23. Connell M, Hall WT. Transmission of Anaplasma marginale by the cattle tick Boophilus microplus. Aust Vet J 1972;48(8):477. [ Links ]
24. Piercy PL. Transmission of anaplasmosis. Ann NY Acad Sci 1956;64:40-48. [ Links ]
25. Stich RW, Kocan KM, Palmer GH, Ewing SA, Hair JA, Barron SJ. Transstadial and attempted transovarial transmission of Anaplasma marginale by Dermacentor variabilis. Am J Vet Res 1989;50(8):1377-1380. [ Links ]
26. Shimada MK, Yamamura MH, Kawasaki PM, Tamekuni K, Igarashi M, Vidotto O, et al. Detection of Anaplasma marginale DNA in larvae of Boophilus microplus ticks by polymerase chain reaction. Ann N Y Acad Sci 2004;1026:95-102. [ Links ]
27. Jiménez-Ocampo R, Vega y Murguía CA, Oviedo N, Rojas-Ramírez EE, García-Ortiz MA, Preciado-de-la-Torre JF, et al. Genetic diversity of the msp1( gene variable region and msp4 gene of Anaplasma marginale strains from Mexico. Rev Mex Cienc Pecu 2012;3:373-387. [ Links ]
28. Gaxiola-Camacho S, García-Vázquez Z, Cruz-Vázquez C, Portillo-Loera J, Vázquez-Peláez C, Quintero-Martínez MT, et al. Comparison of efficiency and reproductive aptitude indexes between a reference and field strains of the cattle tick Rhipicephalus (Boophilus) microplus, in Sinaloa, Mexico. Rev Bras Parasitol Vet 2009;18(4):9-13. [ Links ]
29. Merino O, Antunes S, Mosqueda J, Moreno-Cid JA, Pérez de la Lastra JM, Rosario-Cruz R, et al. Vaccination with proteins involved in tick-pathogen interactions reduces vector infestations and pathogen infection. Vaccine 2013;31(49):5889-5896. [ Links ]
30. Torioni de Echaide S, Knowles DP, McGuire TC, Palmer GH, Suarez CE, McElwain TF. Detection of cattle naturally infected with Anaplasma marginale in a region of endemicity by nested PCR and a competitive enzyme-linked immunosorbent assay using recombinant major surface protein 5. J Clin Microbiol 1998;36(3):777-782. [ Links ]
31. Palmer GH, Knowles DP Jr, Rodriguez JL, Gnad DP, Hollis LC, Marston T, et al. Stochastic transmission of multiple genotypically distinct Anaplasma marginale strains in a herd with high prevalence of Anaplasma infection. J Clin Microbiol 2004;42(11):5381-5384. [ Links ]
32. Corrier DE, Kuttler KL, Terry MK. Observations on anaplasmosis following field exposure to heavy and light infestations with Boophilus microplus. Vet Parasitol 1983;13,187-190. [ Links ]
33. Rogers RJ, Shiels IA. Epidemiology and control of anaplasmosis in Australia. J S Afr Vet Assoc 1979;50(4):363-366. [ Links ]
34. Uilenberg G [Note on babesisasis and anaplasmosis in cattle on Madagascar. I. Introduction. Transmission]. Rev Elev Med Vet Pays Trop 1968;21(4):467-474. [ Links ]
35. Leatch G. Preliminary studies on the transmission of Anaplasma marginale by Boophilus microplus. Aust Vet J 1973;49:16-19. [ Links ]
36. López-Valencia G, Vizcaíno-Gerdts O. Transmisión transovárica de Anaplasma marginale por la garrapata Boophilus microplus. Rev ICA Colombia 1992;27:437-443. [ Links ]
37. Esteves E, Pohl PC, Klafke GM, Reck J, Fogaça AC, Martins JR, et al. Low temperature affects cattle tick reproduction but does not lead to transovarial transmission of Anaplasma marginale. Vet Parasitol 2015;214(3-4):322-326. [ Links ]
Recibido: 15 de Agosto de 2018; Aprobado: 30 de Enero de 2019











 texto em
texto em 


