Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.11 no.1 Mérida ene./mar. 2020 Epub 11-Jun-2020
https://doi.org/10.22319/rmcp.v11i1.4757
Artículos
Producción in vitro de embriones porcinos con el uso de un sistema de medios de cultivo químicamente semi-definidos
a Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Centro Nacional de Recursos Genéticos. Blvd. de la Biodiversidad Nº 400, Tepatitlán de Morelos, Jalisco. CP 47600, México.
bINIFAP, oficinas centrales. Ciudad de México, México.
El objetivo del estudio fue determinar el efecto de un sistema de medios de cultivo desarrollado en laboratorio, denominado Sistema de Medios para Cerdo (PMS por sus siglas en inglés), sobre la producción in vitro de embriones porcinos. En el primer ensayo, los complejos ovocito-células del cúmulo (COCs) fueron madurados, fertilizados y cultivados en PMS suplementado con albúmina sérica bovina (en inglés, BSA), y en un medio desarrollado por la Universidad de Carolina del Norte-23 (NCSU-23 por sus siglas en inglés) suplementado con fluido folicular hasta la evaluación de blastocisto. En el segundo ensayo, la maduración y cultivo fueron realizadas en PMS con BSA o alcohol polivinil (PVA en inglés) en un arreglo factorial 2x2 (PMS-BSA/BSA, PMS-BSA/PVA, PMS-PVA/PVA, PMS-PVA/BSA). El PMS tuvo un efecto positivo sobre el número de células totales (58.04) y la disminución de lípidos totales (49.4 %) con respecto al medio NCSU-23 (37.98 y 59.2% respectivamente; P<0.05). el porcentaje de fertilización monoespérmica fue significativamente más baja (42.3 %; P<0.05) cuando los ovocitos fueron madurados en PMS-BSA comparado con PMS-PVA (52.6 %). La suplementación de BSA en el PMS para cultivo embrionario, incrementó el desarrollo hasta blastocisto y el número de células del blastocisto, y disminuyó los lípidos totales (36.8 %, 46.9 y 49.6 % respectivamente; P<0.05), en comparación con la suplementación de PVA en el PMS para cultivo embrionario. Estos resultados sugieren que el sistema de medios de cultivo desarrollados por el Centro Nacional de Recursos Genéticos (CNRG), tienen un efecto favorable sobre el número de células totales y disminuyen los lípidos totales de blastocistos porcinos producidos in vitro.
Palabras clave Medios de cultivo; Cerdos; Embriones; Producción in vitro
The objective of this study was to determine the effect of a semi-defined culture media system developed in laboratory, named Pigs Media System (PMS) on the in vitro production of porcine embryos. In a first assay, the cummulus-oocytes complexes (COCs) were matured, fertilized and cultured for embryo development in PMS supplemented with bovine serum albumin (BSA), and in North Carolina State University-23 (NCSU-23) supplemented with follicular fluid, until blastocysts evaluation. In the assay 2, maturation and culture were performed in PMS using BSA or polyvinyl alcohol (PVA) in a 2 × 2 factorial arrangement (PMS-BSA/BSA, PMS-BSA/PVA, PMS-PVA/PVA, PMS-PVA/BSA). The PMS had a positive effect on the total cell number (58.04) and the decrease of the total lipids (49.4 %) regarding the NCSU-23 medium (37.98 and 59.2 % respectively; P<0.05). The percentage of monospermic fertilization was significantly lower (42.3 %; P<0.05) when oocytes were matured with PMS-BSA than in PMS-PVA (52.6 %). The supplementation of BSA in the PMS for embryo culture, increased the blastocyst development, the cell number of blastocysts and decreased the content of total lipids (36.8 %, 46.9 and 49.6 % respectively; P<0.05), in comparison with the supplementation of PVA in the PMS for embryo culture. These results suggest that the semi-defined culture media system developed by the National Genetic Resources Center (CNRG), have proved favorable effects on the total cell number and the decrease of total lipids of porcine blastocysts in vitro produced.
Key words Culture media; Pigs; Embryo; In vitro production
Introducción
Durante muchos años, la producción in vitro de embriones porcinos ha sido objeto de estudio de múltiples investigaciones, y si bien actualmente varios grupos de investigadores están trabajando en esta técnica, la tasa de éxito sigue siendo baja, especialmente en comparación con otras especies1. Ello dificulta los avances en la implementación de esta técnica en las unidades de producción, lo cual limita su uso a los fines de investigación.
La baja tasa de desarrollo de embriones porcinos producidos in vitro puede deberse a condiciones de cultivo inadecuadas y a la elevada incidencia de la poliespermia1,2,3. Actualmente, el medio estándar para producir embriones in vitro es el de la Universidad de Carolina del Norte (NCSU)-23 o el NCSU-27, suplementado con líquido folicular para la maduración (medio químicamente indefinido)4.
Un medio de cultivo definido o semi-definido elimina los factores desconocidos presentes en los materiales biológicos, tales como el líquido folicular, el suero bovino fetal o la albúmina sérica, y el uso de estos medios para la producción in vitro de embriones han logrado avances importantes. Además, el uso de medios definidos y semi-definidos facilita la evaluación fisiológica de sustancias en la maduración, la fertilización y el desarrollo embrionario; incrementa la confiabilidad de los medios y permite una alta repetibilidad y reproducibilidad de los resultados5. Algunos sustratos pueden remplazar los materiales biológicos en los medios de cultivo; ejemplos de estos son el alcohol polivinil (PVA), el ácido hialurónico, la albúmina sérica bovina (BSA) libre de ácidos grasos, la albúmina recombinante y el suero sintético.
El objetivo de este estudio fue determinar el efecto de un sistema de medios de cultivo semi-definidos desarrollado en el Centro Nacional de Recursos Genéticos (CNRG), denominado Sistema de Medios para Cerdos (PMS), en la producción in vitro de embriones porcinos.
Material y métodos
El estudio se llevó a cabo en el CNRG, en el Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP) ubicado en Tepatitlán de Morelos, Jalisco, México. Se desarrolló un sistema de medios de cultivo semi-definidos llamado PMS para la producción in vitro de embriones porcinos que consiste en las siguientes soluciones: medio de lavado pre-maduración de ovocitos (H-PMS-M), medio de maduración (PMS-M), medio de lavado pre-fertilización de ovocitos (H-PMS-F), medio de fertilización (PMS-F), medio de pre-cultivo embrionario 1 para lavado de cigotos (H-PMS-E1), medio de cultivo embrionario 1 (PMS-E1), medio de pre-cultivo embrionario 2 para lavado de (H-PMS-E2) y medio de cultivo embrionario 2 (PMS-E2) (Cuadro 1). El PMS se suplementó con 0.4% de BSA libre de ácidos grasos. Todas las sustancias químicas utilizadas en este estudio se adquirieron en la compañía Sigma-Aldrich (St. Louis, MO, USA). Los medios de cultivo se prepararon utilizando agua ultra-pura. La osmolaridad de los medios fue de entre 270 y 290 miliosmoles (mOsm), y el pH se ajustó a 7.4.
Cuadro 1 Composición de los medios de cultivo PMS para la producción in vitro de embriones porcinos
| Componente (mM) | H-PMS- M |
PMS-M | H-PMS-F | PMS-F | H-PMS- E1 |
PMS-E1 | H-PMS-E2 | PMS- E2 |
|---|---|---|---|---|---|---|---|---|
| NaCl | 100 | 94 | 97 | 94 | 100 | 94 | 100 | 94 |
| KCl | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| KH2PO4 | 1.2 | 1.2 | - | - | 1.2 | 1.2 | 1.2 | 1.2 |
| MgSO4 7H2O | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| Glucosa | 5.6 | 5.6 | 5.6 | 5.6 | - | - | 5.6 | 5.6 |
| Alanina-Glutamina | 1.9 | 1.9 | 1.9 | 1.9 | 1.9 | 1.9 | 1.9 | 1.9 |
| Arginina | 0.104 | 0.104 | 0.104 | 0.104 | 0.104 | 0.104 | 0.104 | 0.104 |
| NaHCO3 | 5 | 25 | 5 | 25 | 5 | 25 | 5 | 25 |
| HEPES | 20 | - | 20 | - | 20 | - | 20 | - |
| Piruvato de Na | - | - | 2 | 2 | 0.33 | 0.33 | - | - |
| Lactato de Na | - | - | - | - | 4.5 | 4.5 | - | - |
| Melatonina (µM) | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 |
| CaCl2 2H2O | 1.7 | 1.7 | 7 | 7 | 1.7 | 1.7 | 1.7 | 1.7 |
| Cafeína | - | - | 2 | 2 | - | - | - | - |
| Taurina | 7 | 7 | - | - | 7 | 7 | 7 | 7 |
| Hipotaurina | 5 | 5 | - | - | 5 | 5 | 5 | 5 |
| AANE* ml/L | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| AAE* ml/L | - | 20 | - | - | - | - | 20 | 20 |
| β-mercaptoetanol | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 | 0.05 |
| Cisteína | - | 0.6 | - | - | - | - | - | - |
| EGF* (ng/ml) | - | 10 | - | - | - | - | - | - |
| Osmolaridad | 287 | 286 | 283 | 287 | 291 | 289 | 288 | 286 |
* AANE= aminoácidos no esenciales; AAE= aminoácidos esenciales; BSA= albúmina de suero bovino; FCE= Factor de crecimiento epidérmico.
Recolección de ovocitos y su maduración in vitro
Se obtuvieron ovocitos de ovarios recolectados de cerdas nulíparas en el rastro local y se les transportó en una solución salina al 0.9%, a una temperatura de 35 °C. Folículos ováricos de entre 3 y 6 mm fueron recolectados y aspirados con una aguja de calibre 18 y una jeringa de 10 ml. Se seleccionaron los COCs con una masa compacta de células del cúmulo y un citoplasma uniformemente granulado y oscuro, los cuales se lavaron en H-PSM-M. Los COCs se cultivaron en 1 ml de medio de maduración en una placa de Petri de cuatro depósitos (Nunc, Roskilde, Dinamarca) durante 22 h con 0.5 μg/ml de LH, 0.5 μg/ml de FSH y 1 milimol (mM) de dibutiril-cAmp, y posteriormente, durante 22 h en el mismo medio, pero sin hormonas ni dibutiril-cAmp, a una temperatura de 38.5 °C con 5% de CO2 en el aire.
Fertilización in vitro
Después de la maduración, 30 COCs fueron colocados en 90 μl de medio de fertilización y cubiertos con aceite mineral hasta la fertilización. Se descongeló semen congelado durante 30 seg en agua a 37 °C y se centrifugó (700 ×g por 20 min) en gradiente de Percoll 45/90. El paquete celular de espermatozoides fue resuspendido y lavado por centrifugación (400 ×g por 5 min) con un medio de fertilización. Los COCs se cultivaron durante 3 h con los espermatozoides a una concentración final de 5×105 células/ml a una temperatura de 38.5 °C con 5% de CO2 en el aire.
Cultivo embrionario
Los presuntos cigotos fueron retirados del medio de fertilización y lavados, y 10 cigotos se colocaron en 90 μl de un medio de cultivo temprano y cultivados durante 48 h a una temperatura de 38.5 °C con 5% de CO2, 5% de O2 y 90 % de N2. Posteriormente se transfirieron los embriones a un medio de cultivo tardío, donde permanecieron durante 120 h bajo las condiciones anteriores.
Evaluación de la maduración nuclear, activación y fertilización
Después de la maduración algunos ovocitos fueron retirados de las células del cúmulo y fijados con 25% (v/v) de ácido acético y etanol durante 48 a 72 h. Las muestras se tiñeron con aceto-orceína al 1% (w/v) y el porcentaje de ovocitos maduros (ovocitos en metafase II y primer cuerpo polar formado) se evaluó con un microscopio de campo claro. Diez horas después de la fertilización algunos presuntos cigotos fueron retirados de las células del cúmulo, fijados, teñidos y evaluados, como se mencionó. Las variables medidas fueron: porcentaje de ovocitos penetrados (la proporción del total de ovocitos que tienen el pronúcleo femenino y uno o varios núcleos espermáticos penetrados o pronúcleos masculinos; se consideró a los pronúcleos con cola espermática como masculinos); monoespermia (la proporción de ovocitos con penetración monoespermática que tenían un pronúcleo femenino y un masculino); poliespermia (la proporción de ovocitos con un solo pronúcleo femenino y múltiples núcleos espermáticos penetrados o pronúcleos masculinos), y formación de pronúcleos masculinos (la proporción de ovocitos con formación de pronúcleos masculinos).
Evaluación del desarrollo embrionario
Se evaluaron las siguientes variables del desarrollo embrionario: porcentaje de embriones divididos a las 48 h y desarrollo de blastocistos a las 120 h por observación bajo microscopio invertido (200X); se contó el número total de células de blastocistos utilizando la tinción Hoechst-33342 en un microscopio Eclipse 200 equipado con fluorescencia a una longitud de onda de entre 330 y 380 nm (Nikon Corp., Tokio, Japón).
Cuantificación de lípidos
Los lípidos en el citoplasma de los blastocistos se cuantificaron utilizando el colorante Sudan-Black B . Los embriones fueron fijados en una solución de formalina al 70% (v/v) durante al menos 2 h. Posteriormente los embriones se lavaron en agua ultra-pura durante 1 min y, después, en una solución de etanol al 50% (v/v) durante 2 min. Los embriones se tiñeron con Sudan-Black B al 1% (w/v) en etanol al 70% durante 30 seg a 1 min, lavados tres veces en una solución de etanol al 50% (v/v) durante 5 min, y montados en una lámina con glicerol. Se fotografió cada embrión con un microscopio invertido (Leica, DM IL-LED; cámara Leica, DFC295; se enfocó la parte ecuatorial del embrión). Las imágenes se digitalizaron y analizaron con el software ImageJ®. El porcentaje de lípidos se expresó como valores relativos con respecto al área ocupada por los lípidos teñidos del área total del embrión. Como unidad experimental se consideró cada embrión teñido, y el espacio ocupado por los lípidos se expresó en porcentajes.
Diseño experimental
Ensayo 1. Efecto del PMS en la producción in vitro de embriones porcinos. Los COCs fueron lavados con los medios H-PMS-M o NCSU-23 (a los que se añadió líquido folicular)4 y madurados en los medios PMS-M o NCSU-23. Los ovocitos maduros se lavaron en H-PMS-F o en solución tampón Tris (TBMm)6 y cultivados con esperma en PMS-F o TBMm. Los presuntos cigotos se lavaron en H-PMS-E1 o NCSU-23 y cultivaron durante 48 h, los embriones se lavaron con H-PMS-E2 o NCSU-23 y se cultivaron en PMS-E2 o NCSU-23 durante 120 h, como ya se describió. Se definieron dos grupos: el grupo 1, lavado con PMS, y el grupo 2, lavado con NCSU-23.
Ensayo 2: Efecto del PMS con distintas macromoléculas sobre la maduración, fertilización y producción in-vitro de embriones porcinos. Los COCs se lavaron con el medio H-PMS-M y se maduraron en PMS-M suplementado con 0.4% de BSA o 0.01% de PVA. Después de la maduración, los ovocitos se lavaron con el medio H-PMS-F y se cultivaron con los espermatozoides en PMS-F. Posteriormente los cigotos se lavaron en H-PMS-E1 y se cultivaron en PMS-E1 suplementado con 0.4% de BSA o 0.01% de PVA durante 48 h. Después de este paso, los embriones se lavaron en H-PMS-E2 y se cultivaron en PMS-E2 suplementado con 0.4% de BSA o 0.01% de PVA durante 120 h, como se describió anteriormente. La maduración y el cultivo se realizaron en PMS utilizando BSA o PVA en un arreglo factorial de 2 × 2. se definieron cuatro grupos: PMS-BSA/BSA, PMS-BSA/PVA, PMS-PVA/PVA y PMS-PVA/BSA.
Análisis estadístico
Los datos se sometieron a un análisis de varianza para un diseño completamente al azar (en el experimento 2 se utilizó un arreglo factorial de 2 × 2, en el cual los factores fueron BSA o PVA en la maduración, y BSA o PVA en el cultivo), se usó el procedimiento GLM (con SAS versión 9.3, 2012; Instituto SAS, Cary, NC, EEUUA). Antes de realizar el análisis, los datos expresados como proporciones (p) fueron sometidos a una prueba de homogeneidad de varianza; en los casos en que fue necesario, se los convirtió al valor de su arco seno para el análisis con GLM y posteriormente se los reconvirtió a valores reales, y en los resultados se los expresa como porcentajes.
Resultados
Ensayo 1
No hubo diferencias significativas para la maduración y fertilización de los ovocitos entre el grupo de PMS (88.6 ± 0.8 %) y el grupo de NCSU-23 (87.5 ± 3.4 %) (Figura 1; Cuadro 2). El uso de PMS incrementó significativamente el número total de células en los blastocistos y redujo el porcentaje total de lípidos (58.04 ± 1.8 y 49.4 ± 5.6 %; P<0.05), en comparación con el grupo NCSU-23 (37.9 ± 1 y 59.2 ± 2.2 %) (Cuadro 3). Sin embargo, no hubo diferencias significativas en los porcentajes de división embrionaria ni en el desarrollo de los blastocistos entre los dos grupos.
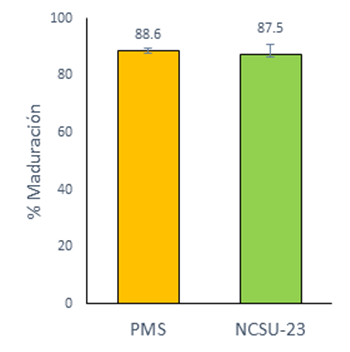
Figura 1 Maduración in vitro de ovocitos porcinos con diferentes medios. La gráfica muestra las medias mínimo cuadradas ± SEM. Datos de cinco réplicas
Cuadro 2 Fertilización in vitro de ovocitos porcinos madurados in vitro con diferentes medios
| Medio | Ovocitos examinados | Porcentaje de ovocitos | |||
|---|---|---|---|---|---|
| Penetrados | Monoespermia* | Poliespermia* | Formación de PNM * | ||
| PMS | 109 | 82.6 ± 1.2 | 45.4 ± 1.6 | 46.6 ± 0.6 | 92.1 ± 1.3 |
| NCSU-23 | 98 | 84.9 ± 1.4 | 41.5 ± 2.7 | 43.7 ± 4.5 | 85.1 ± 6.0 |
Datos de cinco réplicas. Los porcentajes están expresados como medias de mínimos cuadrados ± EEM. *Calculados como un porcentaje de los ovocitos penetrados.
Cuadro 3 Desarrollo in vitro de ovocitos porcinos madurados in vitro con diferentes medios después de la fertilización in vitro
| Medio | Presuntos cigotos cultivados |
Divididos en el blastocisto día 2 (%) |
día 7 (%) | Número
total de células en los blastocistos |
Lípidos totales (%) |
|---|---|---|---|---|---|
| PMS | 236 | 72.0 ± 3.3 | 25.4 ± 7.1 | 58.0a ± 1.8 | 49.4a ± 5.6 |
| NCSU-23 | 253 | 77.6 ± 5.7 | 23.7 ± 2.6 | 37.9b ± 1.0 | 59.2b ± 2.2 |
Datos de cinco réplicas. Los porcentajes están expresados como medias de mínimos cuadrados ± EEM.
ab Los valores con distinto superíndice dentro de cada columna son diferentes (P<0.05).
Ensayo 2
No hubo diferencias significativas en la maduración de ovocitos entre el grupo PMS-BSA (92.8 ± 0.9 %) y el grupo PMS-PVA (91.5 ± 1.3 %) (Figura 2). Sin embargo, el porcentaje de fertilización monoespérmica fue significativamente menor (42.3 ± 3.1 %; P<0.05) cuando los ovocitos se maduraron con PMS-BSA que en los madurados con PMS-PVA (52.6 ± 3.3 %) (Cuadro 4).

Figura 2 Maduración in vitro de ovocitos porcinos en un medio PMS-M con diferente macromolécula. La gráfica muestra las Medias de los Cuadrados Mínimos ± SEM. Datos de cinco replicas
Cuadro 4 Fertilización in vitro de ovocitos porcinos madurados in vitro utilizando diferentes medios
| Medio | Ovocitos examinados | Porcentaje de ovocitos | |||
|---|---|---|---|---|---|
| Penetrados | Monoespermia* | Poliespermia* | Formación de PNM * | ||
| PMS-BSA | 100 | 94.9 ± 2.5 | 42.3a ± 3.1 | 43.3a ± 2.0 | 85.6 ± 4.0 |
| PMS-PVA | 103 | 88.7 ± 2.1 | 52.6b ± 3.3 | 34.2b ± 2.8 | 86.8 ± 4.0 |
Datos de cinco replicas. Los porcentajes están expresados como medias de mínimos cuadrados ± EEM. Los valores con distinto superíndice dentro de cada columna son significativamente diferentes (P<0.05). *Calculados como porcentajes de los ovocitos penetrados.
La interacción con uso de BSA o PVA en el sistema de medios PMS de maduración y cultivo no fue significativa para ninguna de las variables evaluadas. Sin embargo, el porcentaje de desarrollo de blastocistos fue significativamente superior en el grupo PMS-BSA/BSA (36.8 ± 6.0 %; P<0.05), en comparación con los grupos PMS-BSA/PVA y PMS-PVA/PVA (23.5 ± 3.2 y 23.9 ± 4.1 %, respectivamente), mientras que el del grupo PMS-PVA/BSA (30.5 ± 5.1 %) fue intermedio. El número de células en el blastocisto fue significativamente superior para el grupo PMS-PVA/BSA (46.9 ± 2.5; P<0.05) comparado a los grupos PMS-BSA/PVA y PMS-PVA/PVA (38.0 ± 2.3 y 32.8 ± 1.3 respectivamente), mientras que el del grupo PMS-BSA/BSA (44.9 ± 3.0) fue intermedio. El grupo PMS-BSA/BSA (49.6 ± 3.0 %; P<0.05) tuvo un contenido significativamente menor de lípidos totales al de los grupos PMS-BSA/PVA y PMS-PVA/PVA (62.4 ± 3.2 % y 61.3 ± 2.0 %), mientras que el grupo PMS-PVA/BSA (51.2 ± 5.6 %) tuvo un contenido intermedio (Cuadro 5).
Cuadro 5 Desarrollo in vitro de ovocitos porcinos madurados in vitro con diferentes medios después de la fertilización in vitro
| Medio | Presuntos cigotos cultivados |
Divididos al día 2 (%) |
Blastocisto al día 7 (%) |
No.
total de células en los blastocistos |
Lípidos totales (%) |
|---|---|---|---|---|---|
| PMS-BSA/BSA | 160 | 80.2 ± 2.3 | 36.8a ± 6.0 | 44.9ab ± 3.0 | 49.6a ± 2.9 |
| PMS-BSA/PVA | 155 | 76.8 ± 5.4 | 23.5b ± 3.2 | 38.0bc ± 2.3 | 62.4b ± 3.2 |
| PMS-PVA/PVA | 147 | 79.3 ± 3.9 | 23.9b ± 4.1 | 32.8c ± 1.3 | 61.3b ± 2.0 |
| PMS-PVA/BSA | 148 | 79.4 ± 3.2 | 30.5ab ± 5.1 | 46.9a ± 2.5 | 51.2ab ± 5.6 |
Discusión
Los resultados obtenidos en el primer experimento demostraron que los ovocitos porcinos pueden ser madurados, fertilizados y desarrollados in vitro hasta el estadio de blastocisto utilizando PMS semi-definido.
No hubo diferencias significativas para la maduración de los ovocitos entre los medios PMS (88.6 %) y (87.5 %) suplementados con líquido folicular durante este estudio. Los resultados son similares a los de otros estudios en los que se utilizó el medio NCSU-23 suplementado con líquido folicular y un medio definido suplementado con PVA5,7. Se obtuvieron datos similares para la tasa de penetración y de fertilización monoespérmica (87.6 % y 44.8 %) en ovocitos madurados en medios suplementados con líquido folicular y posteriormente fertilizados, en comparación con este estudio (82.6 % y 45.4 %).
Se reportaron porcentajes de embriones divididos y de producción de blastocistos (79.4 % y 28.8 %) en un medio definido8. En este trabajo se obtuvo 25.4 % y 23.7 % de blastocistos para PMS y NCSU-23 respectivamente. Otros estudios reportaron datos similares para la producción de blastocistos con un medio definido y con el medio NCSU-23 suplementado con líquido folicular5,7,9. En los cerdos, la suplementación del líquido folicular en el medio de maduración tiene un efecto benéfico en la maduración nuclear de los ovocitos, la fertilización y el desarrollo embrionario in vitro10,11,12. Sin embargo, se puede remplazar el líquido folicular con otras macromoléculas como el PVA o BSA libre de ácidos grasos5,13. El medio PMS contiene BSA, un total de 22 aminoácidos, suplemento de arginina, melatonina y β-mercaptoetanol, mientras que el medio NCSU-23 no; posiblemente esto favorezca la maduración, fertilización, desarrollo y calidad embrionaria en este estudio. Se ha demostrado que los aminoácidos en un medio de cultivo desempeñan un papel importante como osmorreguladores14, tampones intracelulares15 y quelantes de metales pesados16 y sustratos de energía17. Se han reportado efectos benéficos de los aminoácidos esenciales y no esenciales en un medio NCSU23 químicamente definido en la maduración de ovocitos porcinos13.
La melatonina y sus metabolitos son antioxidantes efectivos que atrapan las especies reactivas de oxígeno (ROS) y regulan varias enzimas antioxidantes18,19. Se ha observado que la melatonina regula la maduración de los ovocitos en la carpa20 y mejora el desarrollo embrionario in vitro y el número total de células en el blastocisto porcino21. PMS demostró tener un porcentaje menor de lípidos (49.4 %), comparados con el medio NCSU-23 (59.2 %). También se ha demostrado que la melatonina tiene grandes propiedades lipolíticas22. En los ovocitos porcinos se ha encontrado melatonina, que promueve el metabolismo de los lípidos y proporciona una fuente esencial de energía para la maduración de los ovocitos y el posterior desarrollo embrionario23. Se ha demostrado que la reducción de los lípidos intracitoplasmáticos en los embriones incrementa su criotolerancia debido a la menor peroxidación de lípidos y por ende al menor daño celular24,25.
La arginina es un aminoácido vital para muchos procesos metabólicos en la célula, tales como la síntesis de proteínas, producción de creatina, la síntesis de poliaminas y la generación de óxido nítrico26. La arginina tiene un efecto positivo en la maduración de ovocitos27 y mejora el desarrollo in vitro de embriones de cerdo28. La adición de arginina en el medio de cultivo embrionario incrementa el porcentaje de los embriones que se desarrollan hasta la etapa de blastocisto y el número total de células del blastocisto29. El PMS exhibió un número total significativamente mayor de células (58.04) en comparación con el medio de NCSU-23 (37.9). Un indicador de la calidad embrionaria es el número total de células del blastocisto29.
La implementación de un sistema de medios de cultivo semi-definidos o definidos para la producción in vitro se considera importante para observar los efectos de ciertos suplementos de interés en el medio de maduración, fertilización y desarrollo embrionario eliminando estos factores desconocidos que el líquido folicular provee al medio30.
En el segundo ensayo, los resultados mostraron un porcentaje de fertilización monoespérmica significativamente menor (42.3 ± 3.1 %; P<0.05) cuando los ovocitos se maduraron con PMS-BSA que con PMS-PVA (52.6 ± 3.3 %). Se ha demostrado que la adición de PVA al medio de maduración mejora el porcentaje de embriones monoespérmicos durante la fertilización in vitro de los ovocitos porcinos5,8. Cuando el medio de maduración se suplementa con PVA, la fertilización monoespérmica puede llegar entre 70 y 80 % de éxito5,7. Sin embargo, se ha observado una reducción de la tasa de penetración de ovocitos madurados cuando se remplaza el líquido folicular con PVA en el medio NSCU-37; quizá debido a esto, el número de ovocitos que alcanzan la etapa de la metafase II durante la fertilización disminuye5. Durante este estudio se observó que la penetración del esperma no decrece cuando se remplaza la BSA con PVA en el medio de maduración, probablemente debido al hecho de que el PMS tiene un contenido más alto de aminoácidos y factores que pueden contribuir a mejorar las condiciones que los que proporciona la BSA. Se requiere de futuros análisis histológicos y bioquímicos de los ovocitos madurados y fertilizados para comprender el mecanismo de la fertilización poliespérmica en el sistema de producción in vitro de embriones porcinos con adición de diferentes macromoléculas.
La adición de BSA durante el cultivo del embrión mejora el desarrollo de éste, incrementa el número de células en el blastocisto y reduce los lípidos totales, probablemente debido a los nutrientes que aporta la BSA. La BSA desempeña un papel en el desarrollo embrionario31 y en la formación y la eclosión del blastocisto32. Sin embargo, no se encontraron diferencias en el porcentaje de embriones bovinos que alcanzaron la etapa del blastocisto en un medio suplementado con PVA, BSA o suero fetal bovino33. Sin embargo, los blastocistos producidos en PVA tuvieron un número menor de células. Se requieren estudios futuros para determinar si existe una relación entre el número total de células y los lípidos en el blastocisto porcino.
Conclusiones e implicaciones
Los resultados sugieren que el PMS semi-definido tiene efectos favorables en el número total de células y en la disminución de los lípidos totales del blastocisto en los cerdos; por ello se pueden utilizar estos medios en la producción in vitro de embriones porcinos. El uso de PVA en lugar de BSA durante la maduración tiene un efecto positivo en la tasa de fertilización monoespérmica in vitro de los ovocitos porcinos. Se requiere de futuros análisis histológicos y bioquímicos de la maduración y la fertilización de los ovocitos, así como del desarrollo embrionario, para comprender los mecanismos de acción de las macromoléculas durante la producción in vitro de los embriones porcinos. El PMS desarrollado por el CNRG se podría utilizar para favorecer la criopreservación de los embriones porcinos producidos in vitro.
Agradecimientos
Se agradece a PIGAMEX y a Efrén Altamirano, de “Posta el Cuatro”, por haber proporcionado el material biológico.
REFERENCIAS
1. Grupen CG. The evolution of porcine embryo in vitro production. Theriogenology 2014;(81):24-37. [ Links ]
2. Funahashi H. Polyspermic penetration in porcine IVM-IVF systems. Reprod Fertil Dev 2003;(15):167-77. [ Links ]
3. Kikuchi K, Somfai T, Nakai M, Nagai T. Appearance, fate and utilization of abnormal porcine embryos produced by in vitro maturation and fertilization. J Reprod Fertil 2009;66(Suppl):135-47. [ Links ]
4. Petters RM, Wells KD. Culture of pig embryos. J Reprod Fertil 1993;(48): 61-73. [ Links ]
5. Yoshioka K, Suzuki C, Onishi A. Defined System for in vitro production of porcine embryos using a single basic medium. J Reprod Dev 2008;(54):208-213. [ Links ]
6. Abeydeera LR, Day BN. In vitro penetration of pig oocytes in a modified Tris buffered medium: effect of BSA, caffeine and calcium. Theriogenology 1997;(48):537-544. [ Links ]
7. Hong JY, Yong HY, Lee BC, Hwang WS, Lim JM, Lee ES. Effects of amino acids on maturation, fertilization and embryo development of pig follicular oocytes in two IVM media. Theriogenology 2004;(62):1473-1482. [ Links ]
8. Yoshioka K, Suzuki C, Itoh S, Kikuchi K, Iwamura S, Rodriguez HM. Production of piglets derived from in vitro-produced blastocysts fertilized and cultured in chemically defined media: Effects of theophylline, adenosine, and cysteine during in vitro fertilization. Biol Reprod 2003;(69):1092-1099. [ Links ]
9. Kohata C, Izquierdo-Rico MJ, Romar R, Funahashi H. Development competence and relative transcript abundance of oocytes derived from small and medium follicles of prepubertal gilts. Theriogenology 2013;(80):970-978. [ Links ]
10. Yoshida M, Ishizaki Y, Kawagishi H, Bamba K, Kojima Y. Effects of pig follicular fluid on maturation of pig oocytes in vitro and on their subsequent fertilizing and developmental capacity in vitro. J Reprod Fertil 1992;(95):481-488. [ Links ]
11. Vatzias G, Hagen DR. Effects of porcine follicular fluid and oviduct-conditioned media on maturation and fertilization of porcine oocytes in vitro. Biol Reprod 1999;(60):42-48. [ Links ]
12. Yoon KW, Shin TY, Park JI, Roh S, Lim JM, Lee BC, et al. Development of porcine oocytes from preovulatory follicles of different sizes after maturation in media supplemented with follicular fluids. Reprod Fertil Dev 2000;(12):133-139. [ Links ]
13. Hong J, Lee E. Intrafolicular amino acid concentration and the effect of amino acids in a defined maturation medium on porcine oocyte maturation, fertilization, and preimplantation development. Theriogenology 2007;(68):728-735. [ Links ]
14. Abeydeera LR, Wang WH, Cantley TC, Prather RS, Day BN. Glutathione contentand embryo development after in vitro fertilization and various concentrations of cysteine. Zygote 1999;(7):203-210. [ Links ]
15. Edwards LJ, Williams DA, Gardner DK. Intracellular pH of the mouse preimplantation embryo: amino acids act as buffer of intracellular pH. Hum Reprod 1998;(13):3441- 3448. [ Links ]
16. Bavister BD. Culture of preimplantation embryos: facts and artifacts. Hum ReprodUpdate 1995;(1):91-148. [ Links ]
17. Rose-Hellekant TA, Libersky-Williamson EA, Bavister BD. Energy substrates and amino acids provided during in vitro maturation of bovine oocytes alter acquisition of developmental competence. Zygote 1998;(6):285-294. [ Links ]
18. Tomas-Zapico C, Coto-Montes A. A proposed mechanism to explain the stimulatory effect of melatonin on antioxidative enzymes. J Pineal Res 2005;(39):99-104. [ Links ]
19. Tan DX, Manchester LC, Terron MP, Flores LJ, Reiter RJ. One molecule, many derivatives: a never-ending interaction of melatonin with reactive oxygen and nitrogen species? J Pineal Res 2007;(42):28-42. [ Links ]
20. Chattoraj A, Bhattacharyya S, Basu D, Bhattacharya S, Bhattacharya S, Maitra SK. Melatonin accelerates maturation inducing hormone (MIH): induced oocyte maturation in carps. Gen Comp Endocrinol 2005;(140):145-155. [ Links ]
21. Shi JM, Tian XZ, Zhou GB, Wang L, Gao C, Zhu SE, et al. Melatonin exists in porcine follicular fluid and improves in vitro maturation and parthenogenetic development of porcine oocytes. J Pineal Res 2009;(47):318-323. [ Links ]
22. Paradies G, Petrosillo G, Paradies V, Reiter RJ, Ruggiero FM. Melatonin, cardiolipin and mitochondrial bioenergetics in health and disease. J Pineal Res 2010;(48):297-310. [ Links ]
23. Jin J-X, Lee S, Taweechaipaisankul A, Kim GA, Lee BC. Melatonin regulates lipid metabolism in porcine oocytes. J Pineal Res 2017;(62):e12388. [ Links ]
24. Gómez E, Rodríguez A, Muñoz M, Caamaño JN, Hidalgo CO, Morán E, et al. Serum free embryo culture medium improves in vitro survival of bovine blastocysts to vitrification. Theriogenology 2008;(69):1013-1021. [ Links ]
25. Paschoal D, Sudano M, Maziero R, Guastali M, Magalhães L, Landim-Alvarenga F, et al. Cryopreservation of in vitro produced bovine embryos after lipid decrease with forskolin. Reprod Fertil Dev 2016;(28):212-213. [ Links ]
26. Wheatley DN, Campbell E. Arginine deprivation, growth inhibition and tumour cell death: 3. Deficient utilisation of citrulline by malignant cells. Br J Cancer 2003;(89):573-576. [ Links ]
27. Coburn RF. Polyamine effects on cell function: possible central role of plasma membrane PI (4,5) P2. J Cel Physiol 2009;(221):544-551. [ Links ]
28. Bauer BK, Isom SC, Spate LD, Whitworth KM, Spollen WG, Blake SM, et al. Transcriptional profiling by deep sequencing identifies differences in mRNA transcript abundance in in vivo-derived versus in vitro cultured porcine blastocyst stage embryos. Biol Reprod 2010;(83):791-798. [ Links ]
29. Redel BK, Tessanne KJ, Spate LD, Murphy CN, Prather RS. Arginine increases development of in vitro-produced porcine embryos and affects the protein arginine methyltransferase-dimethylarginine dimethylaminohydrolase-nitric oxide axis. Reprod Fertil Dev 2015;(27):655666. [ Links ]
30. Wang WH, Day BN. Development of porcine embryos produced by IVM/IVF in a medium with or without protein supplementation: effect of extracellular glutathione. Zygote 2002;(10):109-115. [ Links ]
31. Kim HS, Lee GS, Hyun SH, Lee SH, Nam DH, Jeong YW, et al. Improved in vitro development of porcine embryos with different energy substrates and serum. Theriogenology 2004;61(7):1381-1393. [ Links ]
32. Gardner DK, Lane M, Spitzer A, Batt PA. Enhanced rates of cleavage and development for sheep zygotes cultured to the blastocyst stage in vitro in the absence of serum and somatic cells: amino acid, vitamins and culturing embryos in groups stimulate development. Biol Reprod 1994;(50):390-400. [ Links ]
33. Kubisch HM, Larson MA, Ealy AD, Murphy CN, Roberts RM. Genetic and environmental determinants of interferon-tau secretion by in vivo- and in vitro-derived bovine blastocysts. Anim Reprod Sci 2001;(66):1-13. [ Links ]
Recibido: 26 de Enero de 2018; Aprobado: 08 de Agosto de 2018











 texto en
texto en 


