Introducción
Desde hace un siglo, se ha estudiado la ecología de enfermedades y parasitosis en fauna silvestre, con especial énfasis en especies cinegéticas y de consumo1,2. Este tema en las últimas décadas se ha convertido en un campo de estudio desde un enfoque zoosanitario, ya que pueden desarrollarse enfermedades zoonóticas que afectan a especies domésticas y al ser humano, provocando la muerte de poblaciones silvestres y en cautiverio3,4,5,6.
El venado cola blanca (Odocoileus virginianus), es una especie de alta demanda para diversos usos y fines cinegéticos7,8. En esta especie, se ha descrito la diversidad de parásitos que causan enfermedades infecciosas5, lo que afecta su comportamiento, reproducción e inclusive la morbilidad y mortalidad2,9,10. Por su parte, en el venado temazate (Mazama temama), especie emblemática de los ecosistemas tropicales, son escasos los estudios sobre su parasitosis11 y mínimo conocimiento de las condiciones que deben mantenerse en cautiverio, que permitan el mantenimiento de sus poblaciones.
De manera general, los parásitos que más abundan en animales domésticos son protozoarios, helmintos, artrópodos y pentastómidos12. En el caso particular de los cérvidos, las enfermedades más comunes son causadas por virus, bacterias, cuadros infecciosos y parasitosis2. Dentro de las patologías más importantes que afectan la salud de los venados, figura la parasitosis gastrointestinal, la cual es provocada principalmente por helmintos y protozoarios13. El clima14, presencia o ausencia de hospederos intermediarios, composición del suelo, tipo de vegetación y calidad de agua, son factores que principalmente influyen en la prevalencia de parásitos12. Estudios realizados en poblaciones silvestres de O. virginianus muestran que la mortalidad de venados causada por parásitos gastrointestinales es alrededor del 2.7 %15.
En México, las Unidades de Manejo para la Conservación de la Vida Silvestre (UMA) son estrategias que se han implementado para el manejo con fines de conservación y aprovechamiento de la fauna silvestre; en su modalidad de manejo intensivo, animales mal manejados por la aplicación de protocolos zoosanitarios inadecuados, se traduce en pérdidas por disminución de su reproducción y productividad16, mayor incidencia de infecciones secundarias, ya que aumentan las lesiones en el tracto digestivo, reacciones anafilácticas, anemia, hasta llegar a la muerte del ejemplar; así mismo, incrementan la posibilidad de convertirse en enfermedades zoonóticas y se potencializa el riesgo de contagio entre la fauna silvestre y animales de producción pecuaria3,17, si no se aplican adecuadas medidas de prevención y mitigación18. Al respecto, los programas de manejo de cérvidos deben considerar la prevención y control de las enfermedades infecciosas y parasitarias más comunes, para garantizar la viabilidad poblacional y el éxito en los sistemas de producción2.
Dentro de las UMA, los estudios y la información generada de la parasitosis de fauna silvestre en cautiverio es precaria15,19,20 y los planes de manejo para la producción exitosa de cérvidos en UMA in situ y ex situ distan de su cometido21. En este sentido, es necesario generar conocimiento de los parásitos que afectan la salud de las poblaciones de cérvidos ex situ. Por lo anterior, el objetivo de la presente investigación fue conocer la prevalencia, diversidad de endoparásitos y la abundancia parasitaria que presenta una población de O. virginianus y M. temama en cautiverio.
Material y métodos
Área de estudio
El presente trabajo se realizó en la UMA “El Pochote” en modalidad intensiva, registrada ante la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT) con clave: UMA-IN-CR-0122-VER/og. Se ubica en el municipio de Ixtaczoquitlán, Veracruz, México, entre las coordenadas extremas 18°52´13.70” N y 97°02´59.97” O, a 1,137 msnm. El objetivo principal de esta UMA es la conservación y reproducción de O. virginianus y M. temama.
La región presenta un clima semi-cálido húmedo (Cwa) con abundantes lluvias en verano, temperatura anual que oscila entre los 18 a 24 °C y con precipitación pluvial media anual de 1,900 a 2,600 mm. La selva mediana subperennifolia y el acahual, son los principales tipos de vegetación alrededor de la UMA El Pochote22.
Ejemplares de cérvidos en estudio
Se trabajó con seis individuos de O. virginianus: tres hembras (2, 3 y 5 años de edad) y tres machos (3, 4 y 9 años) y con cuatro ejemplares de M. temama: dos hembras (2 y 4 años) y dos machos (ambos de 3 años), todos aparentemente sanos y con buena conformación corporal. Un año antes de iniciar el muestreo, los venados se trataron con Hemoplex®, un tónico general a una dosis de 2 ml por cada 10 kg de peso; además se suministró Catosal® vía muscular como estimulante metabólico. Los ejemplares de ambas especies de venados, se mantuvieron en diferentes encierros con un tamaño de 30 m de longitud por 12.5 m de ancho, con malla venadera como delimitación y con una separación entre encierros de 50 m; los corrales presentan dos bebederos, techumbre para cubrirlos de la intemperie, se colocó una malla con 80 % de sombra a la altura de la visión de los venados (de 60 a 1.2 cm) para evitar el contacto visual con otros venados; diariamente, se realizó la limpieza de heces. Los animales se alimentaron a las 0800 h con una ración diaria de alfalfa (20 % ~ 2 kg por animal) y alimento balanceado para ovino (80 % ~ 4 kg por animal) que contenía proteína cruda (34 %), grasa (2 %), fibra cruda (5 %), cenizas (17 %) y humedad (13 %); se les ofreció agua ad libitum.
Muestreo de heces
La colecta de los grupos fecales se realizó en dos épocas: lluvias (septiembre-noviembre) y secas (marzo-mayo), dado que hay variación en la incidencia y abundancia de parásitos entre épocas23. En cada periodo de muestreo, mensualmente se obtuvieron las muestras fecales de todos los ejemplares, aprovechando la primera defecación espontánea de los venados, la cual se presentó entre las 0600 y 0900 h. Con guantes de látex, se tomó la porción de la excreta que no se encontraba en contacto directo con el suelo; las muestras se depositaron en bolsas plásticas con cierre hermético con su respectiva ficha de colecta, se mantuvieron en una hielera térmica a 4 °C. Las muestras se transportaron al laboratorio de Microscopía Óptica de la Facultad de Ciencias Biológicas y Agropecuarias, región Orizaba-Córdoba, Universidad Veracruzana, para su posterior análisis. Al final del muestreo, se recolectaron 60 muestras de heces de ambas especies de venados, 30 muestras fueron recolectadas en el periodo de lluvias y 30 muestras en secas durante 2016 y 2017, respectivamente.
Análisis de muestras fecales
Para el análisis parasitoscópico, se utilizó la técnica de flotación en solución saturada de azúcar, la cual consiste en la separación de partículas de mayor y menor densidad. De la solución, se colectaron huevos ligeros e individuos completos de parásitos que se fijaron en portaobjetos, para su posterior identificación morfológica24.
Identificación morfológica y abundancia de endoparásitos
Los parásitos encontrados se identificaron mediante comparación de sus características anatómicas con los reportados en los Catálogos Parasitológicos25, libros de parasitología y de enfermedades parasitarias de animales domésticos12. Se identificó el género del taxón de los ooquistes con base en el número de esporozoítos que presentaron26. La abundancia se consideró como el número de endoparásitos presentes por cada cérvido hospedero, ya que es una medida indirecta de la prevalencia20,27.
Análisis estadístico de datos
Para este trabajo, las especies de venados (O. virginianus y M. temama), el sexo (machos y hembras) y la temporada (secas y lluvias) fungieron como las fuentes de variación, y como variable respuesta fue la abundancia de parásitos de cada cérvido hospedero, ya que ésta se considera como un indicador de infección por parásitos nematodos27. Se calculó la prevalencia (%) por sexo, por especie de cérvido y se obtuvieron los estadísticos descriptivos de la abundancia por cada fuente de variación. Se aplicó una prueba de Kruskall-Wallis junto con la prueba de comparación de medias LSD (Least significant difference) de Fisher (α = 0.05) con el objetivo de determinar qué especie de parásito fue más abundante en determinada especie de venado, sexo y temporada (lluvias o secas). Adicionalmente, se analizó la asociación de la abundancia de parásitos con respecto a la especie de cérvido y el sexo del animal, con una prueba de Ji cuadrada.
Resultados
Se identificaron siete géneros de endoparásitos: Ascaris sp., Eimeria sp., Estrongilido sp., Paragonimus sp., Parascaris sp., Strongyloides sp. y Taenia sp., con diferentes abundancias (Figura 1), que variaron en la época de lluvias y secas y en la especie de cérvido estudiado (Cuadro 1). De los 10 ejemplares bajo estudio, el 100% presentaron endoparásitos, siendo Parascaris sp., Paragonimus sp., y Taenia sp., los parásitos gastrointestinales prevalentes en O. virginianus y ausentes en M. temama.
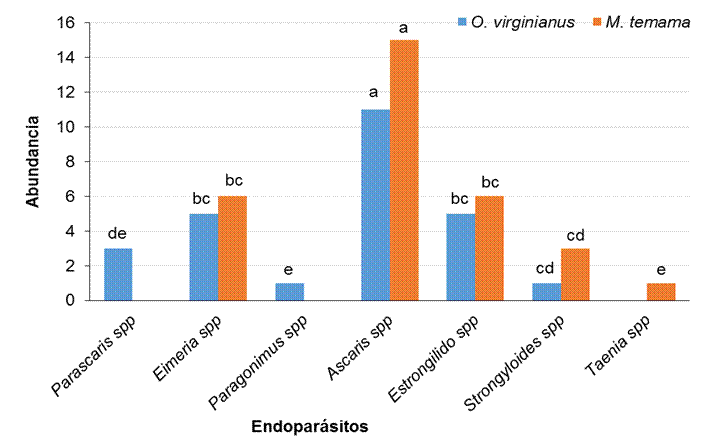
Figura 1 Abundancia de endoparásitos en O. virginianus y M. temama en la UMA El Pochote. Letras diferentes en las barras representan diferencias significativas
Cuadro 1 Géneros identificados y abundancia promedio de endoparásitos en O. virginianus y M. temama durante la época de lluvias y de secas en la UMA El Pochote, Veracruz, México
| Época | Especie | Parásito | Abundancia promedio | DE |
|---|---|---|---|---|
| Lluvia | M. temama | Ascaris sp. | 2.00 | 1.4 |
| Eimeria sp. | 1.67 | 1.7 | ||
| Estrongilido sp. | 1.67 | 1.2 | ||
| Strongyloides sp. | 0.67 | 1.1 | ||
| Taenia sp. | 0.33 | 0.8 | ||
| O. virginianus | Ascaris sp. | 2.33 | 2.0 | |
| Eimeria sp. | 1.67 | 1.2 | ||
| Paragonimus sp. | 0.33 | 0.8 | ||
| Parascaris sp. | 0.33 | 0.8 | ||
| Secas | M. temama | Ascaris sp. | 3.00 | 0.0 |
| Eimeria sp. | 0.33 | 0.8 | ||
| Estrongilido sp. | 0.33 | 0.8 | ||
| Strongyloides sp. | 0.33 | 0.8 | ||
| O. virginianus | Ascaris sp. | 1.33 | 1.1 | |
| Estrongilido sp. | 1.67 | 1.7 | ||
| Parascaris sp. | 0.67 | 0.8 | ||
| Strongyloides sp. | 0.33 | 0.8 |
DE= desviación estándar.
La época y la especie de cérvido no tuvo un efecto significativo (P>0.05) con respecto a la abundancia de los parásitos (Cuadro 2), pero se detectaron diferencias significativas en la abundancia de los géneros de endoparásitos identificados (P<0.05), siendo Ascaris sp., la especie más abundante (Cuadro 3).
Cuadro 2 Efecto de la época del año (secas vs lluvias), la especie de cérvido hospedero (O. virginianus y M. temama) y el género de endoparásitos
| SC | GL | CM | F | P-valor | |
|---|---|---|---|---|---|
| Modelo | 13.06 | 8 | 1.63 | 2.98 | 0.007 |
| Época | 0.14 | 1 | 0.14 | 25 | 0.619 |
| Especie de cérvido | 1.07 | 1 | 1.07 | 1.95 | 0.167 |
| Parásito | 11.86 | 6 | 1.98 | 3.61 | 0.004* |
| Error | 31.2 | 57 | 0.55 | ||
| Total | 44.26 | 65 | |||
SC= suma de cuadrados; GL grados de libertad; CM= cuadrado medio; F= valor de tablas ; P-valor = valor de significancia
Cuadro 3 Abundancia promedio comparada por género de endoparásito en las dos especies de venado
| Endoparásito | N | Promedio | EE | Diferencias |
|---|---|---|---|---|
| Taenia sp. | 6 | 0.17 | 0.57 | a |
| Paragonimus sp. | 6 | 0.17 | 0.57 | a |
| Strongyloides sp. | 12 | 0.33 | 0.4 | a |
| Parascaris sp. | 6 | 0.5 | 0.57 | a |
| Estrongilido sp. | 12 | 0.92 | 0.4 | a |
| Eimeria sp. | 12 | 0.92 | 0.4 | a |
| Ascaris sp. | 12 | 2.17 | 0.4 | b* |
N= tamaño muestral; EE= error estándar; *diferencias a un α= 0.05.
Eimeria sp fue el género de parásito cuya presencia estuvo asociada a machos de M. temama y a hembras de O. virginianus (X 2 = 8.57, g.l. 1; P= 0.0034). Taenia sp., y Paragonumus sp., se presentaron en un macho de M. temama y en una hembra de O. virginianus, respectivamente (X 2 , P<0.05), mientras que Parascaris sp., Ascaris sp., Estrongilido sp., Strongyloides sp., no mostraron asociación (X 2 , P>0.05) con respecto al sexo o a la especie de cérvido.
Discusión
Se identificaron siete géneros de endopárasitos en O. virginianus y M. temama, por lo que este estudio representa el primer reporte de estos endoparásitos en UMAs in situ o ex situ que se encuentran localizadas en el territorio veracruzano. En ambas temporadas y en los dos cérvidos estudiados, se registraron los géneros Ascaris sp., y Eimeria sp., mientras que Taenia sp., solamente se registró para la época de lluvias (P>0.05) en M. temama.
En diversos trabajos realizados, con un número variable de entre 20 y 200 muestras de excretas analizadas en diferentes épocas del año (secas, transición y lluvias), se describieron ocho géneros de parásitos; de ellos, los que destacan en común con nuestro estudio y los que provocan una mayor abundancia parasitaria fueron Eimeria sp., y Strongyloides sp20,27,28. En un estudio donde se recolectaron aproximadamente 1,000 muestras de heces de O. virginianus de tres confinamientos en un periodo de un año15, identificaron siete géneros de endoparásitos, de los cuales Eimeria y Strongyloides coinciden con lo reportado en los trabajos previamente citados y con el presente estudio.
En los ciervos de la UMA bajo estudio, Ascaris sp., fue el género con prevalencia en ambos cérvidos hospederos, de acuerdo a los análisis estadísticos existen diferencias significativas de su abundancia con respecto a los otros géneros de parásitos identificados. Un resultado similar se ha reportado con los parásitos de la Familia Ascarididae, que usualmente se encuentran en el intestino de peces, anfibios, reptiles, aves y mamíferos, pero en las especies que más daño causan son en especies de producción pecuaria, parasitando cerdos, equinos, ganado vacuno, aves de corral, perros, gatos y mamíferos silvestres como zorros27. Por otro lado, en primates: Alouatta fusca y A. seniculus se ha reportado la presencia de huevos de nematodos de Ascaris sp., adjudicado a su cuidador como la probable fuente de contaminación antropozoonótica29. En el caso de las especies del género Eimeria sp., que parasita principalmente a mamíferos, son comúnmente parásitos del canal digestivo del hospedero y se arraigan en las células epiteliales las cuales destruyen, causando la enfermedad conocida como coccidiosis25.
Los ungulados mantenidos en cautiverio presentan un mayor número de endoparásitos comparado con los ungulados de vida libre13; lo que puede deberse a que los animales mantenidos en cautiverio generalmente consumen alimentos brindados por el ser humano sin implementar cuidados sanitarios, en los encierros puede haber mayor humedad, formación de charcas, fuga de agua de bebederos, etc., incrementando las fuentes de riesgo de transmisión parasitaria30. Aunado a esto, el estrés del cautiverio puede disminuir la capacidad inmunológica y propiciar el surgimiento de la parasitosis y una mayor diversidad y abundancia parasitaria31.
Cuando se compararon los tipos de parásitos y su abundancia entre épocas del año encontrados en este trabajo con lo reportado en otros estudios, estos tampoco detectaron diferencias significativas entre los meses de muestreo20,28. Estos resultados se atribuyen a que los cambios ambientales en las dos temporadas, condicionan el ambiente favorable para la transmisión parasitaria; en caso de necesitar desarrollo fuera del hospedero, debe existir la presencia de hospederos intermediarios, favoreciendo o impidiendo el desarrollo parasitario en los cérvidos32.
Los animales silvestres son hospederos de diferentes parásitos sin que estos causen síntomas de enfermedad33, ya que puede mantenerse un equilibrio. Al respecto, algunos autores34, mencionan que existen factores que debilitan el sistema inmune de los hospederos, tales como la edad, desnutrición y estrés, entre otras causas que aumentan el riesgo para que el organismo se sobre-parasite. Estudios demuestran que el contagio de endoparásitos entre especies silvestres y domésticos puede ser peligroso35. La abundancia y riqueza de parásitos puede variar entre especies de cérvidos36, lo cual está relacionado al hábitat, otras especies con las que coexiste, tamaño y características de los encierro y densidad poblacional37; futuros estudios deben considerar las características del encierro de las UMA, para detectar los factores de riesgo asociados a la parasitosis.
La aparición y dinámica de parásitos a lo largo del año, puede estar influida por el sexo del huésped. La prevalencia de parásitos con respecto al sexo de los animales está ligada a características del individuo como la edad y la condición corporal38. En Alces alces39 y en O. virginianus40 se ha reportado que ejemplares adultos tienen una mayor carga parasitaria que los sub-adultos, en la época de celo y sin celo, respectivamente. En este estudio, Eimeria sp., y Paragonumus sp., fueron prevalentes en hembras de O. virginianus, lo que coincidió con la temporada de apareamientos, contagiadas posiblemente por los sementales. El macho de M. temama que estuvo parasitado por Taenia sp., su contagio posiblemente ocurrió por alta humedad que prevalece en su encierro, por las hojas de los árboles que caen al corral o por los brotes de hierba que este ejemplar ingiere. Sin embargo, se requiere seguir estudiando la parasitología de M. temama para fortalecer los programas de manejo en cautiverio, y contribuir a su conservación, como en los casos exitosos de otros ungulados (p. ej. Gazella gazella)41.
Conclusiones e implicaciones
Este estudio proporciona datos básicos sobre la prevalencia y diversidad de parásitos gastrointestinales en O. virginianus y M. temama bajo cautiverio. Se registraron siete géneros de parásitos en ambas especies de cérvidos, ambas especies de venados podrían ser tratadas con desparasitantes específicos que eviten una carga parasitaria excesiva, que cause la morbilidad o mortalidad de los hospederos. Por los resultados obtenidos, la época de secas es la mejor estación para aplicar un tratamiento antiparasitario. Ascaris sp., fue abundante en ambos cérvidos, seguida de Estrongilido sp., y Eimeria sp. Estos hallazgos resaltan la importancia de identificar los factores de riesgo de parasitosis en la fauna silvestre en cautiverio, para optimizar las estrategias de prevención y mitigación. Este estudio tiene implicaciones en la conservación y manejo de O. virginianus y M. temama bajo cautiverio, así como la prevención de enfermedades zoonóticas que puedan afectar las poblaciones tanto de animales silvestres como de especies domésticas y a su vez tenga implicaciones económicas para los productores.











 texto en
texto en 


