Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.10 n.3 Mérida Jul./Sep. 2019
https://doi.org/10.22319/rmcp.v10i3.4453
Revisiones bibliográficas
Anatomía, fisiología, manipulación y aplicaciones veterinarias del surco reticular. Revisión
a Universidad de León. Departamento de Medicina, Cirugía y Anatomía, Facultad de Veterinaria, Tel.: 34.987-29.12.14, Fax: 34.987-29.12.69; Campus de Vegazana s/n. 24071, León, España.
b Universidad de Lleida. Departamento de Ciencia Animal, Lleida, España.
c Universidad de La República. Departamento de Patología de la Facultad de Veterinaria. Montevideo, Uruguay.
El cierre del surco reticular en los rumiantes es un mecanismo primario, casi exclusivo de los animales lactantes, que hace posible el paso de los alimentos desde el orificio del cardias al abomaso, evitando las fermentaciones no deseadas en el rumen y el retículo. En esta revisión se describen algunos aspectos anatómicos y fisiológicos del surco reticular, teniendo en cuenta su desarrollo embrionario y postnatal, su localización topográfica, se estructura, su inervación, su circulación sanguínea y su histología. También se describen los métodos directos e indirectos utilizados para el estudio de su funcionamiento. Finalmente, la revisión se concentra en el manejo de las técnicas para manipular el reflejo de cierre del surco reticular y sus aplicaciones veterinarias tanto en la estimulación como en la inhibición, dado que la posibilidad de controlar este reflejo es de gran interés para la administración oral de diversos medicamentos en el tratamiento de ciertas enfermedades, así como para un mejor aprovechamiento de algunos tipos de alimentos.
Palabras clave Surco reticular; Rumiantes; Lactante
Reticular groove closure in ruminants is a primary mechanism, almost exclusive of lactating animals, which makes the passage of food from the orifice of cardia to the abomasum possible, thus avoiding unwanted fermentations in rumen and reticulum. In this review It is described some anatomical and physiological aspects of the reticular groove, given its embryonic and postnatal development, its topographic location, structure, innervation, blood circulation and histology. Also describing the techniques used to study its functioning, both direct and indirect methods. Finally there is a concentrate on handling techniques to manipulate closing reflex of reticular groove and its veterinary applications, in both the stimulation and inhibition, since the possibility to control this reflex is of great interest in the oral administration of various drugs, the treatment of certain diseases, as well as a better utilization of some types of food.
Key words Reticular groove handling; Ruminants; Suckling
Introducción
Esta revisión se ha dividido en dos partes. En primer lugar, se hace un breve repaso de algunos aspectos anatómicos y fisiológicos del surco reticular en los rumiantes, así como las técnicas utilizadas para estudiar el funcionamiento del reflejo de cierre del surco reticular. La segunda parte trata de aquellos aspectos que pueden estimular o inhibir el reflejo del surco reticular, y las técnicas de manipulación de este reflejo, así como sus aplicaciones en la medicina veterinaria.
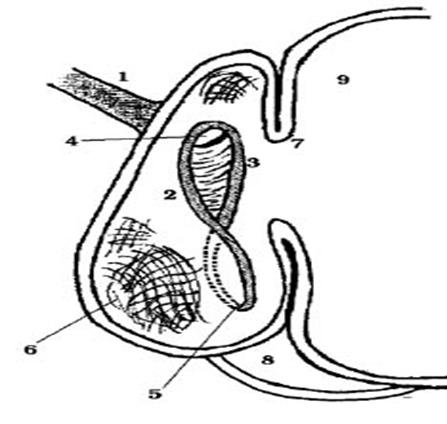
El surco gástrico es una estructura anatómica que se localiza en el estómago de los rumiantes. Se extiende desde el orificio del cardias hasta cerca del píloro, a través de la curvatura menor del retículo, del omaso y del abomaso. Se divide en tres segmentos: el surco reticular (Sulcus reticuli), el surco omasal (Sulcus omasi) y el surco abomasal (Sulcus abomasi)1-3. Mientras que algunos autores sólo consideran dos estructuras: el surco reticular y el surco omasal, que van desde el cardias hasta el orificio omasoabomasal.
Se han utilizado diversos nombres para esta estructura, tales como gotera reticular, ranura gástrica, canal gástrico, canal esofágico o acanaladura esofágica. La nomenclatura científica representada por la Nomina Anatomica Veterinaria4 incluye el término latino "Sulcus reticulari".
El mecanismo del surco esofágico es primario, casi exclusivo de animales lactantes; ofrece a los animales rumiantes la posibilidad de una progresiva adaptación fisiológica del estómago monogástrico al estómago rumiante. Cuando es estimulado, el tejido muscular se contrae, adoptando una estructura hueca que forma un conducto a lo largo de la pared del retículo, la cual conecta el esófago (cardias) con el orificio retículo-omasal5. El orificio retículo-omasal permanece abierto permitiendo el flujo de la leche5-7, lo cual es de gran interés en los animales recién nacidos, ya que permite que el calostro y la leche pasen directamente al abomaso, sin caer en el rumen ni en el retículo, impidiendo así la fermentación anormal. En las primeras horas de vida, este potente reflejo permite que las inmunoglobulinas del calostro pasen al duodeno en donde, gracias a la alta permeabilidad de la mucosa, se absorben rápidamente para desarrollar la inmunidad pasiva que protege al animal de que los patógenos lleguen a su tracto digestivo. Además, el elevado valor energético del calostro proporcionará al animal la energía suficiente para combatir una posible hipotermia y, puesto que este alimento tiene un alto contenido de magnesio, con acción laxante, que ayudará a expulsar el meconio y facilitará el inicio del tránsito intestinal(8, 9). La actividad del surco reticular disminuye después del destete y a medida que avanza la edad del animal, pero puede activarse bajo ciertas condiciones en el animal adulto9.
Repaso anatómico
Embriología
El estómago de los rumiantes representa el máximo desarrollo evolutivo de todas las especies de mamíferos10. Procede de una dilatación fusiforme del intestino primitivo del embrión, llamado estómago primitivo. De la curvatura menor se derivan los surcos reticular, omasal y abomasal. Y de la curvatura mayor se derivan el rumen, el retículo y la curvatura mayor del abomaso1.
La diferenciación de la ranura reticular ocurre tempranamente en el ganado ovino y caprino, y más tardíamente en el ganado vacuno, haciéndose evidente en este último caso a las ocho semanas de desarrollo embrionario. Molinari y Jorquera11 informan que el inicio de la gotera en los fetos de rumiantes es simultáneo con la diferenciación de los rudimentos del rumen y del retículo. En consecuencia, las rotaciones experimentadas por estos rudimentos afectarán a la ranura reticular, que pasará de una posición fetal paralela al eje, en la pared derecha del retículo, a adoptar una orientación vertical. Así, formará un ángulo de 50⁰ con respecto al eje principal, desarrollando finalmente una estructura espiral de 180⁰.
Desarrollo posnatal
Después del nacimiento, el desarrollo del proventrículo dependerá de la alimentación del animal. Al comienzo de la vida de los rumiantes, el abomaso es ligeramente más grande que el tamaño de todo el proventrículo. Posteriormente, cuando la dieta comienza a ser sólida, estos aumentan rápidamente su tamaño. Este desarrollo puede dividirse en tres etapas8,9.
─ Desde el nacimiento hasta la 3ª semana de vida, el animal es considerado como un "no rumiante" porque su dieta es exclusivamente láctea. Los niveles altos de glucosa en la sangre se deben a la absorción de los nutrientes (glucosa) en el intestino y, por lo tanto, el metabolismo de los carbohidratos es típico de un "no rumiante".
─ El periodo entre la 3.a semana de vida y la 8.ava se considera de transición. El animal ingiere pequeñas cantidades de alimentos sólidos. La glucosa en la sangre disminuye y la concentración plasmática de ácidos grasos volátiles aumenta, en forma similar a los niveles del animal adulto.
─ Un animal de 8 semanas de edad será considerado como un “verdadero” rumiante. Esto no ocurre en aquellos casos en los que un animal continúe alimentándose exclusivamente de leche, en cuyo caso el proventrículo sigue siendo rudimentario hasta las 14 o 15 semanas de edad (Figura 1).
Localización topográfica
El surco reticular está situado en el área formada por la intersección de dos líneas imaginarias: la primera, vertical, se extiende desde la octava vértebra torácica hasta la unión costocondral de la séptima costilla izquierda, y la segunda, horizontal, conecta el tercio medio de la séptima costilla izquierda con la séptima costilla derecha. Está situado entre la séptima costilla izquierda y la novena, y el interior del rumen está en contacto con el contenido ruminorreticular10.
Estructura
La ranura gástrica se compone de tres partes diferentes. La primera es el "surco" reticular, el cual está formado por dos pliegues musculares longitudinales o relieves, llamados labio derecho y labio izquierdo, y el surco de la ranura gástrica. Se inicia en el cardias, desciende en espiral a través de la curvatura menor del retículo (pared derecha) en dirección caudal hacia la izquierda y continúa en dirección dextro-caudal hacia el retículo-omasal, invirtiendo a su vez la posición de ambos labios. El labio derecho describe una rotación alrededor del izquierdo, en el sentido de las agujas del reloj, para volver a su posición inicial a la derecha, de modo que las fibras musculares adoptan una disposición en espiral, como un sacacorchos1,2.
Desde el orificio retículo-omasal hasta el orificio omaso-abomasal, la ranura gástrica es llamada "surco del omaso". Pasa a través de la curvatura menor del omaso. Este surco es interrumpido por un pliegue transversal (pilar omasal) formado por la convergencia de las fibras musculares circulares que refuerzan el orificio omaso-abomasal. Los “velos abomasales”, pliegues mucosos de transición, se extienden desde el abomaso hasta el pilar mencionado arriba. En los bovinos, estos velos están revestidos por el tegumento del omaso, mientras que en el ganado ovino, tanto la cara abomasal como la omasal de los velos son totalmente glandulares(1, 2). La última porción de la ranura gástrica es la "ranura abomasal” que corre a lo largo de la curvatura menor del abomaso, sin crestas y terminando en la parte del píloro1.
Inervación de la ranura gástrica
El mecanismo de control de la ranura reticular no está totalmente claro. Se cree que se debe a la interacción entre un control central y un control local6,12,13. El control central de la motilidad se produce a través del nervio vago13. Se puede atribuir el control local al plexo mientérico, pero la función de este plexo es poco conocida14.
En general la inervación corre a cargo del sistema parasimpático o extrínseco y del simpático o intrínseco. El sistema parasimpático, inervación eferente del estómago, consta de los troncos vagales ventral y dorsal, que acompañan al esófago a través del hiato10. Esta vía eferente posee efectos excitomotores sobre el surco reticular e inhibidores sobre la motilidad del complejo ruminorretículo (10.
La vía aferente es trigeminal, cuyos estímulos son la albúmina, la glucosa y los minerales de la leche -cobre en los ovinos y sodio en los bovinos-, se ve reforzado por los aferentes corticales y por el efecto producido por la succión15. Los troncos del nervio vago constan de fibras aferentes viscerosensitivas y motoras, que van a intervenir en los reflejos gástricos a través de centros medulares, que a su vez están influenciados por la corteza cerebral e hipotálamo (1,3.
. Schenk-Saber et al16 han demostrado que en las ovejas y cabras adultas las terminaciones nerviosas aferentes están muy desarrolladas en la membrana del retículo, cerca del labio izquierdo de la ranura reticular. Estas terminaciones, receptores con forma bastón, de botón o de punta de flecha, son muy importantes en la regulación de la ingesta y el paso de los alimentos.
Varios péptidos biológicamente activos, incluyendo el péptido intestinal vasoactivo (VIP, por sus siglas en inglés), han sido encontrados en las neuronas del tracto digestivo de los rumiantes neonatos y adultos. Se cree que el VIP juega un papel en la mediación de la relajación no adrenérgica y no colinérgica del orificio retículo-omasal y del abomaso durante el acto de mamar7,12. Esto se ve acompañado por un aumento en la concentración del VIP en la sangre venosa gástrica e intestinal7. Reid et al7 encontraron que una infusión arterial de VIP produce una relajación del orificio retículo-omasal y del orificio omaso-abomasal, similar a la que se produjo durante el acto de mamar10.
Riego sanguíneo
El suministro de sangre del estómago de los rumiantes proviene de la arteria celíaca, que se divide en varias ramas principales. La irrigación del surco gástrico es proporcionada por la arteria gastroepiploica izquierda, la arteria reticular accesoria y las ramas reticulares de la arteria reticular (que provienen de la arteria ruminal izquierda). Las arterias dorsal y ventral del surco reticular se originan a partir de la arteria reticular y proveen los dos labios del surco reticular. Las venas corren paralelas a las arterias y drenan en la vena porta. La vena esplénica, importante rama de la vena porta, garantiza el drenaje del surco reticular. Los vasos sanguíneos están acompañados por las cadenas de ganglios linfáticos derecha, izquierda y craneal, que a veces pueden faltar. Los órganos linfáticos auxiliares son ganglios situados por encima de la parte inferior; también hay ganglios retículo-omasales y atriales10.
Histología
Según Pochón10 la constitución estructural de las paredes de la ranura reticular comprende cuatro capas:
─ Túnica serosa, compuesta de tejido conectivo (colágeno y fibras elásticas) cubierto por mesotelio.
─ Capa muscular de origen mixto (lisa y estriada). En los labios del surco el tejido muscular es liso, con sus fibras dispuestas longitudinalmente17. En la base hay dos capas de tejido muscular: la capa exterior se compone de fibras lisas y estriadas en disposición longitudinal, y la capa interior comprende sólo el músculo liso y sus fibras están dispuestas perpendicularmente al eje longitudinal del surco. El plexo mientérico está situado entre las dos capas9,17.
─ Túnica submucosa, compuesta de tejido conectivo (fibras colágenas y elásticas), donde se encuentra el plexo submucoso9.
─ Capa mucosa, formada por un epitelio escamoso estratificado, la mucosa muscular y la lámina propia. Tiene pliegues longitudinales en los labios, y su epitelio es más oscuro y plegado. Cerca del orificio retículo-omasal se encuentran unas papilas unguiculiformes -unas papilas gruesas con forma cónica-, con un epitelio cornificado, ligeramente curvadas y aun torcidas desde la base10.
Se ha demostrado la existencia de glándulas de tipo mucoso, especialmente en animales adultos, así como serosas y mixtas en pre-rumiantes (recién nacidos).
Fisiología de la ranura reticular
Los rumiantes inician la vida de manera similar a los animales monogástricos en todos los asuntos referentes a la digestión, la absorción y metabolismo de los nutrientes principales. Así, la bebida consumida pasa directamente al abomaso, impidiendo su entrada en el rumen-retículo18, donde se producen los procesos de coagulación de la caseína por acción del cuajo. El tránsito del contenido abomasal, en un primer momento líquido y posteriormente solidificado, se ralentiza a fin de permitir la acción de las enzimas pepsina y lipasa para reducir los lípidos y proteínas a una forma más adecuada para la digestión intestinal10,19. Las alteraciones en la función de la ranura reticular hacen que caiga mucha leche en una cavidad ruminal todavía inmadura, lo que causará trastornos digestivos significativos a corto o largo plazo19.
La motilidad de la ranura reticular es iniciada por la contracción de las fibras lisas y estriadas de la capa muscular por dos movimientos. El primero de ellos, de acortamiento, se produce al unirse los labios derecho e izquierdo, permitiendo el paso directo del 30 al 40% del volumen del líquido hacia el abomaso. El cierre se completa con una torsión en torno al eje que se extiende a lo largo de la longitud del labio derecho, permitiendo el paso de entre 75 % y 90 % del líquido ingerido al abomaso. El reflejo del surco reticular actúa también en otros órganos, siendo acompañado por la inhibición transitoria de las contracciones del retículo y rumen durante el acto de mamar15,17, expansión del orificio retículo-omasal, apertura omasal y distensión abomasal5,10.
Denac et al14 estudiaron el efecto del péptido intestinal vasoactivo (VIP) en las fibras musculares incubadas en una solución orgánica derivada del surco reticular, orificio retículo-omasal y canal omasal en terneros y vacas adultas. La actividad mecánica muscular fue cuantificada mediante transductores isométricos e isotónicos. Observaron que se producía una relajación de las fibras musculares longitudinales y circulares del surco reticular, siendo el efecto menor en las vacas adultas, posiblemente por una involución de los receptores específicos del VIP en los músculos del surco reticular. También se produce en los terneros la relajación muscular del retículo-omasal y de las fibras longitudinales y circulares del orificio del canal omasal, siendo estas últimas menos sensibles al VIP que las del surco reticular. Finalmente se llegó a la conclusión de que el VIP juega un papel esencial en la función del surco reticular especialmente en los terneros lactantes, como un transmisor inhibidor, no adrenérgico y no colinérgico.
Se puede producir una activación del reflejo de cierre de la ranura reticular por estímulos centrales o periféricos9. El reflejo es iniciado por la acción de mamar y beber, por estímulos producidos por la visión de un biberón o por los preparativos para suministrar alimento. No parecen verse afectados ni por el tipo de líquido (agua, leche entera, leche descremada o suero), ni por la temperatura de la leche, ni por la posición adoptada durante el proceso de mamar9. El reflejo proviene exclusivamente del abomaso9. Contrariamente a esta conclusión, Pochón10 destaca que la temperatura del líquido ingerido juega un papel importante en el reflejo de cierre del surco reticular, siendo la respuesta más eficaz cuando el líquido se ofrece a la temperatura corporal.
La fibra aferente proviene de la región posterior de la cavidad oral después de la estimulación de los receptores orales y faríngeos activados por estímulos mecánicos y por ciertas sustancias, incluyendo algunos de los componentes de la leche20. Estos estímulos se transmiten al núcleo bulbar a través del nervio trigémino. La vía eferente está formada por fibras parasimpáticas colinérgicas del nervio vago dorsal y abdominal que actúa estimulando los labios del surco reticular e inhibiendo la motilidad de proventrículo8,9. Cuando los receptores faríngeos no se activan correctamente, los alimentos se transfieren al rumen y al retículo8. En el animal adulto este reflejo, que es vestigial, puede activarse bajo ciertas condiciones, como tras una severa privación de agua, deshidratación o aumento de la osmolalidad plasmática21. En respuesta, la hormona antidiurética es secretada por la neurohipófisis, causando el cierre del surco reticular, de modo que, cuando el animal bebe agua, ésta pasa directamente al abomaso y al intestino delgado para promover su rápida absorción, esquivando pasar por el retículo y el rumen9.
La influencia del sistema nervioso central se demuestra por la capacidad de condicionar este reflejo en un animal adulto mediante la visión, por ejemplo, de un biberón22. Así, la persistencia de este reflejo en el animal adulto depende de su manejo.
Técnicas para estudiar su funcionamiento
La actitud del animal cuando extiende el cuello, sacude la cola y muestra una evidente satisfacción al mamar vigorosamente, ya nos puede dar una idea del progreso en el reflejo23. Existen varios métodos experimentales para estudiar el funcionamiento del surco reticular en los rumiantes. Es posible hacer una clasificación simple en métodos directos y métodos indirectos.
Métodos directos
Son aquellos que permiten el estudio del surco reticular por observación directa desde fuera del animal. Wester24 abrió una ventana quirúrgica en la pared abdominal izquierda y el rumen, a la cual llamó "fístula ruminal". A través de ésta y por palpación directa de los labios del surco es posible percibir su funcionamiento. La ayuda de un espéculo y una bombilla de luz permite una observación directa de sus movimientos25,26.
Técnicas laparoscópicas. Se han utilizado equipos de endoscopía para mostrar el comportamiento del surco reticular en los rumiantes. Esto implica hacer una fístula ruminal, introducir la fibra óptica del endoscopio, y realizar la extracción de restos de contenido en el retículo y rumen (mediante bombas de vacío o aspiración) para facilitar la visibilidad del surco reticular. Cinotti y Gentile27 y González-Montaña et al28 han verificado la estimulación de la ranura reticular a través de este método.
Métodos indirectos
Se basan en el seguimiento de una sustancia conocida después de que ha sido administrada al animal, lo que hará posible estimar el comportamiento del surco reticular.
( Sacrificio del animal. Es el método más antiguo que se conoce, que consiste en suministrar leche a los animales y posteriormente sacrificarlos para inspeccionar el contenido de sus órganos10.
( Uso de sustancias coloreadas. Se han utilizado sustancias como el azul de metileno y la eosina para teñir el alimento y, a su vez, la mucosa de los órganos por donde se distribuyen29. Ross30 describe la distribución de las soluciones coloreadas en los proventrículos y abomaso tras la necropsia de los animales. También se puede considerar cuánto tiempo tarda el tinte desde su ingesta en los alimentos hasta que aparece en las heces. Se ha encontrado que el tinte que pasa a través del surco reticular podría encontrarse en las heces dentro de 12 h después de ser ingerido; sin embargo, este período se prolonga cuando llega al rumen y al retículo.
( Fístula ruminal y muestreo de su contenido. Consiste en proporcionar un líquido con una sustancia marcadora para observar su presencia o ausencia en el rumen, dependiendo del estado del surco. También permite la extracción de líquido introducido a través de la fístula ruminal31. Se ha utilizado como marcador metileno azul disuelto en agua, administrado a los animales por vía oral26,28.
( Fístula abomasal. Esta técnica quirúrgica también permite la inspección de la ruta que siguen los alimentos. Si se produce el cierre de la ranura reticular, los líquidos administrados a los animales se obtienen de forma inmediata a través de la fístula abomasal26.
( Rayos X y agentes de contraste. Es un método antiguo, pero se sigue utilizando. Los rayos X, principalmente laterolaterales se toman después de la ingestión de alimentos líquidos con un medio de contraste radiopaco (sulfato de bario) para evaluar el funcionamiento del surco reticular13,32,33.
En la actualidad se utilizan marcadores radiopacos sólidos (esferas de polietileno de 1.5 mm de diámetro, impregnadas de bario "BIPS") como un medio de contraste en el proventrículo y el abomaso de ovejas34. Estas esferas a menudo son utilizadas en animales de compañía para el diagnóstico de los trastornos de la motilidad intestinal y la obstrucción intestinal. Poppi et al35 establecieron un tamaño de partícula crítico de 1.2 mm de diámetro, por encima del cual no pueden pasar por el omaso y el abomaso.
( Nivel de glucosa y xilosa en la sangre. Este método se basa en la administración de los alimentos con glucosa y en la determinación de la glucemia o la xilosemia en una muestra de plasma sanguíneo36. La cantidad de glucosa administrada varía entre los diferentes autores, Encinas et al37 utilizaron una concentración de glucosa de 0.625 g/kg de peso corporal, a diferencia de otros26 que utilizan aproximadamente el doble de la dosis de solución de glucosa (1 g/ml/kg de peso corporal). Si ocurre el cierre de la ranura reticular, el alimento es absorbido directamente en el abomaso en un lapso no mayor de 30 a 60 min, y el pico de glucemia aparece de 60 a 90 min después de la ingestión. Por el contrario, si la glucosa entra en el rumen, será degradada por la microflora a ácidos grasos volátiles, aumentando lentamente su concentración en el plasma8,9,33,38,39. Otros investigadores estiman que el surco reticular se cierra cuando aparece el pico de glucosa en sangre entre 5 a 15 minutos posadministración26,37.
Sargison et al34 sugieren que el uso de glucosa y xilosa como marcadores puede ser incorrecto debido a los efectos del manejo del estrés en la concentración de carbohidratos. Se realizó una prueba de absorción de xilosa para evaluar el grado de cierre del surco reticular después de la administración de sulfato de cobre al ganado ovino. Dicha prueba consiste en estimular el surco y, a continuación, aplicar D-xilosa (0.5 g/kg de peso corporal), utilizando un catéter. Si ocurre el cierre, éste causará una elevación de la concentración de xilosa en la sangre8,9. Cuando se aplica la xilosa directamente en el rumen a través de una fístula ruminal, se fermenta y no es posible detectarla en la sangre; pero en los casos en que se la administró por vía oral en ausencia de reflejo del surco, la solución de xilosa llegó al retículo y al rumen y cerca del orificio retículo-omasal, y pasó al omaso y al abomaso y al intestino, desde donde fue absorbida39. La estimulación del surco reticular hace que cuando se administra oralmente, mediante un catéter, 500 ml de una solución de glucosa al 10%, se produzca un aumento significativo de los niveles de azúcar en la sangre, que se encuentra en muestras de sangre tomadas 15 min después de la aplicación28. Sin embargo este aumento es muy pequeño cuando no se ha conseguido estimular el surco reticular.
( Electromiografía. Se basa en la implantación de electrodos en la pared muscular del proventrículo y la detección, amplificación y registro de la acción potencial generada por las fibras musculares lisas. Después de la estimulación del surco reticular, la motilidad del rumen y del omaso cesa; el retículo, por el contrario, experimenta pequeñas sacudidas38.
( Determinación del estroncio y del cromo. El cloruro de estroncio (SrCl2) y el óxido crómico (Cr2O3) son dos marcadores que, al administrarse con alimento líquido son solubles, pudiendo ser determinada su concentración mediante espectrofotometría de absorción atómica, tanto en el contenido ruminal (estroncio) como en la mucosa de los órganos (cromo). Hedde y Ward31 utilizaron estroncio (5 mg/kg de peso corporal) para evaluar la eficacia de la “elusión del rumen” en los terneros mediante diversas vías de administración. Señalaron que el reflejo del surco fue completo en los animales alimentados con biberón, y no se detectó estroncio en las muestras del rumen. Sin embargo, en aquellos terneros que recibieron estroncio en el agua potable se recuperó todo el estroncio del rumen.
( Implantación de termosensores. Se basa en el uso de catéteres con termosensores alojados por laparotomía en el rumen y el abomaso para medir la temperatura con un dispositivo termosensible. Cuando se produzca el cierre del surco reticular, se detecta antes una variación en la temperatura en el sensor ubicado a nivel abomasal que en uno implantado en el rumen23.
( Prueba basada en la detección del carbono 13 del ácido octanoico excretado en la respiración. Consiste en identificar una sustancia con una reacción conocida, a través de una enzima que genera la reacción, en cuya fase final, se libera 13CO2, el cual se difunde a la sangre, es transportado a los pulmones y se exhala a través del aire espirado. Se toman muestras de este aire para luego medirlo en un espectrómetro de masas de relación isotópica23.
Manipulación de la ranura reticular y su uso en la medicina veterinaria
Introducción
El reflejo de cierre del surco reticular en los rumiantes jóvenes evita que el alimento lácteo pase a través del rumen y del retículo, y garantiza que vaya directamente al abomaso a través del orificio retículo-omasal (Figuras 2 a 5). El conocimiento de los factores fisiológicos, así como de las posibles manipulaciones farmacológicas del reflejo del surco reticular, tanto para estimularlo como para inhibirlo, son de gran interés para la administración oral de ciertos fármacos utilizados en el tratamiento de ciertas enfermedades internas, e incluso para el mejor uso de algunos alimentos en los rumiantes, tanto adultos como lactantes26,40.
Técnicas de manipulación
Se han estudiado durante muchos años, los efectos de la dieta y la manipulación del reflejo del surco reticular, especialmente en los terneros. Según la mayoría de los investigadores, la succión es el estímulo más importante, pues se considera que causa el reflejo de cierre del surco reticular10. “El paso hacia el abomaso de líquidos bebidos desde un balde por los terneros, no está determinado por la temperatura o la composición del líquido, ni por la postura del animal mientras mama, ni por el acto de mamar en sí, sino que es resultado de la acción de un tipo de comportamiento que acompaña al acto de mamar” 12.
Condicionamiento del reflejo
Hay muchos experimentos que sugieren que el reflejo puede ser condicionado por una variedad de circunstancias. La prueba definitiva de que el surco reticular es funcionalmente condicionable se obtuvo al comprobar que una sustancia líquida depositada directamente en el fondo de la boca y faringe, donde se encuentran una serie de receptores nerviosos, penetraba hacia el abomaso, siempre y cuando el animal recibiese a la vez estímulos visuales y auditivos de los utensilios y del material utilizados durante la alimentación habitual del rumiante joven, y quizás en este estímulo también participasen estímulos olfatorios15. Sin embargo, en ausencia de los estímulos anteriormente señalados los líquidos llegaban hasta rumen y retículo 41.
La intensa excitación que suscita la visión del biberón en un sujeto condicionado -por ejemplo, una oveja adulta- es suficiente para duplicar o triplicar el volumen de líquido recogido a través de una fístula abomasal después de su administración en la parte inferior del esófago. El electromiograma indica que se produce un cierre eficaz del surco reticular22. Estos resultados muestran que el comportamiento de mamar puede desencadenarse por otros estímulos distintos de éstos de origen orofaríngeo, y sus componentes autónomos no corresponden a un cierre más o menos completo de la ranura reticular. En la misma línea otros investigadores argumentan que la inducción del cierre del surco reticular en terneros alimentados con leche requiere una serie de condicionantes, incluyendo que el líquido bebido debe estar en contacto con los receptores de la faringe, debe ser ingerido voluntariamente por el animal, su olor y sabor no deben ser ofensivos, y el estado general del animal no debe ser alterado42,43. Cuando cualquiera de estos factores no se cumple, el surco reticular se cierra de forma incompleta, lo cual da como resultado que la leche pase al rumen y al retículo, donde es fermentada por los microorganismos43.
Por lo tanto, en algunas enfermedades este reflejo puede ser perturbado, por lo que en los animales lactantes la vía aferente puede dejar de producir el reflejo debido a una faringitis o a la presencia de abscesos orofaríngeos8,9 o infecciones de la laringe19. En terneros de menos de 14 días de edad afectados por enteritis catarral aguda se observó la ausencia de cierre del surco reticular en el 11.2 % de los animales, y de los 249 pacientes murieron 11. Posiblemente eso se haya debido a una acidosis ruminal causada por el incremento del ácido butírico y la fermentación del ácido láctico o viceversa, lo cual puede provocar diarrea neonatal por disfunción del surco reticular en la alimentación con leche materna. Estos terneros tenían lesiones pronunciadas de disqueratosis de la mucosa ruminal43.
Al parecer, un ternero o cordero necesita estar en una situación de confort, sin situaciones estresantes, para el buen funcionamiento del estímulo en el surco reticular. Por tanto, no es de extrañar que una alimentación forzada (mediante sonda o botella aplicada en la boca del animal) significa una ingestión forzada, incómoda para el animal, lo cual puede frenar el estímulo y provocar que los líquidos pasen al retículo y al rumen.
Sin embargo, en aquellos animales que se alimentan directamente del pezón de la madre o de un biberón, el acto de mamar puede ser considerado como el más importante estímulo para el reflejo de cierre del surco reticular10,22,41, e incluso una estimulación mecánica por la tetina del biberón o de un chupete también pueden contribuir32.
Lugar de administración de los líquidos
Hay muchas investigaciones en las que se ha demostrado que cuando algunas sustancias se administran mediante un tubo esofágico se puede inhibir el reflejo de cierre del surco reticular19,20,29,33. Según Ørskov y Benzie44 y Van Weeren-Keverling Buisman et al20, ya desde 1951 Comline y Titchen15 señalaron a los receptores nerviosos ubicados en la boca y la faringe como los responsables del cierre del surco reticular.
Chapman et al33 encontraron un tratamiento más eficaz cuando se suministran grandes cantidades de líquidos a los terneros deshidratados. En los terneros a los que se administraron diversas soluciones por un catéter esofágico se constató que el surco reticular no se cerraba incluso después de la administración de soluciones de bicarbonato de sodio, sulfato de cobre y clorhidrato de guanidina. Sin embargo, cuando se aplicaron soluciones comerciales de glucosa, aminoácidos y electrolitos en cantidades significativas -de por lo menos 2 litros-, hubo un aumento significativo en el nivel de glucosa en la sangre. Por lo tanto, los resultados de este estudio sugieren que es posible administrar ventajosamente los líquidos destinados a ser absorbidos en el intestino utilizando una sonda esofágica, incluso aunque no se produzca el cierre del surco reticular (33.
Características de los líquidos administrados
La estimulación de los receptores orofaríngeos y linguales ha sido atribuida a la proteína y a las sales de la leche, que activan el reflejo de cierre del surco reticular22. Hay muchos ejemplos de investigaciones que han trabajado con líquidos de diferente naturaleza para provocar el cierre efectivo de la ranura reticular15,41,45-48. La leche suministrada a diferentes temperaturas y bajo la misma rutina de manejo, puede estimular eficazmente el surco reticular, pero la respuesta es más intensa cuando la leche se ofrece a temperatura corporal. También el agua administrada oralmente a temperatura corporal es capaz de provocar un cierre parcial de esta estructura, aunque el agua fría no estimula el reflejo10. Algunas investigaciones han demostrado que es posible recuperar agua del abomaso, después de que este líquido ha pasado por la ranura reticular, cuando se realizan experimentos en animales condicionados que han sido previamente acostumbrados a tomar la leche desde una cubeta. Por todo ello parece ser que el reflejo condicionado probablemente sea más importante que la naturaleza del líquido administrado (10,15,41,44,45,47.
Pochón10 cita que en 1957 Hegland et al49, preocupados por los efectos de la dieta y del manejo, estudiaron el destino de diversos líquidos, como la leche entera, leche descremada reconstituida, el suero de leche reconstituido, el agua, y el alimento en cápsulas en terneros fistulados alimentados mediante cubo normal y cubo con tetina. En aquellos casos en que se administraron cápsulas de diferentes tamaños junto con alimento líquido, el cierre del surco reticular condujo a estas cápsulas al omaso; sin embargo, si el ternero no estaba recibiendo alimento líquido junto con las cápsulas, éstas eran colocadas en el retículo. Se aceptó que una cápsula había pasado a través del surco reticular cuando después de un minuto no estaba ni en el rumen ni en el retículo. Por lo tanto, según Hegland et al49 cualquiera de los líquidos probados fue capaz de inducir la estimulación de la ranura reticular, provocando el cierre completo en todos los terneros probados durante las primeras 6 semanas de vida. También encontraron que la eficacia es similar con ambos métodos de alimentación (cubo abierto y cubo con tetina): la alimentación del cubo con tetina prolongó el reflejo en todos los terneros hasta 13 semanas después del nacimiento, mientras que en aquellos terneros que bebieron directamente del cubo abierto sólo se presentó el reflejo en las primeras seis semanas de vida.
Para comprobar el posible efecto del suero en el surco reticular se alimentó a 14 terneras lecheras con una dieta líquida46. Se realizaron observaciones experimentales cada dos semanas, a partir de las 20 semanas de edad hasta la 30a semana, y la ingesta de suero de una cubeta, procediendo a la palpación de los labios del surco a través de una fístula ruminal y a la recolección del suero que había pasado al abomaso. La diferencia entre lo que se había consumido y lo que se recuperó sería la cantidad de suero que llegó al compartimento rúmino-reticular. En la mayoría de los animales, se recolectó el 80% de los alimentos, excepto a las 20 semanas, cuando el porcentaje fue del 53 %. El reflejo del surco ocurrió de 15 a 20 seg después de la ingestión. Se concluye que el uso de suero llevó al cierre de la ranura reticular; también la ingestión continua de cantidades crecientes de lactosuero, manteniendo hábitos de consumo (horarios, forma de dosificación y temperatura), permitió el mantenimiento del reflejo en el tiempo, con la consiguiente digestión del derivado lácteo a nivel intestinal. La ganancia en peso era mayor que en aquellos animales donde el suero de leche se desviaba hacia el rumen 46.
Temperatura de los líquidos administrados
Ya se ha indicado que tanto el agua como la leche a la temperatura del cuerpo puede causar en mayor o menor medida el cierre de la ranura reticular. El agua fría no estimula este reflejo10. Sin embargo, para Ørskov45, los estímulos como la temperatura y la composición de los alimentos, la forma de dosificación y la posición del animal son mucho menos importantes para el reflejo del surco reticular que el entorno que rodea el animal o su estado mental en el momento de la ingestión de alimentos líquidos.
Método de administración de fluidos
La mera visión de un biberón es suficiente para activar el cierre de la ranura reticular en los animales adultos, siempre que se los haya acostumbrado a beber leche o líquidos de esta forma(10,22). Este reflejo también está presente si a los animales jóvenes se les enseña a beber leche de un cubo con una tetina10,41. Este comportamiento sería similar al que se produce cuando un animal mama de la ubre de su madre.
En 1928 ya se había observado, mediante fístulas ruminales, que, al utilizar un mecanismo de tetina en la alimentación de terneros, la leche discurría a través del surco hacia omaso y abomaso, sin embargo cuando bebían directamente desde un cubo gran cantidad de la leche ingerida pasaba hacia la cavidad ruminorreticular 10. Unos años más tarde, en 1942, Wise et al25, al trabajar con terneros de 17-56 días de edad, también encontraron más leche en el rumen y en el retículo cuando el alimento se suministró a los animales en una cubeta común y corriente (abierta) que cuando se utilizó una cubeta con boquilla ligeramente elevada10. Al examinar el efecto del cierre del surco reticular en la absorción de una combinación de sulfametoxazol-trimetoprima en terneros de seis semanas de edad entrenados para succionar la leche de una cubeta con tetina con una tetina, encontraron que la concentración máxima en plasma y la máxima persistencia del sulfametoxazol es 7.5 veces mayor y 6.9 veces más prolongada cuando se administra mediante un cubo con tetina que si se utiliza una sonda esofágica50, mientras que el trimetoprim sólo se detecta en el plasma cuando los terneros son alimentados con leche en cubetas con tetina; esto se justifica en ambos casos por el cierre del surco reticular, con el consiguiente paso de los fármacos administrados oralmente al abomaso, lo que se traduce en una mayor disponibilidad de los mismos50.
Sales minerales
Se han probado diversas sustancias para manipular el reflejo del surco reticular en los rumiantes, en algunos casos aplicadas por vía parenteral y en muchos otros administradas oralmente.
Sales de cobre
Varios autores creen que las sales orales de cobre siguen siendo el método más eficaz. Después de revisar varios estudios, Pochón10 ha señalado que en los ovinos el sulfato de cobre es la sal más eficaz21,25,29,30,32,36,38,39,44, aunque otras como el acetato de cobre y el cloruro de cobre21,32 y el sulfato de zinc21,30 también son capaces de causar el cierre. También se ha demostrado su eficacia en el ganado adulto24, si bien no han sido particularmente eficaces cuando se han utilizado en los terneros10,33 o en cabras51.
Según algunos autores21, la solución de sulfato de cobre al 10 % es el agente más poderoso para estimular el reflejo del surco reticular por estimulación de los receptores orofaríngeos en los ovinos adultos. También se ha empleado el sulfato de cobre al 10% para provocar el cierre del surco reticular y estudiar electromiográficamente la motilidad del estómago de los ovinos adultos. Previamente al estudio electromiográfico administraron por vía oral una solución de glucosa al 20%, antes y después de la aplicación del sulfato de cobre, y comprobaron que todas las ovejas respondían positivamente a la estimulación, modificando de forma importante su glucemia. Para activar el reflejo del surco, Nicholson y Belkhiri18 utilizaron sulfato de cobre oral (1 g en 10 ml de agua), pero más tarde inhibieron el reflejo con la aplicación de clonidina.
En un intento de probar el efecto de la administración de sulfato de cobre y sulfato de cobalto en la estimulación del surco reticular, Sargison et al34 usaron ovejas de 10 meses de edad recientemente alimentadas (10 en cada grupo), a las que se administró sulfato de bario como medio de contraste y esferas de polietileno impregnadas con bario sólido como marcadores radiopacos, y que posteriormente fueron estudiadas bajo radioscopia. Sin embargo, otros52 no lograron estimular sistemáticamente el surco reticular administrando sulfato de cobre (20 ml al 10 %) por vía oral.
Sales de sodio
En cambio, las sales de sodio (cloruro, sulfato, bicarbonato, acetato, etc.) parecen tener un mayor efecto en el ganado bovino, mientras que en los ovinos raramente son eficaces32,53. De Vuyst 29 provocó el reflejo de cierre del surco reticular en bovinos adultos con una solución de NaHCO3 al 10%, mientras que si esta solución era administrada a través de una sonda esofágica, sobrepasando la mucosa bucal, no había reflejo. Un efecto similar se comprobó en un trabajo experimental realizado con una solución de sulfato de sodio en solución al 7%, junto con una solución de eosina al 0,1% como marcador, lo que permitió comprobar que cualquier alimento administrado posteriormente pasaba a través del surco reticular, por lo que en el rumiante adulto los nutrientes de alta calidad podrían pasar al abomaso a través del surco reticular, evitando ser destruidos por las fermentaciones ruminales29. Previamente varios investigadores habían logrado cerrar el surco reticular en el ganado vacuno, con alta efectividad 25,30,36,53.
Mikhail et al26 obtuvieron un aumento significativo en la glicemia en cabras por la administración de glucosa oral después de estimular el surco reticular con 1.5 ml de una solución saturada de NaCl o 10.5 ml de una solución de NaCl al 1.5 % aplicada por vía intravenosa. La administración oral de bicarbonato sódico o sulfato de cobre a terneros utilizando un catéter esofágico no estimula el cierre del surco reticular33, pero quizás este hecho obedezca también a las molestias causadas a los animales cuando se emplea este método, lo que puede dar como resultado una incapacidad para cerrar el surco10. Bakker54 administró soluciones hipertónicas de cloruro de dextrosa, solución salina hipertónica y solución hipertónica de bicarbonato de sodio y de sulfato de magnesio, y ninguna de ellas fue capaz de desencadenar el reflejo del surco reticular, de modo que concluyó que no era posible repetir los estudios anteriores que habían estimulado el cierre mediante el uso de diversas sales, especialmente de NaCl y HCO3Na, y que los resultados obtenidos habían sido una consecuencia de la hipovolemia, más que por el propio cierre de esta estructura.
Soluciones de glucosa
La glucosa en concentraciones de entre 5 y 10 % puede provocar el cierre del surco reticular24; sin embargo, Riek53 no pudo lograr este efecto. La administración de soluciones de azúcar no fue suficiente para estimular el cierre de la ranura reticular cuando fueron administradas oralmente a cabras26, quizá porque los animales utilizados en el experimento todavía conservaban el reflejo de cierre del surco reticular51.
Vasopresina
Hay muchos experimentos en los que se ha utilizado la vasopresina para desencadenar este efecto20,26,48,57. En algunos casos, la administración ha sido exógena; en otros ha sido una liberación endógena en animales deshidratados y sedientos, o bien tras la administración intravenosa de soluciones de cloruro sódico.
En las cabras, la privación de agua provoca un aumento de los niveles sanguíneos de vasopresina (ADH) como respuesta a la sed51. La liberación endógena de vasopresina después de la estimulación de los osmorreceptores con una solución hipertónica de cloruro de sodio provoca el cierre de la ranura reticular y el consiguiente aumento del nivel de glucosa en la sangre58.
Mikhail et al26 determinaron la influencia de la sed, de la administración de cloruro de sodio en la arteria carótida común y de la administración de vasopresina en el cierre del surco reticular en cabras adultas. Las soluciones de NaCl inducen la secreción endógena de vasopresina, la responsable del efecto sobre el surco reticular; la privación de agua durante 48 h también dio lugar al paso de grandes cantidades de agua al abomaso, con hiperglucemia si el agua era administrada oralmente con glucosa26.
Encinas et al37 estudiaron la farmacocinética de un medicamento antiinflamatorio no esteroideo -el meclofenamato sódico- utilizado en las ovejas para el tratamiento y la profilaxis de las enfermedades alérgicas y de la mastitis. Este producto fue administrado oralmente y por vía intravenosa a ovejas, y determinó la influencia del cierre de la ranura reticular en la biodisponibilidad del fármaco. Para estimular la ranura reticular, emplearon como pre-tratamiento una solución de lisina-vasopresina (0.3 UI/kg PV i.v.) o de NaCl al 0.9 % i.v.IV 10 min antes de la administración oral de glucosa (como marcador indirecto) y meclofenamato sódico. Señalaron que en los ovinos a los que se administró la lisina-vasopresina, el surco reticular se cerró en todos los casos, mientras que con el 0.9 % de NaCl, la estimulación ocurrió sólo en 2 de 6 ovejas. Por supuesto, la concentración plasmática y la tasa de eliminación del meclofenamato sódico después de su administración oral fueron influidas por el estado del surco reticular, mientras que no se encontraron diferencias en cuanto a la biodisponibilidad de los pre-tratamientos.
La vasopresina también se ha utilizado con resultados positivos en vacas adultas con grave deficiencia de fósforo, a las que se administró fosfato por vía oral. Se determinó que la solución fue desviada hacia el abomaso, con una absorción más rápida59.
Inhibición del reflejo
La inhibición del reflejo también puede ser interesante en algunas prácticas con ovejas. La inhibición se puede conseguir administrando un anestésico local en la cavidad bucal, con inyecciones intravenosas de atropina, que actúan a nivel de la vía eferente12,60, y con metoclopramida (0.2 mg/kg)61, que actúa como un antagonista de la dopamina a través del sistema colinérgico. La domperidona tiene un efecto similar, aunque no con la misma intensidad de acceso en el SNC que la metoclopramida62. Algunas investigaciones18 establecen que la norepinefrina actúa sobre la motilidad del surco a través de un mecanismo colinérgico.
Nicholson y Belkhiri18 utilizaron la clonidina en dosis de 2 y 4 (g/kg IV en ovinos adultos como un inhibidor del reflejo del surco reticular por su acción agonista al alfa-2 adrenorreceptor , que causa la inhibición de la motilidad rúminorreticular al actuar sobre el SNC. Se utilizó sulfato de cobre administrado oralmente para activar el reflejo del surco reticular. La clonidina en dosis de 2 (g/kg produjo una disminución de la motilidad reticular, y una paralización completa durante 10-50 minutos en aquellos animales que recibieron 4 (g/kg. Cuando se utilizó posteriormente un antagonista (-2 idazoxán en una dosis de 0.1 mg/kg, antes de aplicar clonidina para prevenir la inhibición del cierre del surco, observaron un aumento en la concentración máxima del marcador utilizado (xilosa), más significativo si se utilizaba sólo idazoxán. El hexametonio ejerce un efecto de bloqueo ganglionar similar a la vagotomía, pues evita la contracción del surco reticular10,13.
Uso en medicina veterinaria
La capacidad de controlar este reflejo es de gran interés para la administración oral de diversos medicamentos en el tratamiento de ciertas enfermedades, así como para el uso más eficiente de ciertos recursos alimentarios. Hay muchos protocolos experimentales en los que se ha demostrado que los tratamientos con soluciones de glucosa26,42,63-65, con AINES como el meclofenamato y el paracetamol37,66,67, con ciertos antibióticos como el cloranfenicol57 o el sulfametoxazol-trimetoprim50, y algunos antiparasitarios generalmente son ineficaces debido a la degradación del producto por la microflora ruminal o, por el contrario, debido a su rapidísimo paso por el rumen68-70. Por lo tanto, es de gran interés estimular el cierre del surco en el primer caso y suprimirlo en el segundo.
No hay duda de que la eficacia terapéutica de ciertas sustancias mejoraría considerablemente si estos productos pudieran atravesar directamente el estómago y llegar al abomaso. Incluso se ha postulado que se podría utilizar la manipulación de la ranura reticular para obtener mayores rendimientos económicos al manipular la alimentación del ganado bovino23,29,42,44,62.
Algunos investigadores han hecho uso de la vasopresina en diferentes concentraciones para estimular el surco reticular en los rumiantes, facilitando el tratamiento de enfermedades tales como la cetosis, la diarrea y la toxemia ovina de la gestación ovina26,28,42,64. Así, algunos autores63,71 obtuvieron mejores resultados en el tratamiento de enfermedades tales como la diarrea bovina inespecífica o la cetosis primaria en los animales en los que se utilizó la vasopresina para estimular el cierre del surco reticular que en los del grupo testigo. El-Hamamsy et al64 y González-Montaña et al28 utilizaron la lisina-vasopresina para estimular el cierre del surco reticular y demostraron su eficacia para aumentar el nivel de glucosa tras la administración de una solución de glucosa por vía oral, ya que esta sustancia llegó directamente al abomaso, con lo cual se evitaron fermentaciones ruminales no deseadas.
Según Ranzini Rodrigues et al23, el rendimiento de los terneros que reciben una fuente de proteína no degradable es, en la mayoría de los casos, mejor que el de los animales que no la reciben72-74, debido al mayor flujo de aminoácidos que llegan al intestino delgado23. Por lo tanto, un medio eficaz para evitar la degradación de la proteína a medida que pasa por el rumen, evitando así la pérdida de aminoácidos dietéticos esenciales, sería proporcionar fuentes de proteína a través del surco reticular.
Otros autores han demostrado la eficacia de usar el reflejo del surco reticular en la administración de diversos suplementos líquidos a terneros (leche, leche descremada, suspensión de salvado de soja, harina de pescado y lactosuero) en comparación con aquellos que los recibieron concentrados41,47. También Standaert et al75 encontraron un incremento en la producción de leche en las vacas que fueron alimentadas con caseína a través del surco reticular, comparadas con aquellas que recibieron la misma cantidad de proteínas, pero en forma sólida.
Por el contrario, en algunos casos una inhibición del reflejo del surco reticular es importante desde el punto de vista de la administración de diversos medicamentos. De manera que el manejo del surco reticular es particularmente relevante cuando se usa en conjunción con medicamentos antiparasitarios40,76,77. Mc Ewan y Oakley40 atribuyen el fracaso de ciertos antihelmínticos al cierre del surco reticular en terneros, al reducirse el período de contacto con determinados parásitos como los nematodos. En terneros, con peso entre 125 y 205 Kg, el surco es todavía funcional, por lo que la necropsia evidencia que existe bypass ruminal en la mitad de los animales, y que la eficacia antiparasitaria se ve reducida. La eficacia del fenbendazol (PanacurR; Hoeschst) es variable frente a la inhibición de las larvas de Ostertagia ostertagi en el ternero76,77.
Otros antiparasitarios estudiados mediante la estimulación del surco reticular son el bencimidazol68, el oxfendazol69 o algunos coccidiostáticos como los ácidos grasos de cadena media (AGCM)70,78.
Agradecimientos
A la señora Anna Krutter Abilla su asistencia en la revisión lingüística de este artículo.
REFERENCIAS
1. Sandoval JJ. Tratado de anatomía veterinaria. Tomo 1: Embriología. 3rd ed. León, Spain: Editorial Facultad de Veterinaria de Córdoba; 1988. [ Links ]
2. Barone R. Anatomie comparée des mammifères domestiques. Tome 3: Splanchnologie I, appareil digestif, appareil respiratoire. 3a ed. Paris, France: Editions Vigot; 1984. [ Links ]
3. Nickel R, Schummer A, Seiferle E. The anatomy of the domestic animals. Vol 2: The viscera of the domestic mammals. Berlin, Germany: Verlag Paul Parey; 1979. [ Links ]
4. International Committee on Veterinary Gross Anatomical Nomenclature (ICVGAN). Nomina Anatomica Veterinaria (5th ed). Hannover (Germany), Columbia, (USA), Ghent (Belgium), Sapporo (Japan): International Committee on Veterinary Gross Anatomical Nomenclature; 2012. [ Links ]
5. Titchen DA, Newhook JC. Physiological aspects of sucking and the passage of milk through the ruminant stomach. In: McDonald IW, Warner ACI, editors. Digestion and metabolism in the ruminant. Armidale, Australia: University of New England Publishing Unit Armidale; 1975:15-29. [ Links ]
6. Reid AM, Shulkes A, Titchen DA. Effects of the vagus nerves on gastric motility and release of vasoactive intestinal polypeptide in the anaesthetized lamb. J Physiol 1988;(396):11-24. [ Links ]
7. Reid AM, Shulkes A, Titchen DA. The effects of vasoactive intestinal polypeptide on gastric motility in the lamb. J Physiol 1988;(396):41-54. [ Links ]
8. Ruckebusch Y, Phaneuf LP, Dunlop R. Physiology of small and large animals. Philadelphia, USA: Decker B; 1991. [ Links ]
9. Arruebo MP. Fisiología digestiva de los rumiantes. En: García-Sacristán A, et al, editores. Fisiología Veterinaria. Madrid, España: Mc Graw-Hill-Interamericana; 1996: 599-618. [ Links ]
10. Pochón DO. Surco reticular de los rumiantes. Revisión bibliográfica. Rev Vet 2002;(12/13):34-44. [ Links ]
11. Molinari E, Jorquera B. Periodos del desarrollo intrauterino de los compartimentos gástricos del caprino (Capra hircus). Anat Histol Embryol 1988;17(2):121-37. [ Links ]
12. Newhook JC, Titchen DA. Effects of vagotomy, atropine, hexamethonium and adrenaline on the destination in the stomach of liquids sucked by milk-fed lambs and calves. J Physiol 1974;(237):415-430. [ Links ]
13. Newhook JC, Titchen DA. Cineradiography of the reticular groove mechanism. Aust Vet J 1976;(52):132-135. [ Links ]
14. Denac M, Oertle C, Kümin G, Eggenberger E, Scharrer E. Relaxation of muscle strips from the reticular groove and reticulo-omasal orifice by vasoactive intestinal peptide (VIP). Zentralbl Veterinarmed A 1990;(37):425-429. [ Links ]
15. Comline RS, Titchen DA. Reflex contraction of the oesophageal groove in young ruminants. J PhysiolPhysiological Soc 1951; (115):210-226. [ Links ]
16. Schenk-Saber B, Schnorr B, Weyrauch KD. Afferent nerve endings in the forestomach mucosa of sheep and goats. Z Mikrosk Anat Forsch Germany; 1985; (99):773-784. [ Links ]
17. Dellmann HD, Brown EM. Textbook of veterinary histology. Philadelphia, USA: Lea & Febiger; 1976. [ Links ]
18. Nicholson T, Belkhiri M. The inhibition of the reticular groove reflex in sheep by clonidine. Zentralbl Veterinarmed A 1991;(38):265-270. [ Links ]
19. Scholz H. Sulla funcionalità della doccia esofagea. Atti della Soc Ital di Buiat 1995;(27):551-561. [ Links ]
20. van Weeren-Keverling BA, Kuiper R, Wensing T, Breukink HJ. The effect of vasopressin on the closure of the reticular groove in the veal calf. J Anim Physiol Anim Nutr 1990;(64):240-249. [ Links ]
21. Monnig HO, Quin JI. Studies on the alimentary tract of the merino sheep in South Africa. 11. Investigations on the physiology of deglutition. Onderstepoort J Vet Sci Anim 1933;(5):117-133. [ Links ]
22. Ruckebusch Y, Kay RNB. Sur le réflexe de fermeture de la gouttière esophagienne. Ann Biol Anim Biochem Biophys 1971;(11):281-282. [ Links ]
23. Ranzini Rodrigues R, de Sousa Lucci C, Mazza Rodrigues PH. Alimentação de bezerros ruminantes com dieta sólida ou líquida, via goteira esofageana: formação da goteira e escape ruminal. Rev Bras Zootec 2002;(31):2364-2372. [ Links ]
24. Wester J. The rumination reflex in the ox. Vet J 1930;(86):401. [ Links ]
25. Wise GH, Anderson GW, Linnerud AC. Relationship of milk intake by sucking and by drinking to reticular-groove reactions and ingestion behavior in calves. J Dairy Sci 1984;(67):1983-1992. [ Links ]
26. Mikhail M, Brugère H, Le Bars H, Colvin HWJ. Stimulated esophageal groove closure in adult goats. Am J Vet Res 1988;(49):1713-1715. [ Links ]
27. Cinotti S, Gentile A. Osservazione in endoscopia ruminale nel vitello lattante: funzionalità della doccia esofagea. Atti della Soc Ital di Buiat 1989;(21):283-286. [ Links ]
28. González-Montaña JR, Martín MJ, Benech A, Alonso ME, Alonso AJ, Cal-Pereyra LG. Handling the gastric groove closure in adult sheep using lysine-vasopressin. Small Ruminant Res 2014;121:418-424. [ Links ]
29. De Vuyst A. El reflejo de la gotera esofágica. Zootecnia. 1975;24 (3-4):241-242. [ Links ]
30. Ross IC. The passage of fluids through the ruminant stomach. Aust Vet J 1931;(7):122-134. [ Links ]
31. Hedde RD, Ward GM. Strontium as an indicator of rumen by-pass efficacy. J Dairy Sci 1973;(56):1567-1569. [ Links ]
32. Watson R. Studies on deglutition in sheep. 1. Observations on the course taken by liquids through the stomach of the sheep at various ages from birth to maturity. Counc Sci Ind Res Bull 1944;(180):7-94. [ Links ]
33. Chapman HW, Butler DG, Newell M. The route of liquids administered to calves by esophageal feeder. Can J Vet Res 1986;(50):84-87. [ Links ]
34. Sargison ND, Stafford KJ, West DM. Fluoroscopic studies of the stimulatory effects of copper sulphate and cobalt sulphate on the oesophageal groove of sheep. Small Ruminant Res 1999;(32):61-67. [ Links ]
35. Poppi DP, Norton BW, Minson DJ, Hendricksen RE. The validity of the critical size theory for particles leaving the rumen. J Agric Sci 1980;(94):275-280. [ Links ]
36. Lousse A, Ronsse P. Le refléxe de fermeture de la gouttière oesophagienne. I. Son controle par le mesure de la glucémie apres un repas glucose. Ann Médecine Vétérinaire 1950;94:1-14. [ Links ]
37. Encinas T, Vinagre E, Boggio JC, San Andres MD, Rodriguez C, San Andres MI. Influence of closure of the reticular groove on the bioavailability and disposition kinetics of meclofenamate in sheep. J Vet Pharmacol Ther 1996;(19):15-21. [ Links ]
38. Tsiamitas C, Brikas P. Forestomach motility in adult sheep when reticular groove closure is provoked by copper sulphate solution. Ann Rech Vétér 1981;(12):117-121. [ Links ]
39. Nicholson T. The xylose absorption test in sheep by activation of the reticular groove reflex. Can J Anim Sci 1984;(64):187-188. [ Links ]
40. Mc Ewan AD, Oakley GA. Anthelmintics and closure of the oesophageal groove in cattle. Vet Rec 1978;(102):314-325. [ Links ]
41. Ørskov ER, Benzie D, Kay RN. The effects of feeding procedure on closure of the oesophageal groove in young sheep. Br J Nutr 1970;(24):785-795. [ Links ]
42. Lateur-Rowet HJM, Breukink HJ. The failure of the oesophageal groove reflex, when fluids are given with an oesophageal feeder to newborn and young calves. Vet Q 1983;(5):68-74. [ Links ]
43. Dirr L, Dirksen G. Dysfunction of the esophageal groove (“ruminal drinking”) as a complication of neonatal diarrhea in the calf. Tierarztl Prax 1989;(17):353-358. [ Links ]
44. Ørskov ER, Benzie D. Using the oesophageal groove reflex in ruminants as a means of bypassing rumen fermentation with high-quality protein and other nutrients. Proc Nutr Soc 1969;28:30A-31A. [ Links ]
45. Ørskov ER. Condicionamiento fisiologico en los rumiantes y sus consecuencias prácticas. Rev Mund Zootec 1975;(16):31-36. [ Links ]
46. Thivend P, Vermorel D, Guilhermet R. L’utilisation du lactoserum et de ses derives par les bovins et les ovins. Colloque des Lactoserum 1977;(18):225-243. [ Links ]
47. Guilhermet R, Mathieu CM, Toullec R. Transit des aliments liquides au niveau de la gouttière œsophagienne chez le veau préruminant et ruminant. Ann Zootech 1975;24:69-79. [ Links ]
48. Brugère H, Mikhail M, Le Bars H. Effet de la vasopressine sur la fermeture de la gouttiere oesophagienne de la chevre. Bull Acad Vet Fr 1987;(60):63-68. [ Links ]
49. Hegland RB, Lambert MR, Jacobson NL, Payne LC. Effect of dietary and managemental factors on reflex closure of the esophageal groove in the dairy calf. J Dairy Sci 1957;(40):1107-1113. [ Links ]
50. Nishida Y, Takahashi Y, Oda K, Hayama T. The effect of reflex closure of the esophageal groove on bioavailability of oral sulfamethoxazole-trimethoprim in ruminating calves. J Vet Med Sci 1996;(58):397-400. [ Links ]
51. Mikhail N. La gouttiére oesophagienne chez la chèvre: rôle de la vasopressine [Thèses Doctorat]. Paris, France: Univ. de Pierre et Marie Curie, 1982. [ Links ]
52. Scholz H, Mikhail M. Untersuchungen zur Nutzung der Schlundrinnenkontraktion in der Behandlung innerer Erkrankungen des erwachsenen Rindes 1. Mitteilung: Auslösbarkeit der Schlundrinnenkontraktion durch intravenöse Verabreichung von Vassopresin. Tierarztl Umsch 1987;(42):280-287. [ Links ]
53. Riek RF. The influence of sodium salts on the closure of the oesophageal groove in calves. Aust Vet J 1954;(30):29-37. [ Links ]
54. Bakker BJ. Influence of a high osmolality, high salt concentration, and bitter taste on the reticular groove reflex in the adult cow [Doctoral thesis]. Utrech, Germany: Faculty of Veterinary Medicine; 2009. [ Links ]
55. Smith BL, Reynolds GW, Embling PP. Zinc solutions and closure of the reticular groove in sheep. N Z J Exp Agric 1977;(5):261-263. [ Links ]
56. Smith BL, Reynolds GW, Embling PP. Effect of method of oral administration of zinc sulphate on acute zinc toxicity in the sheep. N Z J Exp Agric 1979;(7):107-110. [ Links ]
57. Nijmeijer SM, Samuriwo E, van Duin CT, Van Miert AS. Oral chloramphenicol in dwarf goats -influence of vasopressin on its absorption and effect of diet on its biodegradation in ruminal fluid samples. J Vet Pharmacol Ther 1990;(13):408-414. [ Links ]
58. Verney EB. The antidiuretic hormone and the factors which determine its release. Proc R Soc London Biol Sci 1947;(135):25-106. [ Links ]
59. Scholz H, Thomsen H. Oral administration of phosphate into the abomasum: can it rapidly overcome acute phosphorus deficiency in cattle? Tierarztl Umsch 1990;(45):714,719-722. [ Links ]
60. Newhook JC. Visual studies of the oesophageal groove in lambs and its response to intravenous atropine. J Anat 1970;(106):199-205. [ Links ]
61. Ooms LAA, Degryse AD, Weyns A, Bouisset S, Ruckebusch Y. Drug-induced effects on reticular groove reflex, eructation and rumination. In: Ooms LAA, et al, editors. Physiological and pharmacological aspects of the reticulo-rumen. Netherlands: Dordrecht; 1987:271-306. [ Links ]
62. Ruckebusch Y. Motilidad del conducto gastro-intestinal. En: Church CD, editor. El rumiante, Fisiología digestiva y nutrición. Zaragoza, España: Acribia; 1993:69-116. [ Links ]
63. Scholz H. Utilization of the reticular groove contraction in adult cattle. A therapeutical alternative for the practitioner? The Bovine Practitioner 1988;(23): 148-152. [ Links ]
64. El-Hamamsy HT, El-Neweehy TK, Abdou OM, Kubesy AA. Clinical significance of oesophageal groove vasopressin induced-closure. II. A new concept in the oral glucose treatment of pregnancy toxaemia in ewes. Vet Med J Giza 1990;(38):373-384. [ Links ]
65. Prichard RK, Hennessy DR. Effect of oesophageal groove closure on the pharmacokinetic behaviour and efficacy of oxfendazole in sheep. Res Vet Sci 1981;(30):22-27. [ Links ]
66. Marriner S, Bogan JA. The influence of the rumen on the absorption of drugs: studies using meclofenamic acid administered by various routes to sheep and cattle. J Vet Pharmacol Ther 1979;(2):109-115. [ Links ]
67. Sharifi K, Grunberg W, Soroori S, Mohri M, Ahrari-Khafi MS. Assessment of the acetaminophen absorption test as a diagnostic tool for the evaluation of the reticular groove reflex in lambs. Am J Vet Res 2009;(70):820-825. [ Links ]
68. Sargison ND, Stafford KJ, West DM. The effects of age, weaning, drench volume and yarding on ruminoreticulum bypass in sheep, with reference to the anthelmintic efficacy of benzimidazole drenches. N Z Vet J 1998;(46):20-27. [ Links ]
69. Sargison ND, Pomroy WE, Adlington BA. Ruminoreticulum bypass in goats and its possible effect on the efficacy of oxfendazole against resistant gastrointestinal parasites. Small Rumin Res 2000;(35):209-212. [ Links ]
70. Sato H, Nitanai A, Kurosawa T, Oikawa S. Anticoccidial efficacy of medium-chain triglycerides (MCT) in calves. J Vet Med Sci 2004;(66):1583-1585. [ Links ]
71. Scholz H, Mikhail M, Assmus G. Untersuchungen zur Nutzung der Schlundrinnenkontraktion in der Behandlung innerer Erkrankungen des erwachsenen Rindes 3: Mitteilung Behandlung unspezifischer Durchfälle. Tierarztl Umsch 1987;(42):481-489. [ Links ]
72. Swartz LA, Heinrichs AJ, Varga GA, Muller LD. Effects of varying dietary undegradable protein on dry matter intake, growth, and carcass composition of Holstein calves. J Dairy Sci 1991;(74):3884-3890. [ Links ]
73. Iriki T, Adachi K, Abe M. Necessity of ruminally undegraded dietary protein in 4-5 months-old calves under the condition of low-protein intake. Anim Sci Technol 1992;(64):414-419. [ Links ]
74. Sampath KT, Prasad CS, Sundareshan K, Rao S. Effect of feeding two levels of undegradable dietary protein (UDP) on growth and nutrient utilization in crossbred female calves. Indian J Anim Nutr 1996;(13):1-6. [ Links ]
75. Standaert FE, Huber JT, Emery RS. Rumen bypass of nutrients through esophageal groove closure in suckling cows. J Dairy Sci 1978;(61):187-188. [ Links ]
76. Elliott DC. The effect of fenbendazole in removing inhibited early-fourth-stage Ostertagia ostertagi from yearling cattle. N Z Vet J 1977;(25):145-147. [ Links ]
77. Lancaster MB, Hong C. Action of fenbendazole on arrested fourth stage larvae of Ostertagia ostertagi. Vet Rec 1977;(101):81-82. [ Links ]
78. Sato H, Karitani A. Anticoccidial versus ruminal defaunation efficacy of medium chain triglyceride depending on delivery route in calves. J Vet Med Sci 2009;(71): 1243-1245. [ Links ]
Recibido: 29 de Marzo de 2017; Aprobado: 06 de Julio de 2018











 text in
text in