Introducción
Las abejas melíferas (Apis mellifera) junto a otras especies de polinizadores silvestres, contribuyen a la polinización de plantas, tanto de sistemas naturales como manejados para la agricultura. En estos ecosistemas, el servicio de polinización contribuye a aumentar la biodiversidad, la producción de alimentos y la producción de fibras utilizadas en las sociedades humanas1,2. Desafortunadamente en la última década han ocurrido múltiples casos de despoblamiento y pérdida de colonias de abejas en todo el mundo, particularmente al final del invierno3-6. Al parecer, diferentes factores contribuyen a la disminución de poblaciones de abejas, entre ellos, patógenos (parásitos, hongos, bacterias y virus), alteración o pérdida de ecosistemas, o el uso de agroquímicos. Debido a que todos estos factores alteran los mecanismos de defensa del sistema inmune de las abejas, es preciso entender su funcionamiento para poder contribuir a dilucidar el comportamiento de las distintas afecciones infecciosas o no infecciosas que afectan a estos insectos.
Los sistemas inmunes en plantas y animales comprenden órganos y mecanismos de defensa que los protegen contra sustancias extrañas y organismos patógenos, reconociendo estos agentes extraños y reaccionando contra ellos. Gran parte de nuestro conocimiento actual de los sistemas inmunes y sus respuestas se han obtenido de estudios utilizando insectos como sujetos de investigación, motivo por el cual la inmunidad en estos organismos ha sido bien estudiada. Muchos insectos son vectores de enfermedades animales y humanas, y otros causan grandes daños a los cultivos agrícolas. Además, incluso cuando la mayoría de ellos viven vidas cortas, poseen sistemas inmunes complejos y eficientes. Los insectos, por ejemplo, son más eficientes en la detección de patógenos y en responder a ellos, que los vertebrados7.
La mosca de la fruta, Drosophila melanogaster, ha sido el insecto más estudiado y algunos de los estudios realizados en este organismo, han conducido a una mejor comprensión de la inmunidad innata en otros organismos. Los estudios en la mosca de la fruta han generado información sobre mecanismos de reconocimiento de patógenos, señalización inmune y respuestas efectoras contra patógenos. Además, nuestro conocimiento sobre las bases moleculares de los sistemas inmunes ha aumentado sustancialmente desde la finalización de la secuencia genómica de Drosophila en el año 2000, lo que permitió análisis más potentes y específicos de las respuestas inmunes. Estos estudios no sólo mostraron cómo funcionan los sistemas inmunes de los insectos, sino también cómo funciona el sistema inmune innato humano, porque muchos de los mecanismos básicos de inmunidad se conservan entre estos dos organismos. Los estudios sobre otros insectos cuyo genoma se ha secuenciado, como la abeja melífera, también podrían contribuir a una mayor exploración de las respuestas inmunes a nivel molecular. Debido a que sus patógenos naturales están bien estudiados, así como al conocimiento de su estructura genética, las abejas melíferas pueden unirse a varias especies de moscas y polillas como sistemas importantes para entender los mecanismos genéticos de la inmunidad y de las enfermedades.
El sistema inmune de la abeja melífera es muy similar al de las moscas Drosophila y los mosquitos Anopheles, excepto que en comparación con los genomas de Drosophila y Anopheles, las abejas melíferas poseen aproximadamente un tercio de genes relacionados al sistema inmune, los cuales están agrupados en 17 familias8,9. Sin embargo, las abejas melíferas tienen más genes para receptores del olor, así como genes propios para la utilización de polen y néctar, lo que es consistente con su comportamiento y organización social10. Se ha sugerido que una reducción implícita en el número de genes del sistema inmune en las abejas refleja la importancia de las defensas sociales (defensas de comportamiento social), o una tendencia de que las abejas sean atacadas por un conjunto limitado de patógenos altamente co-evolucionados con ellas11. Entre las similitudes del sistema inmune innato de las abejas melíferas y el de la mosca de la fruta, así como de los mosquitos Anopheles, es que estos insectos poseen las mismas vías de señalización. Por ello, mucho del conocimiento del sistema inmune de A. mellifera se deduce del conocimiento del sistema inmune de los dípteros.
Los avances en la genómica han permitido el estudio tanto de la evolución de sistemas biológicos, como de sistemas inmunes. Esta profundización tiene gran valor y aporta a la comprensión, tratamiento y prevención de enfermedades en las diferentes especies de importancia social o económica. En este sentido, la secuenciación del genoma de A. mellifera permitió la predicción de componentes del sistema inmune de estos insectos, como receptores de reconocimiento, efectores y vías implicadas en la defensa del huésped8.
En esta revisión del sistema inmune de las abejas melíferas, se aborda de lo general a lo particular, el conocimiento que existe sobre las características del sistema inmune innato, sus componentes, su regulación, las respuestas inmunes y la inmunidad social.
Tipos de sistemas inmunes
Existen dos tipos de sistemas inmunes: innato y adaptativo. Los vertebrados superiores cuentan con ambos sistemas inmunes para hacer frente a diferentes patógenos, mientras que los insectos solo poseen el sistema inmune innato como único sistema de defensa.
El sistema de inmunidad innata responde a la exposición a patógenos o sustancias tóxicas con mecanismos adquiridos de nacimiento (pre-existentes). Entre estos, se incluyen las barreras físicas (cutícula, mucosas, etc.), células y sustancias químicas que neutralizan toxinas y patógenos. En el sistema inmune innato de vertebrados superiores los efectores celulares comprenden a los fagocitos, células dendríticas, células naturalmente asesinas y mastocitos, entre otros7. Los efectores humorales están representados por las fracciones del sistema del complemento, las proteínas de fase aguda, péptidos antimicrobianos (AMPs, por su sigla en inglés), anticuerpos naturales y las diversas citoquinas que modulan la respuesta inmune7. La especificidad del sistema inmune innato en parte se hereda y es resultado de la co-evolución del sistema inmune de los individuos con diversos patógenos12.
La inmunidad adaptativa o adquirida se refiere a reacciones inmunes específicas y adaptadas a toxinas o patógenos particulares. Estas toxinas o patógenos particulares se conocen como antígenos (generadores de anticuerpos) o inmunógenos. La inmunidad adaptativa tiene la capacidad de recordar patógenos específicos y reacciona con la producción de anticuerpos que son específicos para cada patógeno cuando el organismo vertebrado es expuesto al mismo patógeno más de una vez.
Una forma de diferenciar estos tipos de sistemas inmunes puede sustentarse en la manera en la cual un organismo codifica las moléculas con las que reconocen a un agente patógeno. La inmunidad innata codifica estos receptores de reconocimiento de forma directa en la línea germinal, de forma tal que se heredan en la descendencia. En este sentido, en las especies que se han estudiado, el repertorio de receptores es limitado y promiscuo En cambio, la inmunidad adaptativa supera ampliamente el número de receptores en relación a la inmunidad innata. El repertorio de receptores de la inmunidad adaptativa resulta lo suficientemente amplio como para reconocer un número posiblemente infinito de patógenos7. En el Cuadro 1 se puede apreciar a grandes rasgos, las diferencias entre ambos sistemas.
Cuadro 1 Características de la inmunidad innata y adaptativa
| Insecto | Vertebrado superior | ||
| Innata | Innata | Adaptativa | |
| CARACTERÍSTICAS | |||
| Especificidad | Frente a las estructuras compartidas por grupos de microbios afines. | Frente a las estructuras compartidas por grupos de microbios afines. | Para los antígenos microbianos o no. |
| Diversidad de receptores | Limitada | Limitada | Muy amplia |
| Memoria | Nula | Nula | Si |
| Reactividad frente a uno mismo | Si, daño colateral, no específica. | Si, daño colateral, no específica | Si, autoinmunidad, específica. |
| COMPONENTES | |||
| Efectores humorales | Péptidos antimicrobianos, proteínas con enlace tioester, proteínas de la melanización y de la coagulación. | Sistema del complemento. Citoquinas. Sistema del interferón. Quimioquinas. Proteínas de fase aguda. Sistema de la coagulación. | Anticuerpos. Citoquinas. |
| Efectores celulares | Fagocitos. Haemocitos | Macrófagos, células dendríticas, neutrófilos, linfocitos de la inmunidad innata, mastocitos. | Linfocitos |
El sistema inmune innato y sus componentes
Barreras físicas
Los patógenos y xenobióticos que afectan a los insectos deben en primer lugar atravesar las barreras físicas de la inmunidad innata, como lo son el exoesqueleto, tubos traqueales y la mucosa intestinal. Para el caso de los virus en particular, muchos de ellos son transmitidos a A. mellifera por el ácaro Varroa destructor que perfora estas barreras físicas, facilitando la infección viral.
Inmunidad celular
La inmunidad celular está representada por la acción de los hemocitos, células que transportadas por la hemolinfa, llevan a cabo procesos como fagocitosis, encapsulamiento y melanización13. En los insectos, los hemocitos también sintetizan y almacenan efectores humorales como lo son los péptidos antimicrobianos14, en asociación con otras fuentes de efectores solubles del sistema inmune como las glándulas salivales15 y el cuerpo graso; este último es análogo funcional del hígado de los vertebrados superiores, ya que produce proteínas para combatir patógenos16,17. Los mecanismos celulares contribuyen a la eliminación de agentes extraños. Frente a una partícula infecciosa o ajena, los hemocitos pueden responder fagocitándola o lisándola, o bien agregándose alrededor de ella para neutralizarla13,18 .
Si el agente extraño es pequeño, los hemocitos son capaces de fagocitarlo para su eliminación, mientras que si los elementos extraños son más grandes (o un acumulo de agentes pequeños), se desencadena la nodulación o encapsulamiento, favorecido por la acción cooperativa de varios hemocitos19. Este proceso resulta de la agregación y la parcial disrupción de los hemocitos sobre la superficie del agente extraño a eliminar20. Luego se liberan mediadores de oxígeno y nitrógeno que afectan a los microorganismos y simultáneamente se generan sustancias que regulan el proceso y actúan como antioxidantes, minimizando el daño que el agente extraño pudiera causar.
Para poder cumplir con su función de célula fagocítica y reparadora, se ha postulado que los hemocitos presentan algún tipo de moléculas de adhesión que les permite unirse a diferentes superficies o también a otras células o entre sí, como ocurre en la nodulación o encapsulamiento21,22.
Aunque el número de hemocitos varíe en los diferentes estadios de desarrollo de las abejas, la función de encapsulamiento no se ve afectada23. En cambio, se ha observado que en abejas adultas, incluyendo obreras, reinas y zánganos, el número de hemocitos disminuye conforme aumenta la edad de las abejas24.
Los hemocitos de los insectos se han identificado y clasificado por sus características morfológicas, histoquímicas y funcionales. En las abejas en particular, la citología de la hemolinfa ha sido caracterizada por diversos autores y con diversos métodos. Los primeros estudios realizados determinaron cinco tipos principales de hemocitos25, de los cuales más del 90 % están representados por plasmatocitos, que a su vez fueron clasificados en cuatro subtipos: prohemocitos, coagulocitos, células granulares y oenocitoides; estos dos últimos relacionados con la melanización que se presenta después de un proceso de encapsulamiento20. Otros estudios realizados con citómetro de flujo no arrojaron diferencias morfológicas significativas entre los hemocitos26, aunque identificaron dos tipos de plasmatocitos. Otro estudio clasificó a los grupos celulares de la hemolinfa como proleucocitos, eosinófilos, basófilos, neutrófilos, picnonucleocitos, adipoleucocitos, esferulocitos, granulocitos, macronucleocitos, micronucleocitos y células tipo Spindle27. Hay autores que prefieren la clasificación funcional de las células hemolinfáticas, evitando la confusión que pudiera generar la clasificación morfológica, por ejemplo, si presentan o no adherencia al vidrio21.
El proceso de melanización resulta de la combinación de procesos humorales y celulares que se dan durante el encapsulamiento o nodulación y cicatrización, para hacer frente a una lesión mediada por patógenos o no. Es una reacción celular de defensa de los insectos, responsable de eliminar un gran número de células bacterianas, parásitos y xenobióticos19. Su función principal es limitar la propagación del agente y retenerlo para su eliminación13. Esta estrategia de defensa, tan efectiva y central, es blanco de mecanismos de evasión empleados por muchos microorganismos entomopatógenos, lo que demuestra que es un mecanismo importante de defensa19,28.
La melanización está mediada por una proteína humoral, la profenoloxidasa (proPO, por su sigla en inglés). En insectos se ha demostrado que la activación de la proPO ocurre a lo largo de una cascada de activación a partir del reconocimiento de patrones moleculares asociados a los patógenos (PAMPs) por medio de receptores de reconocimiento de patógenos (PRRs, por su sigla en inglés) humorales y celulares de los hemocitos. Estos inician un proceso de adhesión sobre los agentes invasores, generando una vaina superpuesta, produciendo y liberando proPO al desgranularse o al lisarse. Simultáneamente a la formación de melanina y su polimerización junto con otras proteínas para encapsular al agente invasor, se liberan intermediarios reactivos del oxígeno y nitrógeno, como anión superóxido, peróxido de hidrogeno20) y óxido nítrico21,29, que colaboran con la destrucción del agente, así como con la inducción de la melanización, lo cual ha sido demostrado en A. mellifera29. Las abejas poseen un sólo gen de proPO, frente a tres y nueve en Drosophila y Anopheles, respectivamente. Este gen que codifica para proPO se expresa más fuertemente en abejas adultas que en larvas o pupas9.
Inmunidad humoral y química
La respuesta humoral es una segunda categoría de la inmunidad innata, y es el sistema de defensa más importante de los insectos, incluyendo las abejas melíferas. Este mecanismo de defensa es mediado por sustancias químicas y por péptidos antimicrobianos (AMPs, por su sigla en inglés). Los AMPs son pequeñas proteínas altamente conservadas, generalmente de entre 12 y 50 aminoácidos, que son producidos y liberados en la hemolinfa del insecto en respuesta a infecciones bacterianas y micóticas, pero que también se sintetizan en infecciones virales14. Estos efectores humorales de la inmunidad innata de los insectos juegan un papel fundamental en su sistema de defensa. En algunos insectos polinizadores, como Bombus pascurum, la respuesta humoral se detecta dentro de las 24 a 48 h post-infección, siendo el principal tejido responsable de la síntesis de estos efectores el cuerpo graso de la cavidad dorsal, equivalente al hígado en mamíferos30, aunque también son producidos en los hemocitos, epitelios y glándulas salivales31.
Se han descrito más de 170 AMPs en insectos, pero la abeja melífera produce menos efectores humorales que otros insectos como Drosophila y Anopheles32. Las abejas melíferas poseen cuatro familias de AMPs con amplia actividad en la hemolinfa. Estos AMPs son apidaecina, abaecina, himenoptaecina y defensinas. Las defensinas son pequeños AMPs que principalmente actúan contra bacterias Gram-negativas como E. coli, aunque también se ha demostrado su efecto sobre Gram-positivas y hongos33. En total existen 29 diferentes secuencias de ADNc para las defensinas, denominadas Defensina1 a Defensina 29; 11 secuencias de ADNc para abaecina, que codifican para dos diferentes péptidos de abaecina denominados AcAb1 y AcAb2; 13 secuencias de ADNc para apidaecina, que codifican para cuatro péptidos denominados AcAp1 a AcAp4. Por último, existen 34 diferentes ADNc para himenoptaecina, que codifican para 13 péptidos diferentes34.
Para los casos de B. pascuorum y B. terrestris en particular, se ha comprobado que los AMPs actúan en sinergia (mayores efectos aditivos antimicrobianos) y potenciación (un AMP puede permitir mejorar la actividad del otro). La combinación de los AMPs consigue aumentar el espectro de las respuestas, su especificidad, eficacia y robustez, permitiendo de esta forma reducir los recursos asignados al sistema inmune mediante el aumento de la actividad antimicrobiana de AMPs a bajas concentraciones35.
Las barreras físicas, sumado a los mecanismos de defensa humoral y diferentes procesos celulares, constituyen en conjunto y en forma coordinada, una poderosa herramienta que permite eliminar parásitos, agentes patógenos y xenobióticos.
Regulación de la respuesta inmune
Toda respuesta inmune tiene una secuencia lógica de eventos que se puede agrupar en tres etapas: 1) reconocimiento, 2) activación de las vías de señalización y 3) mecanismos efectores celulares y humorales con el objetivo de eliminar al agente agresor36 como se muestran en la Figura 1.
La respuesta inmune se desencadena a partir de un proceso de reconocimiento, donde los PAMPs son reconocidos por PRRs presentes en células del sistema inmune. El reconocimiento desencadena la activación de distintas vías de señalización promoviendo la síntesis de efectores y receptores que intervienen en la respuesta inmune humoral y celular, PGRP: proteínas de reconocimiento de peptidoglucano20.
Reconocimiento de patógenos
Los microorganismos son mosaicos antigénicos que pueden ser reconocidos en forma diferencial por el sistema inmune innato y adaptativo de los animales. El sistema inmune innato reconoce PAMPs, que son estructuras proteicas conservadas y vitales, presentes en grupos definidos de gérmenes, por ejemplo los lipoposacáridos (LPS), ácido lipoteicóico, zimosan, glicolípidos, glicoproteínas o el ARN de doble cadena7. El sistema inmune innato también reconoce patrones moleculares asociados a daño (DAMPs, por su sigla en inglés), que son moléculas que se expresan en células que sufrieron daño infeccioso o no infeccioso, como es la proteína del shock térmico. Pero en insectos es más aceptado hablar en forma genérica de patrones moleculares asociados a microbios (MAMPs, por su sigla en inglés), que incluyen también a los denominados patrones moleculares asociados a virus32) (VAMPs, por su sigla en inglés). Estas estructuras actúan como ligandos exógenos y son reconocidas por proteínas o PRRs, que pueden encontrase en forma soluble o presentes en células del sistema inmune12.
En Drosophila existen múltiples PRRs, por ejemplo, algunos miembros de la familia de proteínas de reconocimiento de peptidoglucano (PGRP). En abejas se encontraron cuatro homólogos de los 13 presentes en Drosophila, de los cuales dos se sintetizan como respuesta a una infección (PGRP-S2 para la vía de Toll, y PGRP-LC para la vía de Imd). Otras proteínas con función de reconocimiento de bacterias Gram negativas, son las GNBP1, que reconocen β glucanos 1,3, que también pueden reconocer hongos y están involucradas en el reconocimiento de ciertas bacterias Gram positivas37,38. Estas proteínas de reconocimiento de patrones estarían involucradas con serinproteasas que iniciarían la división de Spaetzle, el ligando endógeno de Toll en Drosophila, el cual se activa tanto en la embriogénesis como en la respuesta inmunológica39. En el genoma de las abejas se determinó la presencia de dos genes ortólogos de la familia de Spaetzle8,32,40,41,42.
El reconocimiento de estructuras microbianas desencadena 3 dos eventos principales: 1) eventos de señalización, que suceden cuando se estimulan los receptores Toll y/o IMD y 2) eventos de fagocitosis. DSCAM y Eater, son dos ejemplos de genes relacionados con la endocitosis en abejas, mientras que en Drosophila, DSCAM demostró tener relación con el rol de reconocimiento de bacterias por parte de los hemocitos42,43. Péptidoglicanos, LPS y zymosan también reconocen MAMPs. Con respecto a la vitelogenina, se comprobó que es una proteína transportadora de fragmentos bacterianos, que vía transgeneracional son adquiridos por la descendencia, lo que produciría una especie de sensibilización o “priming” del sistema inmune innato en la progenie44,45.
Vías de señalización
Las vías intracelulares de señalización tienen la función de traducir señales o estímulos externos en acciones dentro de las células que inducen la respuesta inmune, por ejemplo, mediante la activación de una serie de genes que codifican proteínas relacionadas con los sistemas de defensa del hospedador, como pueden ser las proteínas que contienen enlaces tioester (TEPs, por su sigla en inglés). Las vías de señalización dependen de grandes complejos multiprotéicos que comienzan con el estímulo de receptores de superficie celular por parte de un ligando específico, y emiten una señal intracelular iniciando una cascada de actividad enzimática. Los receptores formados por proteínas de transmembrana están asociados a enzimas como las proteinkinasas que normalmente fosforilan el aminoácido tirosina, y por esto se denominan tirosinasas. El inicio de esta cascada de señalización intracelular dirige las distintas respuestas bioquímicas que caracterizan una respuesta celular específica. Las abejas presentan genes ortólogos para los miembros o componentes centrales de las cuatro vías intracelulares de señalización involucradas en la activación de los efectores de la inmunidad innata (Figura 2), siendo las vías Toll e Imd, las más importantes en insectos, incluyendo las abejas.
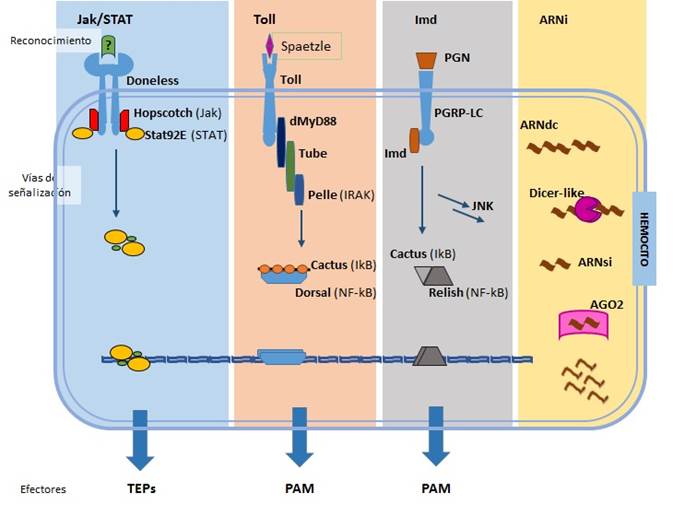
(Modificado de Brutscher et al., 2015)
Figura 2 Vías de señalización. Representación gráfica del detalle molecular
Vía de señalización Toll
Los receptores Toll atraviesan la membrana de las células y cumplen una función crítica tanto en el desarrollo ontogénico como en el sistema inmune. Se han identificado solo cinco genes relacionados con Toll en abejas (Toll-1, -6, -2/7, -8, -10) que también están presentes en el genoma de otros insectos pertenecientes a los órdenes Díptera, Lepidóptera y Coleóptera, con algunas excepciones. Teniendo en cuenta la combinación de genes Toll presentes y ausentes en estos insectos, se infiere que estos cinco genes codifican el conjunto básico de los receptores Toll que estuvo presente en su antepasado común8,32.
Las vías de activación incluyen reclutamiento de proteínas citoplasmáticas adaptadoras, que activan kinasas que conducen a la activación de factores nucleares y a la desregulación de genes que codifican efectores del sistema inmune, como los péptidos antimicrobianos y factores de desarrollo. Una vez que Späetzle se desprende, los receptores Toll son estimulados y reclutan proteínas con dominio de muerte (DD-death) para ensamblar un complejo receptor. En este proceso la proteína adaptadora MyD88 recluta a TUBE y activan a la proteinkinasa PELLE (homólogo de IRAK) y así activada, recluta al adaptador dTRAF0. Este complejo induce la degradación de CACTUS (homólogo de la proteína inhibidora del FNkB, IkB) permitiendo que DORSAL, factor de transcripción (homólogo de FNkB), se transporte al núcleo y se ligue a regiones promotoras de genes de efectores inmunes, lo cual induce su expresión. Los efectores que se sintetizan al activarse esta vía son principalmente péptidos antimicrobianos y lisozimas8,46.
Vía de señalización Imd
La vía de señalización de deficiencia inmune (Imd, por su sigla en inglés) activa al factor de transcripción RELISH (homólogo del factor de transcripción NFκB) en abejas y moscas. En moscas controla la expresión de la mayoría de los péptidos antimicrobianos, lo que hace que esta vía sea indispensable para la respuesta inmune contra microorganismos. También se ha demostrado la presencia de CACTUS como inhibidor del factor de transcripción. Esta vía está altamente conservada en las abejas con posibles ortólogos para todos los componentes. Aunque esto sugiera fuertemente que las vías de señalización son similares entre la mosca y la abeja, no implica necesariamente que compartan exactamente las mismas funciones biológicas8. El reconocimiento de microorganismos a través de la proteína de reconocimiento de peptidoglucano (PGRP-LC, por su sigla en inglés) es el primer paso para el inicio de la respuesta inmune vía la señalización por medio del Imd47. La activación de la vía Imd también conduce a la activación de los componentes de la vía de señalización JNK, y existe evidencia que esta última controla la expresión de la síntesis de péptidos antimicrobianos tanto por retroalimentación positiva como negativa. En abejas se ha determinado la presencia de posibles ortólogos de esta vía como Basket, JNK y JNK-proteína 1 de interacción48, entre otros.
Vía de señalización JAK/STAT
La vía de señalización JAK/STAT (tirosinquinasas de la familia de Janus (JAK)/proteínas activadoras de la transcripción (STAT, por sus siglas en inglés) en insectos está relacionada con la síntesis de efectores similares al sistema del complemento, así como a la proliferación e inducción de fagocitosis por parte de los hemocitos; también está relacionada con la respuesta antiviral8. En vertebrados superiores esta vía de señalización es esencial para la síntesis de muchas citoquinas y se caracteriza por ser una vía rápida de señalización, ya que fosforila de modo directo a las STATs, factores de transcripción que se dimerizan, se transportan al núcleo, y estimulan la expresión de genes inducibles por el ligando del receptor. La única proteína que parece estar completamente ausente en la abeja es el ligando de la vía de señalización JAK /STAT.
Los genes homólogos de Drosophila para los componentes de la vía JAK/STAT presentes en la abeja son el receptor de citoquinas DOMELESS (dom), tirosina JAK quinasa (hopscotch), el factor de transcripción STAT92E y proteínas reguladoras negativas de la vía como SOCS (supresores de la señalización de citoquinas) y PIAS (inhibidor de la proteína STAT activada). A pesar que esta vía termina con la desregulación de los genes que codifican para efectores humorales del sistema inmune, por ejemplo las diferentes proteínas portadoras de tioester o TEPs en abejas, no se han podido encontrar los genes tot, que en Drosophila codifican para efectores humorales dependientes del stress severo y son producto de la activación de esta vía49,50. En las abejas también existen ortólogos de dos componentes de esta vía, la tirosina fosfatasa Ptp61F y la WD408. A pesar de que se desconoce el ligando clave para JAK/STAT, la presencia del homólogo de Domeless, receptor de citoquinas, sumado a la presencia de los demás componentes de esta vía de señalización, determinan que es un mecanismo común en los insectos y que aparece intacto en la abeja, así como en la mosca de la fruta.
Vía de señalización ARNi
El reconocimiento de VAMPs en las abejas ha sido relacionado con el sistema de ARN de interferencia (ARNi), mecanismo fisiológico de silenciamiento de genes y también como mecanismo de defensa contra infecciones virales con la función de silenciar su ciclo replicativo. En abejas se demostró que existen los principales componentes de la vía ARNi en infecciones virales. Durante este proceso los ARN de doble cadena (ARNdc) son reconocidos por un sensor de ARNdc producto del gen dicer-like existente en abejas51. Este sensor está relacionado con la familia de PRRs o sensores citosólicos RIG-1 en mamíferos (dicer). Una vez que DICER corta los ARNdc, los pequeños fragmentos ARNdc resultantes, denominados ARN interferentes pequeños (ARNsi) y micro ARN (ARNmi), son reconocidos por el complejo de silencio inducido de RNA (RISCsi, por su sigla en inglés) que contiene proteínas de la familia AGO2 (argonaute-2)51, que los transforma en pequeños ARN de cadena simple (ARNsc). Estos pequeños ARNsc se unen a otros transcriptos de ARNm que contengan secuencias complementarias, previniendo así la síntesis de proteínas. La activación de esta vía en abejas da como resultado un aumento de la expresión del gen vago, ortólogo de Drosophila, con la consecuente supresión de la replicación viral47,52. Otro mecanismo epigenético con función antiviral presente en las abejas es la metilación del ADN; estudios recientes lo reconocen como parte de la respuesta antiviral en abejas52.
Efectores de respuesta inmune
El resultado del reconocimiento de PAMPs o MAMPs de patógenos por medio de PRRs, con la consecuente activación de las diferentes vías de señalización, finaliza con la síntesis o activación de efectores celulares y humorales del sistema inmune.
Si bien los AMPs son los principales efectores inducidos post infección, en abejas como en otros insectos, se ha demostrado la presencia de transferrina, que en vertebrados superiores es parte del grupo de las proteínas de fase aguda, cuya función inmune es secuestrar hierro y limitar la infección bacteriana53,54. Al igual que en Drosophila y B. mori, las abejas melíferas poseen tres miembros de la familia de transferrinas55. Las vías relacionadas con su expresión serian Imd y Toll9.
La activación de la vía de señalización JAK-STAT da como resultado la síntesis de otros efectores del sistema inmune innato, como las TEPs, que tienen enlace tioester característico de su homólogo en vertebrados superiores, la fracción C3 del sistema del complemento. Este enlace característico permite a las proteínas activadas unirse de forma covalente a la superficie de los microorganismos para activar una respuesta inmune12.
En Drosophila estas proteínas son sintetizadas por el cuerpo graso, mientras que en Anopheles por los hemocitos. En este último, hay evidencias directas de la relación de las TEPs con su función de proteína de reconocimiento de microorganismos y de su participación en la fagocitosis de bacterias Gram negativas, por lo que se les equipara con las opsoninas. En el genoma de las abejas se encontraron solo cuatro genes homólogos de C3 que codifican para TEPs, comparado con los 15 que codifican en el genoma de Anopheles y los seis en el de Drosophila8,56,57.
Las serin proteasas (SP) son enzimas involucradas en varios procesos fisiológicos como la digestión, el desarrollo y la respuesta inmune. Son sintetizadas como zimógenos que luego de su activación pueden participar en cascadas de activación que resultan en la síntesis de efectores. En mamíferos los representantes de esta familia de proteínas con función inmune mejor conocidos, son los que intervienen en la cascada de coagulación y sistema del complemento, mientras que en invertebrados, participan en la respuesta de fase aguda8,58. De las 57 secuencias genómicas relacionadas con SPs encontradas en el genoma de abeja, 44 corresponden a SP y 13 a homólogos de SP. Igualmente, en comparación con las 204 secuencias de Drosophila59 y las 305 secuencias de Anopheles60, el número de genes tipo- SP en la abeja es mucho menor, relación que se ve en la mayoría de los genes8.
En cuanto a la vía de señalización Toll, en abejas se reconocen ortólogos putativos de snake y eater relacionados con el corte de Späetzle y la activación de la vía, con la consiguiente síntesis de efectores como DROSOMICINA, como ocurre en la mosca de la fruta. También en abejas se demostró la presencia de secuencias genómicas similares a SP de otros insectos que están relacionadas con la cascada de activación de prophenoloxidasas58.
El último mecanismo de regulación es el de las SERPINAS, que son proteínas muy conservadas presentes en la hemolinfa de insectos. Estas proteínas son responsables de eliminar el exceso de proteasas, mantener la homeostasis, y evitar la activación no regulada de respuestas inmunes tales como melanización o síntesis de la proteína antimicrobiana Toll mediada61. En abejas melíferas se reconocen siete ortólogos, cinco de los cuales codifican serpinas y los dos restantes codifican para proteínas tipo serpina58
Inmunidad social
Una particularidad que comparten los insectos sociales en general, y en particular las abejas, es el hecho de vivir en sociedad compartiendo el nido. En el nido, suele haber reservas alimenticias y existir una alta densidad de individuos conviviendo en relativa homeostasis. Estas características hacen del nido de insectos sociales un sitio atractivo para el desarrollo de distintos agentes infecciosos62. Sin embargo, este hecho ha favorecido el desarrollo de una inmunidad social11, que se caracteriza por un comportamiento cooperativo de la colonia, representado por diferentes mecanismos, entre los que se pueden citar los siguientes:
1) Fiebre social. La fiebre social es el resultado de la generación de calor adicional de las abejas en el nido. Este mecanismo es costoso para los individuos sanos, pero permite el control de patógenos en los huéspedes infectados. Al elevar la temperatura del nido, las abejas favorecen el control del hongo patógeno Ascosphaera apis63.
2) Acicalamiento. El acicalamiento es la habilidad de las abejas obreras de remover ectoparásitos de sus cuerpos usando sus mandíbulas y sus patas36,64. Existen dos tipos de acicalamiento, auto acicalamiento y acicalamiento grupal, que incluye la participación de varias compañeras de la colonia que actúan en colaboración65, este último, es menos común que el auto-acicalamiento66. Las colonias de abejas que expresan esta habilidad en una alta proporción de sus obreras, son más resistentes a las infestaciones del ácaro Varroa destructor en comparación con colonias que lo expresan en una baja proporción de sus integrantes. Además, el vigor con el que las obreras de una colonia ejecutan este comportamiento, está directamente relacionado con el número de ácaros que las abejas remueven de sus cuerpos66,67. El comportamiento de acicalamiento está influenciado por factores genéticos y su grado de expresión varía entre colonias de diferentes razas y estirpes de abejas68,69. Además, un gen (Neurexin), ha sido mapeado y asociado en varios estudios a este comportamiento70,71.
3) Comportamiento higiénico. El comportamiento higiénico es la capacidad que tienen las abejas obreras de detectar y remover de celdillas de panales, crías (larvas y pupas) enfermas o parasitadas36. Este mecanismo de defensa involucra dos tareas: primero, las obreras destapan celdillas conteniendo larvas o pupas enfermas o parasitadas y después, las remueven36. Este comportamiento social permite un control natural del hongo Ascosphaera apis, agente causal de la cría yesificada72, de la bacteria Paenibacillus larvae73, agente etiológico de la loque americana y del ácaro Varroa destructor68. Abejas de diferente genotipo expresan de manera diferenciada este comportamiento73,74,75. Se ha demostrado que el comportamiento higiénico es influenciado por un grupo de al menos siete genes, lo que indica que tiene una codificación genética más compleja de lo que se creía74 y además, parece heredarse vía materna75.
4) Recolección y uso de propóleos. Las abejas utilizan las propiedades antisépticas y antimicrobianas de los propóleos, resinas que obtienen de las yemas de diversas plantas (principalmente coníferas), como una medicación profiláctica. Al recubrir el interior de las celdas de cría, así como al momificar diversos invertebrados y pequeños vertebrados que entran y mueren dentro de la colonia, evitan o minimizan el desarrollo de bacterias y hongos patógenos64. Además, se ha comprobado que la presencia de ciertos propóleos dentro de la colonia favorece la expresión de genes del sistema inmune de las abejas3,76.
5) Disminución del contacto entre congéneres. Este tipo de comportamiento altruista de individuos ocurre cuando un individuo enfermo se aleja de la colonia para morir lejos del nido de cría77.
6) Comportamiento de canibalismo de la cría. Ante situaciones de estrés, como falta de alimento, o exceso de frío o calor, que provocan la muerte de crías, las abejas nodrizas suelen canibalizar a las crías muertas, evitando de esta manera que en ellas puedan desarrollarse microorganismos patógenos, como A. apis. Asimismo, este mecanismo permite una recuperación de nutrientes para la colonia.
Diferentes autores aceptan que la inmunidad social representa una estrategia de defensa que en gran medida disminuye la presión sobre el sistema inmune en abejas individuales, por lo que requieren un menor número de genes destinados para la defensa contra la infección en comparación con los dípteros. Esto posiblemente explique por qué A. mellifera posee un tercio de los genes relacionados con el reconocimiento y señalización de los efectores inmunes en comparación con Anopheles o Drosophila (8 9,11).
Conclusiones
Las abejas melíferas poseen un sistema inmune innato o inmunidad individual, que incluye barreras físicas, así como respuestas celulares y humorales, que son generalizadas y que les permite defenderse contra organismos infecciosos y parasitarios. Además de los agentes patógenos diversos que afectan a las abejas y activan su sistema inmune, xenobióticos como acaricidas, fungicidas, herbicidas y otros plaguicidas, también han demostrado tener efectos sobre su salud y sistema inmune. Los mecanismos involucrados en la defensa están representados por vías de señalización, receptores de reconocimiento de patógenos y efectores del sistema inmune innato.
El hecho de que las abejas melíferas vivan en sociedad, crea condiciones de alta densidad de individuos en el nido, sumado a una relativa homeostasis de cría y reservas alimenticias, lo que hace de este lugar, un sitio atractivo para el desarrollo de distintos agentes patógenos. Sin embargo, esto también contribuye a la inmunidad social, que se caracteriza por un comportamiento cooperativo de la colonia, representado por diferentes mecanismos como fiebre social, acicalamiento, comportamiento higiénico, recolección de propóleos, etc. Diferentes autores aceptan que la inmunidad social representa una estrategia de defensa que en gran medida disminuye la presión sobre el sistema inmune en estos insectos de manera individual, dando como resultado un menor número de genes destinados para la defensa. Esto posiblemente explique por qué A. mellifera tiene un tercio de los genes relacionados con el reconocimiento y señalización de los efectores inmunes en comparación con Anopheles o Drosophila. En este contexto multifactorial, donde diversos patógenos y plaguicidas impactan al sistema inmune de A. mellifera, es importante continuar el estudio de la relación que tienen estos factores con la respuesta inmune de las abejas. En este sentido, no solo es relevante profundizar en el estudio de los mecanismos moleculares, sino también explorar la posible aplicación de ciertos efectores para el tratamiento o prevención de patologías y desórdenes de salud.











 texto en
texto en 



