Introducción
La garrapata Rhipicephalus microplus es uno de los ectoparásitos que más pérdidas ocasiona en la ganadería bovina. Asimismo, es vector de agentes patógenos como Anaplasma marginale, Babesia bigemina y B. bovis1. De forma global se estima que el 80 % del ganado bovino del mundo está infestado con garrapatas, el cual provoca pérdidas anuales de 2,000 a 3,000 millones de dólares americanos. En México recientemente se estimó que las pérdidas anuales por las infestaciones de R. microplus en el ganado bovino fueron de 573.61 millones de dólares americanos2.
El método más empleado para el control de R. microplus es el uso de compuestos químicos, como piretroides (PSs), organofosforados (OFs), amidinas (Am), fenilpirazolonas, inhibidores del crecimiento de las garrapatas y lactonas macrocíclicas; sin embargo, en los últimos años se ha reportado el aumento de cepas multiresistentes a ixodicidas, principalmente a OFs, PSs, y Am, en el sureste de México3. Además, Pérez-Cogollo et al4 y Miller et al5 reportaron en México los primeros casos de R. microplus resistente a ivermectina y fipronil, respectivamente. Esta situación ha propiciado la búsqueda de métodos alternativos para el control de esta especie de garrapata que reduzca los daños al ambiente y a los humanos1.
Los extractos de plantas pueden ser empleados como métodos alternativos para el control de artrópodos, ya que producen metabolitos secundarios que presentan diferentes mecanismos de acción tales como la inhibición de la alimentación y la síntesis de quitina, disminución del crecimiento, desarrollo, y reproducción, así como afectar su comportamiento sin efectos adversos en especies no objetivo6. Las plantas de las familias Lamiaceae, Fabaceae, Asteraceae, Piperaceae, Verbenaceae y Poaceae presentan mayores eficacias para el control de garrapatas7-11.
Entre los metabolitos secundarios con efecto acaricida contra R. microplus que se han identificado, en extractos de plantas de Cunila angustifolia, Acacia pennatula, Piscidia piscipula, Leucaena leucocephala, Tagetes minuta, Piper amalago, Lippia graveolens y Milinis minutiflora se encuentran los terpenos, estilbenos, cumarinas, ácidos, alcoholes, compuestos sulfurados, taninos, y aldehídos de aceites esenciales7,12.
Hoy en día existen pocos estudios del efecto de los extractos de Leucaena spp. para el control de garrapatas. Fernández-Salas et al12) evaluaron el efecto de un extracto de L. leucocephala sobre R. microplus y encontraron eficacia de 66.79 % sobre larvas; sin embargo, no encontraron eficacia para el control de garrapatas adultas. Recientemente, se he reportado13 que las proteínas defensivas producidas por L. leucocephala (Lam.) de Wit tuvieron un efecto contra garrapatas adultas de R. microplus (56.3 % de eficacia).
Actualmente se encuentran disponibles en el sur sureste de México tres genotipos de Leucaena: L. leucocephala (Nativa), L. leucocephala (Cunningham) y L. leucocephala x L. padilla (KX2), las cuales han sido ampliamente utilizadas como plantas arbustivas forrajeras en sistemas silvopastoriles tropicales, y que podrían contribuir adicionalmente al control de artrópodos. Por tal motivo, el propósito del presente estudio fue evaluar la actividad acaricida de extractos etanólicos de tres genotipos de Leucaena para el control de R. microplus en condiciones in vitro.
Material y métodos
Sitio experimental
El estudio experimental se desarrolló en el Instituto Tecnológico de la Zona Maya (ITZM), ubicado en la carretera Chetumal-Escárcega en el km. 21.5, el ejido Juan Sarabia, Othón P. Blanco, Quintana Roo, México (18° 30” 58’ N y 88° 29” 19’ O). La temperatura máxima promedio de la región es de 32.1 °C, la temperatura mínima promedio de 21.7 °C, precipitación anual de 1,180 mm y humedad relativa promedio de 76 a 82 % (http://smn.conagua.gob.mx).
Producción de larvas de Rhipicephalus microplus
Se colectaron 300 garrapatas adultas ingurgitadas de al menos 25 bovinos del rancho ”Las flores” ubicado en el km 4 en el poblado de Xul-ha, Othón. P. Blanco, Quintana Roo, México. Las garrapatas ingurgitadas se colocaron en tubos de vidrio con tapas de algodón y transportadas al Laboratorio de control biológico del ITZM. Las garrapatas fueron lavadas y secadas y posteriormente pesadas. El peso promedio de las garrapatas fue 200 ± 20 mg. Se utilizó un grupo de garrapatas ingurgitadas para la prueba de inmersión de adultos (PIA) y otro grupo de garrapatas ingurgitadas se incubó a 27 ± 1.5 °C y 70 a 80 % de humedad relativa14 durante dos semanas para permitir la oviposición; los huevos se transfirieron a viales de vidrio de 10 ml con tapa de algodón. La eclosión de las larvas ocurrió aproximadamente 30 días después de la recolección de las hembras ingurgitadas. Larvas de 7 a 14 días de edad se utilizaron para la prueba de inmersión en larvas.
Material vegetal
Se estudiaron tres genotipos de Leucaena spp: L. leucocephala (Lam.) de Wit (Nativa), L. leucocephala (Cunningham) y L. Leucocephala x L. padilla (KX2). Para ello se colectaron de cada genotipo 25 kg de hoja fresca de diferentes partes de la planta. Las plantas fueron cultivadas y usadas cuando tenían siete meses de edad; se secaron a 60 ºC durante 72 h y se pulverizaron con un molino eléctrico tipo Thomas Wiley para obtener partículas de 3 mm.
Elaboración de extractos
El material pulverizado se llevó al laboratorio del ITZM donde se sumergió en 80 % de etanol (etanol absoluto) durante 72 h (800 ml de metanol y 350 g de material pulverizado de cada genotipo). Se usó etanol por ser un disolvente polar general que extraen distintos compuestos polares de interés desde la matriz vegetal (ejemplo terpenos y flavonoides). La extracción etanólica se filtró y evaporó a 45 ºC mediante un evaporador rotacional de vacío. Los extractos crudos obtenidos se transfirieron a frascos de cristal y se mantuvieron a 4 °C hasta su uso.
Bioensayo con larvas
Para determinar la eficacia de los tres genotipos de Leucaena se realizaron bioensayos con larvas empleando la prueba de inmersión de larvas modificada por Soberanes et al15). Se realizaron seis concentraciones (50, 40, 30, 20 y 10 %) de cada genotipo de Leucaena. Cada concentración se transfirió en placas de Petri (60 mm x 15 mm de diámetro), y 300 a 500 larvas se colocaron entre dos papeles Whatman No. 1 y sumergidas por 10 min. Aproximadamente 100 larvas se recolectaron con un pincel (No. 4), y transferidas suavemente a un paquete de papel filtro limpio previamente identificado; la abertura del papel filtro se selló con un clip metálico. El grupo control fue expuesto a Tween 20 (2 %) y agua. Se probaron tres repeticiones por concentración. Los paquetes, se colocaron en charolas y se introdujeron a una incubadora por 48 h a una temperatura de 27 ± 2 °C y 80 a 90 % de humedad relativa.
A las 48 h, se realizó el conteo de larvas vivas y muertas; únicamente las larvas con capacidad de caminar se consideraron vivas. Las larvas sin movimiento, ataxia o movimiento de apéndices fueron consideradas muertas. Para calcular el porcentaje de mortalidad se utilizó la fórmula descrita por Santamaría y Soberanes16. Asimismo se calculó la eficacia para los diferentes genotipos de Leucaena17.
% Mortalidad= larvas muertas/larvas totales x 100
Media del % mortalidad = (mortalidad 1 + mortalidad 2 + mortalidad 3)/3
%Eficacia = (grupo control-grupo tratado)/grupo control x 100
Bioensayo con adultas
Se formaron 12 grupos homogéneos de 10 garrapatas ingurgitadas cada uno con un peso promedio de 200 ± 20 mg. Se emplearon los mismos extractos de Leucaena spp., en las concentraciones de 20 y 10 %; cada uno con tres repeticiones. Los grupos tratados y el grupo control se sumergieron durante un minuto en el extracto diluido y en Tween 20 (2%), respectivamente18.
Las garrapatas se colocaron individualmente en una placa de cultivo con 24 pozos y se incubaron durante 15 días a las condiciones de temperatura y humedad ya descritas. La mortalidad y sobrevivencia de las garrapatas se registró diariamente con ayuda de un estereoscopio, asimismo, 15 días después de iniciado el bioensayo se registró el peso de los huevos producidos en cada grupo, se colocaron 100 huevos en viales de vidrio en las mismas condiciones y durante 21 días se estimaron los porcentajes de eclosión en los diferentes tratamientos y se compararon con los controles.
Análisis por cromatografía en capa delgada (CCD)
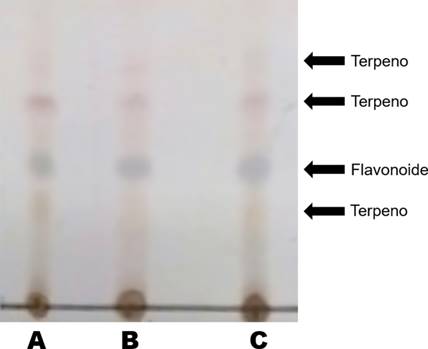
Para determinar el perfil de metabolitos secundarios de los tres genotipos de Leucaena se emplearon placas analíticas de cromatografía para CCD de Sílica gel 60 F264 de la marca Merck, así como Sílica gel 60, malla 70-230 (Sigma Aldrich®) para cromatografía por gravedad. Como reveladores cromatográficos se emplearon sulfato cérico (revelador universal), Oleum (Identificación de terpenos) y cloruro de estaño (detección de flavonoides y terpenos)19.
Análisis estadísticos
La mortalidad larval se calculó a través de la fórmula de Santamaría y Soberanes16, para el cálculo de la eficacia se utilizó la fórmula reportada por Álvarez et al17. La eficiencia reproductiva (ER) y el porcentaje de reducción de la reproducción estimada (PRRE) se obtuvieron por medio de la ecuación reportada por Rodríguez-Vivas et al20, y por último se calculó la concentración letal al 50% (CL50) y su intervalo de confianza al 95% (IC95), mediante el programa de análisis probit. A continuación de presentan las fórmulas para determinar el ER y PRRE.
ER= peso de la masa de huevos X % de eclosión de larvas/ peso inicial de la garrapata
PRRE= ER grupo control- ER grupo tratado/ ER grupo control X100
Resultados
Mortalidad larvaria
Los extractos de los genotipos Cunningham y KX2 al 50 % presentaron 91.7 y 82.0 % de mortalidad y 92.7 y 90.7 % de eficacia respectivamente, contra larvas de R. microplus; mientras que el genotipo Nativa alcanzó 54.6 y 75.6 %, respectivamente. Asimismo, se calculó la CL50 de los tres genotipos y se encontró que KX2 necesita 15.8 % (11.9 ± 19.0) de la concentración para matar al 50 % de las larvas, mientras que los genotipos Cunningham y Nativa necesitan 22.2 % (19.2 ± 25.3) y 43.7 % (36.0 ± 19.0), respectivamente.
Mortalidad de adultos, índice de eficiencia reproductiva y reducción de la reproducción estimada
El genotipo Nativa presentó el mejor comportamiento con 50 % de mortalidad a la concentración de 20 %. Asimismo, este genotipo redujo el PRRE en 51.3 %. Los genotipos Cunningham y KX2 presentaron mortalidades ≤20 %. y PRRE de 52.0 y 40.8 %, respectivamente (Cuadro 1).
Mediante la CCD no se observaron diferencias en el perfil cromatográfico de los metabolitos mayoritarios de los tres genotipos. Entre los metabolitos encontrados se observaron terpenos y flavonoides, principalmente a polaridad media (Figura 1).
Cuadro 1 Porcentaje de mortalidad e índice de eficiencia reproductiva (IER) y porcentaje de reducción en la reproducción estimada (PRRE) en garrapatas adultas de Rhipicephalus microplus expuestas a diferentes concentraciones de Leucaena spp.
| Leucaena spp. | Mortalidad (%) | IER (%) | PRRE (%) |
|---|---|---|---|
| Control | 0 | NA | NA |
| Nativa 20% | 50 | 16.01 | 51.31 |
| Nativa 10% | 0 | 45.09 | 13.19 |
| Cunningham 20% | 10 | 4.04 | 52.04 |
| Cunningham 10% | 20 | 40.36 | 0.0 |
| KX2 20% | 20 | 42.05 | 44.55 |
| KX2 10% | 10 | 49.84 | 40.86 |
NA= no aplica.
Discusión
La leguminosa arbustiva L. leucocephala es una planta con amplia distribución en áreas tropicales y sub-tropicales21. Ha mostrado gran relevancia debido a la capacidad de desarrollar mecanismos de defensa contra hongos, bacterias e insectos herbívoros22,23, por lo que podría ser empleada como una alternativa de control de la garrapata R. microplus.
Los genotipos Cunningham y KX2 a la concentración de 50% presentaron 91.7 y 82.0 % de mortalidad contra larvas de R. microplus (Cuadro 2). Asimismo, se determinó que se necesita 15.8 % de concentración del genotipo KX2 para matar al 50 % de larvas, mientras que el genotipo Cunningham necesita una concentración de 22.2 %. Estos resultados son similares a los reportados en otro trabajo12, donde evaluaron el efecto de un extracto acetónico de L. leucocephala contra diferentes fases de R. microplus; los autores reportaron que los extractos produjeron una mortalidad en la fase larval de 66.79 %.
Cuadro 2 Porcentaje de mortalidad y eficacia de larvas de Rhipicephalus microplus expuestas a diferentes concentraciones de extractos etanólicos de tres genotipos de Leucaena spp.
| Leucaena spp. | Concentración (%) | Mortalidad (%) | Eficacia (%) |
|---|---|---|---|
| Control | NA | 0 | NA |
| Nativa | 50.0 | 54.6 | 75.6 |
| Nativa | 40.0 | 49.5 | 67.3 |
| Nativa | 30.0 | 38.7 | 62.1 |
| Nativa | 20.0 | 28.0 | 57.0 |
| Cunningham | 50.0 | 91.7 | 92.7 |
| Cunningham | 40.0 | 78.4 | 82.0 |
| Cunningham | 30.0 | 62.4 | 71.0 |
| Cunningham | 20.0 | 29.5 | 59.3 |
| KX2 | 50.0 | 82.0 | 90.7 |
| KX2 | 40.0 | 77.7 | 83.0 |
| KX2 | 30.0 | 64.9 | 82.0 |
| KX2 | 20.0 | 58.4 | 72.7 |
NA= no aplica.
En garrapatas adultas se encontró que el genotipo Nativa presentó 50.0 % de mortalidad a una concentración de 20 %; además redujo en el 51.3 % del PRRE. Estos resultados difieren a los obtenidos por Fernández-Salas et al12 quienes no encontraron efecto en el control de garrapatas adultas. Recientemente13 evaluaron el efecto de las proteínas defensivas y la peroxidasa que produce L. leucocephala, cuando se encuentran en estrés, contra garrapatas adultas de R. microplus adultas, y mencionaron que las proteínas defensivas producidas por L. leucocephala redujeron 8.5 % la producción de huevos, 47.7 % la eclosión de larvas y presentaron una eficacia del 56.3 % a una concentración de 0.1 mg/ml. Existen otros estudios que evaluaron el efecto de otras plantas de la familia Fabaceae contra R. microplus. Por ejemplo Rosado-Aguilar et al7 evaluaron el efecto de los extractos de hojas de Habardia albicans y Cesalpinia gaumeri a una concentración de 20 % y reportaron una baja mortalidad de 23 y 30 %, respectivamente, así como una eficacia moderada en la inhibición de la postura y eclosión de larvas para H. albicans (54.4 % y 48.7 %) contra garrapatas adultas de R. microplus. Adicionalmente encontraron una mortalidad de 90 a 93 % a una concentración de 10 % para el control de larvas. Por su parte, Singh et al24, evaluaron el extracto etanólico de Dalbergia sissoo a una concentración del 10 % contra garrapatas adultas de R. microplus y reportaron mortalidad, inhibición de la postura y de la eclosión de larvas en 85.0, 55.9 y 0 %, respectivamente. Asimismo, los extractos etanólicos de las hojas Acacia farnesiana y A. harmandiana a una concentración del 10 % produjeron una mortalidad de 4.0 y 5.0 % contra garrapatas adultas de R. microplus, respectivamente25. En otro estudio26 utilizaron los extractos metanólicos de Stylosanthes humilis y hojas de S. hamata y la eficacia contra larvas de R. microplus fue del 82 y 75 %, respectivamente.
La mayoría de estos compuestos naturales tienen modos de acción que difieren de los tratamientos farmacéuticos comerciales disponibles y, por lo tanto, pueden ser eficaces para el control de R. microplus. Debido a los buenos resultados que se encontraron en este estudio para el control de larvas y moderado para el control de adultas, los extractos etanólicos de Leucaena spp. podrían ser una alternativa para el control de R. microplus.
En un estudio27 evaluaron la composición de cuatro genotipos de Leucaena spp: Cunningham, K636 (L. leucocephala), Nativa y KX2, y reportaron que los cuatro genotipos presentaron taninos condensados y mimosina en diferentes niveles. Las propiedades biológicas de los genotipos de Leucaena pueden ser atribuidas principalmente a la presencia y abundancia de taninos, mimosina, fenoles, cumarinas y flavonoides, entre otros. En este estudio únicamente se pudo observar la presencia de terpenos y flavonoides que son los metabolitos mayoritarios en los extractos. El efecto acaricida de terpenos sobre R. microplus ha sido reportado previamente28,29. Gomes et al30 estudiaron el aceite esencial de hojas de Lippia sidoides y encontraron que el 67.6 % del aceite contenía timol (compuesto terpeno). Este aceite esencial fue evaluado contra larvas de R. microplus y encontraron mortalidades de más de 95 %. Asimismo, se ha determinado la eficacia del extracto natural de Verbena officinalis en el control in vitro de la garrapata adulta R. microplus31; los extractos contenían altas concentraciones de flavonoides y presentaron mortalidades de hasta 67 %. Estos estudios refuerzan la eficacia que pueden tener los terpenos y flavonoides para el control de la garrapata R. microplus.
El mecanismo de acción de los terpenos y flavonoides sobre artrópodos ha sido estudiado. Se ha demostrado32 que los monoterpenos contenidos en aceites esenciales de plantas (D-limoneno, mirceno, terpineol, linalool y pulegona) son neurotóxicos para la mosca común (Musca domestica) y la cucaracha alemana (Blattella germanica). Priestley et al33 sugieren que el timol potencializa la acción de los receptores GABA (ácido gama-aminobutírico) en lugares indefinidos en los insectos. En futuros estudios será necesario identificar los metabolitos contenidos en los extractos etanólicos de Leucaena que tengan actividad acaricida para probarlos de manera individual o en sinergia.
Conclusiones e implicaciones
Se concluye que los extractos de los tres genotipos de Leucaena spp. tuvieron una buena eficacia contra larvas y una moderada eficacia contra garrapatas adultas de R. microplus, además de reducir el PRRE. En los extractos se identificaron flavonoides y terpenos que pudieran ser los responsables de la actividad acaricida de los tres genotipos de Leucaena spp.; sin embargo, se requiere de más estudios para identificar los metabolitos que tengan una acción individual o en sinergia para el control de R. microplus.











 texto en
texto en