La cunicultura se define como el proceso de cría, engorda y reproducción del conejo (Oryctolagus cuniculus) en forma sistemática y económica, cuyo objetivo es obtener los mayores beneficios a partir de la venta de sus productos y subproductos1. En México, la cunicultura es una actividad creciente; en 2016, la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA), estimó que la producción total nacional superó las 15 mil toneladas de carne de conejo, siendo las entidades de mayor producción Puebla, Tlaxcala, Morelos, Michoacán, Querétaro y el Estado de México, siendo este último el principal productor y consumidor de carne de conejo2. En dicha entidad, la zona sur-oriente es una de las regiones donde se lleva a cabo una mayor producción, comercialización y consumo de carne de conejo2,3. Si bien la cunicultura en México se encuentra en constante crecimiento, sigue siendo una actividad ganadera a la que se le ha dado poca importancia respecto a otras especies productivas, dejándola con una orientación hacia el sector rural en el traspatio y de subsistencia alimentaria, realizada generalmente por campesinos en regiones con escasos recursos4. Este tipo de producción a pequeña escala representa el 95 % de la producción cunícola nacional5.
Uno de los mayores problemas que enfrenta la cunicultura de traspatio, es la falta de información respecto a las buenas prácticas de producción pecuaria, especialmente de temas importantes como sanidad, bioseguridad y bienestar animal, situación que puede favorecer la presentación de agentes patógenos causales de diversas enfermedades6,7. Las enfermedades entéricas tienen un papel importante en las granjas de producción animal, ya que generan severas pérdidas económicas debido a la mortalidad, depresión del crecimiento y disminución del índice de conversión8-11. Entre los agentes patógenos importantes en la producción cunícola que causan signología entérica se encuentra Rotavirus (RV)9,12, es considerado una de las principales causas de gastroenteritis viral aguda en humanos y animales jóvenes en todo el mundo13,14, incluyendo conejos15.
Rotavirus es un virus RNA de doble cadena (dsRNA), miembro de la familia Reoviridae, subfamilia Sedoreovirinae, género Rotavirus16. En conejos, rotavirus cepa Lapine (LRV) puede causar cuadros entéricos principalmente en conejos post-destete, además, también está implicado en la etiología de brotes de enteritis graves en asociación con bacterias, parásitos y otros virus. La infección por rotavirus es más frecuente en conejos de 35 a 50 días de edad, se caracteriza por una alta tasa de morbilidad y la presencia de signos clínicos inespecíficos, tales como diarrea, deshidratación, anorexia y depresión. Los conejos enfermos pueden morir debido a la deshidratación y a las infecciones secundarias, mientras que los que se recuperan, comúnmente muestran una disminución de la productividad debido a la reducida capacidad de absorción de nutrientes9, 12,17.
En México existe sólo un reporte de la presencia de RV en conejos18, realizado en conejos con perfiles clínicos entéricos, por lo anterior, el objetivo del presente estudio fue analizar la presencia de LRV en conejos sanos y con signología entérica, de los 13 municipios que integran la región sur-oriente del Estado de México.
La presente investigación se llevó a cabo en el periodo comprendido entre abril de 2014 a noviembre de 2016, donde se recolectaron y analizaron 147 muestras tomadas de conejos sanos y conejos con manifestaciones clínicas entéricas (distención abdominal, anorexia, depresión, diarrea, deshidratación) de entre 25 a 60 días de edad, procedentes de 39 granjas de producción cunícola de traspatio; las producciones presentaban baja tecnificación, con escasas o nulas medidas de bioseguridad y manejo sanitario inadecuado. Las granjas fueron ubicadas dentro de la región sur-oriente del Estado de México, la cual se encuentra conformada por 13 municipios: Valle de Chalco, Chalco, Temamatla, Cocotitlan, Tlalmanalco, Juchitepec, Tenango del Aire, Ayapango, Amecameca, Atlautla, Ozumba, Tepetlixpa y Ecatzingo (Figura 1).
Figura 1 Zona geográfica de muestreo. A: Estados Unidos Mexicanos; B: Estado de México; C: Región sur-oriente del Estado de México
Las muestras recolectadas de animales vivos, fueron a partir de 1 ml de excremento líquido o bien 2 g de excremento blando o sólido; se colocaron en viales estériles, transportados en refrigeración al Laboratorio de Biotecnología, Biología Molecular y Genética de la Universidad Autónoma del Estado de México, Centro Universitario UAEM Amecameca, donde se mantuvieron en congelación a -75 °C, para su posterior análisis. En animales muertos, las muestras se tomaron directamente del intestino delgado, dentro de un periodo no mayor a 5 h. Finalmente, los animales con cuadro clínico entérico severo, se sacrificaron de forma humanitaria (NOM-033-ZOO-1995), se tomaron muestras de excremento y de tejido de intestino delgado (junto con su contenido), las cuales se conservaron de la forma descrita. Este estudio fue autorizado por el Comité de Bioética del Centro Universitario UAEM Amecameca (CBE/13/2014).
Las muestras se analizaron para la identificación de RV a través de la amplificación de tres de sus proteínas estructurales; VP6, VP4 y VP7, mediante la reacción en cadena de la polimerasa con transcripción reversa (RT-PCR), a partir del RNA total extraído de la muestra. Para la detección de VP6, se emplearon los cebadores diseñados por Iturriza-Gómara et al19 los cuales amplifican un fragmento de 379 pares de bases (pb) del gen VP6 (VP6-F [nt 747-766] 5' GACGGVGCRACTACATGGT 3' y VP6-R [nt 1126 a 1106] 5' GTCCAATTCATNCCTGGTGG 3'). Para VP4 se utilizaron los cebadores previamente reportados20 para la amplificación de un fragmento de 876 pb que codifica para la proteína VP4 (Con 3 [nt 11-32] F 5’ TGGCTTCGCCATTTTATAGACA 3’ y Con 2 [nt 887-868] R 5’ ATTTCGGACCATTTATAACC 3’). Para la amplificación completa de VP7, se utilizaron los cebadores Beg 9 (nt 1-28) F 5’ GGCTTTAAAAGAGAGAATTTCCGTCTGG 3’ y End 9 (nt 1062-1036) R 5’ GGTCACATCATACAATTCTAATCTAAG 3’21. El RNA total se obtuvo empleando el GeneJET Viral DNA and RNA Purification kit (Thermo Scientific TM), de acuerdo a las instrucciones del fabricante. Una vez obtenido el RNA viral, se realizó una RT-PCR de un solo paso empleando el kit comercial SuperScript® III One Step RT-PCR with Platinum® Taq (InvitrogenTM). Como control positivo de la reacción se utilizó la vacuna pentavalente Rotateq (Laboratorio Sanofi Pasteur MSD), como control negativo se utilizó DNA de conejo. Los productos de PCR se visualizaron en geles de agarosa al 2%, teñidos con bromuro de etidio.
Un total de 147 muestras fueron procesadas, 99 procedentes de conejos sanos y 48 de conejos con signología entérica, de las cuales se identificó LRV en 9 de ellas (Cuadro 1). No se detectó LRV en conejos sanos.
Cuadro 1 Características de las muestras procesadas en diferentes municipios del Estado de México para detección de rotavirus (RV)
| Municipio | Granjas | Conejos totales | Sanos | Enfermos | Positivos a RV |
|---|---|---|---|---|---|
| Valle de Chalco | 2 | 8 | 6 | 2 | 0 |
| Amecameca | 5 | 19 | 12 | 7 | 3 |
| Atlautla | 4 | 14 | 11 | 3 | 1 |
| Ozumba | 2 | 9 | 6 | 3 | 0 |
| Tepetlixpa | 2 | 8 | 6 | 2 | 0 |
| Juchitepec | 4 | 12 | 9 | 3 | 1 |
| Ayapango | 4 | 15 | 8 | 7 | 3 |
| Tenango del Aire | 2 | 9 | 6 | 3 | 0 |
| Temamatla | 3 | 8 | 5 | 3 | 0 |
| Cocotitlán | 2 | 10 | 6 | 4 | 0 |
| Chalco | 3 | 8 | 6 | 2 | 0 |
| Tlalmanalco | 4 | 15 | 10 | 5 | 1 |
| Ecatzingo | 2 | 12 | 8 | 4 | 0 |
| Total | 39 | 147 | 99 | 48 | 9 |
Las manifestaciones clínicas de los conejos enfermos incluyeron distención abdominal, anorexia, depresión, diarrea y deshidratación. Rotavirus se identificó mediante la amplificación de VP6, VP4 y VP7, a través de RT-PCR, se amplificaron fragmentos de 379, 1062 y 879 pb respectivamente para los genes VP6 (Figura 2), VP7 (Figura 3) y VP4 (Figura 4), a partir de muestras de excremento y de tejido de intestino delgado provenientes de conejos con signología entérica.
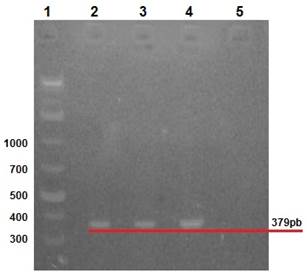
Carril 1: marcador de peso molecular 1 Kb; carril 2: control positivo (vacuna); carriles 3 y 4: muestras de conejos; carril 5: control negativo.
Figura 2 Gel de agarosa 2%, amplificación de fragmentos de 379 pb correspondientes al gen VP6 de RV
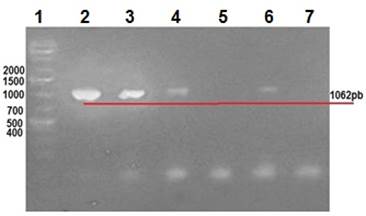
Carril 1: marcador de peso molecular 1 Kb; carril 2: control positivo (vacuna); carriles 3 - 6: muestras de conejos; carril 7: control negativo.
Figura 3 Gel de agarosa 2%, amplificación de fragmentos de 1062 pb correspondientes al gen VP7 de RV
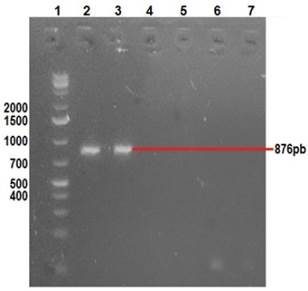
Carril 1: marcador de peso molecular 1 Kb; carril 2: control positivo (vacuna); carril 3: amplificación de VP4; carril 7: control negativo.
Figura 4 Gel de agarosa 2%, amplificación de un fragmento de 876pb correspondiente al gen VP4 de RV
Se conoce que, las enfermedades entéricas tienen un papel importante en las granjas de producción cunícola, ya que pueden causar grandes pérdidas económicas9,22. El síndrome entérico es una de las enfermedades más importantes en los conejos, especialmente por su relación al impacto productivo y económico. Entre los diversos patógenos que se han identificado en conejos con perfiles clínicos entéricos, se encuentra Rotavirus cepa Lapine, el cual al considerarse de baja virulencia23, no debería ser capaz de inducir episodios de alta gravedad, sin embargo puede causar enfermedad entérica en conejos posdestete y estar implicado en la etiología de brotes graves de enteritis en asociación con otros agentes patógenos24.
En este estudio se analizaron 147 muestras para la identificación de LRV, 99 procedentes de conejos sanos y 48 de conejos con signología entérica, identificando LRV en 9 de ellas (18.7 %). El objetivo de analizar muestras de conejos sin signología entérica fue identificar posibles infecciones subclínicas; debido a que, se ha indicado, que una vez ingresado RV al organismo, la extensión y severidad de los signos clínicos y las lesiones intestinales dependen de la cantidad de partículas virales ingeridas, por lo que conejos de 4 a 5 semanas de edad pueden tener una infección subclínica, favoreciendo la diseminación del virus9,12.
El porcentaje de detección de LRV en animales enfermos, concuerda con la suposición de que en conejos con signología entérica, los virus parecen tener un papel importante, pero no decisivo, y que la participación de LRV no es determinante para la presentación de la enfermedad6,9. Los resultados obtenidos fortalecen la hipótesis sustentada por diversos autores22,25-28, donde se indica que el síndrome entérico de los conejos tiene un origen multifactorial, en el cual diversos agentes patógenos actúan sinérgicamente para inducir gastroenteritis. Se ha sugerido que tanto en la naturaleza, como en las granjas de producción cunícola, rotavirus podría desempeñar un papel importante en la inducción de la enfermedad, ya sea por ejercer una actividad patógena directa o por facilitar la entrada y replicación de otros agentes patógenos mediante la alteración mínima del epitelio intestinal17.
En el presente estudio, el porcentaje de identificación de RV en conejos con sinología entérica (18.7 %), fue mayor que lo reportado por diversos investigadores en Italia9,25,27, y por Xie et al28 en Canadá, donde el rotavirus fue identificado en el 15.3, 17.6, 16 y 3 % de las muestras analizadas, respectivamente. Por el contrario, fue menor que lo informado por Cerioli et al29, también en Italia, donde obtuvieron un porcentaje de identificación de RV del 23 %. A nivel mundial, Italia es uno de los principales países productores de carne de conejo30, contando con granjas de producción tecnificadas. La situación de la cría intensiva de conejos se caracteriza por una intensa selección genética, excesos de rendimiento productivo, sobrepoblación y hacinamiento, lo que consecuentemente genera una alta contaminación ambiental de patógenos facultativos9. Si bien, la producción cunícola a gran escala presenta problemas de salud animal, los resultados obtenidos sugieren que la producción de traspatio posee un mayor riesgo de presentación de enfermedades, debido posiblemente a factores como falta de sanidad, bioseguridad e infraestructura adecuada, derivado de la escasez de recursos económicos y falta de información respecto a buenas prácticas de producción pecuaria.
Los resultados obtenidos en este estudio, son mayores a los previamente reportados en México18, donde LRV fue identificado en 10.34 %; esta diferencia puede ser producto de que, la cría de conejos para producción de carne se encuentra en constante crecimiento2; por lo tanto se propone que un incremento en la población cunícola, aunado a un mayor movimiento de compra-venta de animales dentro de la misma región y a las constantes prácticas productivas, podrían explicar el aumento de la presencia de agentes patógenos, entre ellos RV; sin embargo, es necesario realizar más estudios para determinar la epidemiología de LRV y de otros microorganismos infecciosos, que se encuentran circulando en granjas de producción cunícola, ubicadas en una región altamente productora, comercializadora y consumidora de carne de conejo.
Además de su impacto económico, se sabe que varios rotavirus animales son una fuente potencial de infección humana (zoonosis), eventos que han sido confirmados a través de diversas investigaciones31-33. Dicha situación ha llevado a intensificar la vigilancia epidemiológica y la caracterización molecular de ciertas cepas, especialmente de las especies hospederas que se encuentran en estrecho contacto con la población humana22.
Debido a que la producción de carne de conejo a pequeña escala representa el 95 % de la producción cunícola nacional5, en este estudio, se trabajó en producciones cunícolas de traspatio con características similares tanto de infraestructura como de manejo, en las cuales diversas especies animales se encuentran en continuo contacto, pudiendo favorecer la transmisión inter-especies de distintas enfermedades, así como la presentación de eventos zoonóticos. Bajo este panorama, se enfatiza la importancia de conocer los agentes patógenos presentes en las granjas de producción pecuaria, especialmente, a los que pueden representar un riesgo para la salud pública.
Se sugiere la posibilidad de que LRV no sea endémico en granjas de producción cunícola de la región sur-oriente del Estado de México, encontrándose ocasionalmente sin inducir episodios entéricos graves de forma individual; no obstante, podría ser un factor importante en la presentación de brotes entéricos en asociación con otros agentes patógenos.
Ante el continuo crecimiento de la industria cunícola, se precisa el conocimiento y aplicación de prácticas de producción pecuaria adecuadas, con el objetivo de reducir los riesgos biológicos para la población animal y humana, mejorando la producción y disminuyendo las pérdidas económicas. Sin embargo, se requieren más estudios para determinar la epidemiología de rotavirus y otros agentes patógenos que afectan la producción cunícola en nuestro país. No obstante, este es uno de los primeros reportes de la presencia de rotavirus en conejos con signología entérica en México.











 texto en
texto en 


