Introducción
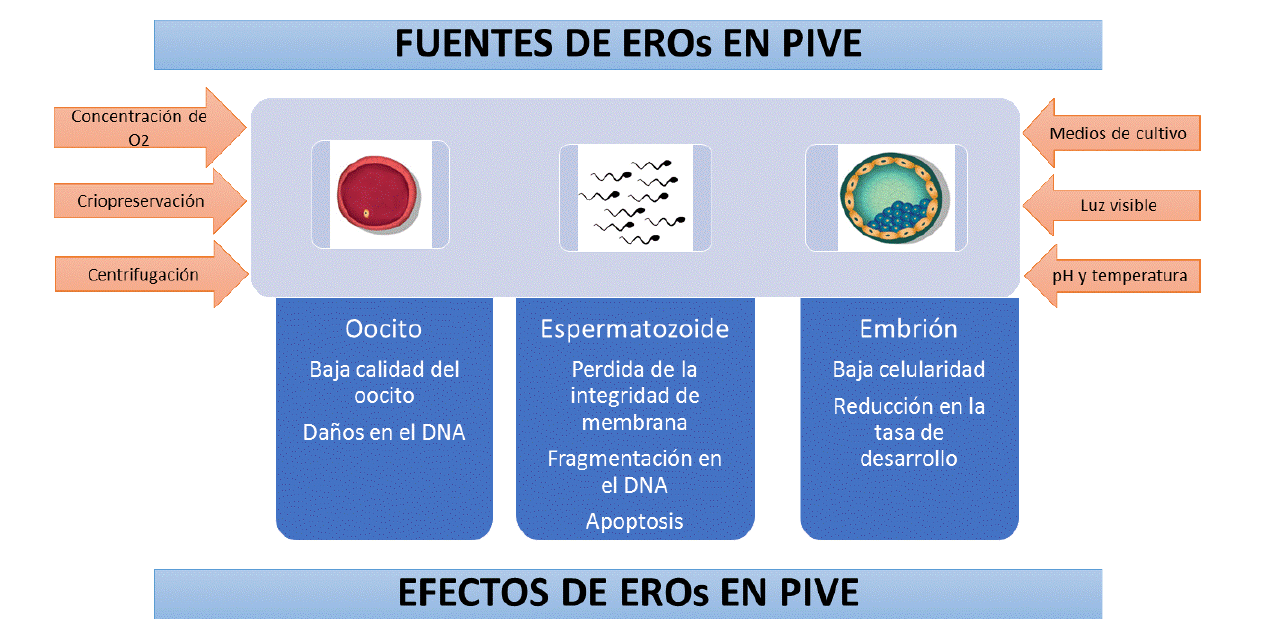
La producción in vitro de embriones (PIVE) involucra tres pasos: la maduración in vitro (MIV) de oocitos obtenidos a partir de folículos antrales, la coincubación de gametos masculinos y femeninos o fertilización in vitro (FIV), y finalmente el cultivo in vitro (CIV) de los presuntos cigotos hasta los estadios de blastocistos. Sin embargo, bajo condiciones fisiológicas los oocitos de mamíferos crecen y son fertilizados en el mejor ambiente protector, el ovario y el tracto reproductivo femenino, mientras que en condiciones in vitro los gametos y embriones deben ser manipulados durante la maduración, la fertilización y el desarrollo embrionario en ambientes que generan estrés oxidativo, entre los cuales destacan: la concentración de oxígeno alta (20 %), en relación al ambiente in vivo (3 A 5 %)1, la exposición a la luz2, la composición del medio de cultivo3, cambios de pH4, procesos de centrifugación5, entre otros6, lo cual tiene un efecto deletéreo sobre los gametos y embriones, alterando la funcionalidad de biomoléculas como lípidos, ácidos nucleicos y proteínas, y subsecuentemente afectando el desarrollo embrionario7.
A pesar de que las células cuentan con un sistema de defensa antioxidante enzimático y no enzimático, algunas moléculas antioxidantes han sido utilizadas como suplemento en los medios de cultivo para disminuir la producción de especies reactivas de oxígeno (ERO) en gametos y embriones, con el fin de mejorar su calidad y su potencial reproductivo a través de la disminución de ERO intracelular8, protegiéndolos de daños al ADN y otras biomoléculas, y por consiguiente mejorando la competencia de desarrollo embrionario9-11. El objetivo de esta revisión es analizar el efecto del estrés oxidativo y el uso de antioxidantes en la producción in vitro de embriones, sobre la calidad de los gametos y embriones a nivel metabólico, de expresión génica y marcas epigenéticas.
Especies reactivas de oxígeno y estrés oxidativo
Las ERO son un grupo de moléculas generadas a través de la reducción parcial del oxígeno molecular; la mayoría de estas especies (excepto el peróxido de hidrógeno), poseen uno o más electrones desapareados, configuración a la que se le denomina radical libre. En condiciones basales, el metabolismo aeróbico está vinculado con la producción de ERO tales como el peróxido de hidrógeno (H2O2), el anión superóxido (O2-) y el radical hidroxilo (OH-), mientras que las especies reactivas de nitrógeno como el óxido nítrico (NO•), son formadas por la conversión de L-arginina a L-citrulina por efecto de la enzima óxido nítrico sintasa (NOS). Cuando se presenta una producción exagerada de ERO que excede la defensa celular, da lugar a un proceso denominado estrés oxidativo12, que genera un daño oxidativo a biomoléculas tales como lípidos, proteínas, carbohidratos y ácidos nucleicos, lo que inducen cambios estructurales y funcionales tales como hidroperóxidos de lípidos13, proteínas carboniladas14 y DNA con bases oxidadas7,8 dihidro-8-oxoguanina)15.
Por otro lado, la cadena respiratoria mitocondrial es susceptible a daño oxidativo; principalmente los complejos I y II por la producción de radicales superóxido y nitrilo, los cuales pueden afectar proteínas mitocondriales y alterar la función de muchas enzimas metabólicas en la cadena transportadora de electrones mitocondrial16. Además, se ha demostrado que el ADN mitocondrial (mtDNA) es más sensible que el ADN nuclear a estrés oxidativo17, posiblemente porque el mtDNA carece de histonas, las cuales lo protegen contra el daño de los radicales libres, no cuenta con un sistema de reparación adecuado y está localizado cerca de la membrana mitocondrial interna, el cual es el mayor sitio de producción de ERO18,19. Adicionalmente, el daño oxidativo en el mtADN puede inducir mutaciones y alterar la función e integridad mitocondrial20, lo cual en humanos, da lugar a enfermedades mitocondriales degenerativas tales como Alzheimer, Parkinson y esclerosis amiotrófica lateral21,22.
Producción de ERO durante la producción in vitro de embriones
En el tracto reproductivo algunos procesos celulares son regulados por ERO, los cuales actúan como segundos mensajeros generando una respuesta celular específica. Algunas macromoléculas sensibles a modificaciones redox (fosfatasas, quinasas, factores de transcripción) juegan un papel importante durante el desarrollo celular, como la proliferación, diferenciación y muerte celular. En relación a esta última, diferentes niveles de ERO generan diferentes tipos de muerte celular, por ejemplo, bajas concentraciones promueven la apoptosis, concentraciones intermedias generan autofagocitosis y altas concentraciones promueven la necrosis celular12,23. Durante la MIV, son necesarios niveles fisiológicos de ERO para el reinicio de meiosis de los oocitos arrestados en diploteno, para estimular la liberación de Ca2+ intracelular en el oocito y para estimular la proteína quinasa activada por mitógeno (MAPK)24,25.
Con respecto a los espermatozoides, niveles fisiológicos de ERO son requeridos para la capacitación, hiperactivación y reacción acrosómica de espermatozoides mamíferos26. Durante la capacitación espermática, las ERO como el anión peroxinitrato, H2O2 y NO• tienen un efecto dosis-dependiente sobre la función espermática. A bajas concentraciones las ERO son requeridas para promover el flujo de colesterol, la producción de AMPc, la hiperactivación y la fusión oocito-espermatozoide27,28. En contraste, un exceso de ERO puede afectar la funcionalidad espermática, debido a que la membrana celular de los espermatozoides es rica en ácidos grasos polinsaturados; lo cual la hace susceptible a peroxidación lipídica; además puede afectar la función mitocondrial, la interacción espermatozoide-zona pelúcida, reducir la motilidad espermática y generar un efecto deletéreo sobre el ADN de los espermatozoides, lo cual podría comprometer la fertilidad en los machos29-31. Por lo tanto, el uso de moléculas antioxidantes es de vital importancia para proteger las células de los altos niveles de ERO y sus efectos deletéreos.
A pesar de los grandes avances en las técnicas de reproducción asistida para simular las condiciones in vivo, dos factores principales contribuyen a la generación y acumulación de ERO in vitro: la ausencia de mecanismos de defensa endógenos y la exposición de los gametos y embriones a ambientes que generan ERO. Por lo tanto, las ERO pueden provenir de dos fuentes: endógenas, en las cuales los oocitos, espermatozoides y embriones inducen su acumulación a través de varias rutas metabólicas y enzimas, incluyendo principalmente la fosforilación oxidativa, NADPH oxidasa y la xantina oxidasa32.
Entre las fuentes exógenas de ERO se encuentran factores ambientales, como la criopreservación, la concentración de oxígeno, la fuente de energía, el medio de cultivo, y la luz6,33. El oxígeno es un componente importante de los ambientes oviductal y uterino, y puede tener un papel importante en la regulación del desarrollo embrionario, particularmente a través de la regulación del metabolismo. Ha sido reportado que la tensión de oxigeno encontrada en el oviducto y útero se encuentra en un rango de 5 a 8.7 % en varias especies34. Diferentes reportes soportan buenos resultados utilizando 5 y 20 % durante maduración y cultivo de oocitos35,36. Sin embargo, la tendencia es utilizar un 20 % de O2 durante la maduración del oocito, debido a que la ruta de producción de energía a concentraciones de O2 baja (5 %), disminuye la proporción de oocitos en MII, lo cual afecta la competencia de desarrollo del oocito1. En contraste, un 5 % de O2 durante el cultivo favorece su competencia para el desarrollo embrionario, celularidad y expresión génica relacionada con estrés oxidativo37. No obstante, se ha reportado que la exposición a altas concentraciones de oxigeno (20 % en aire), potencia el aumento de los niveles de ERO, disminuyendo los porcentajes de desarrollo embrionario en murinos38, porcinos39,40, caprinos41, bovinos42 y humanos43, generando arresto en el desarrollo, daño en el ADN, apoptosis y peroxidación lipídica, afectando la competencia embrionaria44. Además, al evaluar la abundancia relativa de RNAm en oocitos, se observa un patrón de mejor calidad cuando los oocitos son madurados en bajas concentraciones de oxígeno (5 %)45,46. Estos resultados reflejan los efectos perjudiciales de la concentración de oxigeno atmosférico sobre el cultivo de embriones mamíferos.
Por otra parte, los medios de cultivo, dependiendo de su composición y suplementos, pueden contribuir con la producción de ERO al sistema de producción in vitro de embriones3,47. El medio de cultivo incluye iones metálicos, tales como Fe2+ y Cu2+, los cuales son inductores de la formación de ERO a través de las reacciones de Fenton y Haber-Weiss, y en el caso del hierro, también puede actuar sobre lípidos generando peroxidación lipídica iniciada por radicales hidroxilos libres48. La suplementación con fluidos biológicos como es el suero bovino fetal (SBF), puede aumentar los niveles de ERO en relación con otros suplementos como la albumina sérica bovina (BSA). La presencia de la enzima amino oxidasa en suero49, que participa en la oxidación de aminas primarias, genera como producto secundario el peróxido de hidrógeno50, lo cual podría explicar el efecto de la concentración del suero sobre el porcentaje de apoptosis51, la criotolerancia y el patrón de expresión génica en embriones bovinos producidos in vitro52. Sin embargo, este suplemento proteico mejora la tasa de producción y la calidad de embriones bovinos53. Adicionalmente, para mantener la competencia de desarrollo de los oocitos bovinos durante la maduración in vitro, es necesario regular el contenido de glucosa. Altas concentraciones de glucosa en el medio de maduración incrementan los niveles de ERO y disminuyen el contenido de glutatión (GSH) intracelular en oocitos bovinos, inhibiendo enzimas responsables en la síntesis de GSH y afectando así la capacidad de los oocitos para reducir las ERO54,55, las cuales durante el desarrollo embrionario temprano pueden causar peroxidación lipídica de la membrana celular, fragmentación del ADN y afectar la síntesis de proteínas32,56.
Además, la luz visible también induce la producción de ERO generando oxidación de bases, quiebres en las cadenas del ADN y daño oxidativo en otras biomoléculas2. Se ha reportado que la motilidad y la hiperactivación espermática se ven afectadas por una producción excesiva de ERO, generada por la exposición a luz visible57. Además, se ha encontrado una producción excesiva de ERO en embriones in vitro que han sido expuestos transitoriamente a la luz visible, siendo la luz fluorescente blanca fría, que es la luz comúnmente utilizada en los laboratorios, la que más ERO genera en cigotos de ratón y hámster, reflejándose en el índice de apoptosis de blastocisto, pero el uso de filtros ha permitido disminuir los efectos de la luz58. En adición, estudios en los cuales se evaluaron dos tipos de luz (luz del día y luz del laboratorio) y tiempo de exposición en los medios de cultivo y en embriones porcinos, se encontró que redujo la calidad y los porcentajes de blastocistos partenogenéticos59. Esto sugiere que los medios de cultivo y los embriones deben ser protegidos de la luz durante los procesos de producción in vitro.
En los procesos de producción in vitro de embriones, el protocolo de preparación y capacitación del semen para la fertilización in vitro requiere el uso de centrifugación. Sin embargo, el tiempo y la fuerza centrífuga son factores que contribuyen a aumentar los niveles de ERO, causando daño oxidativo y afectando la función espermática5,60. Además, se observó que la centrifugación de espermatozoides sexados y no sexados por largos periodos de tiempo (45 min) a 700 xg causaba pérdida de la integridad de la membrana plasmática y fragmentación del ADN61,62. Este resultado sugiere que la membrana plasmática de los espermatozoides sufre un proceso de peroxidación lipídica debido a los altos niveles de ERO, disminuyendo la fluidez de la membrana y la funcionalidad para llevar a cabo la fertilización. Por esta razón, diferentes técnicas de preparación espermática como el “Swim-up” y los gradientes de densidad, han sido usadas para obtener espermatozoides con mayores porcentajes de motilidad e integridad en el ADN, y probablemente mejorar la capacidad fertilizante de los espermatozoides durante los procesos de producción in vitro63.
Finalmente, la criopreservación aumenta significativamente la producción de ERO en espermatozoides, afectando la motilidad, viabilidad, capacitación y potenciando la peroxidación lipídica de la membrana espermática, lo cual afecta el potencial de fertilidad64. En oocitos, las bajas tasas de fertilización de los oocitos criopreservados se relacionaron con los daños por congelamiento, incluido el endurecimiento de la zona pelúcida, debido a la liberación prematura de los gránulos corticales y la desorganización del huso y la pérdida o aglutinación de microtúbulos65,66. Por lo tanto, el uso de antioxidantes sería un factor importante en la supervivencia y función espermática antes, durante y después de la criopreservación. La Figura 1 muestra los efectos del estrés oxidativo y las fuentes de ERO durante los procesos de producción de embriones in vitro.
Antioxidantes enzimáticos y no enzimáticos
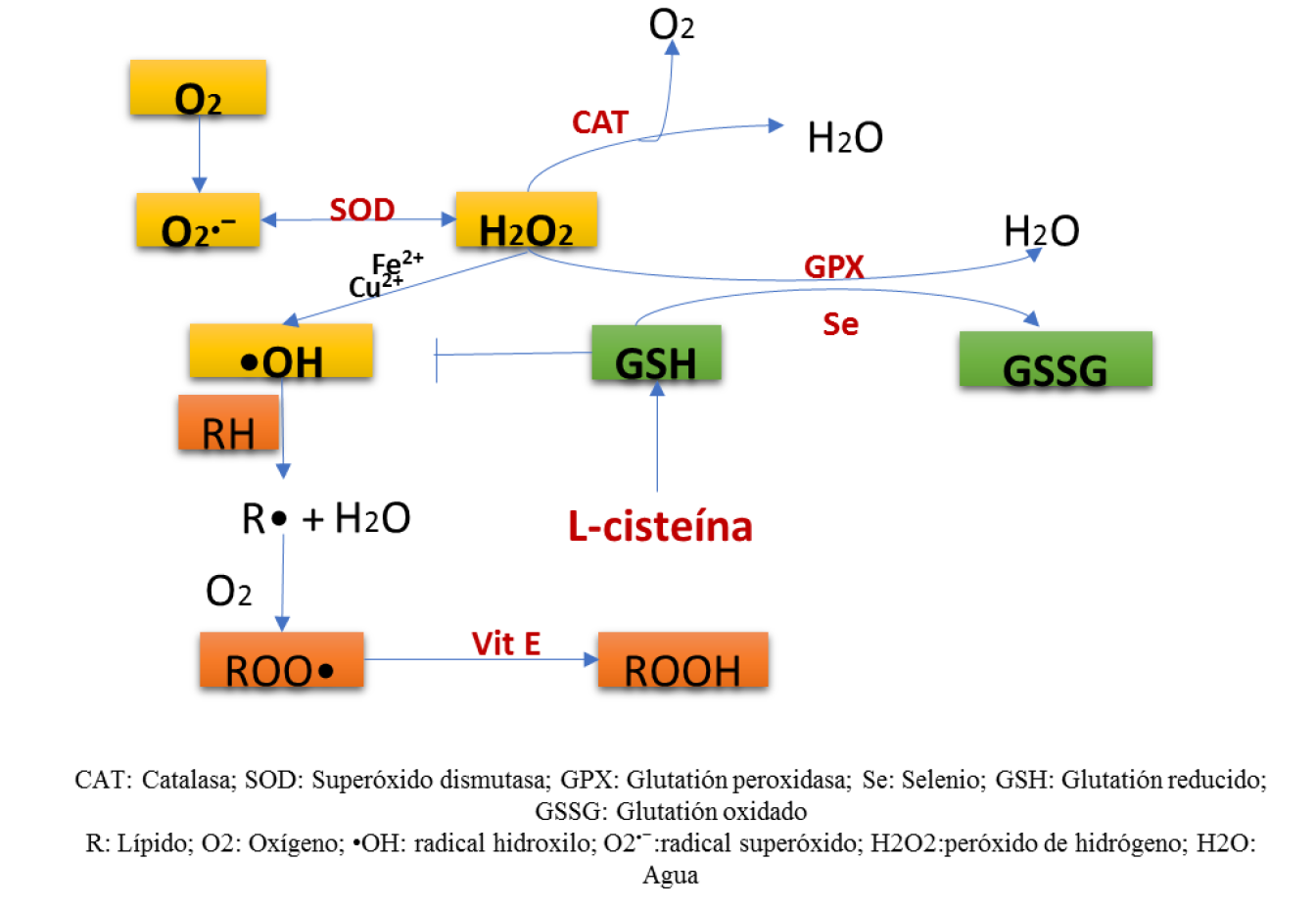
Un antioxidante con función biológica se define como una sustancia que disminuye o evita la oxidación del sustrato, resultando un agente reductor más potente67. Las especies reactivas de oxígeno pueden ser inactivadas por un sistema de defensa que consiste en enzimas y moléculas antioxidantes2. Estos mecanismos antioxidantes pueden ser mediados por proteínas de unión a hierro y cobre, tales como la transferrina, la ferritina y la albúmina68, por pequeñas moléculas antioxidantes principalmente derivadas de frutas y vegetales, o mecanismos enzimáticos, los cuales incluyen enzimas, tales como superóxido dismutasa (SOD), que cataliza la dismutación del anión superóxido en oxígeno y peróxido de hidrógeno; la catalasa (CAT) y glutatión peroxidasa (GPX) que convierten el peróxido de hidrógeno en agua (y oxígeno para la reacción de la CAT); moléculas hidrofílicas como el ascorbato, el urato y el GSH, y lipofílicas como tocoferoles, flavonoides, carotenoides y ubiquinol (Figura 2). También, enzimas involucradas en la reducción de formas oxidadas de pequeñas moléculas antioxidantes, como GSH reductasa y dehidroascorbato reductasa, o moléculas responsables del mantenimiento de grupos tioles en proteínas (tiorredoxina) hacen parte de los mecanismos antioxidantes de la célula12.
El GSH es el mayor componente sulfhidrilo no proteico en las células mamíferas, y es conocido por proteger la célula del daño oxidativo y regula el balance redox intracelular69; sin embargo, varios estudios han sugerido que el GSH puede jugar un papel importante en muchos procesos biológicos incluyendo la síntesis de ADN y proteínas y proliferación celular durante el desarrollo embrionario70. En oocitos bovinos, es considerado un importante marcador bioquímico de la viabilidad y la calidad de oocitos mamíferos71. Adicionalmente, se ha reportado la síntesis de GSH durante la maduración in vitro72,73, y su asociación con la formación del pronúcleo masculino después de la fecundación72,74 y el desarrollo embrionario temprano70. Por lo tanto, los niveles intracelulares de GSH son considerados un marcador de calidad del oocito y de su competencia para el desarrollo embrionario después de la fertilización in vitro.
Los antioxidantes más evaluados para suplementar los medios de cultivo son el ácido ascórbico (AA) y el alfa tocoferol (AT). El AT presenta principalmente un efecto benéfico sobre la tasa de blastocistos y su celularidad75,76, mientras el AA disminuye la producción de ERO en oocitos bovinos, mejorando su potencial para el desarrollo embrionario9. Para el caso del sistema de producción in vitro de embriones, el antioxidante AT, puede tener ventajas, debido a su hidrofobicidad, que le permite atravesar la bicapa lipídica, intercalarse en ella y disminuir las ERO dentro de la célula. El AA es un antioxidante hidrosoluble, que actúa sinérgicamente con tocoferol en algunas condiciones regenerando tocoferol a partir de radicales tocopheroxyl en un ciclo redox77. Ha sido reportado que AA disminuyó la producción de ERO en los medios de cultivo y mejoró la competencia de desarrollo embrionario bovino a través de la disminución de ERO intracelular en oocitos madurados con AA78. En adición, AA aumentó la tasa de blastocistos y la celularidad11, aumentó los niveles intracelulares de GSH y disminuyó la producción de EROS en oocitos bovinos10, mientras durante el CIV, AA disminuyó la producción de ERO y la expresión de genes pro-apoptóticos en embriones porcinos, potenciando el desarrollo embrionario79 y mejorando la tasa de supervivencia y calidad de embriones vitrificados80,81.
Además, se observó que el medio de cultivo embrionario suplementado con AT o AA aumentó la capacidad de desarrollo y la celularidad, y redujo la proporción de células apoptóticas en blastocistos porcinos derivados de fecundación in vitro (FIV) o transferencia nuclear de células somáticas (SCNT); sin embargo, este efecto no se observó cuando la suplementación fue combinada76.
Otros estudios han reportado los efectos benéficos de la melatonina, debido a que tiene una alta capacidad para atrapar radicales libres, reducir la concentración de ERO, aumentar la expresión de enzimas antioxidantes (SOD y glutatión reductasa)82,83, suprimir la expresión de enzimas pro-oxidantes y mejorar la función mitocondrial84,85. La melatonina, como muchos antioxidantes, tiene un efecto positivo o deletéreo dependiendo de la concentración que sea usada en el medio de cultivo. Como suplemento en el medio de FIV, a bajas concentraciones mejora la calidad y la motilidad espermática, disminuye los niveles de ERO y la peroxidación lipídica, y actúa como agente antiapoptótico en espermatozoides bovinos86 y espermatozoides humanos eyaculados87-89. En contraste, altas concentraciones de melatonina inducen fragmentación y oxidación de DNA espermático, disminuyen el número de espermatozoides viables y generan una disminución en las tasas de blastocistos, sin afectar la calidad embrionaria90,91. En relación al medio de cultivo embrionario, la melatonina aumenta las tasas de clivaje, blastocisto y eclosión, aumenta la celularidad embrionaria y promueve la activación de enzimas antioxidantes92,93.
Antioxidantes fenólicos
Se han realizado grandes avances en la identificación, purificación y evaluación de moléculas antioxidantes de origen natural94, como es el caso de los antioxidantes fenólicos, los cuales sirven para inhibir la oxidación de compuestos que tengan importancia biológica o comercial al tener una gran estabilidad, por la presencia de anillos aromáticos en su estructura y la presencia de grupos hidroxilo94,95. Debido a esto, algunos trabajos señalan su uso potencial como medicamento para la prevención y terapia de enfermedades causadas por los radicales libres tales como la isquemia, aterosclerosis, enfermedades neuronales y cardiovasculares96,97.
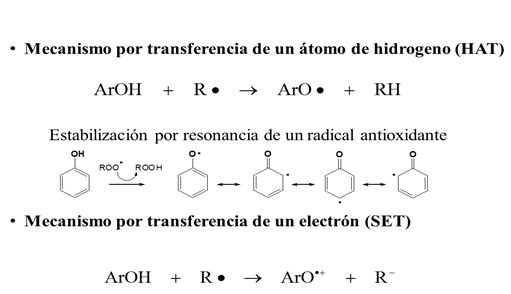
Los antioxidantes fenólicos (ArOH) poseen dos mecanismos de acción: por transferencia de un átomo de hidrógeno (HAT) o por transferencia de un electrón (SET). En el primero, el radical libre (R•) remueve un átomo de hidrogeno del antioxidante (ArOH), convirtiéndose en un radical ArO• más estable y más eficiente; debido a que los enlaces de hidrógeno, la conjugación y la resonancia lo convierten en un radical fenoxil no reactivo. En el segundo mecanismo, el antioxidante puede donar un electrón al radical libre formando entre los productos un catión radical del antioxidante (ArO•+), el cual es estable y no reacciona con sustratos (Figura 3). Ambos mecanismos pueden ocurrir siempre en paralelo, pero con diferentes tasas de reacción98.
Con el objetivo de buscar nuevos antioxidantes y evaluar su actividad en reproducción, el extracto de té verde (cuyos principales componentes son polifenoles), fue evaluado en oocitos madurados in vitro, y encontraron una respuesta favorable con respecto a la tasa de blastocistos y a las concentraciones de glutatión reducido dentro del oocito, pero con la limitante de la escasa repetitividad, debido a que el extracto puede variar de composición99. Otras moléculas de origen biológico con capacidad antioxidante son las antocianinas, la cuales se evaluaron en el medio de maduración de oocitos porcinos100 y bovinos101, sobre los diferentes parámetros de calidad del oocito, como son, el nivel de producción de radicales libres, los niveles de glutatión intracelular, la abundancia relativa de RNAm asociados a desarrollo embrionario y su competencia para la producción in vitro de embriones. Además, el efecto benéfico de los compuestos fenólicos presentes en la uva ha comenzado a capturar la atención de los investigadores, como es el caso del resveratrol (3,5,4’-trans-trihidroxiestilbeno) y el pterostilbeno (antioxidante natural análogo de resveratrol), los cuales se han encontrado en forma abundante en plantas y frutos como arándanos, moras, cacahuates, uva y vino tinto102,103. La actividad del resveratrol y el pterostilbeno se debe a distintas propiedades biológicas, tanto a nivel in vivo como in vitro, tales como su capacidad antioxidante, cardioprotectora, antiinflamatoria, quimiopreventivo en algunos modelos de cáncer y algunos efectos positivos en enfermedades metabólicas102,104. Estos resultados conllevan a la exploración de efectos biológicos in vitro en otros modelos y sistemas animales como la producción in vitro de embriones.
En relación al pterostilbeno, ha sido reportado que puede reducir los niveles de ERO y el porcentaje de lípidos en embriones, cuando es adicionado el medio de cultivo embrionario105. Sin embargo, pocos trabajos se han realizado con este tipo de antioxidante en biotecnologías reproductivas, lo que hace necesario realizar más estudios para comprender el mecanismo molecular por el cual el pterostilbeno ejerce su efecto sobre el metabolismo embrionario.
Por otro lado, se han encontrado reportes sobre el uso del resveratrol en la maduración in vitro del oocitos porcinos106, bovinos10,107-109 y cabras110, donde aumenta la concentración de glutatión reducido dentro del oocito, disminuye la producción de ERO y aumenta la tasa de blastocistos. Además, el uso del resveratrol durante el cultivo in vitro de embriones tiene un efecto positivo en el desarrollo embrionario111 y un aumento en la criotolerancia de blastocistos112,113, reflejando que la capacidad antioxidante del resveratrol mejora la calidad de los oocitos y su resistencia a los procesos de criopreservación. Sin embargo, cuando la concentración de resveratrol es alta (20 y 40 µM) el efecto benéfico desaparece y disminuye el porcentaje de oocitos bovinos capaces de completar el proceso de maduración hasta el estadío de metafase II114.
El efecto fisiológico del resveratrol parece estar relacionado a su capacidad para potenciar procesos celulares dependientes de Sirtuina 1 (SIRT1), la cual está también relacionada a la proteína quinasa activada por adenosina monofosfato (AMPK), que es un sensor energético que controla el metabolismo celular, incluyendo la fosforilación oxidativa y la oxidación de ácidos grasos115. La activación de AMPK a través de resveratrol incrementa los niveles de NAD+, el cofactor de SIRT1, el cual disminuye la acetilación de sustratos de SIRT1 y activa PGC-1α (coactivador 1α del receptor activado gamma del proliferador de peroxisoma)116,117. Sin embargo, se ha encontrado que a pesar de la activación de AMPK para observar los efectos metabólicos del resveratrol, el blanco directo de éste se encuentra corriente arriba de AMPK. Uno de los mecanismos propuestos es que el resveratrol activa AMPK a través de una inhibición competitiva de fosfodiesterasas (PDEs), incrementando los niveles de AMPc118. Este segundo mensajero juega un papel importante en la maduración de oocitos mamíferos, el cual es generado después de la unión de la FSH y LH a sus receptores específicos en la membrana plasmática de las células de la granulosa, por la activación de la adenilato ciclasa119. Los niveles intracelulares del AMPc son regulados por las PDEs, las cuales lo hidrolizan a 5´-AMP. El uso de inhibidores de PDE, generan un retraso del reinicio de la meiosis y una cinética más lenta en la expansión del cúmulo, lo cual prolonga el mantenimiento de las uniones gap entre el oocito y las células del cúmulo120. Esta prolongación de las uniones gap durante la maduración in vitro en presencia de inhibidores de PDE4 podría permitir el paso de metabolitos, iones, nucleótidos y aminoácidos, que mejoran la maduración citoplasmática del oocito, aproximándose a una sincronización entre la maduración nuclear y citoplasmática, lo cual favorecería la producción y calidad de blastocistos. El Cuadro 1 contiene un resumen de los estudios clave que usaron resveratrol como suplemento antioxidante durante la producción in vitro de embriones.
Cuadro 1 Resultados de estudios usando resveratrol como suplemento en los medios de cultivo para producción in vitro de embriones
| Cultivo | Gametos | Especie | Concentraciones de resveratrol | Resultados del estudio | Referencia |
|---|---|---|---|---|---|
| MIV | oocitos | Porcino | 0.1, 0.5, 2.0 y 10.0 μM | Mejoró el desarrollo de embriones partenogenéticos y fertilizados in vitro, aumentó el de GSH intracelular y disminuyó los niveles de ERO | (106) |
| Porcino | 20 µM | Aumentó la expresión de SIRT1, mejoró las funciones mitocondriales y la capacidad de desarrollo de los oocitos | (142) | ||
| Porcino | 2 µM | Mejoró la resistencia de los oocitos porcinos a los daños inducidos por la criopreservación | (113) | ||
| Bovino | 0.1, 1 y 10 µM | Indujo la secreción de progesterona, aumentó el de GSH intracelular y disminuyó los niveles de ERO, promovió la maduración del oocito y el subsecuente desarrollo embrionario | (107 ) | ||
| Bovino | 20 µM | Aumentó el contenido de ATP y la expresión de la proteína SIRT1 en oocitos madurados, mejoro la fertilización reforzando los mecanismos responsables del bloqueo de la poliespermia | (143) | ||
| Bovino | 2 μM | Disminuyó los niveles de ERO, aumentó las tasas de desarrollo embrionario y de celularidad embrionaria | (10) | ||
| Bovino | 20 y 40 μM | Resveratrol regula la expresión del gen CYP1A1 involucrado en el reinicio de meiosis | (114) | ||
| Bovino | 1, 10, 20 y 40 μM | Aumentó el desarrollo de embrionario, aumentó el de GSH intracelular y disminuyó los niveles de ERO | (108) | ||
| Bovino | 0.2 µM, 1 µM y 20 µM | Mejoró la capacidad de desarrollo de los oocitos, aumentado las tasas de maduración y las tasas blastocistos | (109) | ||
| Bovino | 2 µM | Resveratrol afectó la expresión de la proteína SIRT1 en oocitos y blastocistos de donantes de diferentes edades | (144) | ||
| Bovino | 2 µM | Disminuyó los niveles de ERO, aumentó los niveles de GSH y las tasas de clivaje y blastocisto y disminuyó la expresión de genes proapoptóticos | (145) | ||
| Caprino | 0.1, 0.25, 0.5, 2.0 y 5.0 µM | Disminuyó los niveles de ERO, aumentó los niveles de GSH y las tasas de desarrollo embrionario, y disminuyó la expresión de los genes proapoptóticos en las células del cúmulo, oocitos maduros, y blastocistos | (110) | ||
| FIV | Espermatozoides | Ratón | 15 µg/ml | Aumentó de la fertilización de oocitos, disminuyó la generación de ERO, la actividad del glutatión peroxidasa y la concentración de peroxidación lipídica. | (146) |
| Humano | 0.1, 1.0 y 10.0 mM | Evitó el daño del ADN inducido por criopreservación en hombres infértiles | (147) | ||
| CIV | Embriones | Porcino | 0.05, 0.1, 0.5, 1.0 y 25 µM | El resveratrol a 0.5 µM durante el cultivo presentó un efecto positivo en el desarrollo embrionario | (111) |
| Bovino | 0, 0.25, 0.5 y 1 µM | El resveratrol a 0.5 µM mejoró la calidad de los embriones y mejoró la criotolerancia embrionaria | (112) |
MIV= maduración in vitro; FIV= fertilización in vitro; CIV= cultivo in vitro.
Cambios de expresión génica y desórdenes epigenéticos inducidos por ERO
La competencia de desarrollo de un oocito está definida como la capacidad de un oocito para reiniciar meiosis, ser fertilizado, dividirse y alcanzar el estadio de blastocisto121. Esta competencia o calidad, es adquirida progresivamente durante la foliculogénesis con el crecimiento del oocito y su maduración a través de una serie de cambios celulares (actividad mitocondrial), moleculares (perfil de expresión génica) y funcionales (actividad de proteína quinasa)55,122. Durante el crecimiento y maduración del oocito son sintetizadas RNAm y proteínas, los cuales contribuyen al desarrollo temprano antes y después de la activación del genoma embrionario. Este almacenamiento de RNAm se da durante el crecimiento del oocito y se desarrolla un evento de poliadenilación en cada transcripto, como un regulador clave en la expresión de genes y es conocido como un importante paso para el desarrollo del embrión mamífero123. Sin embargo, las condiciones de maduración in vitro pueden afectar los niveles de poliadenilación en mRNAs materno, lo cual puede tener implicaciones en la calidad embrionaria124. Esto sugiere que deficiencias en la competencia para el desarrollo en la mayoría de los oocitos madurados in vitro, podrían reflejarse en la composición y abundancia de transcriptos de RNAs específicos en el oocito.
Por esta razón, diferentes transcriptos se han evaluado en el oocito con el fin de asociarlos a su calidad o a la competencia para el desarrollo embrionario. Entre los más estudiados están NLRP5 (NLR Family Pyrin Domain Containing 5, conocido como MATER) , un gen de efecto maternal específico del oocito requerido para el desarrollo embrionario temprano en bovinos, ratones y humanos125-127. POU5F1 (POU domain class 5, transcription factor 1) o también conocido como OCT-4, el cual ha sido validado como marcador para reprogramación epigenética y pluripotencia, y es crucial para el desarrollo embrionario normal128. Se reportó que la expresión de POU5F1 aumentó en embriones porcinos derivados de SCNT tratados con vitamina C129.
Adicionalmente, con el objetivo de predecir el éxito de la fertilización y mantener la viabilidad del oocito, la expresión de genes como ácido hialurónico sintetasa 2 (HAS2), ciclooxigenasa 2 (COX2; PTGS2) y gremlin (GREM1) en las células del cumulo han sido correlacionados con competencia del oocito y su subsecuente desarrollo embrionario111,130.
En el desarrollo de embriones bovinos, la viabilidad celular está determinada por alteraciones en la expresión de genes relacionados al metabolismo como GLUT-1 (glucose transporter-1transcriptos)131, factores de crecimiento como IGF-2 (insulin-like growth factor 2) e IGF-2R (insulin-like growth factor 2 receptor), la diferenciación temprana y funciones trofoblásticas como IF (interferon tau) y Mash2 (mammalian achaetescute homologue)132,133. Sin embargo, durante los procesos de producción in vitro de embriones no solo se observan cambios en la expresión génica, sino también desórdenes epigenéticos que pueden afectar los patrones de metilación de ADN sobre algunos genes (DNA methyltransferase, DNMT1a, DNMT3a y DNMT3b) y por consiguiente afectar los perfiles de expresión génica que codifican para un tejido especifico134.
Además, se ha evaluado el efecto de los suplementos antioxidantes en los medios de cultivo sobre la regulación de la expresión génica. En el caso del resveratrol durante la maduración in vitro de oocitos porcinos106,111,135 y caprinos110, se observó una disminución en los niveles de transcripción de genes relacionados con apoptosis como BAX, BAK y Caspasa-3, mientras que no se observaron cambios en la expresión del gen BCL-2. Esto sugiere que el resveratrol suprime la expresión de genes proapoptóticos en oocitos madurados, y ejerce un efecto protector sobre los embriones producidos in vitro. También se observó que la suplementación con AA en el medio reguló positivamente la expresión génica pluripotente en blastocistos porcinos partenogenéticos, y disminuyó la expresión del gen proapoptótico Bax79.
Cuando se suplementó el medio de cultivo y los medios de vitrificación- descongelación con AA, se observó que la expresión de los genes asociados a estrés oxidativo GPX1 y SOD1 aumentó, mejorando las tasas de supervivencia y disminuyendo los niveles de peróxido a las 24 h pos- descongelación136. Un reporte anterior en bovinos, encontró que la abundancia relativa de GPX1 es mayor en blastocistos de excelente calidad (grado 1) que en blastocistos buenos (grado 2), lo que sugiere que una menor expresión del gen GPX1 se asocia con menor calidad embrionaria137.
Además, las ERO producidas de manera endógena y exógena durante la PIVE pueden inducir cambios epigenéticos. Condiciones de cultivo que incluyen cambios en el pH, osmolaridad, temperatura, exposición a la luz visible, concentración de oxígeno y centrifugación de las células, pueden afectar el patrón epigenético durante el proceso in vitro afectando la calidad de los gametos y embriones134. Se ha sugerido que el estrés oxidativo puede producir en los gametos, alteraciones en los patrones de metilación del ADN y modificación de las proteínas histonas, cambios transmisibles de gametos a embriones generando variaciones en el epigenoma que podrían alterar el subsecuente desarrollo embrionario138-140. Los mecanismos de transmisión al embrión durante la fertilización y el clivaje aún no han sido dilucidados; sin embrago, se sugiere que el daño por estrés oxidativo en el epigenoma de los gametos -los cuales aumentan los aductos en el ADN y las alteraciones en los perfiles de metilación-, son transferidas al embrión, manifestándose en alteraciones fenotípicas observadas en los recién nacidos141.
Recientemente se ha demostrado que la inducción de estrés oxidativo en espermatozoides utilizando H2O2 causa daño oxidativo en el epigenoma de los espermatozoides, el cual subsecuentemente reduce las tasas de desarrollo embrionario y altera la diferenciación celular en los blastocistos. Lo cual resulta en una reducción en las tasas de implantación, reducido crecimiento fetal, aumento del tejido adiposo, disminución de la masa magra y reducida tolerancia a la glucosa. Estos hallazgos implican a las ERO como uno de los mecanismos responsables de la transmisión de señales de salud de los padres a los hijos141.
Conclusiones
A pesar de que las técnicas de producción in vitro de embriones se utilizan de manera comercial en la producción animal, es evidente que existen múltiples factores que pueden generar estrés oxidativo y afectar potencialmente la calidad de los oocitos madurados y consecuentemente las tasas de desarrollo embrionario. El ambiente y los procedimientos a los cuales son sometidos los embriones y los gametos, generan un aumento en los niveles de ERO contrario a los niveles fisiológicos requeridos para regular varias funciones celulares, afectando la morfología y funcionalidad de la célula. Estos factores pueden afectar diferentes biomoléculas generando daños en el ADN, peroxidación lipídica, cambios en los niveles de expresión génica y desórdenes epigenéticos. Esto sugiere el uso de moléculas con actividad antioxidante durante la maduración in vitro y la búsqueda de nuevas sustancias de origen natural, que permitan disminuir el estrés oxidativo durante los procesos de producción in vitro de embriones, con el fin de mejorar la calidad del oocito y su competencia para el desarrollo embrionario.











 texto en
texto en