Introducción
En la actualidad, está comprobado que la implementación de promotores de crecimiento de tipo sintético en producción animal genera mejores ganancias de peso en corral, y mayores rendimientos de carne magra1; no obstante, se han encontrado repercusiones negativas con el uso de estos compuestos, los cuales han ocasionado detrimento en algunos parámetros de la calidad de la carne2,3 y riesgos de intoxicación debido a la residualidad de los compuestos sintéticos en las vísceras y carne4-7.
En países de la Unión Europea y Asia, se ha restringido el uso de estos compuestos debido a los riesgos de residualidad que pueden provocar4, por lo que resulta una limitante para los países importadores que utilizan este tipo de tecnologías, lo cual lleva a importantes pérdidas económicas, por lo que la industria de la carne ha tratado de buscar opciones seguras para promover el crecimiento animal.
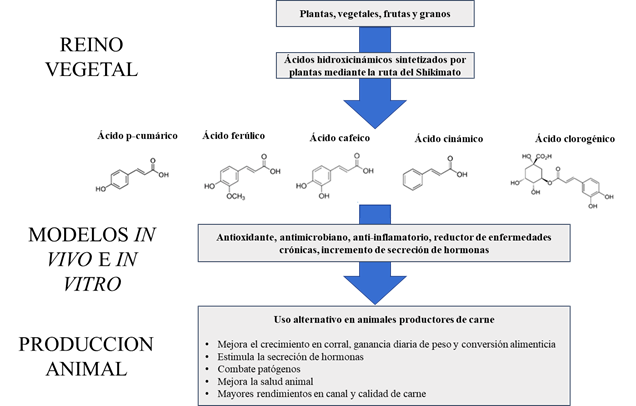
Es por lo anterior, que una de las alternativas recientemente implementadas es el uso de compuestos naturales de origen vegetal, mejor conocidos como fitoquímicos (FQ). Los FQ son metabolitos secundarios no nutricionales utilizados por las plantas para protegerse contra microorganismos, plagas y herbívoros; su clasificación es compleja, y puede ser de acuerdo a diferentes propiedades como su función biológica, origen, estructura química o pureza, donde en esta última se clasifican en polifenoles, isoprenoides, aceites esenciales y fitoestrógenos8,9. La forma de uso puede ser utilizando partes enteras o subproductos de la planta, tales como raíces, hojas, corteza; o bien, los compuestos bioactivos presentes en la planta como aceites esenciales, compuestos aislados o mezclas de compuestos10.
La mayoría de los FQ se catalogan como generalmente reconocidos como seguros (GRAS “por sus siglas en inglés”), los cuales se han utilizado durante años en humanos como medicina alternativa y remedio para padecimientos crónicos7,11. Asimismo, los FQ se han llevado a la práctica en producción animal con la finalidad de combatir infecciones, mejorar el estatus de salud para sobrellevar un desarrollo óptimo de los animales a lo largo de las etapas de crecimiento, y así sustituir a las sustancias sintéticas implementadas de manera rutinaria como antibióticos, hormonas y agonistas adrenérgicos β12.
Dentro de los FQ se encuentran los ácidos hidroxicinámicos (AH) los cuales son un grupo de fenoles presentes en plantas, frutas, raíces, granos, semillas; los más conocidos son el ácido caféico, ferúlico, p-cumárico, sináptico y clorogénico13. Su uso no sólo se ha limitado a combatir padecimientos o enfermedades en humanos, también pueden ser incorporados en la dieta animal ya sea intrínsecamente como parte del alimento o de forma aislada, con la finalidad de ejercer cambios fisiológicos que contribuyan a un efecto en el crecimiento14. Recientemente, algunos estudios han reportado cambios favorables con AH suplementados de forma exógena en la dieta animal, generando mejoras en el crecimiento, salud animal y calidad de la carne15,16,17.
Sin embargo, para elucidar el mecanismo involucrado totalmente, se necesita conocer la cinética y cómo los AH son aprovechados por el organismo, cuánto es el tiempo de vida media que poseen (absorción, distribución, metabolismo y excreción), la biodisponibilidad y la farmacodinamia, que es la relación directa entre el aditivo o fármaco suplementado y el sitio de acción, biotransformación y modificaciones fisiológicas, y los cambios que pueden ocurrir en el metabolismo18.
La controversia actual al utilizar los AH y la mayoría de los aditivos naturales, es tratar de encontrar las dosis efectivas y las posibles rutas involucradas en el crecimiento, la deposición muscular y el aprovechamiento de nutrientes, para tratar de sugerirse como alternativa ante los compuestos promotores de crecimiento sintéticos. Esta revisión discute las posibles vías de absorción, biotransformación y cambios metabólicos ocurridos cuando los AH son suplementados en animales de engorda, con el propósito de buscar un efecto promotor del crecimiento y sin afectar negativamente la calidad de la carne.
Definición, fuentes y propiedades de los ácidos hidroxicinámicos
Los ácidos hidroxicinámicos se derivan del ácido cinámico, normalmente están presentes en plantas y frutas en forma de ésteres de ácidos orgánicos o glucósidos o inclusive unidos a proteínas y otras moléculas de la pared celular como celulosa, xilanos y lignina13,19. Estos AH se encuentran en gran cantidad y son productos secundarios del metabolismo en plantas, los cuales estas mismas los sintetizan mediante la vía del shikimato, donde el aminoácido fenilalanina es el precursor de los AH en esta ruta, se conoce que estos compuestos son usados por las plantas como defensa ante patógenos e insectos8,20. Recientemente se han estudiado sus posibles efectos bioactivos y beneficios en humanos y animales cuando son utilizados como suplementos alimenticios: estas propiedades bioactivas incluyen su efecto antioxidante, antimicrobiano, preventivo de enfermedades crónicas como el cáncer, arterosclerosis y últimamente se ha indagado su efecto como promotor de crecimiento con fines zootécnicos21,22,23.
Los AH se pueden extraer desde la pared celular mediante métodos alcalinos y enzimáticos24,25,26, su estructura básica es un fenilpropanoide, donde el ácido cafeico, es el más predominante en la naturaleza27.
El principal atributo de los AH es su actividad antioxidante, debido a los grupos hidroxilo presentes en el anillo aromático22. Esta capacidad se ha demostrado en modelos in vivo e in vitro con la finalidad de prevenir o tratar diferentes enfermedades relacionadas con el estrés oxidativo como cáncer, diabetes, alteraciones cardiovasculares y enfermedades inflamatorias13,28,29,30. Recientemente, el efecto antimicrobiano ha tomado un interés en función de su capacidad para inactivar o eliminar bacterias patógenas, inclusive modificar la microflora intestinal con el objetivo de mejorar el aprovechamiento de nutrientes, además de reducir la incidencia a enfermedades mediante un óptimo funcionamiento del sistema inmune31,32,33. Con base a ello, existe un amplio campo de posibilidades para utilizarse en animales de engorda, primero con la finalidad de sustituir a las moléculas sintéticas y segundo con la posibilidad de aprovechar sus diferentes propiedades bioactivas.
Ácidos hidroxicinámicos como aditivos en animales de engorda
La siguiente temática aborda algunos reportes de AH suplementados en ganado y sus potenciales actividades biológicas que estos compuestos pueden generar. Las nuevas perspectivas de los consumidores de carne se centran en la demanda de productos más saludables de fuentes naturales, evitando el riesgo que puede generar al consumir productos sintéticos tanto en la salud como en la calidad de la carne.
Los supuestos de cómo pueden actuar los AH al suplementarse como aditivos son diversos, ya sea como antibiótico, ionóforo, antioxidante, antiinflamatorio, anabólico o mejorador de la palatabilidad, y en la mayoría de los casos sin comprometer la salud y calidad de la carne34,35 (Figura 1). En contraste con algunas sustancias sintéticas que se usan por tiempo limitado y en ciertas etapas del crecimiento animal, al menos los AH u otros compuestos fitoquímicos no se han encontrado limitantes en una fase de crecimiento específica en el animal o posible daño por efectos residuales de estos compuestos36,37,38.
Evaluación de ácidos hidroxicinámicos en pruebas de comportamiento y calidad de la canal
La inclusión de AH de forma aislada en pruebas de comportamiento aún es limitado, y no hay pruebas suficientes que eluciden un beneficio productivo en animales10,39. El ácido ferúlico (AF) es uno de los AH que recientemente se ha probado en animales de engorda con el objetivo de buscar un efecto promotor del crecimiento. Sin embargo, el mecanismo de acción se desconoce y sus efectos han sido contradictorios y no del todo consistentes.
En cerdos40 recibiendo 100 mg de AF/kg de alimento por 28 días, no se presentaron mejoras ni en comportamiento productivo ni en los cortes primarios en canal. Por su parte en corderas 41 suplementadas con 300 mg de ácido ferúlico/día por 34 días, no se encontraron diferencias en comportamiento productivo respecto a los animales sin aditivo, solamente se mejoró el área de ojo de costilla de la canal (control= 16.61 vs AF= 18.0 cm2), lo cual puede ser un indicativo de una mayor deposición muscular en el animal.
Un efecto promotor de crecimiento se encontró en vaquillas en finalización, donde se probaron dos dosis de AF (5 y 10 mg/kg peso vivo/día) y se encontraron resultados interesantes, ya que la ganancia diaria de peso fue mayor en las dosis de AF (1.02 y 1.24 kg/día) respecto al control (0.93 kg), y la conversión alimenticia se mejoró hasta un 20 %; asimismo el rendimiento de las canales fue 1.64 % mayor que el control y en la dosis de 5 mg de AF, el área de ojo de costilla fue más grande que el control (85.61 vs 82.12 cm2)42.
En otro estudio donde se suplementó 15 mg/kg de alimento de AF a cerdos en finalización, se observó un espesor de la grasa dorsal similar entre los cerdos suplementados con el β-agonista ractopamina y AF (9.60 y 9.67 mm, respectivamente)43, lo cual sugiere una posible activación de la hormona sensible a lipasa a nivel de grasa subcutánea, la cual es la responsable de la lipólisis, y donde gran parte de esta energía generada es aprovechada por el organismo animal para redirigirla a otras funciones metabólicas como la deposición muscular. En el mismo sentido, se ha reportado que AF incrementa la síntesis de hormonas endógenas entre las cuales se encuentra prolactina y hormona del crecimiento, lo que se puede traducir en una mayor deposición de músculo44. Sin embargo, es necesario realizar más investigaciones a nivel celular y de metabolitos en sangre para aseverar si AF actúa como un promotor de crecimiento de tipo anabólico.
Por otro lado, el ácido cinámico en su forma pura aún no ha sido estudiado in vivo con animales de engorda; sin embargo, un estudio in vitro demostró que el ácido cinámico es reconocido en células 3T3-L1 de los adipocitos, y que estimula la activación de la AMPk y mejora la sensibilidad a la insulina causando una posible alteración en el perfil de ácidos grasos45. El cinamaldehído no es un AH, pero es un compuesto presente en fuentes similares que el ácido cinámico, y a partir de este compuesto se puede sintetizar ácido cinámico en el animal. Un reporte indica que al suplementar cinamaldehído (400 y 800 mg/día) en novillos durante 28 días, la ganancia diaria de peso se mejoró (2.18 y 2.08 kg vs 1.97 kg dieta control) y el área de ojo de costilla se incrementó respecto al control (89.5 vs 86.3 cm2)46; basándose en esto, los autores sugieren que el cinamaldehído modifica las poblaciones microbianas y cambia el perfil de ácidos grasos volátiles, efecto que produce una mejor digestibilidad de nutrientes, reducción de gas metano y se aprovecha esta energía para re-direccionarla hacia el crecimiento del músculo; sin embargo, una dosis elevada de cinamaldehído (1,600 mg/día) puede disminuir la fermentación ruminal y de esta forma, reducir la disponibilidad de proteína microbiana y de alimento, y así causar un detrimento en la nutrición del animal47.
Se ha planteado la hipótesis de que en rumiantes, los compuestos fenólicos como ácido cinámico, p-cumárico y ferúlico, podrían perderse en el líquido ruminal por absorción y utilización por los microorganismos del rumen o hidrogenación por bacterias específicas que provocan una limitación en el crecimiento48, y contradictoriamente otros autores indican que los monómeros fenólicos que se encuentran en el forraje se pueden liberar y absorber en el tracto gastrointestinal y posiblemente provocar cambios benéficos en el animal49,50.
Estudios in vitro y en ratones con ácido ferúlico, muestran posibles actividades reductoras de grasa, debido a una disfunción de los adipocitos, y que involucra un menor crecimiento de preadipocitos, detrimento de los ácidos grasos y colesterol en hígado y plasma51,52. Por su parte, el ácido caféico y ácido clorogénico muestran una inhibición de enzimas responsables de la síntesis de ácidos grasos tales como la ácido graso sintasa y 3-hidroxi-3-metilglutaril CoA53,54.
En base a lo revisado, la suplementación de los AH en el ganado tiene repercusiones favorables sobre un efecto promotor del crecimiento, por lo que es necesario indagar en más estudios para aseverar si existe esta actividad promotora. Se ha encontrado que estos monómeros fenólicos provenientes del forraje o adicionados exógenamente pueden tener un efecto negativo en rumen y actuar como antimicrobiano en las poblaciones celulolíticas y limitar el aprovechamiento de energía de los carbohidratos estructurales del forraje, esto se comprobó en un estudio en cultivo ruminal con 0.2 % de p-cumárico y clorogénico donde se ejerció tal efecto inhibitorio50,55.
No obstante, los AH presentes en la lignina del forraje presentan digestibilidad en diferentes secciones del tracto gastrointestinal, mayormente en rumen, abomaso e íleon, lo cual puede indicar un potencial de diversas interacciones, tanto positivas como negativas, entre los AH y los procesos biológicos de la digestión y el metabolismo de los rumiantes 50.
Con base a lo reportado con AF en cerdos y bovinos donde se han probado dosis y tiempos, se pueden sugerir dosis bajas (5 mg/kgPV/día) durante tiempos no mayores a 30 días para la suplementación de otros AH con la finalidad de buscar un efecto promotor de crecimiento; sin embargo, cada monómero puede actuar, absorberse y metabolizarse de diferente manera, por lo cual al suplementar estos aditivos con fines productivos, es necesario monitorear de cerca el estado de salud del animal.
Cambios en la calidad de la carne de animales suplementados con ácidos hidroxicinámicos
La oxidación y el crecimiento microbiano son las principales causas de la pérdida de calidad de la carne fresca, lo que lleva al detrimento de propiedades nutricionales, sensoriales, funcionales y de salud para el consumidor; generando un rompimiento en la cadena de producción animal y por consecuencia, pérdidas económicas importantes para la industria cárnica56,57.
Con base a esto, la industria ha probado antioxidantes tanto sintéticos como naturales, con el propósito de mejorar la calidad y estabilidad de la carne y los productos cárnicos58,59,60. El uso de aditivos desde la dieta animal se realiza con la finalidad de reducir los procesos de oxidación, formación de compuestos volátiles y deterioro microbiano en la carne, manteniendo la calidad nutricional y extendiendo la vida de anaquel de la misma, todo lo anterior desde el metabolismo animal31,61.
En realidad, existe una gran variedad de compuestos y mezclas utilizadas en la dieta animal para ejercer este efecto protector en la carne, donde uno de los principales es la vitamina E62,63,64; pero en el contexto de los AH los estudios son escasos. Sin embargo, debido a la alta capacidad antioxidante de los ácidos ferúlico, cafeico y p-cumárico, se pueden sugerir como suplementos alimenticios para prevenir la oxidación lipídica de la carne mediante inhibición de la formación de productos primarios y secundarios, por ejemplo la reducción de la formación de malonaldehído (MDA)17,40,65,66.
Se ha evidenciado que los fitogénicos pueden mejorar la calidad de la carne de cerdos y bovinos67,68; específicamente se ha demostrado que AF en dosis de 5 y 6 mg/kgPV/día durante 30 días en dieta de bovinos, se logra retardar la oxidación de lípidos, obteniéndose valores por debajo de 1 mg de MDA/kg carne al día 10 de almacenamiento bajo condiciones de refrigeración, aunado a una reducción en la formación de metamioglobina, respecto a la carne de los animales no suplementados, confirmándose así, un efecto protector contra la oxidación de los ácidos grasos poliinsaturados y de la proteína mioglobina17,69. En el mismo sentido, se encontró un efecto protector de AF (100 mg/kg alimento) mezclado con vitamina E (400 mg/kg alimento) al suplementarse en cerdos en finalización, generando valores de TBA en músculo menores que el control, y con una menor dureza de la carne40.
No obstante de la potencial actividad antioxidante, suplementaciones por un largo periodo o a dosis altas de compuestos fenólicos pueden causar un efecto pro-oxidante en la carne y acelerar la oxidación de los ácidos grasos y proteínas; particularmente se ha visto que AF suplementado en bovinos a 6 mg/kgPV/día durante 60 días17 o 10 mg/kgPV/día por 30 días69 previo al sacrificio, genera valores de MDA/kg de carne por encima de 2 mg desde el día 3 de almacenamiento y hasta un 30 % de formación de metamioglobina a los 7 días de almacenamiento. El efecto prooxidante de AF después de la suplementación por tiempo prolongado o una dosis alta, posiblemente se debe a una alta acumulación de esta molécula en el músculo, generando un estímulo para el inicio de la oxidación; es conocido que una alta concentración de antioxidantes afecta la estabilidad de metales traza, lo que puede alterar la estabilidad de la proteína mioglobina causando su oxidación70,71.
En engordas comerciales es común utilizar vitamina E durante la fase de finalización o en etapas anteriores58,60, con la finalidad de mantener la estabilidad del color de la carne y retardar su oxidación durante el almacenamiento; los AH pueden ejercer un beneficio similar aunado al efecto promotor que puede provocar en el metabolismo animal y deposición de este antioxidante en músculo, por lo que se puede obtener un doble beneficio o inclusive utilizarse como coadyuvante a la vitamina E; esta sinergia se ha probado en cerdos, y se encontró que una mezcla de AF (100 mg/kg alimento) y vitamina E (400 mg/kg alimento) reducen un 50 % el contenido de MDA en músculo Longissimus dorsi y se incrementa el área de ojo de costilla respecto a la dieta control (44.70 vs 37.17 cm2)40, por lo que buscar combinaciones de compuestos puede resultar benéfico para el productor.
Propiedades farmacocinéticas de ácidos hidroxicinámicos en producción animal
Los estudios de farmacocinética con FQ, especialmente los relacionados con el uso de AH en ganado de engorda, aún son limitados e inclusive no son del todo claros; sin embargo, algunos reportes muestran que estos compuestos al ser suplementados o consumidos a través de la dieta sí logran llegar al sistema portal y así, estar biodisponibles para el organismo72-76.
La farmacocinética se define como la ruta que puede tomar algún fármaco o compuesto una vez consumido hasta excretarse y conocer las tasas de absorción en diferentes órganos, esto con el objetivo de saber si el compuesto se aprovecha por el organismo o no. Los AH, pueden añadirse en forma pura o en combinación con otros AH y se plantea la hipótesis de que estos se absorben en cierta cantidad en el estómago y en mayor proporción en el intestino, para llegar al torrente sanguíneo y ejercer los cambios fisiológicos, como la capacidad de reducir la oxidación en tejidos como hígado y músculo23,77; sin embargo, la tasas de absorción de estos compuestos en el tracto gastrointestinal y el alcance al torrente sanguíneo pueden variar debido a enzimas, microorganismos presentes en rumen o intestino, factores de estrés y especie animal y biotransformaciones que pueden sufrir como glicosilación o sulfatación de estos72,78.
Una de las características de algunos AH es su tamaño tan pequeño, que pueden llegar a cruzar el tracto gastrointestinal mediante difusión pasiva, principalmente en el estómago e intestino delgado, para ser absorbidos y depositados en distintos órganos con la ayuda de transportadores como la albúmina54. Posteriormente, estos compuestos ya absorbidos cambian su polaridad y se hacen más afines al agua, para ser excretados en la orina a través de los riñones en su forma glicosilada79. La mayoría de los estudios se centran en modelos murinos, y elucidar una posible ruta y farmacocinética de AH en animales de engorda es complejo33,80; cabe destacar que el sitio de absorción depende de la especie, dieta utilizada, fisiología, estado de salud, genética entre otros. Por lo tanto, es interesante revisar algunos informes con rumiantes y no rumiantes y así aseverar cuales AH son los más efectivos o están más biodisponibles para actuar en el organismo.
Farmacocinética de ácidos hidroxicinámicos en rumiantes
En los rumiantes, el metabolismo y la cinética de los compuestos fenólicos incluidos los AH es muy complejo porque se presentan varias modificaciones principalmente en rumen; cuando el rumiante consume un ácido fenólico, el primer sitio de acción donde se modifica al AH es el rumen, ya que las poblaciones microbianas y el ambiente anaerobio ocasionan una hidrogenación rápida de compuestos fenólicos, una deshidroxilación y una subsiguiente biotransformación al ácido fenilpropiónico. Posteriormente este fenilpropionato es absorbido en el torrente sanguíneo y llega al hígado, produciéndose una β-oxidación para finalmente excretarse en forma glicosilada o ácido libre81.
Algunos estudios farmacocinéticos han mostrado la ruta y la modificación del ácido ferúlico, ácido cafeico y cinámico en rumiantes; dos estudios con ácido ferúlico suplementado en ovinos y vacas lactantes indicaron que éste se absorbe dentro de las primeras 5 h después de la administración. En las vacas el muestreo se hizo a intervalos de tiempo más cortos, y se observó que la concentración de ácido ferúlico aumentó al inicio y durante las primeras 6 h post-administración y disminuyó con el tiempo hasta regresar a los niveles basales (14 h después de la dosificación), lo cual sugiere una rápida absorción; así mismo, posiblemente la parte del compuesto que no fue modificada en rumen se absorbió posteriormente en bajas concentraciones72,73.
En el líquido ruminal pueden encontrarse una gran variedad de compuestos fenólicos provenientes de la dieta, siendo el ácido 3-fenilpropiónico el más abundante (50 a 80 %), y el ácido cinámico presente en una proporción mínima (7 %)49,82. Es necesario indicar que la estructura de los AH depende de los microorganismos del rumen y las cantidades de dosis administradas, donde aproximadamente un 0.4 % de estos aditivos en dieta puede perjudicar negativamente el crecimiento y aprovechamiento de la dieta55; además la degradación del forraje, particularmente lignina, puede verse comprometida su degradación debido a la liberación de AH, mayormente AF y limitar el crecimiento de bacterias celulolíticas; por su parte ácido p-cumárico presenta enlaces ésteres más fuertes, por lo que su liberación se da en menor cantidad que AF50,83; las bacterias celulolíticas del rumen son microorganismos responsables de degradar los compuestos fenólicos a través de la hidrogenación de la cadena lateral del AH, lo cual limita su biodisponibilidad, por lo que es necesario indagar en pruebas futuras con distintas especies de microorganismos presentes en el rumen, ya que pueden generar cambios importantes en los AH suministrados, también sería de interés cuantificar los cambios en las poblaciones microbianas y los ácidos grasos volátiles, los cuales son de suma importancia en el aprovechamiento de los nutrientes en el animal72,84.
Una alternativa para evitar estas biotransformaciones de los AH en el rumen, puede ser suministrarlos en forma protegida como encapsulación o saponificación, y así llegar a tejidos diana y ejercer sus efectos bioactivos. La encapsulación consiste en la formación de partículas lipídicas de pequeño tamaño (nano y micro partículas), capaces de almacenar y estabilizar sustancias bioactivas como sales, aminoácidos, proteínas o compuestos fenólicos, protegiéndose de interacciones con el ambiente y controlando su liberación en un sitio específico del organismo o tejido blanco85,86. Debido a la complejidad de bacterias en el rumen y su importancia en el aprovechamiento de nutrientes para el animal, diferentes estudios se han enfocado en el uso de la encapsulación con la finalidad de dirigir compuestos hacia tejidos diana, o que el compuesto sea aprovechado por ciertas poblaciones bacterianas mediante la liberación controlada del compuesto. Sustancias como resveratrol, ácido fumárico, probióticos, ácido linoleico conjugado, ionóforos, entre otros, se han implementado con la finalidad de disminuir las emisiones de metano mediante cambios en la población del rumen o estabilizar la microbiota intestinal86-89.
Farmacocinética de ácidos hidroxicinámicos en monogástricos
Los compuestos fenólicos en monogástricos son más capaces de conservar su estructura y tener una menor tasa de degradación-transformación, por lo que se asevera que pueden tener cierto efecto principalmente como antioxidantes, ya que debido a su rápida absorción y aparición en torrente sanguíneo, pueden prevenir la generación de radicales libres por estrés oxidativo23,40. Además, dentro de las actividades biológicas de los AH, se han reportado propiedades como agentes antimicrobianos en la microbiota intestinal o contra especies patógenas, y reducción de procesos inflamatorios, mejorando la absorción de nutrientes por la mejoría en la fisiología de intestino31. Sin embargo, la estructura inicial dependerá del AH suministrado y deben tomarse en cuenta todos los cambios estructurales que pueden sufrir, lo cual podría limitar sus efectos24,78.
En los monogástricos como el cerdo, el ácido cinámico proviene del cinamaldehído presente en el alimento, y más tarde se oxida a ácido cinámico en el estómago e intestino delgado. Su vida media estimada para este compuesto oscila entre 3 y 5 h después de la administración. Debido a la posible circulación de ciertos AH en el torrente sanguíneo, también se requieren de transportadores que los lleven al tejido diana correcto, como es el caso de la albúmina sérica, que es uno de los principales acarreadores de metabolitos para el organismo y que recientemente se ha demostrado su afinidad al ácido clorogénico, ácido ferúlico y ácido cinámico; lo cual puede ser de interés para indagar sobre su afinidad en órganos como hígado, riñones, intestino y tejido muscular54.
Los estudios con ácido cafeico y ferúlico, muestran que estos compuestos son absorbidos rápidamente en el estómago y el intestino delgado, de manera similar al ácido cinámico (aproximadamente 90 %)25. El ácido cafeico presenta una rápida absorción que ocurre las primeras 2 h post-alimentación; sin embargo, también puede sufrir absorción pasiva en el estómago, debido a su forma no ionizada53.
Los AH después de ser absorbidos en el organismo, se pueden encontrar en el plasma o la orina de forma intacta, o conjugados como glucurónidos, sulfatos o sulfoglucurónidos. Sin embargo, las poblaciones microbianas del intestino pueden transformar los AH dependiendo de su interés por estos metabolitos. Por otro lado, se sabe también que los transportadores de ácido monocarboxílico son responsables de la absorción de algunos ácidos fenólicos (incluyendo AH); por lo tanto, estos transportadores se presentan en diferentes tejidos24 y también podrían estar implicados en el transporte de los procesos de absorción en los tejidos diana como el hígado, la grasa o músculo.
Biodisponibilidad de ácidos hidroxicinámicos
Cuando una sustancia como los fármacos o compuestos dietarios se suministran, en el organismo se producen una serie mecanismos que alteran su estructura y reducen la biodisponibilidad de estos compuestos para ejercer su efecto biológico; por tanto, la biodisponibilidad puede definirse como el porcentaje o fracción de un compuesto que está disponible en forma intacta para llegar al tejido diana, teniendo en cuenta los posibles cambios que este compuesto puede generar cuando pasa por cada etapa del tracto gastrointestinal90.
A pesar de los efectos beneficiosos de los compuestos fenólicos mayoritarios incluyendo AH, se reporta que la tasa de biodisponibilidad de estos es baja cuando van intrínsecos en la dieta, posiblemente debido a que dichos compuestos están incrustados en las matrices poliméricas de arabinoxilanos, pectinas, xiloglucanos, lo que limita su acción en el organismo, y además, se generan modificaciones microbianas durante el tracto gastrointestinal; y puede ser allí donde se producen formas conjugadas de los AH24,91,92. La mayoría de los estudios en ganado se centran en el uso de plantas y extractos con un gran número de compuestos fenólicos donde los AH están incluidos; sin embargo, la mejora en el crecimiento animal, el estado de salud y los cambios metabólicos ocurridos no están del todo esclarecidos, debido a la gran variedad de compuestos que están inmersos en la planta; donde lo más conveniente sería apoyarse con estudios in vitro, probando los AH en forma aislada, por lo que la verdadera disponibilidad in vivo es limitada, y los posibles efectos se atribuyen a los complejos de las mezclas, las formas conjugadas y no a los compuestos individuales31,34,36,93.
Reportes en rumiantes indican que existe una liberación de AF y ácido p-cumárico procedentes del forraje, donde en íleon se liberan cantidades de alrededor de 4 y 9 mg/ml de AF y ácido p-cumárico, respectivamente. Cabe destacar que en rumen la concentración de estos dos compuestos está por debajo de 1.0 mg/ml, posiblemente por la complejidad de la matriz y por las enzimas y microorganismos que modifican estructuralmente estos monómeros50,83.
Una estrategia para encontrar una acción efectiva de los AH puede ser la encapsulación, la cual se ha demostrado en algunos estudios con otros compuestos inmersos en matrices, y puede ejercer efectos importantes en el metabolismo animal. Un estudio donde se suplementó en vacas una mezcla de cinamaldehído y ácido gálico (300 mg/d) en forma encapsulada durante 15 días, se incrementó la concentración total de AGV en rumen (108.9 mmol/L vs 98.3 mmol/L) y la producción de leche (3 kg/día más respecto al control); los autores atribuyen este incremento en gran parte a la modificación de las poblaciones microbianas del rumen ocasionando cambios en los AGV principalmente mediante una reducción en la generación gas metano, provocando un mayor aprovechamiento de la energía del alimento94. En otro estudio, una mezcla encapsulada de cinamaldehído y timol (100 y 150 g/t alimento, respectivamente) en cerdos, mejoró la ganancia diaria de peso (0.45 vs 0.37 g/día) y el índice de diarreas se disminuyó hasta un 50 %, esto debido a la óptima modulación de la microbiota intestinal, especialmente por una reducción de las poblaciones de E. coli, provocando una mejora en el sistema inmune del cerdo95.
Cabe indicar que esta estrategia de encapsulación se ha venido utilizado con otras moléculas y se han encontrado resultados eficientes; una de ellas es el zinc, donde a dosis de 100 ppm con una cubierta lipídica del 10 %, se pueden mitigar los síntomas de colibacilosis en cerdos destetados96; además, diferentes estudios han demostrado que el uso de cultivos probióticos en forma protegida es una estrategia viable para mejorar la digestibilidad y absorción de nutrientes, mejorar el sistema inmunológico y prevenir infecciones en especies tanto rumiantes como monogástricos97,98,99. Por lo tanto, el diseño de sistemas de encapsulación de AH puede ser una estrategia cercana a implementarse con fines zootécnicos y con lo que podrá esclarecerse la ruta de acción y los efectos que estos compuestos pueden ocasionar.
Farmacodinamia de ácidos hidroxicinámicos en animales de engorda
La farmacodinamia se define como el estudio de la acción de los fármacos en sitios específicos a diferentes niveles, como sub-molecular, molecular, celular, tejido, órgano o cuerpo entero, utilizando modelos in vivo e in vitro, donde se utilizan diferentes tipos de técnicas e instrumentos para determinar la acción efectiva del compuesto en el organismo100. En el caso de los AH, existen diferentes mecanismos y modificaciones a diferentes niveles biológicos, los cuales pueden traducirse en beneficios al organismo, como un mayor crecimiento o mantenimiento del estatus oxidativo; sin embargo, sus evidencias en farmacodinamia no son claras o aún no existen.
Actualmente son pocos los reportes sobre la farmacodinamia con AH en animales de engorda con la finalidad de elucidar un efecto promotor de crecimiento; en el caso del uso de ácido ferúlico como aditivo en ganado, se han encontrado efectos interesantes in vitro e in vivo al ser suministrado en forma pura y ligado a los ingredientes de la dieta14,81,92. La actividad del ácido ferúlico in vivo, se ha reportado que afecta el perfil de enzimas y hormonas tanto en rumiantes como en cerdos (Cuadro 1)44,72,73.
Cuadro 1 Farmacodinamia de ácidos hidroxicinámicos en animales de engorda y ensayos in vitro
| Especie | Aditivo | Sitio de acción | Respuesta | Autor |
|---|---|---|---|---|
| Vaquillas | Ácido ferúlico (100 mg y 500 mg) | Plasma | Incremento de prolactina y hormona de crecimiento | (44) |
| Rumiantes | 0.1%, 0.2% de ácido p-cumárico, ferúlico y sináptico | Rumen | No se modifica la población celulolítica en rumen; solo ácido p-cumárico presenta una reducción de bacterias responsables de la degradación de fibra | (55) |
| Cerdos | Ácido ferúlico (100 mg/kg de alimento) | Plasma | Incremento de enzimas antioxidantes GPx11 y NFE2L2-ARE2, y reducción de concentración de malonaldehído en sangre | (40) |
| Cerdos | Ácido ferúlico (150 mg/kg) | Oído | Aumento en la síntesis de la enzima hemo-oxigenasa-1 y reducción de radicales libres | (101) |
| Cerdos | Extractos de plantas que incluyen ácidos hidroxicinámicos | Plasma | Incremento de Factor de Crecimiento Insulínico-1 (IGF-1) | (102) |
| In vitro | Ácido cinámico | Adipocitos | Activación de AMPk3 responsable de activación de enzimas lipolíticas y lipogénicas en la célula | (45) |
1 GPx1= Glutatión peroxidasa-1; 2 NFE2L2-ARE= Factor nuclear derivado de eritroides-2. 3AMPk= Proteína cinasa activada por AMP
Un reporte de investigación donde el AF fue suplementado en vacas, indicó que se produjo un incremento de la hormona del crecimiento y la prolactina sérica, sugiriendo que existe una posible alteración de la glándula pituitaria y por consecuencia una mayor deposición de proteína en músculo44. Otro estudio para evaluar los cambios en las poblaciones microbianas del rumen, se probaron concentraciones de suplementación de 0.1% y 0.2% de ácido ferúlico, sináptico y p-cumárico. Se observó que ferúlico y sináptico presentaron poco efecto sobre las bacterias celulolíticas responsables de la degradación de fibra, lo cual indica que estos dos ácidos no limitaron la viabilidad de esas bacterias y mantuvieron un nivel normal en la degradación de fibra. Sin embargo, de manera contraria, el ácido p-cumárico mostró una fuerte capacidad de atravesar la pared celular de las bacterias celulolíticas y los protozoos, generando un efecto antimicrobiano, lo cual limita la digestibilidad de los nutrientes y ocasiona una baja en la concentración de proteína microbiana55.
Por otra parte, en monogástricos, cuando ácido ferúlico fue suplementado en cerdos en finalización, aumentó la actividad de las enzimas antioxidantes GPX1 (glutatión peroxidasa 1) y NFE2L2-ARE; sin embargo, no existieron cambios significativos en el comportamiento productivo y rendimientos de la canal40. Un efecto característico de los compuestos agonistas β-adrenérgicos sintéticos es la reducción de la deposición de grasa dorsal. En un estudio reciente43, la suplementación de ácido ferúlico a cerdos en finalización demostró un efecto similar al reducir la grasa dorsal de los animales, lo cual podría ser atribuido a una estimulación de la enzima sensible a la lipasa (no evaluada), la cual es responsable de la degradación de los ácidos grasos y redirigir la energía de la grasa hacia la deposición muscular. También se ha descrito un efecto neuroprotector del ácido ferúlico al ser suplementado en cerdos, debido a la capacidad de eliminar los radicales libres y la regulación de la enzima citoprotectora hemo oxigenasa-1 (HO-1) en cerdos confinados y sometidos a ruido constante101.
La literatura revisada indica una limitación en el estudio de la farmacodinamia en animales de engorda; la mayoría de las respuestas se centran en estudios con ratas. Sin embargo, es necesario elucidar los efectos directos que suceden en rumiantes y monogástricos para tratar de conocer el mecanismo por el cual se mejora el crecimiento en los animales.
Conclusiones e implicaciones generales
Actualmente, el uso de ácidos hidroxicinámicos en la dieta animal no es una estrategia rutinaria; sin embargo, su implementación puede ser una estrategia promisoria, debido a los cambios positivos que se han presentado en el crecimiento animal y mejorador de la calidad de la carne. Cabe indicar que el conocimiento sobre el metabolismo de los ácidos hidroxicinámicos al ser suplementados en la dieta animal todavía no se ha elucidado por completo, y resulta de interés conjuntar todos estos efectos benéficos y las rutas metabólicas que se están activando o inhibiendo.
Además, es importante estudiar otras variables como toxicidad, efectos alergénicos, antioxidantes en la carne y costos de producción. En algunos ácidos hidroxicinámicos aislados, su farmacocinética y biotransformación se conoce principalmente en ratas o en modelos in vitro; por otro lado, ácido p-cumárico, clorogénico y sináptico han sido poco estudiados en modelos animales y algunos reportes indican un efecto negativo en crecimiento; sin embargo, se pueden sugerir pruebas de comportamiento usando dosis bajas similares a las implementadas con AF. Por lo tanto, son necesarios estudios más precisos y comprensivos sobre la acción de los AH en la cadena de producción animal.











 texto en
texto en