Introducción
Las técnicas in vitro se usan comúnmente para evaluar la fermentación y la digestibilidad de los ingredientes de los alimentos utilizados en las raciones de rumiantes1,2,3. Sin embargo, la necesidad de animales fistulados para la recolección de líquido ruminal es una limitación importante de estas técnicas4,5,6. Por lo tanto, la preservación del fluido ruminal podría superar esta limitación, ya que permite el uso del inóculo sin tener que mantener animales donantes7,8,9. Esto se lleva a cabo utilizando glicerol para minimizar el daño celular microbiano10,11,12 y mantener la comunidad microbiana13,14.
La reactivación apropiada del inóculo conservado antes de ser utilizado sigue siendo, en gran parte, desconocida. El líquido ruminal liofilizado subestima la fermentación in vitro y la digestibilidad de la materia seca, en comparación con el líquido ruminal fresco cuando se reconstituye en el buffer de McDougall8. La depresión en los parámetros de fermentación15 presumiblemente debido al daño celular8,9 o la muerte microbiana9 puede explicar esta subestimación. Además, las limitaciones en la disponibilidad de nutrientes como el nitrógeno16,17 y los carbohidratos18,19,20 pueden influir en la reactivación, el crecimiento y la actividad de los microbios ruminales. Por lo tanto, recientemente, se ha reconocido que la reactivación de bacterias conservadas es un paso crítico para obtener microorganismos activos, y que las condiciones de reactivación deben optimizarse 21,22,23.
Debido a la limitada información sobre estrategias para mejorar la reactivación del inóculo ruminal, se requiere realizar investigación para encontrar un enfoque rentable y práctico. Por lo tanto, los objetivos de este estudio consistieron en evaluar los efectos del medio de cultivo utilizado y el tiempo de incubación necesario para la reactivación adecuada del inóculo ruminal liofilizado. Las variables de respuesta evaluadas se basaron en la cinética de fermentación in vitro y la digestibilidad de la materia seca de alfalfa, pasto ovillo, cocuite y pasto de Guinea. La hipótesis fue que no habría diferencias en la digestibilidad del forraje in vitro y la cinética de fermentación entre el inóculo ruminal fresco y el preservado.
Material y métodos
Los experimentos se llevaron a cabo en la Universidad Autónoma Chapingo. Los animales utilizados en los experimentos se manejaron de acuerdo con las directrices y las regulaciones de la Universidad.
Sustratos de fermentación y análisis químico
Se utilizaron cuatro especies de forraje comúnmente utilizadas para rumiantes de pastoreo en México como sustratos de fermentación (Cuadro 1): alfalfa (Medicago sativa L.) cv San Miguel, pasto ovillo (Dactylis glomerata L) cv Potomac, cocuite (Gliricidia sepium (Jacq.) Kunth ex Walp.) y pasto de Guinea (Panicum maximum Jacq.) cv Tanzania. La alfalfa, el pasto de Guinea y el pasto de ovillo se cortaron a 7 cm por encima del nivel del suelo; sólo las hojas de cocuite se recolectaron a mano de las ramas de varios árboles. Se reunió suficiente material para obtener al menos 1 kg de muestra (base DM) para cada especie de forraje. Las muestras recolectadas se secaron en un horno de aire forzado a 60 ºC durante 96 h; se molieron a través de un tamiz de 1 mm (Wiley Mill, Arthur H. Thomas Co., Filadelfia, PA) y se analizaron para medir el contenido de proteína cruda, ceniza, extracto etéreo24 (métodos # 976.06; # 942.05; # 920.39, respectivamente). La fibra detergente ácido (ADF)25, la fibra detergente neutro (NDF) se analizaron sin amilasa estable al calor y se expresaron con la inclusión de ceniza residual25 y azúcares solubles26.
Cuadro 1 Composición química (g/kg MS) de especies forrajeras utilizadas como sustratos de fermentación
| Composición química (g/kg MS) | ||||||
|---|---|---|---|---|---|---|
| Especies forrajeras | Proteína bruta | Ceniza | Extracto etéreo | FDA | FDNA | Azúcares |
| Alfalfa | 206 | 119 | 11 | 350 | 442 | 41 |
| Pasto ovillo | 197 | 163 | 26 | 400 | 540 | 35 |
| Cocuite | 183 | 85 | 24 | 367 | 465 | 47 |
| Pasto Guinea | 65 | 123 | 5 | 564 | 779 | 29 |
FDA= fibra detergente ácida; FDN= fibra detergente neutra.
ASe ensayó fibra detergente neutra sin amilasa termoestable y expresada incluyendo ceniza residual.
Recolección, conservación y reactivación de fluidos ruminales
Los procedimientos in vitro para cada experimento incluyeron tres repeticiones27,28. De manera similar a los estudios previos29, para cada ensayo in vitro se recolectó líquido ruminal fresco de tres carneros criollos adultos fistulados con un peso promedio de 53.0 kg. Los carneros donantes fueron alimentados con una dieta que contenía 80 % de forraje y 20 % de concentrado. Se ofreció alimentación a las 9:00 h y a las 15:00 h todos los días; se permitió la ingesta ad libitum. Además, se dispuso de agua fresca y limpia ad libitum. Los carneros se equiparon con una cánula ruminal para recoger el fluido ruminal por succión30. El fluido ruminal recogido se filtró a través de cuatro capas de estopilla y se combinaron volúmenes iguales de fluido ruminal de cada donante para obtener una muestra representativa y evitar variaciones entre animales31,32,33.
Se incorporó 5% (v/v) de glicerol (Sigma-Aldrich, St. Louis, MO) para servir como crioprotector del inóculo ruminal12,13. Se colocaron alícuotas en recipientes de vidrio estériles de 10 ml. Los contenedores se cerraron herméticamente y se congelaron a -70 ºC durante 3 días. La liofilización se realizó como se describió anteriormente8 (Labconco Lyph Lock, modelo 195) al vacío (-0.133 mBar), y el inóculo se almacenó hasta su uso posterior. La reactivación del inóculo conservado se realizó mediante la reconstitución de muestras liofilizadas en una solución de cisteína a un volumen igual al del fluido ruminal filtrado original. Esta solución contenía 2.5 g de L-cisteína, 2.5 g de sulfito de sodio y 0.1 mL de resazurina (1%) disuelta en 15 mL de hidróxido de sodio (2N), se agregó agua destilada para hacer un volumen total de 100 mL (Cuadro 2), que sirvió como amortiguador y creó un entorno reducido en los medios, simulando las condiciones reducidas del rumen. El inóculo reconstituido se incubó a temperatura ambiente durante 10 min para permitir la rehidratación, el inóculo reconstituido se transfirió a 100 ml de medio de cultivo y luego se incubó previamente a 39 °C durante 24 o 12 h. El medio de cultivo utilizado y el tiempo de preincubación variaron según el experimento, como se describe a continuación.
Cuadro 2 Composición de los ingredientes de los tres medios de cultivo utilizados para la reactivación del inóculo ruminal liofilizado
| Tipo de inóculo | |||
|---|---|---|---|
| Ingrediente del medio utilizado para la reactivación | BAJO 24 | MODE 24 | ALTO 24 |
| ---------- Cantidad por 100 mL ---------- | |||
| Agua destilada, ml | 50 | 50 | 50 |
| Líquido ruminalA, ml | 29 | 29 | 29 |
| Solución de carbonato de sodio (8%), ml | 5 | 5 | 5 |
| Solución mineral IB, ml | 7 | 7 | 7 |
| Solución mineral IIC, ml | 7 | 7 | 7 |
| Solución de cisteínaD, ml | 2 | 2 | 2 |
| Solución de resazurina 1%, ml | 0.10 | 0.10 | 0.10 |
| Extracto de levadura, g | --- | 0.50 | 0.50 |
| Peptona de caseína, g | --- | 0.50 | 0.50 |
| Forraje molidoE, g | 0.25 | 0.25 | 0.25 |
| Glucosa, g | --- | --- | 0.30 |
| Celobiosa, g | --- | --- | 0.30 |
| Almidón, g | --- | --- | 0.25 |
A= colado a través de 4 capas de estopilla, centrifugado 2 veces a 13,416 ×g y esterilizado a 15 psi durante 15 min.
B= con 6.0 g de potasio hidrógeno fosfato por litro de agua destilada44.
CCon 6.0 g de fosfato de potasio monobásico, 6.0 g de sulfato de amonio, 12 g de cloruro de sodio, 2.45 g de monohidrato de sulfato de magnesio, y 1.6 g de monohidrato de cloruro de calcio por litro de agua destilada44.
D2.5 g de L-cisteína disueltos en 15 ml de hidróxido de sodio (2N), 2.5 g de sulfuro de sodio y 0,1 ml de rezasurina (1%); el volumen fue llevado a 100 ml; la solución se calentó y se esterilizó mediante autoclave.
EPasto de Guinea molido.
Inóculo ruminal evaluado
Experimento 1. Se evaluaron cuatro tipos de inóculo ruminal para las mediciones de cinética de fermentación y DIVMS. Se comparó un fluido ruminal fresco (control) con inóculos liofilizados reactivados por preincubación durante 24 h en 1 de 3 medios de cultivo (Cuadro 2). Específicamente, los tratamientos fueron 1) CONTROL, fluido ruminal fresco; 2) BAJO24, el inóculo se reactivó en un medio que contenía 100 ml de una solución de cultivo basal (compuesta de 50 % de agua destilada, 29 % de líquido ruminal clarificado, 14 % de soluciones minerales I y II, 5 % de carbonato de sodio, 2 % de solución de cisteína) y 0.1 % de resazurina; 3) MODE24, el inóculo reactivado en un medio que contiene 100 ml de la solución de cultivo basal, resazurina al 0.1 %, 0.5 g de extracto de levadura (Sigma-Aldrich, St. Louis, MO) y 0.5 g de peptona de caseína (Bioxon Becton Dickinson, México); y 4) ALTO24, el inóculo reactivado en un medio que contiene 100 ml de una solución de cultivo basal, 0.1% de resazurina, 0.5 g de extracto de levadura (Sigma-Aldrich, St. Louis, MO), 0,5 g de peptona de caseína (Bioxon Becton Dickinson , México), 0.3 g de glucosa, 0.3 g de celobiosa y 0.25 g de almidón. Los medios también incluyeron 0.25 g de forraje de tierra sobre una base de DM (Cuadro 2).
Experimento 2. En el segundo experimento se compararon dos tipos de fluido ruminal: 1) CONTROL, fluido ruminal fresco, y 2) ALTO12, inóculo reactivado utilizando un medio descrito previamente para ALTO24. Sin embargo, en este experimento, el inóculo ruminal preservado se reactivó mediante preincubación durante solo 12 h en un intento de encontrar un enfoque más práctico y más rápido para el proceso de reactivación.
Cinética de fermentación y DIVMS
En cada experimento, se combinaron inóculos ruminales frescos y reactivados con un agente diluyente que contenía las soluciones minerales reducidas I y II y la solución de cisteína34 en una proporción de 1: 9 (v/v, fluido ruminal: agente de dilución, Cuadro 2). El CO2 se agregó mientras se añadía el agente de dilución al fluido ruminal, que se mantuvo a 39 ºC.
Posteriormente, se determinaron las cinéticas de fermentación y DIVMS de forraje combinando 90 ml de inóculo ruminal diluido con 0.5 g de sustrato de fermentación utilizando botellas de vidrio de 125 ml. La determinación de los parámetros de cinética de fermentación se basó en el procedimiento utilizado para la medición de gas35,36. Específicamente, se registró la presión del gas (kg / cm2) a 1, 2, 4, 6, 10, 14, 18, 24, 30, 38, 48 y 72 h de incubación. Después de registrar este valor en cada punto de tiempo, la presión del gas se restableció a cero. Los valores de presión se convirtieron después en volumen de gas (ml / g de MS de sustrato); para hacerlo, primero se generó una curva estándar al inyectar volúmenes conocidos de CO2. La ecuación de esta curva estándar se generó agregando una línea de regresión lineal, y esta ecuación fue: volumen de gas (mL / g de sustrato) = presión (kg/cm2) * 39.46 + 0, con un R2 de 0.94. Esta curva estándar se generó a temperatura ambiente. El uso de esta técnica también ha sido registrado recientemente por otros investigadores29.
El volumen acumulado de gas en cada punto de tiempo se utilizó para estimar los parámetros de la cinética de fermentación: volumen máximo de gas (Vm; mL / g), fase de retraso (L; h) y la tasa de producción de gas (S; h -1). Esto se realizó utilizando un modelo logístico descrito por Schofield et al37:
Donde Vm es el volumen máximo; S es la tasa de producción de gas; t es el punto temporal de la medición, y L es la fase de retraso. Además de los parámetros de cinética de fermentación, la DIVMS de los sustratos se determinó a las 24 y 72 h de fermentación (DIVMS 24 y DIVMS 72, respectivamente). En cada momento, el contenido de las botellas de fermentación correspondientes se filtró a través del papel filtro Whatman No. 4. El residuo se secó a 100 ºC durante 12 h en un horno de aire forzado y se registró el peso seco. Posteriormente, se calculó la DIVMS en relación con la cantidad de muestra original utilizada.
Análisis estadístico
Se utilizó el procedimiento GLM de SAS38. En cada experimento (n= 3), los valores medios dentro de cada sustrato de fermentación se consideraron como la unidad experimental. Dadas las condiciones experimentales controladas, se declaró un efecto significativo a P <0.01; este nivel de importancia también puede contribuir a reducir el riesgo de error de tipo I. Solo cuando la interacción de primer orden no fue significativa, la separación de medias para los efectos principales se llevó a cabo mediante la prueba de Tukey; de lo contrario, se realizó una separación de medias pareada mediante la prueba t. El parámetro de dispersión reportado es el error estándar más grande de la media (SEM).
Los datos del Exp 1 se analizaron como un diseño experimental completamente al azar con una disposición factorial de tratamientos 4×4 (4 tipos de inóculo y 4 sustratos de fermentación). Los datos del Exp 2 se analizaron de acuerdo con un diseño experimental completamente al azar con una disposición factorial de tratamientos 2×4 (2 tipos de inóculo y 4 sustratos de fermentación). En ambos experimentos se analizaron los efectos principales del tipo de inóculo y el sustrato de fermentación. También se evaluó la interacción del inóculo tipo × y el sustrato de fermentación. El modelo estadístico para los análisis fue:
Donde:
Yijk representa la observación del tratamiento ijk;
µ representa la media general;
τi representa el inóculo tipo i;
βj representa el substrato de fermentación j;
τβij representa el efecto de interacción del inóculo tipo i y el substrato de fermentación j;
El término residual ε ijk se asumió como distribuido de forma normal, independiente e idéntica con varianza σ2 e .
Resultados
Composición química de los forrajes utilizados como sustratos de fermentación
La composición química analizada de los cuatro forrajes utilizados se incluye en el Cuadro 1. El pasto de Guinea fue bajo en proteína cruda y alto en contenido de fibra (65.0 y 779.0 g / kg de MS para proteína cruda y NDF, respectivamente); mientras que la alfalfa fue alta en proteína y baja en contenido de fibra (206.0 y 442.0 g / kg de MS para proteína cruda y NDF, respectivamente); el valor de estos nutrientes en pasto de ovillo y el cocuite fue intermedio.
Cinética de fermentación y DIVMS para inóculos reactivados por preincubación de 24 h
La Figura 1 ilustra la producción de gas in vitro para el CONTROL y los inóculos reactivados por preincubación durante 24 h. El CONTROL mostró la producción máxima y más rápida de gas en comparación con los otros tratamientos. Incluso con el tratamiento ALTO24, la fermentación se redujo en 50 %, aproximadamente, durante las primeras horas de incubación. Entre los inóculos preservados, ALTO24 registró la mayor producción de gas, seguido del tratamiento MODE24 y del BAJO24. La Figura 2 ilustra la producción de gas para cada substrato de fermentación. La alfalfa tuvo la producción máxima y más rápida de gas en comparación con el resto de los forrajes. El pasto de ovillo tuvo valores intermedios para la producción de gas, y el cocuite y el pasto de Guinea, los valores más bajos.
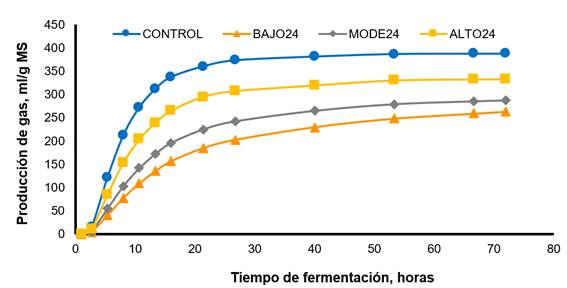
CONTROL, líquido ruminal fresco; BAJO24, inóculo reactivado por pre-incubación durante 24 h en una solución de cultivo basal; MODE24, similar a BAJO24, pero incluye extracto de levadura y peptona de caseína; ALTO24, similar a MODE24, pero incluye carbohidratos. Testigo: Vm=387.15 mL/g, L=4.06 h, S=0.041 h-1; BAJO24: Vm=266.11 mL/g, L=13.70 h, S=0.018 h-1; MODE24: Vm=288.22 mL/g, L=7.62 h, S=0.023 h-1; ALTO24: Vm=332.83 mL/g, L=8.05 h, S=0.32 h-1.
Figura 1 Producción de gas in vitro para el control y los inóculos preservados y reactivados por pre-incubación durante 24 h en diferentes medios de cultivo.
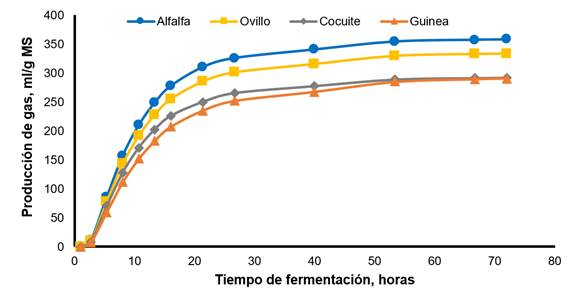
Alfafa: Vm=357.90 mL/g, L=5.22 h, S=0.030 h-1; Ovillo: Vm=333.50 mL/g, L=11.77 h, S=0.029 h-1; cocuite: Vm=291.50 mL/g, L=3.83 h, S=0.030 h-1; Guinea: Vm=291.20 mL/g, L=12.20 h, S=0.025 h-1.
Figura 2 Producción de gas in vitro de cuatro forrajes cuando se promediaron los valores de líquido ruminal fresco y de los inóculos reactivados por pre-incubación durante 24 h
Específicamente, la cinética de fermentación, la DIVMS 24 y la DIVMS 72 se vieron afectadas por el substrato de tratamiento y fermentación (Cuadro 3). Independientemente de la composición de nutrientes del medio utilizado para reactivar el inóculo, hubo una disminución de Vm (P<0.01) cuando se usó inóculo reactivado en comparación con el líquido ruminal fresco, siendo esta diferencia mayor durante las primeras 24 h (Figura 1). Sin embargo, el tratamiento ALTO24 mostró una mayor Vm (P<0.01) en comparación con los tratamientos MODE24 o BAJO24 independientemente del sustrato de fermentación. Además, tanto la alfalfa como el pasto de ovillo tuvieron los Vm más altos (P<0.01) en todos los tratamientos, con un promedio de 345.7 ± 14.40 mL/g. La interacción del tratamiento × sustrato de fermentación fue significativa (P<0.01) para L y S. Específicamente, L fue más alta (P<0.01) para el tratamiento BAJO24 cuando se usó pasto de ovillo o pasto de Guinea como sustrato de fermentación con una estimación de 22.29 h. Sin embargo, no hubo diferencia en la L entre los tratamientos cuando se utilizó cocuite como sustrato de fermentación. Además, S fue menor (P<0.01) para el tratamiento BAJO24 independientemente de los sustratos de fermentación, con un promedio de 0.018 h-1. Sin embargo, S alcanzó los valores más altos (P<0.01) en la mayoría de los sustratos de fermentación cuando se utilizó el CONTROL como inóculo seguido de ALTO24.
Cuadro 3 Parámetros de la cinética de fermentación (Vm, L y S) y digestibilidad in vitro de la materia seca a las 24 y 72 h (DIVMS24, DIVMS72) para inóculos reactivados mediante pre-incubación durante 24 h
| Inóculo | Substrato | Parámetro de fermentaciónA | DIVMS24 (g/kg) |
DIVMS72 (g/kg) |
% gas a 72 h |
% DIVMS a 24h/72h |
||
|---|---|---|---|---|---|---|---|---|
| Vm (mL/g) | L (h) | S (h -1) | ||||||
| TESTIGO | Alfalfa | 435.75a | 2.80d | 0.043a | 558.0a | 622.0a | 100.0 | 89.7 |
| Ovillo | 390.25a | 4.89d | 0.041ba | 538.0a | 618.0a | 100.0 | 87.1 | |
| Cocuite | 346.25a | 2.46d | 0.044a | 466.0ba | 508.0dc | 100.0 | 91.7 | |
| Guinea | 376.35a | 6.09dc | 0.036cb | 398.0c | 550.0cb | 99.9 | 72.4 | |
| LOW24 | Alfalfa | 309.30b | 7.31bc | 0.019e | 432.0cb | 590.0b | 94.9 | 73.2 |
| Ovillo | 303.20b | 20.2a | 0.017e | 314.0d | 624.0a | 87.1 | 50.3 | |
| Cocuite | 207.85c | 2.89d | 0.020e | 324.0d | 454.0e | 97.1 | 71.4 | |
| Guinea | 244.10c | 24.38a | 0.016e | 180.0f | 424.0e | 94.0 | 42.5 | |
| MODE24 | Alfalfa | 319.45b | 5.14dc | 0.025d | 482.0ba | 674.0a | 99.1 | 71.5 |
| Ovillo | 307.75b | 10.32bc | 0.018e | 402.0c | 636.0a | 92.0 | 63.2 | |
| Cocuite | 288.80c | 4.91d | 0.025d | 382.0c | 516.0c | 99.1 | 74.0 | |
| Guinea | 236.90c | 10.12bc | 0.021ed | 252.0e | 484.0d | 96.1 | 52.1 | |
| HIGH24 | Alfalfa | 367.15a | 5.64dc | 0.033cb | 524.0a | 630.0a | 99.9 | 83.2 |
| Ovillo | 333.00b | 11.68bc | 0.039ba | 502.0ba | 656.0a | 99.9 | 76.5 | |
| Cocuite | 323.25b | 5.04dc | 0.030dc | 404.0c | 512.0c | 99.8 | 78.9 | |
| Guinea | 307.75b | 9.85bc | 0.025d | 324.0d | 554.0b | 98.5 | 58.5 | |
| Medias inóculo | CONTROLy | 387.15a | 4.06c | 0.041a | 490.0a | 574.5a | 100.0 | 85.3 |
| BAJO24x | 266.11c | 13.70a | 0.018d | 312.5d | 523.0b | 90.0 | 59.8 | |
| MODE24w | 288.22c | 7.62b | 0.023c | 379.5c | 577.5a | 98.1 | 65.7 | |
| ALTO24v | 332.83b | 8.05b | 0.032b | 438.5b | 588.0a | 99.8 | 74.6 | |
| Medias forraje | Alfalfa | 357.90a | 5.22b | 0.030a | 499.0a | 629.0a | 99.8 | 79.3 |
| Ovillo | 333.50a | 11.77a | 0.029a | 439.0b | 633.5a | 99.3 | 69.3 | |
| Cocuite | 291.50b | 3.83b | 0.030a | 394.0c | 497.5b | 99.8 | 79.2 | |
| Guinea | 291.20b | 12.61a | 0.025b | 288.5d | 503.0b | 98.1 | 57.4 | |
| EEMB | 14.40 | 1.290 | 0.0012 | 10.80 | 10.50 | |||
| P-values | Inoculum | 0.001 | 0.001 | 0.001 | 0.001 | 0.001 | ||
| Forage | 0.001 | 0.001 | 0.001 | 0.001 | 0.001 | |||
| Inoculum × forage | 0.0766 | 0.001 | 0.0002 | 0.0012 | 0.0001 | |||
AVm= volumen máximo de gas; L= fase lag; S= porcentaje de producción de gas.
EEM= mayor estandar de la media.
a-f Medias en columna con distinta literal son diferentes (P<0.01).
La interacción entre el tratamiento y el sustrato de fermentación fue significativa (P<0.01) para la DIVMS24 y la DIVMS72. Específicamente, cuando se utilizó alfalfa como sustrato de fermentación, la DIVMS24 para los tratamientos MODE24 y ALTO24 fue similar (P≥0.1) al CONTROL, con un promedio de 521.3 ± 10.8 g/ kg. Sin embargo, la DIVMS24 para alfalfa fue menor (P<0.01) para el tratamiento BAJO24 en comparación con el CONTROL con estimaciones de 432.0 y 558.0 ± 10.8 g/kg para el tratamiento BAJO y el CONTROL, respectivamente. Igualmente, las DIVMS 72 para los tratamientos MODE24 y ALTO24 fueron similares (P≥0.1) al CONTROL, con un promedio de 642.0 ± 10.5 g/ kg. Sin embargo, la DIVMS72 para alfalfa fue menor (P<0.01) para el tratamiento BAJO24 en comparación con el CONTROL 24, con estimaciones de 590 y 622.0 ± 10.5 g/kg para el tratamiento BAJO24 y el CONTROL, respectivamente. Se observó la DIVMS72 más baja (P<0.01) para el tratamiento BAJO24 cuando se usó cocuite como sustrato de fermentación con un promedio de 439.0 ± 10.5 g/kg. En general, independientemente del sustrato de fermentación, hubo una depresión (P<0.01) en la DIVMS para el tratamiento BAJO24 en comparación con cualquiera de los otros tratamientos.
Cinética de fermentación y DIVMS para el inóculo reactivado por 12 h en preincubación
La Figura 3 ilustra la producción de gas in vitro para el CONTROL y el inóculo reactivado por incubación durante 12 h. El CONTROL mostró una producción de gas máxima más rápida y mayor en comparación con el tratamiento ALTO12. La Figura 4 ilustra la producción de gas para cada sustrato de fermentación. La alfalfa mostró la producción máxima y más rápida de gas en comparación con el resto de los forrajes, con cocuite y el pasto de Guinea, que tienen los valores más bajos.

CONTROL, líquido ruminal fresco; ALTO12, inóculo reactivado por pre-incubación durante 12 h en una solución de cultivo basal, extracto de levadura, peptona de caseína y carbohidratos. Testigo: Vm=410.80 mL/g, L=5.42 h, S=0.032 h-1; ALTO12: Vm=264.97 mL/g, L=4.29 h, S=0.017 h-1.
Figura 3 Producción de gas in vitro del testigo y del inóculo preservado y reactivado por pre-incubación durante 12 h en un medio de cultivo
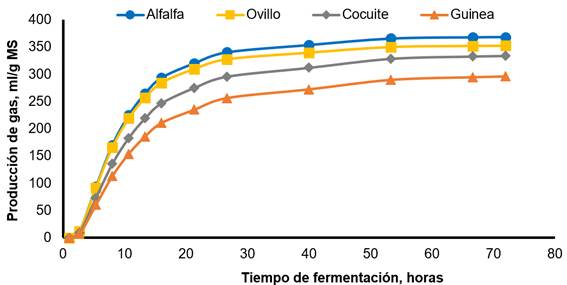
Alfafa: Vm=368.30 mL/g, L=2.13 h, S=0.032 h-1; pasto de ovillo: Vm=352.51 mL/g, L=9.19 h, S=0.033 h-1; cocuite: Vm=334.16 mL/g, L=3.79 h, S=0.027 h-1; pasto de Guinea: Vm=296.56 mL/g, L=4.31 h, S=0.025 h-1.
Figura 4 Producción de gas in vitro de cuatro forrajes cuando se promediaron los valores de líquido ruminal fresco e inóculo reactivado por pre-incubación durante 12 h
Específicamente, la cinética de fermentación, la DIVMS 24 y la DIVMS 72 se vieron afectadas por el sustrato de tratamiento y fermentación (Cuadro 4). El Vm fue mayor (P<0.01) para el CONTROL en comparación con el tratamiento ALTO12, con estimaciones de 410.80 y 264.97 ± 13.050 mL / g, respectivamente. La interacción del tipo de inóculo × sustrato de fermentación fue significativa para L (P<0.011); el pasto de ovillo y la alfalfa incubados en el tratamiento ALTO12 tuvieron la mayor y menor (P <0.01) L, respectivamente, con estimaciones de 12.4 y 0.07 ± 0.700 h-1 para pasto de ovillo y alfalfa. Asimismo, se detectó una interacción (P<0.01) para S; la alfalfa incubada en el CONTROL y el cocuite incubado en el tratamiento ALTO12 tuvieron la mayor y menor S, respectivamente; con estimaciones de 0.047 y 0.013 ± 0.007 h-1 para alfalfa y cocuite. Independientemente del tipo de forraje, la DIVMS 24 fue mayor para el CONTROL en comparación con el tratamiento ALTO12, con estimaciones de 520.6 y 374.3 ± 12.70 g/kg, respectivamente. Hubo una interacción de tipo de inóculo x sustrato de fermentación (P<0.01) para la DIVMS72, alfalfa y pasto de ovillo incubados en el CONTROL tuvieron la mayor DIVMS72, y cocuite y el pasto de Guinea tuvieron los valores más bajos de DIVMS72.
Cuadro 4 Parámetros de fermentación, cinética (Vm, L and S) y digestibilidad in vitro de la materia seca a 24 y 72 h (DIVMS24, DIVMS72) para inóculos reactivados 12 h pre-incubación
| Parámetros de fermentaciónA | ||||||||
|---|---|---|---|---|---|---|---|---|
| Inóculo | Substrato | Vm (mL/g) | L (h) | S (h -1 ) | DIVMS24 (g/kg) | DIVMS24 (g/kg) | % gas a 72 h | % DIVMS a 24 h |
| Testigo | Alfalfa | 457.33d | 4.19b | 0.047f | 625.3a | 673.3d | 100.0 | 92.9 |
| Ovillo | 409.96c | 6.14b | 0.042e | 594.6a | 678.6d | 100.0 | 87.6 | |
| Cocuite | 400.80c | 4.36b | 0.041e | 463.9b | 573.3b | 100.0 | 80.9 | |
| Guinea | 375.10b | 7.00b | 0.034d | 398.6c | 551.9b | 99.9 | 72.2 | |
| ALTO12 | Alfalfa | 279.26a | 0.07a | 0.017b | 461.3b | 619.9c | 94.7 | 74.4 |
| Ovillo | 295.06a | 12.24c | 0.024c | 407.9b | 657.3d | 97.7 | 62.1 | |
| Cocuite | 267.53a | 3.23ab | 0.013a | 350.6c | 478.6a | 82.9 | 73.3 | |
| Guinea | 218.03a | 1.63ab | 0.015ab | 278.6d | 459.9a | 90.2 | 60.6 | |
| Medias de inóculo | Testigo | 410.80b | 5.42 | 0.041b | 520.6a | 619.3b | 100.0 | 84.1 |
| ALTO12 | 264.97a | 4.29 | 0.017a | 374.3b | 553.9a | 93.1 | 67.6 | |
| Medias de forraje | Alfalfa | 368.30b | 2.13a | 0.032 | 543.3a | 646.6b | 99.9 | 84.0 |
| Ovillo | 352.51b | 9.19c | 0.033c | 501.3a | 667.9b | 99.8 | 75.1 | |
| Cocuite | 334.16b | 3.79ab | 0.027b | 407.3b | 525.9a | 99.5 | 77.4 | |
| Guinea | 296.56a | 4.31b | 0.025a | 338.6c | 505.9a | 99.2 | 66.9 | |
| EEMB | 13.050 | 0.700 | 0.0007 | 12.70 | 7.80 | |||
| P-values | Inóculo | 0.0001 | 0.0359 | 0.0001 | 0.0001 | 0.0001 | ||
| Forraje | 0.0003 | 0.0001 | 0.0001 | 0.0001 | 0.0001 | |||
| Inóculo × forraje | 0.1200 | 0.0001 | 0.0001 | 0.0295 | 0.0006 | |||
A Modelo para producción de gas, Schofield et al. (1994):
Donde Vm = valor máximo de gas; L= fase lag, S= tasa de producción de gas.
BEEM= mayor estándar de la media reportado.
a-f: Medias en columna con distinta literal son diferentes (P<0.01).
Discusión
Muestreo de líquido ruminal y el uso de glicerol como crioprotector
Los estudios31,32,33 han encontrado diferencias en los patrones de fermentación in vitro entre el fluido ruminal de diferentes donantes. La fuente de líquido ruminal puede influir en los ensayos de fermentación y digestibilidad in vitro31,39. Las diferencias en los patrones de fermentación entre los animales observados por esos investigadores pueden atribuirse parcialmente a las diferencias en la composición de la comunidad bacteriana establecida entre los animales huéspedes40,41. Por lo tanto, en el presente estudio, las muestras de líquido ruminal de tres donantes se agruparon para obtener una muestra representativa para evitar el sesgo debido a la fuente de líquido ruminal.
El uso de glicerol mejora la preservación de la comunidad bacteriana ruminal12,13,14. Los beneficios del glicerol pueden explicarse por la vitrificación periférica que brinda protección a las membranas citoplásmicas bacterianas del daño potencial que puede causar la formación de cristales de hielo42. Específicamente, el glicerol penetra en las células, lo que puede protegerlas de los daños al mantener un estado semifluido43,44. En consecuencia, el uso de glicerol no solo protege la integridad y la viabilidad de las células bacterianas ruminales, sino que también puede prevenir la degradación del ADN microbiano13.
La cinética de la fermentación in vitro y la DIVMS revelaron diferencias entre el líquido ruminal fresco y el liofilizado. Cuando se comparó con el líquido ruminal fresco, se observó la mayor depresión en los parámetros cinéticos de fermentación cuando los inóculos liofilizados se reactivaron en medios sin azúcares ni promotores del crecimiento. Estas observaciones concuerdan con otros estudios15, que indican una depresión en los parámetros de fermentación con inóculos congelados, lo que puede explicarse por una disminución en la actividad microbiana debido a la muerte microbiana o la limitación de nutrientes9. Además, los investigadores han informado8 que las tasas de degradación de proteínas con microorganismos ruminales preservados fueron de 4 a 8 veces más lentas que cuando se usa líquido ruminal fresco. Además, el uso de inóculo conservado por congelación afecta los parámetros de fermentación durante las primeras horas de fermentación30, y la ultracongelación puede representar un método de conservación mejor en comparación con la congelación a -20 ° C. En consecuencia, de acuerdo con informes recientes, la reactivación de bacterias conservadas es uno de los pasos más críticos para obtener microorganismos activos y efectivos para los ensayos de fermentación in vitro21,22,23.
En este estudio, en comparación con el líquido ruminal fresco, los efectos negativos de la liofilización sobre la cinética de la fermentación y la DIVMS fueron menos graves cuando los inóculos ruminales se reactivaron en un medio rico en nutrientes que incluye una solución de cultivo basal, promotores del crecimiento y azúcares. Estas observaciones indican que los promotores del crecimiento como el extracto de levadura y la peptona de la caseína y los carbohidratos como la glucosa, la celobiosa y el almidón aumentan la reactivación de los microorganismos ruminales, mejorando así la fermentación in vitro. La necesidad de extracto de levadura en el medio para una reactivación bacteriana adecuada y el crecimiento puede atribuirse a la ausencia de los genes para la síntesis de algunos aminoácidos proteinogénicos como la arginina y la asparagina en el genoma de algunas especies de bacterias ruminales45,46, lo que indica que estos aminoácidos contenidos en el extracto de levadura deben incluirse en el medio. Además, la peptona de la caseína y los carbohidratos proporcionan una reactivación, crecimiento y actividad microbiana adecuada y estimulada por la energía y el nitrógeno fácilmente disponibles19,47. Es interesante observar los diferentes patrones (producción de gas en diferentes puntos de tiempo) entre las curvas de fermentación, lo que sugiere que diferentes poblaciones microbianas pueden actuar sobre los sustratos en cada punto de tiempo de fermentación. Investigación futura en el tema debe tener como objetivo evaluar los cambios en la estructura de la comunidad microbiana48,49 utilizando técnicas como la secuenciación de ADN de alto rendimiento50,51,52, que permite una evaluación amplia del perfil de la comunidad microbiana de los niveles taxonómicos de mayor a menor.
Se ha encontrado que, en comparación con el fluido ruminal fresco, la digestibilidad de la alfalfa disminuyó 17.63% cuando se usó inóculo congelado o inóculo liofilizado reactivado por 24 h de preincubación en la solución de McDougall9. En contraste con observaciones anteriores9, en el presente estudio, la DIVMS 72 no se vio afectada cuando se usó inóculo liofilizado reactivado por 24 h de preincubación en un medio rico en nutrientes; lo que indica que, en comparación con el uso de la solución de McDougall, usar un medio rico en nutrientes que contenga una gama más amplia de nutrientes constituye un mejor enfoque para estimular la reactivación y la actividad de los microorganismos ruminales.
Cuando se promedió a través de sustratos de fermentación (es decir, alfalfa, pasto ovillo, cocuite y pasto de Guinea), la DIVMS para cualquiera de los inóculos reactivados resultó afectada negativamente, en comparación con los valores obtenidos con el control. Sin embargo, dentro de los inóculos liofilizados, la reactivación mediante preincubación de 24 h en un medio rico en nutrientes mostró el mejor rendimiento. Además, cuando el inóculo se reactivó 12 h antes de la incubación, los valores de DIVMS fueron más bajos en comparación con el líquido ruminal fresco del control. Es importante tener en cuenta que, a las 72 h de fermentación, todos los forrajes, excepto el cocuite, alcanzaron casi 100% del gas total producido. Esto indica que las tasas de fermentación de 72 h no son adecuadas para medir la efectividad de los tratamientos, lo que también sugiere que un mejor enfoque sería medir las tasas de fermentación y el DIVMS a las 24 o 48 h de fermentación.
Efecto del sustrato de fermentación sobre la cinética de fermentación y DIVMS
El uso de sustratos de fermentación con una amplia gama de composición de nutrientes facilitó la evaluación de nuestra hipótesis en diferentes escenarios. En general, los resultados revelaron que los forrajes de zonas templadas, a saber, alfalfa y pasto de ovillo, tenían un mayor Vm y una mayor DIVMS en comparación con sus contrapartes de las regiones tropicales. Estas observaciones probablemente se debieron a las diferencias en los componentes estructurales de la pared celular de la planta que existen entre los forrajes de zonas templadas y los de las zonas tropicales53.
Por otro lado, se han sugerido fuentes de inóculo alternativas para las fermentaciones in vitro. Una de estas fuentes son las heces de rumiantes; sin embargo, los resultados han sido inconsistentes. Por ejemplo, se ha demostrado que el inóculo fecal es eficaz para los estudios de producción de gas in vitro54; sin embargo, el inóculo fecal de ovejas no fue comparable con el líquido ruminal fresco cuando se evaluó la digestibilidad de la materia seca in vitro55. Además, otros estudios han revelado que el inóculo fecal no funciona tan bien como el líquido ruminal en las técnicas de fermentación in vitro55,56, lo que puede deberse a diferencias en las poblaciones bacterianas entre el rumen y el tracto gastrointestinal inferior57.
Conclusiones e implicaciones
La cinética de la fermentación in vitro y la DIVMS se vieron afectadas por la liofilización del líquido ruminal. En la mayoría de los casos, los parámetros de fermentación Vm, L y S se afectaron negativamente cuando se utilizó el inóculo ruminal liofilizado. Sin embargo, cuando se añadió glicerol al inóculo ruminal liofilizado y se reactivó durante 24 h en un medio rico en nutrientes previo a la incubación, incluidos los promotores del crecimiento y los azúcares, los efectos negativos de la liofilización en la cinética de la fermentación in vitro y la DIVMS fueron menos graves. Como se esperaba, la alfalfa y el pasto de ovillo tuvieron un mayor Vm y una mayor DIVMS en comparación con el cocuite y el pasto de Guinea. Los resultados presentados en este estudio proporcionan nuevos conocimientos sobre la reactivación del inóculo ruminal preservado, así como su utilización en ensayos de fermentación y digestión in vitro para laboratorios con acceso limitado a animales fistulados o líquido ruminal fresco. Investigaciones futuras deberían explorar los cambios en las poblaciones microbianas del rumen durante las fermentaciones in vitro utilizando la secuenciación de ADN de alto rendimiento para comprender cómo los cambios en los perfiles microbianos conducen a los diferentes patrones observados entre las curvas de fermentación.











 texto em
texto em 


