Introducción
Se ha reconocido que la ganadería tiene un papel fundamental en la sobrevivencia de más de 800 millones de pobres en el mundo1. Sin embargo, la producción animal también contribuye en la degradación de los recursos naturales, la contaminación ambiental y el cambio climático (CC)2, principalmente por su contribución en las emisiones de gases de efecto invernadero (GEI)3. La ganadería tropical en América Latina, primordialmente está basada en el pastoreo de pastos naturales e introducidos bajo sistemas extensivos4, con escasa o nula suplementación, escasa infraestructura y poco capital5. En este contexto, los sistemas silvopastoriles y el aprovechamiento de árboles y arbustos forrajeros locales, ha sido una opción viable para mejorar los sistemas productivos ganaderos, reducir su impacto ambiental y contribuir en la mitigación de los GEI6-9.
En sistemas silvopastoriles, la presencia de proteína en el follaje de árboles de uso múltiple en los géneros botánicos de Leucaena, Gliricidia, Erythrina, entre otros, es rápidamente degradable en el rumen, lo que hace necesario la incorporación de alimentos energéticos para mejorar la eficiencia de la fermentación, sincronía y balance de nutrientes en el rumen10,11. Por otra parte, los subproductos energéticos comerciales de alta calidad para los sistemas ganaderos que producen carne o leche, tienen un alto costo monetario12, por lo cual se requiere buscar suplementos basados en recursos locales de fácil acceso y aceptable valor nutritivo13. Se sabe que en el follaje de muchos árboles forrajeros hay presencia de metabolitos secundarios14, los cuales tienen la capacidad de mitigar las emisiones de metano entérico en los rumiantes15,16. Así, hay evidencias que indican que el follaje de árboles forrajeros tienen la capacidad de reducir la población de protozoarios y archaeas metanogénicas17,18,19, provocando una menor síntesis y producción de CH4 entérico20.
El objetivo de este estudio fue evaluar el efecto de diversas fuentes energéticas locales sobre los parámetros de fermentación ruminal y emisiones de metano usando forrajes de un sistema silvopastoril de ovinos en pastoreo (P. maximum) complementados con follaje de Gliricidia sepium y Leucaena leucocephala.
Material y métodos
Área de estudio
Los materiales para desarrollar este estudio se obtuvieron de un rancho productor de ovinos con manejo silvopastoril en el municipio de Chiapa de Corzo, Chiapas, México (16° 42’ N y 93° 00’ W). La unidad ganadera tiene una altitud de 400 a 450 msnm, con una precipitación promedio anual de 900 mm y con temperatura media anual de 26.0 °C. El suelo predominante es de textura franca, con contenido de materia orgánica de 2.4 %, pH de 7.0 y ligeramente pobre en nitrógeno (0.15 %)21. La unidad silvopastoril tiene 12 ha y un hato promedio de 55 vientres de ovinos de la raza Pelibuey x Katahadin. Se cuenta con 10 ha para pastoreo con pasto Tanzania (P. máximum) con cercos vivos de L. Leucocephala (Guash= nombre comun), G. sepium (Cocoite= nombre común) y Cordia dentata (Vahl) (Ñanguipo= nombre común). Diversos potreros (3 ha) también tienen árboles de L. Leucocephala en callejones y 7 ha tienen árboles dispersos en las áreas de pastoreo como Enterolobium cyclocarpum (Jacq) y Ceiba pentandra L. Se cuenta con 2 ha de reserva natural de selva baja caducifolia, no se utiliza fertilización química de pasturas, hay manejo rotacional de potreros mediante cercos eléctricos y uso de riego en épocas de estiaje. El destino de los animales es para el mercado de carne de ovinos regional y nacional.
Análisis químico de los alimentos usados
La determinación de materia seca (MS) de los forrajes y suplementos usados se realizó en una estufa de aire forzado a 55 °C por 48 h (peso constante) según la NOM-116-SSA1-1994. El contenido de proteína cruda se realizó mediante un método interno (ECOSUR-ET-BR04) con base en la norma NMX-F-608-NORMEX-2002. El contenido de materia orgánica (MO) se evaluó mediante incineración en una mufla a 550 ° C durante 3 h según la norma NMX-F-607-NOMRMEX-2002 y el contenido de fibra detergente neutra (FDN) y fibra detergente acida (FDA) se determinó según lo sugerido por Van Soest22 usando el procedimiento secuencial, con uso de alpha - amilasa y sin corrección de cenizas en todas las muestras (AOAC)23. Los taninos condensados se determinaron por el método de vainillina acidificada (solución al 1 % p/v de vainillina en metanol)24.
Producción de gas in vitro
Se realizó un ensayo de gas in vitro utilizando la metodología de la técnica acumulativa de gas sugerida por Theodorou25 y Williams26. Se consideraron seis materias primas y se diseñaron cinco dietas (tratamientos) (Cuadro 1): P. maximum como forraje base (control), G. sepium y L. leucocephala como fuentes de proteína. Melaza, Z. mays y M. paradisiaca (guineo verde) como fuentes energéticas. La formulación de las dietas fueron isoenergeticas e isoproteicas formuladas para cubrir las demandas de ovinos adultos utilizados en la unidad silvopastoril, con un contenido de 2,200 kcal/kg y 14 % de PC. La fermentación in vitro de cada uno de los tratamientos se realizó por triplicado en viales de vidrio color ámbar de 90 ml introduciendo 0.5 ± 0.001 g de sustrato, y se evaluó la fermentación mediante la producción de gas a diferentes tiempos (0, 2, 4, 6, 8, 10, 12, 16, 20, 24, 30, 36, 48, 60, 72 h). El manejo de los borregos y la extracción del líquido ruminal se realizó de acuerdo a lo indicado por Alexander y McGowan27, Blummel y Orskov28 y bajo las normas de bienestar animal del grupo de investigación en ganadería sustentable de ECOSUR. Para la extracción de líquido ruminal se utilizaron cinco borregas del área experimental con un peso vivo de 40.0 ± 3.0 kg, edades similares y condición corporal de 3.5 promedio. Se extrajeron 300 ml de líquido ruminal por animal por medio de una sonda esofágica para obtener un total 1.5 L. Las muestras se mantuvieron a 39 °C protegidas de la luz solar. El monitoreo de la presión generada en cada vial se realizó con un manómetro analógico (Marca: METRON Mod.63100 rango: 0-1 kg/cm2), y se generaron las siguientes variables de respuesta: volumen máximo de gas (V), tasa de producción de gas (S), fase de retraso (L), volúmenes fraccionales de gas generados durante el ensayo: V8: volumen fraccional de rápida fermentación en las primeras 8 h, V24: volumen generado en la fracción media, entre 8-24 h de fermentación, y V72: volumen generado en la fracción entre 24 a 72 h de fermentación. Se realizaron dos tandas de incubación de forma simultánea, cada tanda comprendía tres repeticiones (viales) por cada alimento y tratamiento, respectivamente. La primera tanda fue para evaluar la producción de gas total acumulado a 72 h, en cada una de las fracciones fermentables: fracción rápida, fracción media y fracción lenta. En las fracciones fermentables se estimaron tres grupos de carbohidratos fermentables (monosacáridos, almidón y celulosa) de acuerdo a los volúmenes de gas obtenido para los intervalos de tiempo de 0 a 8 (Vf0-8), 8 a 24 (Vf8-24) y 24 a 72 (Vf24-72) horas de incubación. Estos volúmenes se utilizaron para estimar de acuerdo con las ecuaciones de regresión lineal propuestas por Miranda et al29: FR=Vf0-8 /0.4266, FM=Vf8-24/0.6152, FL=Vf24-72/0.3453) las fracciones de rápidamente, medianamente y lentamente fermentables. Los valores de producción de gas acumulado se ajustaron al modelo de Menke and Steingas30:
Cuadro 1 Tratamientos y porcentaje de ingredientes usados en el experimento de gas In vitro en Chiapas, México
| Alimentos | P. maximum | G.sepium | L. leucocephala | M. Paradisiaca | Z. mays | Melaza |
|---|---|---|---|---|---|---|
| P100 (control) | 100 | 0 | 0 | 0 | 0 | 0 |
| G100 | 0 | 100 | 0 | 0 | 0 | 0 |
| L100 | 0 | 0 | 100 | 0 | 0 | 0 |
| MP100 | 0 | 0 | 0 | 100 | 0 | 0 |
| Z100 | 0 | 0 | 0 | 0 | 100 | 0 |
| M100 | 0 | 0 | 0 | 0 | 0 | 100 |
| Tratamientos | ||||||
| D1LM | 47 | 0 | 30 | 0 | 8 | 15 |
| D2LMP | 47 | 0 | 30 | 15 | 8 | 0 |
| D3GM | 47 | 30 | 0 | 0 | 8 | 15 |
| D4GMP | 48 | 30 | 0 | 15 | 7 | 0 |
| D5GLMPM | 47 | 16 | 17 | 5 | 5 | 10 |
P100 (control)= P. máximum; G100= G.sepium; L100= L. leucocephala; MP100= M.paradisiaca; Z100= Z. mays; M100= melaza; D1LM= 47% P. maximum, 30% L. Leucocephala, 8% Z. mays, 15% melaza; D2LMP= 47% P. maximum, 30% L. Leucocephala 8% Z. mays, 15% M. paradisiaca; D3GM: 47% P. maximum, 30% G. sepium, 8% Z. mays, 15% melaza; D4GMP= 48% P. maximum, 30% G. sepium., 7% Zea mays, 15% M. paradisiaca; D5GLMPM= 47% P. maximum, 16% G. sepium 17% L. leucocephala. 5% M. paradisiaca., 5%, Z. mays, 10% melaza.
Donde:
Y= volumen total de gas producido
v= volumen máximo de producción
s= tasa constante de producción de gas,
t= tiempo,
L= fase lag o de retraso.
La digestibilidad in vitro de la materia seca (DIVMS) se obtuvo mediante análisis gravimétricos, tomando en cuenta el peso de la MS inicial y la final obtenida a 24 y 72 h después de iniciada la fermentación, recuperando el material mediante filtrado (200 micrómetros) y secado de material a 65 °C hasta peso constante, utilizando la siguiente fórmula:
Donde:
% DIVMS= porcentaje de digestibilidad in vitro de la materia seca;
PI= peso inicial de la materia seca incubada en gramos,
PF= peso final de la materia seca incubada en gramos. Con los datos de DIVMS24/72 y volúmenes de gases emitidos en la fermentación, se generó un índice potencial de emisión de gases fermentables (IPEGF), Este índice hace referencia a la cantidad de gas que puede producir un sustrato por cada gramo de MS o MO fermentada en el rumen31.
Determinación de la producción de metano
Con las muestras de la segunda tanda de incubación se analizó la producción de CO2 y CH4 y gases menores durante las primeras 24 horas de fermentación. Se realizó la separación del CO2 por medio de una trampa (frasco de vidrio herméticamente sellado con tapón de hule y aro de aluminio) que contenía 90 ml de hidróxido de potasio (KOH) a una concentración de uno molar y una dilución de 56.10 g de KOH en un litro de agua desionizada de acuerdo a la metodología propuesta por Bartha y Pramer32 modificada por Miranda29. Se tomó una muestra en viales estériles y al vacío para su posterior análisis en cromatografía de gases y cuantificar el CH4 por cada sustrato. Para el análisis de la producción de CH4 se utilizó un cromatógrafo de gases marca PERKIN ELMER CLARUS 500, Software Versión 6.3.2.0646, diámetro de columna 0.530 mm y 50 m de largo, con una temperatura de inyección de 35 °C. Se analizaron 36 muestras recolectadas durante la fermentación in vitro de 24 h, en la segunda corrida de incubación, inyectando 20 µl de muestra por cada análisis. Las concentraciones de CH4 se corrigieron en cada tratamiento restando la producción de metano promedio de los tres blancos. Para calcular la concentración y el efecto de los tratamientos sobre la producción de CH4 se expresó en L de CH4/kg MSDIG.
Análisis estadístico
Los parámetros de producción de gas, DIVMS y producción de metano se analizaron mediante ANOVA en un diseño completamente al azar. El modelo matématico fue:
Donde:
Yij = Variable respuesta en la j-ésima repetición (frascos) del i-ésimo tratamiento.
μ= es la media global de todos los datos del experimento.
T i= Efecto del tratamiento i.
ε ij = el error experimental asociado al j sujeto bajo el i tratamiento.
Los datos obtenidos de todas las variables de respuesta fueron sometidos a un análisis de varianza33. Las diferencias entre promedios de los tratamientos se compararon con la prueba de Tukey (P≤0.05) mediante PROC GLM del SAS34.
Resultados y discusión
El Cuadro 2 muestra la composición química de los forrajes, fuentes energéticas y tratamientos (dietas) usados en el presente experimento. El contenido proteico (PC) en el follaje de G. sepium y L. leucocephala fue alto, siendo superior a lo reportado por otros autores32,33. Como era de esperarse, las fuentes energéticas tuvieron bajos contenidos de PC y FDN. El pasto P. máximum (control) tuvo una buena concentración de PC si se compara con los valores promedio de pastos tropicales, los cuales se encuentran normalmente entre 7 y 9 % de PC. Esta alta concentración de PC en la pastura puede estar asociado a la fertilización natural derivadas de las excretas de los ovinos bajo un manejo de pastoreo controlado. La pastura presentó altos contenidos de FDN y FDA. Se encontraron escasos taninos condensados (TC) en L. leucocephala, comparado con otros estudios35,36. Esto pudo deberse a la variabilidad en las características del valor nutricional del follaje en árboles forrajeros de la misma especie, debido a condiciones de sitio, manejo, etapa fenológica y particulares del área de estudio37. El contenido de lignina en L. leucocephala encontrado fue alto, sin embargo esta dentro de los rangos sugeridos por la FAO. La cantidad de lignina presente en la L. leucocephala de este ensayo, afectó directamente su digestibilidad y seguramente los componentes de la ración, reduciendo el aprovechamiento de energía38,39.
Cuadro 2 Composición química (g/Kg MS) de los forrajes, fuentes energéticas y tratamientos usados en el experimento de gas in vitro en Chiapas, México
| MS | MO | PC | Lignina | FDN | FDA | TC | CHO | |
|---|---|---|---|---|---|---|---|---|
| P. maximum (control) | 933 | 853 | 124 | 103 | 712 | 490 | NA | 231 |
| G. sepium | 930 | 889 | 367 | 133 | 353 | 250 | 0 | 269 |
| L. leucocephala | 932 | 883 | 261 | 207 | 462 | 308 | 56 | 352 |
| M. paradisiaca | 925 | 953 | 52 | NA | 137 | 37 | NA | 763 |
| Z. mays | 866 | 984 | 59 | 6 | 86 | 16 | NA | 795 |
| Melaza | 788 | 866 | 53 | 3* | 8* | 5* | NA | 600 |
| D1LM | 906 | 874 | 149 | 111 | 481 | 324 | 16 | 368 |
| D2LMP | 926 | 887 | 149 | 111 | 501 | 329 | 16 | 392 |
| D3GM | 905 | 876 | 181 | 89 | 448 | 307 | NA | 343 |
| D4GMP | 926 | 888 | 182 | 90 | 474 | 317 | NA | 361 |
| D5GLMPM | 914 | 877 | 172 | 105 | 482 | 326 | 9 | 349 |
MS= materia seca, MO= materia orgánica, PC= proteína cruda, FDN= fibra detergente neutra, FDA= Fibra detergente ácida; TC= taninos condensados, CHO= carbohidratos; NA= no analizada. * https://www.feedipedia.org/01/05/2018. ; D1LM= 47% P. maximum, 30% L. Leucocephala, 8% Z. mays, 15% melaza; D2LMP= 47% P. maximum, 30% L. Leucocephala 8% Z. mays, 15% M. paradisiaca; D3GM= 47% P. maximum, 30% G. sepium, 8% Z. mays, 15% melaza; D4GMP= 48% P. maximum, 30% G. sepium, 7% Z. mays, 15% M. paradisiaca; D5GLMPM= 47% P. maximum, 16% G. sepium 17% L. leucocephala. 5% M. paradisiaca, 5%, Z. mays, 10% melaza.
El Cuadro 3 expresa los parámetros de la producción de gas total y sus volúmenes fraccionales a las 8, 24 y 72 h de fermentación. Los tratamientos MP100, Z100 y M100 (M. paradisiaca, Z. mays y melaza, respectivamente) tuvieron los mayores volúmenes de gas producido (544.0, 467.3 y 325.7 ml/g-1 MS) y con diferencias (P<0.05) entre los tres y también con respecto a las dietas (P<0.05). Este comportamiento es propio de los alimentos con carbohidratos como los monosacáridos y almidones40. Por otra parte, se observó que G. sepium (G100) y L. leucocephala (L100) tuvieron un menor volumen de producción gas (V) y fueron diferentes entre las dos arbóreas (P<0.05). Al respecto, esto pudo deberse a la presencia de metabolitos secundarios (taninos) en la L. leucocephala40, por la presencia de altos contenidos de lignina en el follaje de ambas arbóreas (111 g/kg MS) o por la naturaleza fibrosa de los follajes, que disminuyen la producción de gas en comparación con dietas con mayores contenidos de carbohidratos41. Los tratamientos con mezclas energéticas- proteicas, aumentaron significativamente su producción de gas (V) (P< 0.05), observándose el efecto aditivo de los carbohidratos sobre el follaje de la L. leucocephala y G. sepium. Los valores en la tasa de producción de gas (S) fueron similares entre todos los tratamientos, a pesar de haber diferencia estadística (P<0.05). En las Figuras 1 y 2 se observan los comportamientos de la PGIV por hora de los alimentos usados y dietas, respectivamente.
Cuadro 3 Parámetros de la producción de gas total y sus volúmenes fraccionales en los alimentos y tratamientos usados en el experimento de gas in vitro en Chiapas, México
| Parámetros | Volúmenes fraccionales (ml g-1 MS ) | |||||
|---|---|---|---|---|---|---|
| Alimentos | V (ml g-1 MS) | S (ml h-1) | L (h) | V8 | V24 | V72 |
| P100 (control) | 266.3de | 0.03ab | 11.2a | 15.1e | 100.5d | 159.7b |
| G100 | 253.0e | 0.03ab | 9.0b | 28.7ed | 85.9de | 144.8bcd |
| L100 | 180.8f | 0.03ab | 2.7f | 40.6cd | 63.2e | 81.9e |
| MP100 | 544.9a | 0.03ab | 3.7ef | 117.7a | 250.0a | 206.4a |
| Z100 | 467.3b | 0.04a | 6.2c | 44.1cd | 271.2a | 194.7a |
| M100 | 325.7c | 0.04a | 2.6f | 71.6b | 166.9b | 119.5d |
| Tratamientos D1LM | 299.8cd | 0.03b | 4.7cde | 51.7c | 105.0c | 149.9bc |
| D2LMP | 308.9cd | 0.03ab | 5.7cd | 46.8c | 119.7cd | 152.4bc |
| D3GM | 293.6cde | 0.03ab | 4.5de | 54.0c | 115.6cd | 134.3bcd |
| D4GMP | 337.4c | 0.03ab | 5.6cd | 52.6c | 147.1bc | 151.5cb |
| D5GLMPM | 292.3cde | 0.03ab | 3.6fe | 57.5cb | 122.2cd | 128.7cd |
V= volumen máximo de producción de gas; S= tasa de producción constante de gas; L= fase Lag ó tiempo de retraso (h); V8= volumen fraccional generado en la fracción rápida de la fermentación (0-8 h); V24= volumen fraccional de gas (ml.g-1) generado en la fracción media (8-24 h); V72= volumen fraccional de gas generado en la fracción lenta (24-72 h).
P100 (control)= P. máximum; G100= G. sepium,L100= L. leucocephala; MP100= M.paradisiaca; Z100= Z. mays; M100= melaza; D1LM= 47% P. maximum, 30% L. Leucocephala, 8% Z. mays, 15% melaza; D2LMP= 47% P. maximum, 30% L. Leucocephala 8% Z. mays, 15% M. paradisiaca; D3GM= 47% P. maximum, 30% G. sepium, 8% Z. mays, 15% Melaza; D4GMP= 48% P. maximum, 30% G. sepium, 7% Z. mays, 15% M. paradisiaca; D5GLMPM= 47% P. maximum, 16% G. sepium 17% L. leucocephala 5% M. paradisiaca, 5%, Z. mays, 10% melaza.
abcde Letras distintas en una misma columna indican diferencias significativas entre tratamientos (α= 0.05).
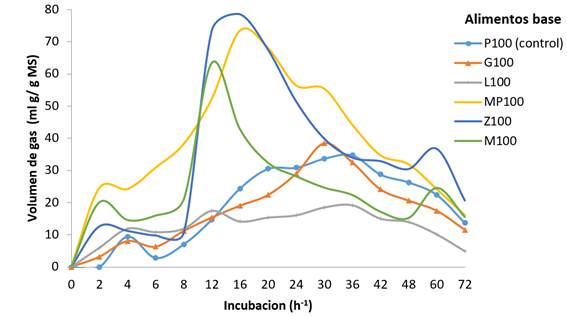
P100 (control)= Panicum máximum; G100= Gliricidia sepium, L100= Leucaena leucocephala; MP100= Musa paradisiaca; Z100= Zea mays; M100= melaza de caña.
Figura 1 Comportamientodel control y de las materias primas usados en el experimento de gas In vitro en Chiapas, México
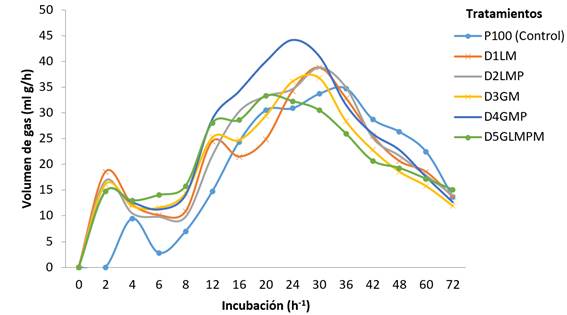
P100 (control) = P. máximum; D1LM= 47% P. maximum, 30% L. Leucocephala, 8% Z. mays, 15% melaza; D2LM = 47% P. maximum, 30% L. Leucocephala 8% Z. mays, 15% M. paradisiaca; D3GM: 47% P. maximum, 30% G. sepium, 8% Z. mays, 15% melaza; D4GMP = 48% P. maximum, 30% G. sepium., 7% Zea mays, 15% M. paradisiaca; D5GLMPM = 47% P. maximum, 16% G. sepium 17% L. leucocephala. 5% M. paradisiaca., 5%, Z. mays, 10% melaza.
Figura 2 Producción de gas in vitro (ml gas/h) de 5 dietas utilizadas en la alimentación de ovinos en un sistema silvopastoril en Chiapas México
Los alimentos como el banano (MP100) y la melaza (M100) inician su fermentación rápidamente, incrementándola durante la fase intermedia de incubación y disminuyendo rápidamente. Sin embargo, en los tratamientos que se encuentran mezclas de forrajes con fuentes energéticas, la producción de gas y tasa de fermentación es más lenta inicialmente, sin embargo en las horas intermedias de incubación, la producción de gas (V) aumenta y se mantiene por más tiempo (Figura 2). Al respecto, se sabe que durante la fermentación el sustrato se hidrata y se coloniza por los microorganismos ruínales, y dependiendo de la cantidad y tipo de carbohidratos presentes, se origina el volumen de gas y su efecto sobre la digestibilidad de la MS42,43.
El Cuadro 4 muestra los resultados en la DIVMS, IPEGF y producción total de CH4. Los forrajes como el P. máximum y la L. leucocephala presentaron la menor DIVMS a las 72 h (50.9 y 29.9 % respectivamente) en comparación de la G. sepium y las dietas diseñadas (P≤0,05). Resalta el valor bajo de la DIVMS de la L. leucocephala respecto a otros estudios realizados bajo condiciones in vitro e in vivo34,42,43. Esto pudo deberse, como ya se indicó, a que el follaje colectado de la arbórea estuvo en un estado de madurez avanzado y a su contenido alto de lignina. Las DIVMS más altas a las 24 h y 72 h fueron observadas (P≤0,05) en los los alimentos M100 (Z. mays), Z100 (Melaza) y MP100 (M. paradisiaca). Los valores intermedios de DIVMS (P<0.05) se encontraron en los tratamientos-dieta D1LM, D2LMP, D3GM, D4GMP y D5GLMPM, los cuales tuvieron un incremento lineal (Figura 1) , observándose en estas la contribución en la fermentación y digestibilidad del follaje de G. sepium y L. leucocephala. La inclusión de fuentes energéticas (tratamientos D3GM y D4GMP) permitió una mejor digestibilidad (P≤0,05) en comparación con los tratamientos D2LMP, y P100 y L100 (P≤0,05). Mientras que la digestibilidad encontrada para G. sepium es similar a la reportada en otro trabajo43. La alta digestibilidad encontrada en las fuentes energéticas (MP100, Z100 Y M100) es debido a su alto contenido de azucares solubles. En este contexto, cuando una dieta es balanceada con altos contenidos de G. sepium y melaza, la digestibilidad y aprovechamiento es mayor debido a la sincronía entre proteína y energía contenida en la dieta44.
Cuadro 4 CH4 , CO2 , DIVMS, IPEGF y CH4 Total, obtenidos en la fermentación de los tratamientos usados en el experimento de gas In vitro en Chiapas, México
| Tratamientos | CH4 (%) | CO2 (%) | DIVMS 24 h (%) | DIVMS724 h (%) | IPEGF/MS 24 h | IPEGF/MS 72 h | CH4 (L CH4/kg MSDIG) |
|---|---|---|---|---|---|---|---|
| P100 (control) | 22.5bcd | 77.5abc | 33.7f | 50.9e | 791.0a | 523.5cd | 1.55d |
| G100 | 23.2bcd | 76.8abc | 51.0cd | 60.1cd | 496.8e | 420.9e | 1.68d |
| L100 | 30.8a, b | 69.2cd | 28.8f | 29.9f | 628.1bcd | 606.6ab | 1.94d |
| MP100 | 18.1d | 81.9a | 77.0b | 83.6b | 708.1ab | 652.1a | 15.75b |
| Z100 | 16.4d | 83.6a | 80.1b | 87.0b | 583.6cde | 537.2cd | 28.59a |
| M100 | 17.9d | 82.1a | 92.7a | 92.4a | 351.4f | 352.5f | 9.03c |
| D1LM | 31.9a | 68.1d | 44.4e | 56.6d | 678.6bc | 529.7cd | 8.82c |
| D2LMP | 27.0abc | 73.0bcd | 44.9de | 50.9e | 690.0b | 606.5ab | 8.83c |
| D3GM | 24.2abcd | 75.8abcd | 55.1c | 61.9c | 533.0de | 474.2de | 6.32cd |
| D4GMP | 21.9cd | 78.1ab | 54.5c | 61.1cd | 619.4bcd | 552.1bc | 9.60c |
| D5GLMPM | 22.3bcd | 77.7abc | 51.7c | 56.6d | 565.5de | 516.9cd | 6.31cd |
CH4= metano + gases menores in vitro; CO2= bióxido de carbono in vitro, DIVMS24= digestibilidad in vitro de la materia seca a 24 h, DIVMS72= digestibilidad in vitro de la materia seca a 72 h; IPEGF/MS24= índice potencial de emisión de gas fermentable a 24 h de fermentación; IPEGF/MS72= índice potencial de emisión de gas fermentable a 72 h de fermentación; CH4= concentración de metano en 24 h de incubación.
P100 (control)= P. máximum; G100= G. sepium; L100= L. leucocephala; MP100= M.paradisiaca; Z100= Z. mays; M100= melaza; D1LM= 47% P. maximum, 30% L. Leucocephala, 8% Z. mays, 15% melaza; D2LMP= 47% P. maximum, 30% L. Leucocephala 8% Z. mays, 15% M. paradisiaca; D3GM: 47% P. maximum, 30% G. sepium, 8% Z. mays, 15% melaza; D4GMP= 48% P. maximum, 30% G. sepium, 7% Z. mays, 15% M. paradisiaca; D5GLMPM= 47% P. maximum, 16% G. sepium 17% L. leucocephala 5% M. paradisiaca, 5%, Z. mays, 10% melaza.
Letras distintas en una misma columna indican diferencia estadísticamente significativas entre los tratamientos (α= 0.05).
La máxima producción total de CH4 (L/Kg MSDG) fue observada en el maíz (Z100) y banano (MP100) (P≤0,05). Los valores más bajos se obtuvieron con el control (P100), G. sepium (G100) y L. leucocephala (L100), no habiendo diferencias (P>0.05) entre ellos. Los tratamientos que tuvieron mezclas de los alimentos usados, como D5GLMPM, D3GM, D1LM, D2LMP y D4GMP, presentaron valores intermedios (P>0.05). De los tratamientos con dietas mixtas de energía y proteína, la dieta D5GLMPM tuvo el menor valor de producción de CH4, mostrando la importancia de la inclusión de forrajes asociada entre carbohidratos45,46. Estos autores resaltan que el tipo de carbohidratos determina la taza de pasaje, afectando la producción de CH4 por gramo de sustrato digerido. El tipo de carbohidrato parece ser un factor determinante en la producción de CH447; ya que puede estar mediada por una menor disponibilidad de carbohidratos digeribles48. También una concentración de 550 g kg-1 MS, se encuentra por arriba de la concentración que afecta negativamente el consumo voluntario y la digestibilidad de los nutrientes en los animales49. Adicionalmente los follajes de arbóreas y arbustivas contienen baja concentración de fracciones estructurales44 haciéndolos más susceptibles a la degradación y acción de las bacterias, provocando un aumento de la tasa de pasaje disminuyendo la producción de gas total y por lo tanto una menor producción de CH4 entérico36,50.
La cuantificación de GEI provenientes de la fermentación ruminal y el diseño de índices para evaluar el potencial de contaminación ambiental y diseñar estrategias sustentables de manejo animal, ha sido de interés por agencias de investigación y desarrollo51,52. El Cuadro 4, muestra que hay una amplia variación (P<0.001) en los IPEGF/MS, tanto a las 24 h como 72 h en los alimentos y tratamientos evaluados. Destaca observar, que los índices más bajos corresponden a M100 y G100 (496. 8 y 420.9 ml.g-1/DIVMS a 24 y 72 h). Los tratamientos con mayor IPEGF fueron MP100, con 708.1 y 652.1 ml.g-1/DIVMS a 24 y 72 h respectivamente. De los tratamientos que incluyen follaje de arbóreas y fuentes energéticas, el menor índice correspondió a la mezcla D3GM. Los datos encontrados sugieren la importancia del tipo de follaje proveniente de árboles forrajeros en asociación con el tipo de carbohidrato, especialmente si este último tiene proceso lento de fermentación, como son los almidones53.
Conclusiones e implicaciones
Este estudio sugiere que en sistemas silvopastoriles, la combinación del follaje de arbóreas forrajeras con fuentes energéticas locales, especialmente la melaza y bananos, pueden mejorar el valor nutritivo de los forrajes para permitir una mejor respuesta en la producción animal y en la mitigación de gases de efecto invernadero (GEI), como el metano. Así, la combinación de 30 % en MS de follaje de arbóreas como G. sepium y L. leucocephala con fuentes energéticas locales como melaza y banano, contribuir a tener sistemas ganaderos de bajas emisiones de CH4. Por su mejoramiento en la calidad de las dietas para sistemas silvopastoriles y en contribuir en una baja de emisiones de CH4, se sugiere el manejo de arbóreas forrajeras como G. sepium y L. leucocephala, incorporando fuentes energéticas locales. Importante en un futuro hacer estudios de respuesta animal (ganancias de peso) y balance bio-económico, para encontrar viabilidad económica- social en la adaptación de estas estrategias en un contexto de mejorar la producción animal, contribuir en el bienestar social de los productores y la mitigación de GEI.











 texto en
texto en 


