La dosis letal media (DL50) y la de reducción del crecimiento (RC50) son parámetros utilizados para seleccionar la dosis de irradiación adecuada, para inducir mutaciones en programas de mejoramiento genético vegetal. Lo anterior con la finalidad de inducir cambios genéticos y fenotípicos que permitan seleccionar plantas con características que no se encuentran en la naturaleza. Diversos investigadores concuerdan que en dosis donde muere el 50 % de los individuos irradiados, es donde existe mayor probabilidad de producir mutaciones útiles para programas de mejoramiento genético1-4. Así mismo, otros investigadores han señalado que además de la DL50, otra dosis con alta probabilidad de producir mutaciones efectivas es donde se reduce el crecimiento en un 50 % (RC50)5,6. Cabe señalar que ambos parámetros (DL50 y RC50) se basan en el supuesto de que en dosis bajas de radiación los impactos en el genoma son mínimos y difícilmente se reflejan en cambios fenotípicos, mientras que con dosis altas, el genoma sufre múltiples impactos que regularmente producen aberraciones o cambios negativos7,8. Por lo anterior, el primer paso para el mejoramiento genético a través de mutagénesis con radiación gamma, es conocer la DL50 y la RC50.
En México la mayor parte de los pastizales de zonas áridas y semi áridas se encuentran degradados debido al sobrepastoreo y otras prácticas antropogénicas9. Lo anterior, ha provocado una disminución en la cobertura vegetal, grandes extensiones de suelo desnudo y pérdida de biodiversidad, lo cual ha menguado la funcionalidad y productividad de estos ecosistemas. Una alternativa para rehabilitar estos ecosistemas degradados es la resiembra de pastos, dentro de la cual se recomienda utilizar vegetación nativa. No obstante, en áreas con alto grado de degradación este tipo de vegetación tiene problemas para establecerse. Ante esto, una alternativa es utilizar especies introducidas de mayor rusticidad y capacidad de establecimiento, como es el pasto garrapata (Eragrostis superba). Esta especie es considerada como una de las de mayor potencial para ser utilizadas en programas de rehabilitación de pastizales10, ya que posee mayor capacidad de establecimiento que especies nativas utilizadas en este tipo de programas, como el pasto banderita (Bouteloua curtipendula), navajita (Bouteloua gracilis) e incluso de introducidas como el llorón (Eragrostis curvula)11. Sin embargo, presenta menor valor nutricional y rendimiento de forraje que otros pastos introducidos como buffel (Pennisetum ciliare), klein (Panicum coloratum) y el mismo llorón12. Debido a esto, el pasto garrapata puede ser considerado para someterse a un programa de mejoramiento genético. No obstante, por ser una especie introducida, probablemente en México existe poca variabilidad genética de esta especie. En este sentido, la mutagénesis puede ser una alternativa para el mejoramiento genético del pasto garrapata, ya que ha demostrado ser una técnica viable para inducir variabilidad en gramíneas13,14,15. Sin embargo, a la fecha se desconoce la dosis con mayor probabilidad de producir mutaciones efectivas en esta especie. Por lo anterior, el objetivo fue determinar la DL50 y la RC50 en pasto garrapata, para con esto establecer la dosis óptima de irradiación gamma para inducir mutagénesis en esta especie.
El experimento se llevó a cabo en condiciones de laboratorio e invernadero. Se irradió semilla de pasto garrapata variedad Palar; importada de la empresa Curtis & Curtis, ubicada en Clovis, Nuevo México, EUA. Se evaluaron 9 dosis de irradiación y un testigo: 0 (testigo), 100, 200, 300, 450, 600, 900, 1400, 2000 y 4000 Gray (Gy). Los tiempos de exposición para las dosis evaluadas se determinaron utilizando el sistema Gafchromic dosimetry y una cámara de ionización marca RADCAL modelo Acudose No. de serie 4094118, USA. La irradiación de la semilla se realizó en el Complejo MOSCAFRUT SAGARPA//IICA en Metapa de Domínguez, Chiapas, México en colaboración con el Campo Experimental Rosario Izapa, Chiapas del INIFAP. Las dosis se aplicaron dentro de un irradiador panorámico tipo Gamma Beam Modelo GB-127 MDS Nordion, con fuente de almacenamiento en seco, con una actividad de 15,000 Curies de 60Co.
El diseño experimental utilizado para esta prueba fue un completamente al azar con 10 tratamientos de irradiación y cuatro repeticiones por cada dosis, considerándose como unidad experimental cada caja Petri de 90 mm de diámetro provistas de algodón y papel filtro con 50 semillas por repetición. Las cajas Petri se humectaron con 25 ml de agua al inicio de la prueba, y posteriormente se suministraron riegos por aspersión de 2.0 ml cada dos días, durante los 15 días que duró la prueba. Las cajas Petri se colocaron en una incubadora Precision Scientific, modelo 6M a temperatura de 28 ± 2 °C. Se consideró semilla germinada aquella que alcanzó 0.5 cm de plúmula o de radícula16. Las variables evaluadas fueron porcentaje germinación (PG), índice de velocidad de germinación (Vge), longitud de plúmula (LP) y de radícula (LR). Para obtener LR y LP se dejaron crecer tres plántulas por caja Petri durante siete días después de germinadas. La Vge se calculó mediante la ecuación16:
Donde: Vge = velocidad de germinación, n¡ = número de semillas germinadas por día, t = día de la germinación.
Para la evaluación de la emergencia y desarrollo de la planta se utilizó un diseño experimental de bloques al azar con 10 repeticiones por tratamiento, estableciendo los bloques perpendicularmente a la intensidad de luz solar durante el día. Se sembraron 20 semillas por maceta para asegurar emergencia y establecimiento; sin embargo, solamente se dejó una planta por maceta. La siembra se realizó en bolsas de polietileno negro de 26 cm de altura por 18 cm de diámetro, perforadas en la parte inferior. Las bolsas se llenaron con 23 cm de suelo franco-arenoso de origen aluvial. Los riegos se suministraron hasta punto de saturación cada dos o tres días, según el desecamiento del suelo. La prueba se realizó por 16 semanas durante los meses de abril a agosto. Las variables evaluadas fueron rendimiento de forraje (RF), producción de semilla (PS), proporción tallo hoja (PTH) e índice de concentración de clorofila (ICC). Para el PS se recolectó la totalidad de la semilla de cada planta y se colocó en bolsas de papel. Para el RF la biomasa se cortó a 5 cm del suelo. Posteriormente, se separaron los tallos y las hojas y se colocaron en bolsas de papel. Las muestras extraídas tanto de forraje como de semilla se secaron en una estufa a 65 °C durante 72 h. Una vez secas las muestras se pesaron en una balanza analítica de la marca Viper BC, Mettler. El ICC se midió en la parte media de cinco hojas seleccionadas al azar con un medidor de la marca Opti-Sciences, modelo CCM-200.
Para asegurar los rangos de temperatura (T) y humedad relativa (HR) que requiere el pasto garrapata, se realizaron mediciones dentro del invernadero con una sonda modelo HMP60 (Vaisala, Woburn, MA, USA). Estos datos se registraron cada segundo y fueron promediados cada minuto en un datalogger CR1000 (Campbell Scientific Inc., Logan, UT, USA). La T media durante el experimento fue de 26.7 ± 5.6 °C, con una mínima de 17.1 y máxima de 44.7 °C. La HR media fue de 52.0 ± 16.8 %.
Los datos se analizaron mediante análisis de regresión para cada variable. Con la ecuación de regresión resultante del porcentaje de germinación se estimó la dosis letal media (DL50). Por este mismo procedimiento, se estimó la reducción media del crecimiento (RC50) de las variables índice de velocidad de germinación, longitud de plúmula, longitud de radícula, rendimiento de forraje, peso de semilla, proporción tallo hoja e índice de concentración de clorofila. Adicionalmente, todos los datos se sometieron a un análisis de varianza y comparación de medias con la prueba de Dunnett, donde el factor de influencia fue la dosis de radiación con un nivel de significancia de 0.05 (α=0.05). Los análisis se realizaron con los procedimientos REG y GLM del paquete estadístico SAS 9.1.317.
Con los resultados de la DL50 y las RC50 obtenidas de las ocho variables, se obtuvo una media ponderada. Ponderándose, la DL50 con un 30 % y las RC50 con un 10 % para las demás variables (PG, Vge, LP, LR, RF, PS, PTH e ICC). Esto para obtener un solo valor y con ello establecer la dosis optima de irradiación gamma para inducir mutagénesis en pasto garrapata. El porcentaje de germinación fue la variable a la que se le asignó mayor ponderación, debido a que la muerte del individuo indica el daño máximo que puede producir la radiación.
El comportamiento del PG mostró una tendencia cuadrática (P=0.008). Además, todas las dosis de radiación presentaron diferencias (P<0.05) con respecto al tratamiento testigo (T-0). En términos generales el PG tendió a disminuir conforme aumentó la dosis de irradiación (Figura 1a). La ecuación de regresión indica que la DL50 en pasto garrapata se presenta a 1,529.1 Gy. De manera similar, la Vge mostró una tendencia cuadrática (P=0.001) y todos los tratamientos de irradiación presentaron diferencias (P<0.05) con el T-0. También, la Vge disminuyó conforme se incrementó la dosis de radiación (Figura 1b). De acuerdo con la ecuación de regresión, en esta variable la RC50 se encontró a los 805.3 Gy.
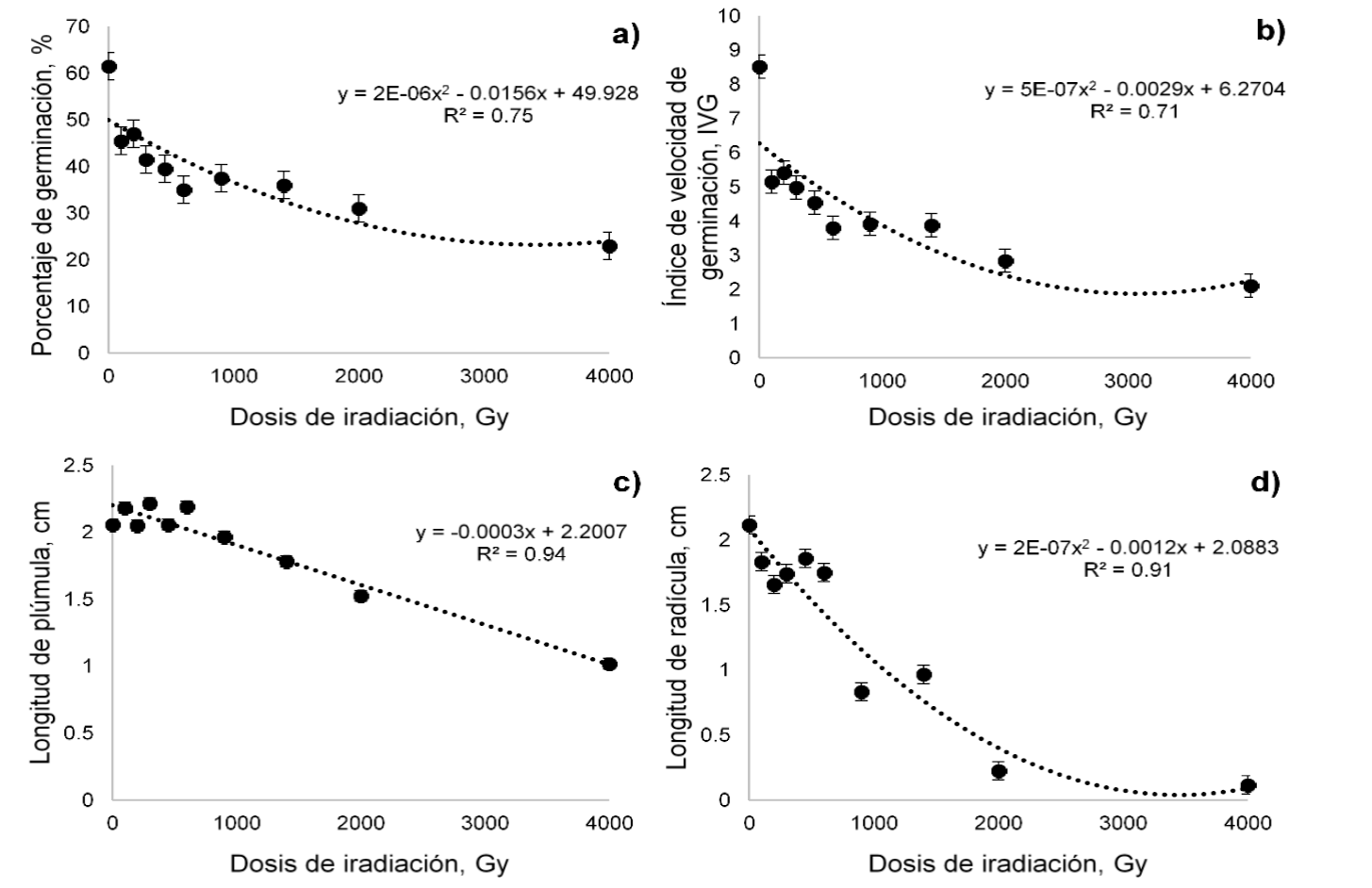
Figura 1 Efecto de diferentes dosis de irradiación con CO60 sobre el porcentaje de germinación (a), índice de velocidad de germinación (b), longitud de plúmula (c) y longitud de radícula (d) de pasto garrapata (Eragrostis superba)
La LP presentó una tendencia lineal negativa (P<0.0001). No obstante, solamente las dosis de 2000 y 4000 Gy presentaron menor LP (P<0.05) que T-0 (Figura 1c). Según la ecuación de regresión, en esta variable la RC50 se ubicó en los 3,905.3 Gy. Así mismo LR mostró una tendencia cuadrática (P<0.0001). Para esta variable solamente los tratamientos 900, 1400, 2000 y 4000 Gy tuvieron menor LR (P<0.05) que el T-0 (Figura 1d). La ecuación indicó que en esta variable la RC50 se presentó a los 1,037.8 Gy.
El comportamiento del RF mostró una tendencia cuadrática (P=0.0009). En esta variable se presentó un aumento (P<0.05) en las dosis de 450 y 600 Gy. Posteriormente, tendió a disminuir hasta los 4000 Gy, donde todas las plantas de esta dosis murieron antes de los 21 d de edad (Figura 2a). En esta variable, la ecuación de regresión indica que la RC50 se presentó a 2,262.8 Gy.
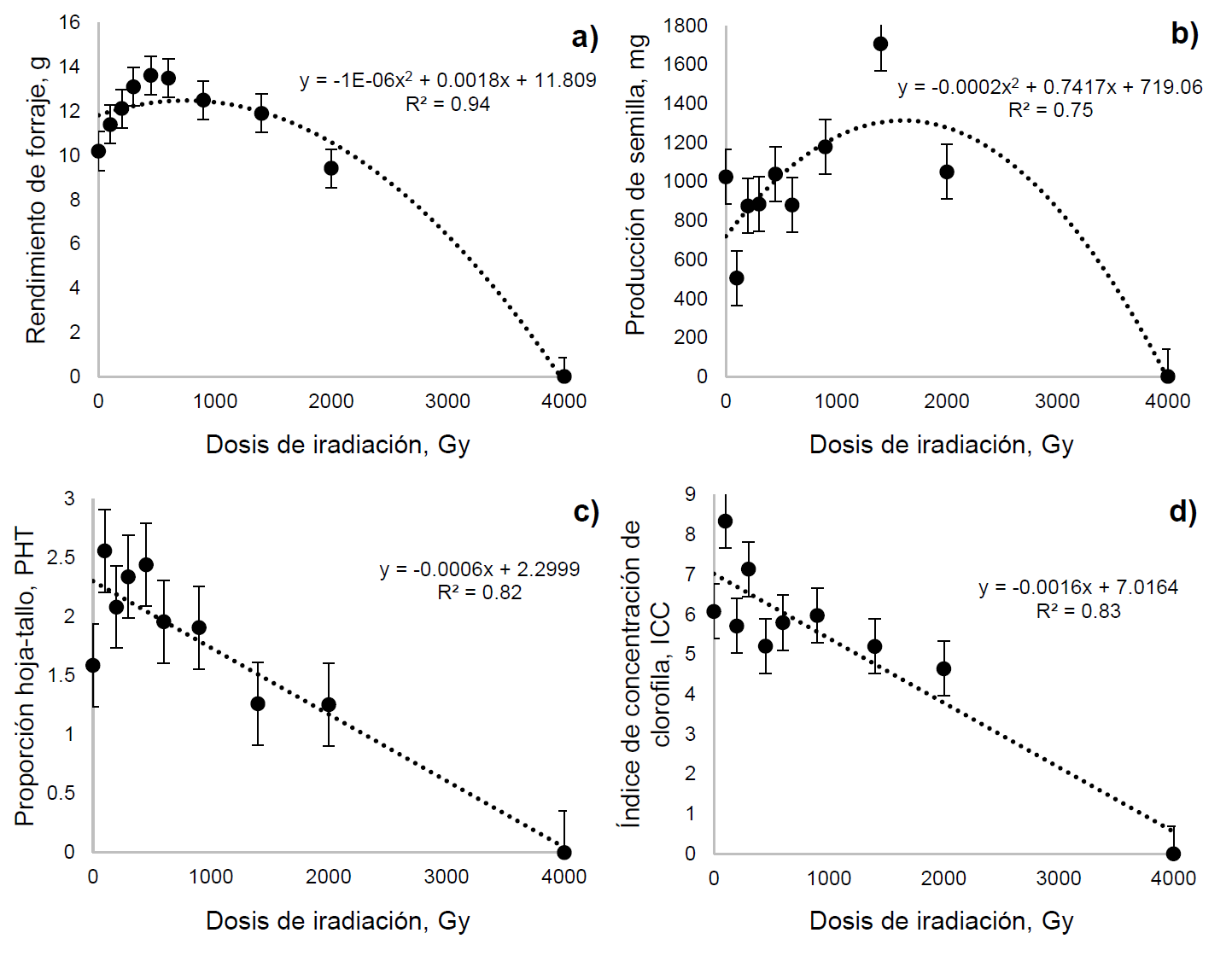
Figura 2: Efecto de diferentes dosis de irradiación con CO60 sobre el rendimiento de forraje (a), producción de semilla (b), proporción hoja-tallo (c), índice de concentración de clorofila (d) de pasto garrapata (Eragrostis superba)
El PS presentó una tendencia cuadrática (P<0.05). Sin embargo, los únicos tratamientos que mostraron diferencias (P<0.05) conforme al testigo fueron 1400 y 4000 Gy. En la dosis de 1400 Gy el PS aumentó (P<0.05; Figura 2b). De acuerdo con la ecuación de regresión y el PS la RC50 se presentó a los 3,968.7 Gy. La PHT mostró una tendencia lineal (P<0.0001). El único tratamiento diferente (P<0.05) al testigo fue el de 4000 Gy. Lo anterior debido a que en este tratamiento todas las plantas murieron y por lo tanto presentó una PHT de 0. En esta variable la RC50 se obtuvo en 2,509.9 Gy. El ICC presentó un comportamiento lineal (P<0.0001). No obstante, al igual que en la variable anterior, el único tratamiento diferente (P<0.05) al testigo fue el de 4000 Gy. De acuerdo con la ecuación de regresión, la RC50 se presentó a los 2,486.6 Gy. La media ponderada de la DL50 y las RC50 resultantes de las ocho variables fue de 2,159.2 Gy.
La germinación del pasto garrapata disminuyó conforme aumentó la dosis de irradiación. Este resultado concuerda con diversos autores, quienes encontraron que la germinación de diferentes especies de plantas tiende a disminuir a medida que aumenta la dosis de radiación18-21. Esto se debe a que dosis altas de radiación pueden inhibir funciones vitales para las células, lo cual puede provocar la muerte de algunas células e incluso la del embrión en la semilla. Este fenómeno tiende a aumentar en frecuencia conforme se incrementa la dosis de irradiación y es la causa por la que la germinación disminuye20. La radiación puede provocar daños en compuestos relacionados con el metabolismo de planta como auxinas, ácido ascórbico, clorofila y proteínas, lo cual puede inhibir el crecimiento de las plántulas22,23. Debido a estos desórdenes se ha observado que la semilla irradiada con dosis altas no es capaz de germinar, o que sus plántulas no son capaces de sobrevivir más de unos cuantos días24, lo cual ocurrió en este estudio en la dosis de 4000 Gy. Así mismo, la reducción de la germinación se ha atribuido a que la frecuencia en los daños cromosómicos aumenta con el incremento de la dosis22. Lo anterior puede cambiar la expresión de proteínas e influir en el funcionamiento celular, lo que puede afectar al desarrollo de la plántula e impedir la germinación25.
Una de las gramíneas más estudias en cuestión de radiosensibilidad es el arroz (Oryza sativa). En un estudio realizado en esta especie expusieron 13 variedades a radiación gamma y encontraron que la DL50 varió según la variedad entre 345 y 423 Gy26. En otro estudio realizado en dos variedades de arroz se estableció la DL50 en 288 y 354 Gy27, mientras que otros investigadores establecieron la dosis letal media en esta especie a los 229 Gy28. En otras gramíneas como Pennisetum glaucum y Pennisetum typhoides la DL50 se ha determinado en 669.3 y 200 Gy, respectivamente28,29. En gramíneas forrajeras la DL50 se ha determinado en pasto sudán (Sorghum sudanense), donde la DL50 varió entre 307 y 342 Gy para diferentes variedades3. Cabe mencionar que en los estudios anteriores se utilizó el mismo agente que en este estudio. No obstante, los resultados anteriores son inferiores a la DL50 del pasto garrapata, obtenida en este estudio. Este resultado probablemente se debe, entre otros factores, a las variaciones en el contenido de humedad de la semilla que se da entre especies. Esto debido a que la radiación ionizante puede provocar la ruptura de enlaces covalentes y descomposición de moléculas de agua. Lo anterior forma radicales libres que de manera indirecta pueden dañar los diferentes organelos de la célula e incluso las moléculas de ADN dentro de la célula30.
Al igual que el PG, la Vge del pasto garrapata tendió a disminuir conforme se incrementó la dosis de radiación. Este resultado concuerda con lo reportado en cacahuate (Arachis hypogaea), donde la velocidad de germinación disminuyó con el aumento de la dosis de radiación31. El retraso en la germinación puede deberse a que se ha observado que dosis altas de radiación pueden inhibir procesos vitales para la célula, como son la síntesis de proteínas y la actividad enzimática, lo cual puede retrasar la división celular y por ende la germinación20,32.
Con respecto a la LP y LR se observó que éstas disminuyeron con el incremento de la dosis de irradiación. Este resultado concuerda con el encontrado en Eleusine coracana, donde la LP y la LR se vieron afectadas por el incremento en la dosis de radiación y se encontró la RC50 a los 500 Gy, para ambas variables33. Este mismo efecto fue encontrado en arroz, donde encontraron la RC50 a los 250 y 450 Gy para ambas variables, respectivamente34.
La disminución en longitud de plúmula y radícula puede deberse a que la radiación ionizante comúnmente afecta al metabolismo y la división celular en plantas, lo cual inhibe o retrasa su crecimiento20,31. Respecto a esto, Kiong et al22 encontraron que la radiación gamma puede disminuir la cantidad de proteínas y compuestos clorofílicos, lo cual afecta al metabolismo de la plantas. Por otro lado, Preuss y Britt35 encontraron que la radiación gamma puede inhibir el crecimiento de las plantas, debido a que estas tienen un mecanismo de señales de transducción que monitorea el daño celular. Este mecanismo detiene la división celular cuando se produce un daño en la estructura celular.
El RF y la PS del pasto garrapata presentaron un incremento con dosis bajas de irradiación. Esto probablemente se debe a que la radiación gamma puede incrementar la cantidad de pigmentos fotosintéticos como las clorofilas a y b y los carotenos22. Estos pigmentos son los encargados de captar fotones de luz solar para que la planta pueda convertirlos en compuestos ricos en energía, a través de la fotosíntesis36. Por esta razón, un incremento en la concentración de estos pigmentos puede aumentar las tasas fotosintéticas, lo cual pudo ser la causa del incremento en el rendimiento de forraje y la producción de semilla en este estudio. El incremento en RF y PS también puede deberse a que la radiación gamma en algunas ocasiones incrementa la actividad de enzimas antioxidantes como la superóxido dismutasa y la glutatión reductasa, lo cual disminuye el estrés oxidativo en la planta. Esto último ayuda a la planta a lidiar de manera más fácil con los factores de estrés a los que se enfrenta diariamente, como son las fluctuaciones de temperatura y luz solar que recibe, lo cual beneficia su crecimiento37,38.
No obstante, después del incremento en el RF y la PS se presentó un decremento. Esto se debe a que la radiación también puede causar efectos negativos, ya que la exposición a radiación gamma frecuentemente produce radicales libres durante el proceso de la radiólisis del agua. Estos radicales libres son especies químicas inestables pueden dañar organelos celulares. En un experimento realizado por Wi et al39 se observó que la radiación gamma produjo importantes modificaciones en la estructura de algunos organelos en células de Arabidopsis thaliana. En este experimento, los tilacoides dentro de los cloroplastos mostraron dilatación y daños, las mitocondrias presentaron formas distorsionadas y el retículo endoplasmático presentó membranas distendidas. Además, como se menciona con anterioridad, la radiación puede provocar la destrucción de auxinas, ácido ascórbico, clorofila y proteínas, lo que afecta al metabolismo de las plantas22,23. Es poca la probabilidad de que se presente alguno de estos fenómenos con dosis bajas de radiación; sin embargo, conforme se incrementa la dosis de radiación aumenta la probabilidad de que ocurran22. Lo anterior, puede ser la causa por la que después de que se incrementó el rendimiento de forraje y la producción de semilla, se haya presentado una reducción en ambas variables.
La DL50 y RC50 son parámetros utilizados para determinar la dosis óptima de irradiación para inducir mutaciones efectivas en programas de mejoramiento genético. Esto se debe a que se ha observado que con dosis bajas de irradiación, los impactos en el genoma pueden ser mínimos y difíciles de reflejarse fenotípicamente; mientras que con dosis altas el genoma puede sufrir múltiples impactos que regularmente producen aberraciones o cambios negativos7,8. Además, las dosis bajas de irradiación pueden inducir un incremento en la división celular, actividad enzimática o cantidad de pigmentos fotosintéticos31,34. En contraste, dosis altas de irradiación pueden también producir daños físicos en los organelos o químicos en las células, como la destrucción de enzimas y hormonas, entre otros. Sin embargo, por no haber sido producidos por modificaciones genéticas, estos cambios no pasarán a las siguientes generaciones. En este sentido, las dosis bajas y altas de radiación pueden generar cambios fenotípicos en las plantas que pueden ser confundidos con cambios genéticos. Por lo anterior, antes de iniciar un programa de mejoramiento genético por mutagénesis se debe establecer la dosis óptima de irradiación, lo cual incrementa la posibilidad de encontrar mutaciones efectivas. La dosis óptima de irradiación se establece a través de la dosis letal media o la dosis de reducción media del crecimiento6,7. En este estudio, la reducción que se presentó en los valores de todas las variables por efecto de irradiación, permitió determinar la DL50 y RC50. No obstante, los valores de ambos parámetros en cada variable oscilaron entre 805 y 3,905 Gy. Debido a la amplitud de este rango, se calculó una media ponderada para establecer la dosis óptima de irradiación gamma en la semilla. A la variable que se le asignó mayor ponderación fue el porcentaje de germinación, ya que la muerte del individuo indica daño máximo que puede producir la radiación.
Dosis bajas de radiación gamma puede producir un incremento en algunos atributos agronómicos en pasto garrapata. No obstante, en general todos los parámetros físicos evaluados se vieron afectados con dosis altas de irradiación gamma, lo cual permitió determinar la dosis media letal y reducción media del crecimiento. Para el mejoramiento genético del pasto garrapata, se recomienda utilizar la dosis óptima de radiación obtenida con la ponderación de ambos parámetros (2,486 Gy). Esto contribuirá para la obtención de nuevo material genético que pueda ser utilizado para rehabilitación de pastizales.




![Composición botánica y valor nutritivo de la dieta consumida por bovinos en un área invadida por pasto rosado [Melinis repens (willd.) Zizka]](/img/pt/prev.gif)






 texto em
texto em 


