Introducción
El período de transición se define como los últimos 21 días de gestación hasta los 21 días después del parto, donde el estrés y los cambios metabólicos que ocurren en este tiempo hacen que el animal sea más susceptible a las enfermedades1-3. El 75 % de todas las enfermedades en el ganado lechero ocurren en el primer mes de lactancia y el 50 % de las enfermedades metabólicas e infecciosas se generan en el período de transición4. Además, ocurre una disminución en el consumo de materia seca (CMS) y un aumento en la demanda de energía debido al crecimiento fetal y al aumento de la producción de leche postparto1; como resultado, la vaca experimenta un balance energético negativo (BEN), caracterizado principalmente por la movilización de grasa, que se transporta en el plasma como ácidos grasos no esterificados (NEFA, por sus siglas en inglés) alcanzando el hígado y siguiendo diferentes vías metabólicas. Cuando los niveles de glucosa son normales, los NEFA son re-esterificados a triglicéridos y transportados a la sangre en forma de lipoproteínas de muy baja densidad5. Si los niveles de glucosa son bajos, los NEFA entran a la mitocondria y se oxidan hasta acetil-CoA para continuar en el ciclo de Krebs o formar cuerpos cetónicos. Para entrar al ciclo de Krebs, se requiere de oxaloacetato, el cual proviene principalmente de la glucosa. Dado que hay una respuesta adaptativa pobre al BEN y la glucosa se dirige a la glándula mamaria para la síntesis de lactosa, la formación de cuerpos cetónicos se incrementa con un resultado final de cetosis5, la cual puede ser clínica o subclínica. La cetosis subclínica se caracteriza por niveles de β-hidroxibutirato circulante (BHB) ≥ 1.2 mmol/L en ausencia de signos clínicos6-8. La cetosis se puede diagnosticar mediante la determinación de los cuerpos cetónicos en la orina (acetoacetato), la leche (BHB), el suero (BHB), el plasma (BHB) y la sangre (BHB)9. Las vacas que desarrollan cetosis disminuyen su producción de leche y corren mayor riesgo de experimentar otras enfermedades posparto, en consecuencia, reducen su fertilidad10,11, lo que implica pérdidas significativas para la industria lechera7,12.
Dado a que existe una mayor susceptibilidad a las enfermedades durante el período de transición, es necesario establecer estrategias de prevención, incluyendo un adecuado manejo nutricional. Dentro de esto, el uso de aditivos como la monensina, un ionóforo que altera la fermentación ruminal en favor de la producción de ácido propiónico (principal precursor gluconeogénico en el rumiante), podría contribuir a disminuir la incidencia de cetosis y trastornos relacionados13,14, con la consecuente mejora en producción de leche, la salud y la fertilidad durante la lactancia2,15.
La hipótesis de este estudio fue que las vacas tratadas con un bolo de monensina intraruminal tienen menores concentraciones de BHB en sangre, menor incidencia de enfermedades posparto y mayor producción de leche que las vacas sin suplementación. Por lo tanto, el objetivo fue evaluar el efecto de una cápsula de monensina sódica intraruminal que libera 300 mg de monensina por día durante 95 días sobre los niveles de BHB en el postparto, incidencia de enfermedades del periparto y producción de leche y sus componentes en vacas Holstein bajo condiciones chilenas, relativo al medio ambiente y clima (tipo mediterráneo), variedades y calidades de los forrajes (heno y ensilaje de alfalfa y ensilaje de maíz) y calidad de los concentrados (en base a maíz grano, harina de soya, harina de canola, harinilla de trigo, semilla de algodón, y subproductos agrícolas), etc.
Material y métodos
Lechería y animales
El estudio se realizó en una lechería Holstein, con 400 vacas en ordeña de la zona central de Chile (33.8o S, 71.3o O). La precipitación media anual y la temperatura más baja y más alta fue de 235 mm, 2 °C y 30 °C, respectivamente16. Las vacas eran confinadas en cubículos con camas de arena; eran ordeñadas tres por día, con una producción a los 305 días de 12,800 kg de leche. Las vacas se secaban entre 45 y 60 días antes de la fecha probable de parto (FPP), alojadas en un corral de tierra y alimentadas con una ración para vacas secas. A las cuatro semanas de la FPP, las vacas se movían a un grupo preparto y se alimentaban con una dieta aniónica y un precursor de glucosa (propilenglicol; 200 g/vaca/día). Este producto no se utilizó en el posparto. Las vacas parían en maternidades y después se trasladaban al grupo posparto hasta los 21 días en Lactación. Las raciones se formularon para cubrir los requerimientos nutricionales del modelo Cornell Net Carbohydrate and Protein System17 usando un software comercial (NDS, RUM & N Sas, Reggio Emilia, Italia).
Diseño experimental
Con el fin de encontrar una diferencia en la concentración de BHB en sangre de 0.2 mmol/L (DE= 0.22) entre el grupo tratado (1.0 mmol/L) y el grupo control (1.2 mmol/L (valor de corte para cetosis subclínica)6, con un 95% de confianza y un 80% de potencia, se calculó un tamaño muestral de 30 animales por grupo. Debido a que durante el experimento se pueden producir eliminaciones involuntarias de animales, se decidió asignar 40 animales por grupo para poder terminar el periodo experimental con el número mínimo de animales calculados. Los animales se asignaron aleatoriamente a los 28 días antes de la FPP. El grupo de tratamiento recibió por vía oral un bolo de monensina sódica que libera diariamente ~ 335 mg de monensina de sodio durante un período de 95 días (Rumensin® Cápsula, Elanco, Greenfield, IN, USA). El bolo tenía un número de identificación, que se registra en el momento de su aplicación para identificar la vaca si el bolo es regurgitado. Tanto las vacas tratadas como las controles fueron alojadas en el mismo corral preparto, recibieron la misma ración y fueron expuestas a las mismas condiciones ambientales y de manejo. Diariamente, se inspeccionaba el corral preparto y posparto para identificar bolos regurgitados. Si un bolo era encontrado, se evaluaba su estado y si no se observaba defectuoso era re-administrado; de lo contrario, se aplicaba un nuevo bolo. La composición de las dietas y su contenido nutricional se muestran en los Cuadros 1 y 2.
Cuadro 1: Composición de la dieta preparto y postparto (kg/día, base materia seca) consumidas por las vacas tratadas con monensina y el grupo control
| Ingrediente | Preparto | Postparto |
|---|---|---|
| Heno alfalfa | 0.90 | 2.65 |
| Ensilaje de maíz | 5.04 | 6.24 |
| Paja de trigo | 1.8 | - |
| Maíz grano | 0.44 | 3.98 |
| Harina de soya | 0.45 | 2.5 |
| Harina de canola | 0.25 | 0.29 |
| Harinilla de trigo | 0.88 | 2.03 |
| Grasa de sobrepaso | - | 0.09 |
| Orujo de cebada | 2.45 | 1.6 |
| Carbonato de calcio | 0.049 | 0.09 |
| Sal aniónica | 0.87 | - |
| Minerales | 0.12 | 0.1 |
| Vitaminas | 0.032 | 0.015 |
| Ligante de micotoxinas | 0.05 | 0.05 |
| Precursor gluconeogenico1 | 0.02 | - |
| Levaduras | 0.01 | 0.01 |
| Total materia seca | 13.22 | 19.64 |
1 Precursor en base a propilenglicol al 50%.
Cuadro 2: Composiciones nutricionales de las dietas preparto y postparto consumidas por las vacas tratadas con monensina y el grupo control
| Nutriente | Preparto | Postparto |
|---|---|---|
| Materia seca, %1 | 48.5 | 49.5 |
| Proteína cruda, % MS1 | 15.2 | 15.9 |
| Proteína soluble, % PC1 | 26.6 | 27.3 |
| Proteína degradable, % MS2 | 9.49 | 9.08 |
| FDA, % MS1,a | 27.4 | 18.3 |
| aFDNmo, % MS1,b | 47.1 | 35.0 |
| peFDN, % MS 2 , c | 32.3 | 21.6 |
| CNF, % MS1, d | 25.1 | 37.2 |
| Almidón, % MS1 | 16.6 | 23.5 |
| EE, % MS1 | 4.59 | 5.01 |
| Cenizas, % MS1 | 7.99 | 6.96 |
| Ca, % MS1 | 0.89 | 0.85 |
| P, % MS1 | 0.41 | 0.41 |
| Mg, % MS1 | 0.40 | 0.31 |
| Na, % MS1 | 0.23 | 0.32 |
| K, % MS1 | 1.02 | 1.13 |
| S, % MS1 | 0.21 | 0.21 |
| Cl, % MS1 | 1.23 | 0.30 |
| ENLac, Mcal/kg MS2 | 1.19 | 1.60 |
| DCAD, mEq/kg MS3 | -90 | +210 |
1 Análisis de laboratorio.
2 Calculado a partir de fórmulas después del análisis de laboratorio.
3 Fórmula diferencia catiónica-aniónica dietaria (Na+ + K+) - (Cl- + S-).
a Fibra detergente acido.
b Fibra detergente neutro libre de cenizas y tratada con amilasa.
c Fibra detergente neutro físicamente efectiva.
d Carbohidratos no fibrosos.
Muestra de sangre
Se recolectaron muestras de sangre a los 7, 14, 21 y 28 días postparto para evaluar los niveles de BHB mediante un medidor portátil (FreeStyle Optium®, Abbott Diabetes Care Inc., Alameda, CA). El medidor tiene una sensibilidad del 94.8% (IC95%: 92.6-97.0), y especificidad del 97.5% (IC95%: 96.9-98.1)9. Se definió como cetosis subclínica un valor de BHB ≥ 1.2 mmol/L6-8.
Condición corporal, enfermedades del postparto y producción de leche
El puntaje de condición corporal se evaluó por la misma persona a la asignación de la vaca, al parto y a los 28 días después del parto utilizando la escala de 1 a 5 con un incremento de 0.25 unidades, basado en una metodología estándar18.
Para la identificación de las enfermedades posparto, la temperatura corporal se midió con un termómetro digital vía rectal a los 3, 5 y 7 días después del parto. Dentro de las 24 h postparto, se observó la presencia de membranas fetales retenidas (RMF), definidas como membranas presentes en la vulva, vagina o en el útero por examen vaginal después de 24 h postparto19. Dentro de las primeras dos semanas de lactancia, se realizó palpación rectal diaria para determinar la presencia de secreciones puerperales de mal olor o metritis, definida como la inflamación uterina con flujo genital anormal con o sin signos sistémicos, que ocurren dentro de los primeros 14 días en lactación20. La presencia de mastitis se evaluó en la sala de ordeña a través de la inspección visual de la leche. Se consideró como mastitis clínica una leche visualmente anormal (por ejemplo, coagulada, acuosa, restos de fibrina o pus) de uno o más cuartos. Esta secreción podía estar o no acompañada de signos de inflamación de la ubre (calor, hinchazón o enrojecimiento)19. La presencia de endometritis se evaluó al día 25 a 38 postparto, mediante vaginoscopio y secreciones genitales caracterizadas por descargas vaginales purulentas o muco-purulentas después de 21 días del parto20.
La producción de leche se midió semanalmente a través de un test oficial hasta los 90 días de lactancia, utilizando medidores proporcionales (Waikato Milking Systems LP, Verona, WI 53593, EE.UU). Además, se midieron semanalmente los porcentajes de grasa y proteína y el contenido de células somáticas (CCS) durante las primeras tres semanas de lactancia, utilizando un laboratorio comercial (Cooprinsem, Osorno, Chile).
Análisis estadístico
El análisis de los datos se realizó con el programa computacional SAS 9.421. La incidencia de las enfermedades posparto se comparó a través de un modelo de regresión logística considerando como variable principal el efecto tratamiento y ajustando por el número de lactancia y la condición corporal al parto. Se calcularon las Razones de Riesgo (RR) ajustadas e intervalos de confianza al 95% (IC 95%). Se analizaron las concentraciones de BHB, los porcentajes de grasa y proteína y CCS mediante análisis de varianza para medidas repetidas, considerando los efectos de tratamiento, día de la muestra, número de lactancia (2, ≥3) y condición corporal al parto y sus interacciones. Los porcentajes de grasa y proteína se transformaron al arco seno de la raíz cuadrada, según la fórmula propuesta por Blis22. El CCS se transformó a su puntuación lineal usando la fórmula log 2 (CCS/100) +3, según el método de Dabdoub y Shook23. Se construyeron modelos mixtos considerando la mejor estructura de covarianza basada con la mejor prueba de bondad del ajuste24. La condición corporal se evaluó mediante el cambio en la puntuación de la condición corporal desde el pre-parto hasta el parto y desde el parto hasta los 21 días posparto. Esta variable se analizó mediante un ANDEVA multivariable. El nivel de significancia se estableció con un valor de P≤0.05. La tendencia se consideró con un valor de P entre 0.1 y 0.05.
Resultados
Para el análisis final se consideraron 40 vacas en el grupo control y 37 vacas en el grupo tratado. Tres vacas del grupo tratado no fueron consideradas debido a que una vaca murió de enterotoxemia poco después del parto, y dos vacas abortaron pocos días después de recibir el bolo de monensina.
Las concentraciones sanguíneas promedio (± error estándar de la media) de BHB (mmol/L) no fueron diferentes entre los dos grupos a través del tiempo (P>0.05) (Cuadro 3). Esto significa que la interacción grupo por tiempo no tuvo un efecto significativo y por ende ambas curvas fueron paralelas. La mayor diferencia en BHB se dio al día 7 postparto con una concentración para el grupo control de 0.7 mmol/L y para el grupo tratado de 0.57 mmol/L, sin embargo, esta diferencia tampoco fue significativa (P>0.05).
Cuadro 3: Resultados análisis de varianza para medidas repetidas y mínimos cuadrados medios para BHB (mmol/L) para el grupo control y monensina durante las primeras cuatro semanas postparto
| Efecto | GL num 1 | GL den 2 | Valor F | Valor de P |
|---|---|---|---|---|
| Tratamiento | 1 | 74 | 0.14 | 0.70 |
| Semana | 3 | 225 | 1.30 | 0.27 |
| Tratamiento por semana | 3 | 225 | 1.20 | 0.31 |
| Lactancia | 1 | 74 | 1.74 | 0.19 |
| Concentraciones de BHB (mmol/L) en sangre | ||||
| Semana | Control | Monensina | EEM3 | Valor de P |
| 1 | 0.695 | 0.573 | 0.062 | > 0.05 |
| 2 | 0.605 | 0.597 | 0.062 | > 0.05 |
| 3 | 0.595 | 0.608 | 0.062 | > 0.05 |
| 4 | 0.658 | 0.716 | 0.062 | > 0.05 |
1 grados de libertad numerador.
2 grados de libertad denominador.
3 Error estándar de la media.
A la asignación de los animales ambos grupos no difirieron en su condición corporal (3.28 y 3.21 para el grupo control y tratado respectivamente, P>0.05). Sin embargo, las vacas tratadas con el bolo de monensina presentaron una condición corporal más alta al momento del parto (3.21) que las vacas controles (3.12), así como a los 28 días de lactancia (3.14 y 2.78, para el grupo tratado y control, respectivamente). En el Cuadro 4 se presentan los mínimos cuadrados medios de las pérdidas de condición corporal entre el preparto y el parto y entre el parto y el postparto.
Cuadro 4: Cambio en la condición corporal (CC) entre preparto y parto y entre parto y postparto en vacas tratadas con monensina y controles
| Grupo | Diferencia entre CC parto - preparto | EEM | Valor de P |
|---|---|---|---|
| Monensina | 0.17 | 0.04 | 0.015 |
| Control | 0.01 | 0.04 | |
| Grupo | Diferencia entre CC postparto - parto | EEM1 | Valor de P |
| Monensina | -0.13 | 0.04 | 0.008 |
| Control | -0.31 | 0.04 |
EEM= error estándar de la media.
Para la incidencia de enfermedades sólo hubo una tendencia (P=0.08) de presentación de una menor frecuencia de endometritis en el grupo tratado (14 %) en comparación al grupo control (30 %). La cetosis fue de 15 vs 27 %, RMF 23 vs 16 %, metritis 45 vs 30 % y fiebre 25 vs 16 %, para el grupo control y tratado, respectivamente. Las diferencias no fueron significativas (P>0.05).
La producción de leche a través del tiempo no fue diferente entre ambos grupos (P>0.05) (Figura 1). En general, el primer control postparto (semana 1) la producción del grupo control fue de 37.4 kg y la del grupo tratado de 36.0 kg (P>0.05). Esta diferencia se mantuvo durante las 10 semanas del estudio entre ambos grupos, por lo tanto, la interacción grupo por semana no fue significativa, lo que implica que ambas curvas fueron paralelas. Para los sólidos de la leche, sólo el porcentaje de proteína en la semana 1 fue mayor para el grupo tratado con monensina (3.4 7%) que para el grupo control (3.16 %) (Cuadro 5, Figura 2). Sin embargo, los kilogramos totales de proteína por semana no fueron diferentes entre ambos grupos. Para la grasa de la leche, tanto el porcentaje como el total de kilogramos entre ambos grupos no fueron estadísticamente diferentes (P>0.05) (Cuadro 5, Figura 3), a pesar que en la primera semana postparto la grasa para el grupo tratado fue 4.10 % y para el grupo control 3.71 %. Tampoco hubo diferencias en la puntuación lineal de CCS en la semana 1, 2, y 3 entre ambos grupos (P>0.05) con una puntuación lineal que se mantuvo alrededor de 2 a 2.5 para ambos grupos (200 a 300 mil células por ml aproximadamente), salvo para la semana 2 en que la puntuación de CCS para el grupo tratado fue de 1.57 y para el grupo control de 2.05 (P>0.05) (Figura 4).
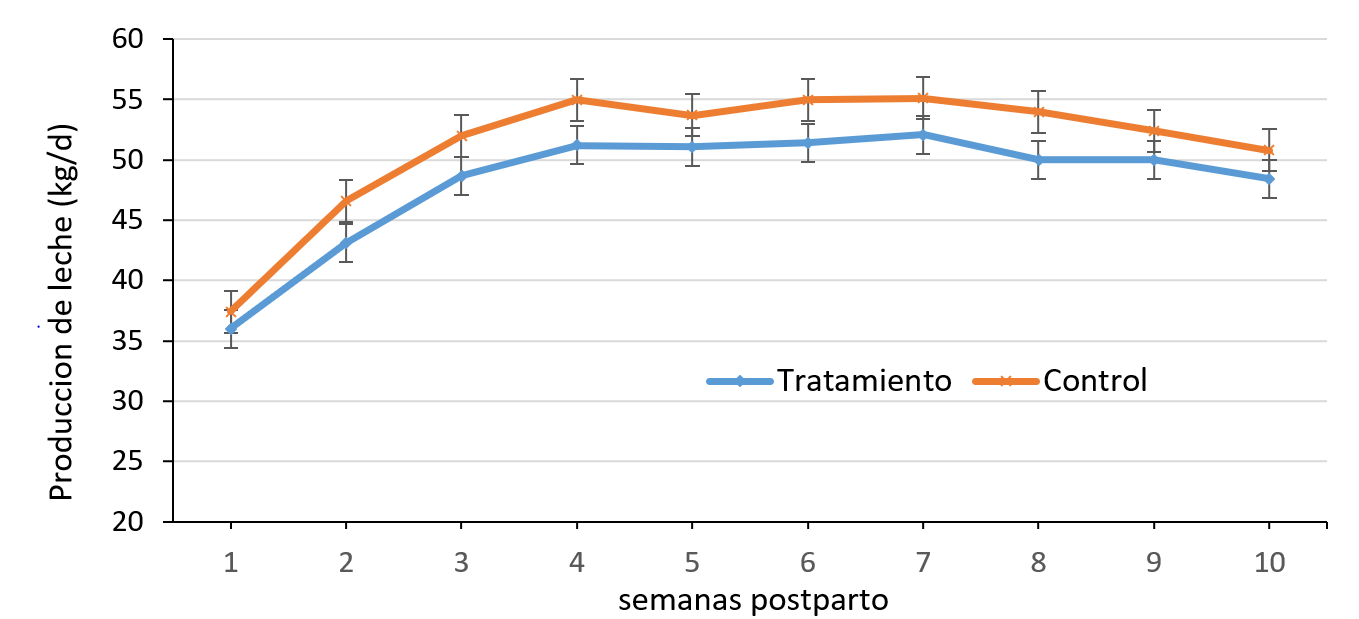
Interacción grupo por tiempo no fue significativo (P>0.05).
Figura 1: Promedio de producción de leche semanal en vacas tratadas con monensina y controles

Semana 1 diferencias significativas (P≤0.05).
Figura 2: Porcentaje de proteína de la leche durante las 4 primeras semanas postparto entre vacas tratadas con monensina y controles

Interacción grupo por semana no fue estadísticamente significativo (P>0.05).
Figura 3: Porcentaje de grasa de leche durante las 4 primeras semanas postparto entre vacas tratadas con monensina y controles

Interacción grupo por semana no fue significativa (P>0.05).
Figura 4: Puntaje lineal de células somáticas durante las 3 primeras semanas postparto en vacas tratadas con monensina y controles
Cuadro 5: Porcentaje de grasa y proteína de la leche en vacas tratadas con monensina y controles durante las primeras cuatro semanas postparto
| % Grasa | ||||
|---|---|---|---|---|
| Semana | Control | Monensina | EEM | Valor de P |
| 1 | 3.88 | 4.26 | 0.61 | > 0.05 |
| 2 | 3.36 | 3.19 | 0.59 | > 0.05 |
| 3 | 4.43 | 4.26 | 0.60 | > 0.05 |
| 4 | 3.40 | 3.45 | 0.61 | > 0.05 |
| % Proteína | ||||
| Semana | Control | Monensina | EEM | Valor de P |
| 1 | 3.19 | 3.51 | 0.06 | 0.002 |
| 2 | 3.12 | 2.99 | 0.06 | > 0.05 |
| 3 | 3.06 | 3.00 | 0.06 | > 0.05 |
| 4 | 3.16 | 3.11 | 0.06 | > 0.05 |
EEM= error estándar de la media.
Discusión
El uso de la monensina sódica en vacas lecheras es ilegal en muchos países del mundo, sin embargo, está permitida en países como EE.UU, Chile y Argentina. Una de las fortalezas de este estudio es que las vacas del grupo tratado y control se mantuvieron en el mismo corral o lote y se manipularon indistintamente durante todo el período de estudio. Esto permitió descartar cualquier efecto de corral y manejo sobre las variables en estudio y así disminuir la variabilidad de las características estudiadas. Sin embargo, una de las deficiencias de este estudio fue que algunas variables del posparto sólo se pudieron evaluar semanalmente y únicamente durante los primeros 30 días en lactación. A pesar que la mayoría de los cambios metabólicos ocurren dentro del postparto temprano, es indudable que hay efectos de arrastre que pueden afectar tanto la producción de leche, como el contenido de sólidos y variables de fertilidad más allá del primer mes de lactancia. Sin embargo, como este estudio se llevó a cabo en una lechería comercial, donde los animales después de los 30 días en lactación se mueven a distintos grupos de producción, fue técnicamente imposible continuar evaluando en forma consistente las variables de estudio. A pesar de estas deficiencias, de igual forma se pudieron demostrar algunas diferencias significativas en variables como porciento de proteína, algunas enfermedades como la endometritis, y cambios en la condición corporal, independiente que es una herramienta visual que presenta cierto grado de subjetividad.
Los resultados de este estudio mostraron cierto beneficio de la aplicación de un bolo de monensina de liberación lenta en vacas Holstein durante el período de transición bajo las condiciones de manejo de los animales en la zona central de Chile. La condición corporal a las cuatro semanas de lactancia fue significativamente menor en las vacas control que en el grupo tratado con monensina. Esto podría indicar que el tratamiento con monensina ayudaría a las vacas a tener una menor pérdida de condición corporal después del parto. Resultados similares con respecto a la condición corporal han sido reportados en otros estudios que han evaluado el uso de monensina. Las vacas suplementadas con monensina perdieron menos condición corporal durante la lactancia temprana y mantuvieron o aumentaron su condición corporal desde el inicio del estudio (preparto) hasta el parto que las vacas no alimentadas con monensina25,26. Esta menor disminución en las reservas corporales podría ser el resultado de una mayor disponibilidad de energía y proteína aportada por el efecto de la monensina en la fermentación ruminal. Este mecanismo podría explicarse parcialmente por un aumento de la proporción molar de ácido propiónico con una disminución simultánea de la proporción molar de acetato y butirato en el rumen27. El aumento del propionato ruminal podría estar acompañado de una reducción de la cantidad de metano producido en el rumen y por un incremento en el nivel de glucosa en sangre14,28, ya sea para la síntesis de leche o para la deposición de grasa2,5. Además, se sabe que la monensina disminuye las concentraciones de L-lactato28,29 y afecta al metabolismo del nitrógeno al disminuir la producción de nitrógeno amoniacal (N-NH3) ruminal28, lo que en consecuencia podría aumentar el flujo duodenal de aminoácidos. Sin embargo, en el presente estudio, las concentraciones sanguíneas de BHB no fueron diferentes entre el grupo control y el grupo tratado. Este resultado contrasta con varios estudios a nivel mundial que informan que la monensina tiene un marcado efecto anti-cetogénico26,30-32. Dentro de estos, es clásico el estudio de meta-análisis publicado14, donde se resumen 59 investigaciones de todas partes del mundo, considerando un numero de 4,000 vacas en estudio, donde se demostró que la monensina sódica disminuyó la concentración de BHB en 13 %, sobre todo en vacas durante el primer mes de lactancia y también en vacas a pastoreo. Sin embargo, dentro de este mismo meta-análisis, se reportaron dos ensayos en que las vacas tratadas con monensina tuvieron una mayor concentración de BHB que vacas control. Una explicación parcial de que las vacas de nuestro estudio demostraron no tener diferencias en los niveles de BHB, podría estar relacionada con la suplementación de precursores gluconeogénicos en la dieta preparto en forma de propilenglicol. Una alta proporción de propilenglicol escapa a la degradación del rumen y se absorbe en el intestino delgado; el resto se metaboliza hacia propionato33,34. En el hígado, el propilenglicol se convierte en glucosa, principalmente a través de la vía del lactaldehído y posterior oxidación a lactato35. Desafortunadamente, no fue posible inferir un efecto de interacción potencial positivo o negativo entre el propilenglicol y la monensina en los escenarios experimentales actuales. Esto podría ser en parte una explicación del porqué la monensina no demostró diferencia alguna en los niveles de BHB.
No hubo diferencias significativas entre los dos grupos sobre la incidencia de enfermedades del periparto. Esto difiere de Meléndez et al13,36, quienes señalan que la monensina indirectamente mejora la función inmune, a través de un mejor estado energético. De hecho, el uso de un bolo análogo de liberación lenta de monensina también logró mejorar la condición corporal desde el secado al parto, y se logró disminuir la pérdida de condición corporal entre el parto y el postparto en comparación a vacas sin monensina, resultando en un menor número de enfermedades36. No obstante, de acuerdo con los resultados de este estudio, en la mayoría de estas enfermedades, el hato estudiado presentó una incidencia de enfermedades que se encuentran dentro de lo considerado normal19, excepto para la incidencia de metritis y endometritis en el grupo control (>30 %), donde hubo una tendencia a que las vacas tratadas con monensina desarrollaran un menor grado de infecciones uterinas.
Cabe señalar, que el uso de modelos mixtos ANDEVA para medidas repetidas es una herramienta estadística muy potente que sirve para comparar medias y curvas de variables continuas a través del tiempo. Esta técnica permite considerar una matriz de correlación entre cada una de las medidas a través del tiempo. En este sentido, cada promedio en un tiempo determinado covaría por el promedio de la medida obtenida en la medición previa, generándose una estructura de covarianza que ofrece un gran poder estadístico24. En cuanto a la producción de leche, no se encontraron diferencias estadísticas entre ambos grupos. Esto es consistente con lo que se ha informado en otros estudios, que indican que la aplicación de monensina no produce cambios en la producción de leche13,37. Además, en la mayoría de los estudios, no se ha demostrado que la administración de propilenglicol antes o después del parto afecte significativamente el nivel de producción de leche en vacas lecheras38,39. Sin lugar a dudas, el impacto del propilenglicol preparto sobre la producción de leche y la concentración de BHB en sangre es un factor que puede haber enmascarado el efecto positivo de la monensina sobre estas variables en estudio. Tanto la monensina como el propilenglicol suplementados en conjunto pueden tener una interacción positiva o negativa en las rutas metabólicas de la glucosa y energía de las vacas lecheras. Esto podría implicar que algunas vías metabólicas pueden ser saturadas con gran cantidad de propionato disponible para el hígado, afectando marginalmente la síntesis de glucosa. Como resultado, se sugiere que ambos grupos (control y tratamiento) produjeron suficiente glucosa para cubrir el rendimiento en producción de la leche y mantener bajos niveles de cuerpos cetónicos y el exceso potencial de glucosa sintetizada por el grupo tratado (con monensina y propilenglicol) pudo ayudar a disminuir el balance energético negativo y reducir las pérdidas de condición corporal durante el período postparto. Desafortunadamente, no hay un estudio que pruebe la hipótesis de una posible interacción entre monensina y propilenglicol en vacas lecheras de transición. Sólo hay un estudio que compara un grupo alimentado con propilenglicol y un grupo alimentado con monensina comparados con un grupo control; el grupo alimentado con propilenglicol presentó mayores niveles de glucosa y menores niveles de BHB en comparación con el grupo suplementado con monensina, sin haber diferencias en la producción de leche40. Estos hallazgos apoyan parcialmente los resultados obtenidos en el presente estudio. En consecuencia, basándose en estos resultados, se propone considerar las implicancias del uso de ambos productos, con el fin de aclarar si existe una posible interacción beneficiosa o antagónica entre la monensina y el propilenglicol.
En relación con la proteína de la leche, hubo un mayor porcentaje de proteína en la muestra tomada al día 7 posparto a favor del grupo tratado con monensina, pero no hubo diferencias significativas en términos de kilogramos totales de proteína entre el grupo tratado y el grupo control. Esto es contrario a lo que se ha reportado14, donde la monensina aumentó la producción total de proteína (kg) pero disminuyó el porcentaje en la leche. Por otra parte, el tratamiento con monensina no afectó significativamente el porcentaje de grasa de la leche, contrariamente al estudio de meta-análisis reportado por Duffield et al14, y que establece claramente que la monensina produce una disminución en el porcentaje de grasa, producción de acetato y butirato en el rumen, lo que lleva a una reducción de precursores lipogénicos para la síntesis de ácidos grasos en la glándula mamaria.
Indudablemente, toda la dinámica metabólica de la vaca lechera durante el periodo de transición y principalmente durante el posparto temprano es compleja y multifactorial. Es bien sabido hoy en día que la insulina juega un rol fundamental en todos estos procesos, y que además las vacas en la actualidad presentan un estado de insulino-resistencia hacia finales de la gestación y comienzos de la lactancia, como una estrategia metabólica de favorecer el drenaje de glucosa hacia el feto y hacia la glándula mamaria durante el posparto temprano41. Dado estas especulaciones, se sugiere que en futuros estudios se puedan analizar además las concentraciones de glucosa e insulina como para poder intentar dilucidar el real impacto que puede tener la hormona pancreática sobre el estado metabólico de la vaca durante el posparto temprano, bajo manejos de suplementación de precursores que ayudan a estimular la síntesis de glucosa.
El CCS en ambos grupos no fue diferente. Los valores promedio para las vacas control y tratadas fueron de 57,000 células/ml y 51,000 células/ml, respectivamente, valores muy por debajo de las 200,000 que se recomiendan para considerar la leche de buena calidad. Estos valores coinciden con el bajo número de mastitis clínicas observadas.
La menor pérdida de condición corporal presentada por el ganado al inicio de la lactancia podría deberse a la buena calidad y manejo de la ración y manejo adecuado y mayor confort en los grupos pre y posparto, haciendo que la vaca experimente un menor déficit energético con baja movilización de sus reservas corporales. Esto podría hacer que los niveles de BHB siguieran siendo menores, por lo que la salud y la producción de leche en ambos grupos no se vieran afectadas. Con estos resultados, se podría sugerir que la administración de este aditivo aporta beneficios en ganado lechero bien manejado, teniendo una ración formulada de acuerdo con los requerimientos de los animales y manteniendo buenas condiciones de confort. Además, las buenas prácticas de manejo llevadas a cabo por esta finca, como el diagnóstico precoz y el tratamiento oportuno de las enfermedades, especialmente en la vaca lechera durante el posparto temprano, podrían ser la explicación de un patrón de baja incidencia de enfermedades.
Conclusiones e implicaciones
El uso de un bolo de monensina de liberación lenta mejoró la dinámica de la condición corporal después del parto, hubo una tendencia a reducir la incidencia de infecciones uterinas y mejoró levemente el contenido de proteína de la leche. No hubo diferencias significativas ni en la producción de leche y la concentración de BHB en sangre entre ambos grupos en estudio.











 texto en
texto en 


