Introducción
La mastitis, una respuesta inflamatoria de la glándula mamaria ocasionada usualmente por bacterias, es probablemente la más costosa de las enfermedades infecciosas que afecta a las vacas lecheras. Ésta impacta de manera negativa el bienestar del ganado y la calidad de la leche producida, la cual generalmente presenta anormalidades, lo que genera pérdidas económicas para los ganaderos y para la industria láctea1. El principal patógeno contagioso responsable de las infecciones clínicas y subclínicas de las vacas lactantes es la bacteria Gram positiva Staphylococcus aureus2,3, la cual es capaz de invadir el tejido mamario y sobrevivir dentro de las células hospederas, ocasionando infecciones persistentes y recaídas frecuentes4,5.
La administración intramamaria de antibióticos ha sido el método más común para tratar la mastitis bovina6. Sin embargo, los tratamientos se han visto comprometidos en numerosas ocasiones, principalmente en aquéllas en las que está involucrado S. aureus, ya que éste tiene la capacidad de evadir el efecto de los antibióticos7. Asimismo, diferentes estudios han demostrado un incremento importante en la frecuencia de aislados de S. aureus resistentes a antibióticos8,9, lo que finalmente resulta en infecciones recurrentes y crónicas en el ganado.
El incremento en la emergencia de S. aureus resistente a antibióticos se debe al uso inadecuado de estos compuestos en el tratamiento de infecciones, así como su utilización como promotores del crecimiento en animales de granja. Lo anterior cobra mayor importancia debido a que la selección de resistencia a una clase de antibiótico puede conducir a resistencia-cruzada a otro tipo10. Para el caso de la mastitis bovina, estos compuestos son utilizados en los hatos lecheros como inyecciones intramamarias para tratar a la mastitis clínica y subclínica, por lo que el monitoreo de la emergencia de S. aureus resistentes es particularmente importante, ya que ello resulta sustancial para la salud pública11.
Las dificultades para controlar a S. aureus han hecho necesaria la búsqueda de nuevas alternativas terapéuticas. El uso de péptidos antimicrobianos (PAMs) como la nisina y polisacáridos biodegradables como el quitosano, representan opciones atractivas12,13. La nisina es un péptido de 34 aminoácidos producido por Lactococcus lactis, el cual posee actividad antimicrobiana sobre un amplio rango de bacterias Gram positivas12, además de que es considerada como segura por la FAO14. Por su parte, el quitosano (poly β-[1-4]-N-acetyl-D-glucosamina) es un biopolímero lineal producido por la desacetilación química de la quitina, la cual se encuentra en el exoesqueleto de crustáceos e insectos. Adicionalmente, el quitosano es considerado un policatión con propiedades antibacterianas importantes, no es tóxico, es biodegradable y compatible con el ambiente, por lo que es reconocido como seguro por la FAO15,16.
La Ciénega de Chapala, Michoacán, México, es una de las regiones más importantes del estado en cuanto a producción de leche se refiere (en 2015 produjo 73,641 L, lo que representó el 21 % de la producción estatal), la cual está formada principalmente por hatos de lechería familiar17. En la actualidad, aunque existe información sobre las principales bacterias asociadas a la mastitis bovina en la región, la información sobre sus perfiles de resistencia a antibióticos es escasa, además de que no existen datos sobre la susceptibilidad de patógenos contagiosos, como S. aureus, a nisina, quitosano y al compósito nisina/quitosano. Por lo tanto, el objetivo del presente trabajo fue analizar los perfiles de resistencia a antibióticos de aislados de S. aureus obtenidos de vacas con mastitis y determinar su susceptibilidad in vitro a nisina, quitosano y al compósito nisina/quitosano.
Material y métodos
Detección de mastitis y obtención de muestras de leche
La detección de la enfermedad y la obtención de leche se realizaron de julio de 2012 a agosto de 2014, como parte de un programa regional para el estudio de la mastitis bovina en La Ciénega de Chapala, Michoacán, México. Se analizaron 363 animales en ordeña pertenecientes a 30 hatos lecheros de los municipios de Venustiano Carranza y Marcos Castellanos. La mastitis se detectó mediante la Prueba de California (PC), siguiendo las instrucciones del fabricante (Sanfer®, México). La PC se realizó en los cuatro cuartos de cada animal y a partir de los cuartos infectados, se colectó una muestra de leche (30 ml) en tubos (Falcon®) estériles. Dichas muestras fueron mantenidas a 4 °C y transportadas al laboratorio de Biología Molecular de la Universidad de La Ciénega del Estado de Michoacán de Ocampo, en donde fueron procesadas. Previo a la colecta de las muestras, los cuartos se desinfectaron con algodón que contenía alcohol al 70 %, desechando los dos primeros chorros de leche.
Aislamiento e identificación de S. aureus
De las muestras de leche colectadas se tomaron alícuotas de 100 µl, las cuales se inocularon en cajas Petri que contenían agar de sal y manitol (BD Bioxon®, México) y se incubaron a 37 °C durante 24 h. Los aislados de S. aureus obtenidos fueron adicionalmente identificados mediante pruebas bioquímicas como tinción de Gram, ensayo de catalasa y coagulasa (BD Bioxon®, México) y reducción de telurito y actividad lipolítica en cajas Petri con agar baird parker (Dibico®, México). Posteriormente, los aislados se caracterizaron molecularmente mediante la amplificación de un fragmento del gen nuc, el cual codifica para la nucleasa termoestable de S. aureus, con los siguientes oligonucleótidos 5´-GACTATTATTGGTTGATCCACCTG-3´ y 5´-GCCTTGACGAACTAAAGCTTCG-3´18. Para las amplificaciones por PCR se utilizó ADN genómico de S. aureus obtenido mediante la técnica de Pospiech y Neumann19. Las reacciones de PCR se realizaron en un termociclador C1000 (Bio-Rad, México), bajo una desnaturalización inicial de 5 min a 95 °C, seguido de 25 ciclos a las siguientes temperaturas: desnaturalización a 95 °C por 1 min, alineamiento a 54 °C por 30 seg, extensión a 72 °C por 5 min. Los fragmentos amplificados se separaron por electroforesis en geles de agarosa al 1 %, se tiñeron con bromuro de etidio y se visualizaron en un fotodocumentador Gel Doc Universal Hood II (Bio-Rad, México). Como control positivo se utilizó la cepa certificada de S. aureus subsp. aureus ATCC (27543), la cual fue aislada de un caso clínico de mastitis bovina y amablemente proporcionada por el Dr. Joel Edmundo López-Meza del CMEB-FMVZ-UMSNH. Los aislados se identificaron con las letras AMC y AVC, correspondientes a Marcos Castellanos y Venustiano Carranza, Michoacán, respectivamente, seguidas de un número arábigo.
Ensayos de resistencia-susceptibilidad a antibióticos
Los ensayos de resistencia-susceptibilidad a antibióticos se realizaron mediante el método de difusión en disco sobre cajas Petri con agar Mueller-Hinton (BD Bioxon®, México)20. Se utilizaron multidiscos para Gram positivos (II) (Bio Rad®, México) con los siguientes antibióticos: ampicilina 10 µg, cefalotina 30 µg, cefotaxima 30 µg, cefepime 30 µg, cefuroxima 30 µg, dicloxacilina 1 µg, eritromicina 15 µg, gentamicina 10 µg, levofloxacina 5 µg, penicilina 10 U, tetraciclina 30 µg y trimetoprim-sulfametoxazol 25 µg. Las cajas Petri se incubaron a 37 °C durante 24 h. Después de ese tiempo, los halos de inhibición se midieron y se interpretaron de acuerdo a los criterios establecidos por el CLSI21, los aislados se clasificaron como susceptibles, intermedios y resistentes. Se tomó el criterio de multirresistencia de Srinivasan et al22, quienes consideran una cepa multirresistente como aquélla que resiste a tres o más grupos distintos de antibióticos.
Preparación de nisina, quitosano y del compósito nisina/quitosano
La nisina proveniente de L. lactis subsp. lactis, se obtuvo de Sigma-Aldrich®, México y se solubilizó en HCl 0.02 M. Se preparó una solución stock a una concentración de 10 mg/ml, la cual se esterilizó por filtración, con membranas de 0.22 (m de tamaño de poro (Millipore®, USA)12,23. El quitosano de bajo peso molecular se adquirió de Sigma-Aldrich®, México. Se preparó una solución stock a una concentración de 20 mg/ml, la cual se disolvió en ácido acético (J.T. Baker®, México) al 1 %, durante 12 h. Posteriormente, el pH de la solución se ajustó a 5.5 con NaOH (Meyer®, México) 1 N. Finalmente, la solución se esterilizó a 120 °C, 20 psi, 15 min24. El compósito nisina/quitosano se preparó de la siguiente manera: una vez preparadas y esterilizadas ambas soluciones, la concentración correspondiente de nisina se disolvió en la solución de quitosano a temperatura ambiente (25 ± 2 °C). Dicho compósito se agitó vigorosamente por 5 min y se utilizó en los ensayos antibacterianos correspondientes.
Determinación de la concentración mínima inhibitoria (CMI) de nisina y quitosano
La CMI de la nisina y del quitosano se determinó para todos los aislados bacterianos. Lo anterior se realizó mediante el método de dilución en caldo Mueller-Hinton (BD Bioxon®, México)25,26, con algunas modificaciones. Tubos con caldo Mueller-Hinton conteniendo un inóculo de cada uno de los aislados de S. aureus ajustado a la turbidez del tubo 0.5 de la escala de McFarland, fueron asépticamente mezclados con nisina hasta alcanzar concentraciones de 1.0, 1.25, 1.5, 1.75, 2.0, 2.25, 2.5, 2.75 y 3.0 mg/ml. El mismo procedimiento se realizó para el quitosano. Posteriormente, los tubos se incubaron a 37 °C, con agitación constante (160 rpm). La concentración más baja sin crecimiento visible se consideró como la CMI para cada aislado, luego de 24 h de incubación20,27. Como testigos se utilizaron tubos con caldo Mueller-Hinton que contenían HCl 0.02 M y ácido acético al 1 % (pH 5.5). Los experimentos se realizaron por triplicado.
Determinación de la CMI del compósito nisina/quitosano
La CMI del compósito nisina/quitosano también se determinó para todos los aislados20,27. Lo anterior se realizó bajo la metodología descrita previamente en Rodríguez-Núñez et al26 con las modificaciones descritas en el ensayo anterior. Asimismo, se evaluaron concentraciones inferiores a la CMI de los compuestos por separado (2.0, 2.25, 2.5 y 2.75 mg/ml para la nisina y 1.0, 1.25, 1.5 y 1.75 mg/ml para el quitosano) para observar un posible efecto aditivo del compósito. Posteriormente, los tubos se incubaron a 37 °C, con agitación constante (160 rpm). Como control se utilizaron tubos con caldo Mueller-Hinton que contenían HCl 0.02 M y ácido acético al 1 % (pH 5.5). Los experimentos se realizaron por triplicado.
Determinación del efecto de la nisina, quitosano y del compósito nisina/quitosano
El efecto bactericida o bacteriostático de la nisina y el quitosano solos y en combinación, se determinó sobre dos bacterias multirresistentes seleccionadas. Lo anterior se realizó de acuerdo a Felicio et al14 y Mirdamani et al28 con algunas modificaciones. Tubos con caldo Mueller-Hinton conteniendo un inóculo de cada uno de los dos aislados de S. aureus ajustado a la turbidez del tubo 0.5 de la escala de McFarland, se mezclaron asépticamente con la CMI de la nisina, quitosano y del compósito nisina/quitosano. Posteriormente, los tubos se incubaron a 37 °C, con agitación constante (160 rpm). A continuación, el efecto de los compuestos sobre la viabilidad de S. aureus se examinó a las 4, 8, 24, 32, 47, 52 y 72 h, mediante la siembra y conteo de células viables (UFC/ml) incubadas a 37 °C en agar Mueller-Hinton. Las UFC/ml de S. aureus se transformaron a logaritmos. Los experimentos se realizaron por triplicado.
Resultados
Identificación de aislados de S. aureus y evaluación de resistencia-susceptibilidad a antibióticos
En un programa regional para el estudio de la mastitis en La Ciénega de Chapala, Michoacán, 363 vacas en ordeña pertenecientes a 30 hatos lecheros fueron analizadas. De acuerdo a la PC, 50.4 % (183) de las vacas mostraron mastitis subclínica. Muestras de leche de estas vacas fueron colectadas y utilizadas para el aislamiento de S. aureus, obteniéndose un total de 53 aislados, los cuales se identificaron mediante pruebas microscópicas y bioquímicas (fermentación de manitol, tinción de Gram, catalasa, coagulasa y reducción de telurito y actividad lipolítica). Asimismo, la identidad se confirmó por PCR, mediante la amplificación de un fragmento del gen nuc, que codifica para la nucleasa termoestable de S. aureus (Figura 1).
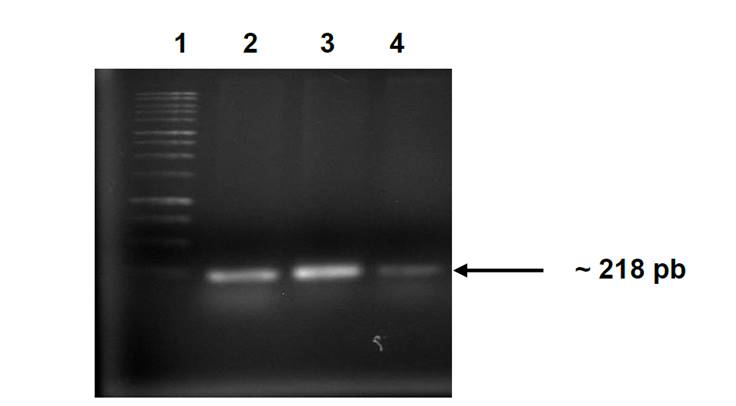
Carril 1) Marcador de tamaño molecular 1 kb DNA ladder. Carril 2) Control positivo, S. aureus ATCC 27543. Carril 3) Aislado AMC-9. Carril 4) Aislado AMC-23.
Figura 1 Amplificaciones representativas del fragmento del gen nuc (~ 218 pb)
Los resultados de resistencia-susceptibilidad mostraron comportamientos variables de los 53 aislados frente a los antibióticos evaluados (Cuadro 1). Los compuestos hacia los cuales mostraron mayores índices de resistencia fueron a penicilina (92.4 %), dicloxacilina (67.9 %) y ampicilina (60.3 %) (beta-lactámicos). Índices de resistencia menores que van de 5.6 a 33.9 % se observaron en los 9 antibióticos restantes. Asimismo, se observó resistencia intermedia hacia cefuroxima (24.5 %), eritromicina (24.5 %) y ampicilina (20.7 %). Además, se obtuvieron altos índices de susceptibilidad hacia levofloxacina (100 %), trimetroprima-sulfametoxazol (94.3 %) y gentamicina (88.6 %). Por otra parte, se observaron 34 patrones de resistencia distintos entre los 53 aislados de S. aureus, siendo los de resistencia a ampicilina-dicloxacilina-penicilina los de mayor frecuencia con 7 aislados. Finalmente, 7 (13.2 %) aislados se clasificaron como multirresistentes, ya que toleraron a tres o más antibióticos de grupos diferentes, de los cuales 5 (71.4 %) presentaron resistencia de 7 a 9 antibióticos (Cuadro 2).
Cuadro 1 Perfiles de susceptibilidad a antibióticos de los aislados de S. aureus asociados a mastitis bovina
| Número de aislados (%) | |||
|---|---|---|---|
| Antibiótico | Resistentes | Intermedios | Susceptibles |
| Ampicilina | 32 (60.3) | 11 (20.7) | 10 (18.8) |
| Cefalotina | 18 (33.9) | 4 (7.5) | 31 (58.4) |
| Cepefima | 11 (20.7) | 6 (11.3) | 36 (67.9) |
| Cofotaxima | 11 (20.7) | 10 (18.8) | 32 (60.3) |
| Cefuroxima | 12 (22.6) | 13 (24.5) | 28 (52.8) |
| Dicloxacilina | 36 (67.9) | 3 (5.6) | 14 (26.4) |
| Eritromicina | 16 (30.1) | 13 (24.5) | 24 (45.2) |
| Gentamicina | 3 (5.6) | 3 (5.6) | 47 (88.6) |
| Levofloxacina | 0 (0) | 0 (0) | 53 (100.0) |
| Penicilina | 49 (92.4) | 1 (1.8) | 3 (5.6) |
| Tetraciclina | 10 (18.8) | 6 (26) | 37 (69.8) |
| Trimetroprima-sulfametoxazol | 3 (5.6) | 0 (0) | 50 (94.3) |
Cuadro 2 Patrones de resistencia a antibióticos de los aislados de S. aureus
| Antibióticos | No. de aislados |
|---|---|
| DC | 1 |
| AM, PE | 5 |
| DC, FEP | 1 |
| DC, GM | 1 |
| DC, PE | 2 |
| FEP, PE | 1 |
| PE, TE | 4 |
| AM, DC, PE | 7 |
| AM, FEP, PE | 1 |
| CF, CXM, PE | 1 |
| CF, DC, PE | 1 |
| DC, CTX, PE | 1 |
| AM, CF, DC, PE | 2 |
| AM, DC, E, PE | 1 |
| AM, DC, PE, TE | 2 |
| AM, E, FEP, PE | 1 |
| CTX, CXM, FEP, PE | 1 |
| CF, DC, E, PE | 2 |
| DC, E, PE, SXT | 1 |
| CF, DC, E, PE | 1 |
| DC, E, GM, PE | 1 |
| AM, CF, DC, E, PE | 2 |
| AM, CF, CXM, DC, PE | 1 |
| AM, CF, CTX, DC, PE | 1 |
| AM, CTX, DC, FEP, PE | 1 |
| CTX, DC, FEP, PE, TE | 1 |
| AM, CTX, CXM, DC, PE | 1 |
| AM, CF, CXM, DC, E, PE | 1 |
| AM, CF, CXM, DC, E, PE, TE | 2 |
| AM, CF, CTX, CXM, DC, FEP, PE | 1 |
| AM, CF, CTX, CXM, DC, E, FEP, PE | 1 |
| AM, CF, CTX, CXM, E, FEP, PE, SXT | 1 |
| AM, CTX, CXM, E, FEP, PE, SXT, TE | 1 |
| AM, CF, CTX, CXM, DC, E, FEP, GM, PE | 1 |
AM ampicilina, CF cefalotina, FEP cefepima, CTX cefotaxima, CXM cefuroxima, DC dicloxacilina, E eritromicina, GM gentamicina, LEV levofloxacina, PE penicilina, TE tetraciclina, SXT trimetoprima-sulfametoxazol.
Concentración mínima inhibitoria
La nisina mostró efecto antibacteriano en las concentraciones estudiadas, solo en 28 de los 53 aislados de S. aureus, así como en la cepa ATCC, en los cuales las CMI variaron entre 1.75 y 3.0 mg/ml. En el resto de los aislados se observó crecimiento aún a la concentración más alta de nisina utilizada en este estudio (3.0 mg/ml) (Cuadro 3). Por otra parte, el quitosano mostró efecto antibacteriano en los 53 aislados y la cepa de referencia de S. aureus ATCC. En estos casos las CMI oscilaron entre 1.5 y 2.5 mg/ml. De igual forma, el compósito nisina/quitosano mostró efecto antibacteriano importante sobre los 53 aislados y la cepa control, cuyas CMI fluctuaron entre 1.5/1.25 y 3.0/2.0 mg/ml, respectivamente. Para este último tratamiento, destacó que las CMI se redujeron en todos los casos en un rango de 0.25 a 0.5 mg/ml, en comparación con las de los compuestos cuando se utilizaron solos.
Cuadro 3 Concentración mínima inhibitoria (CMI) de la nisina, quitosano y del compósito nisina/quitosano sobre los aislados de S. aureus (mg/ml)
| Aislados de S. aureus | CMI nisina | CMI quitosano | CMI nisina-quitosano |
| AMC-7 | ND | 2.0 | 2.75-1.75 |
| AMC-9 | ND | 2.0 | 2.75-1.75 |
| AMC-10 | ND | 2.0 | 2.75-1.75 |
| AMC-12 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-13 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-14 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-18 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-21 | ND | 1.75 | 2.5-1.25 |
| AMC-22 | ND | 2.0 | 2.75-1.5 |
| AMC-23 | ND | 2.0 | 2.5-1.25 |
| AMC-25 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-26 | ND | 2.0 | 2.75-1.75 |
| AMC-28 | ND | 2.5 | 3.0-2.0 |
| AMC-30 | ND | 2.0 | 2.5-1.75 |
| AMC-31 | ND | 1.75 | 2.5-1.25 |
| AMC-34 | ND | 2.0 | 2.5-1.5 |
| AMC-35 | ND | 2.5 | 2.5-1.5 |
| AMC-36 | 3.0 | 2.0 | 2.5-1.5 |
| AMC-37 | 3.0 | 2.0 | 2.5-1.5 |
| AMC-38 | ND | 2.5 | 2.75-1.75 |
| AMC-43 | ND | 2.0 | 2.75-1.75 |
| AMC-44 | 3.0 | 1.75 | 2.5-1.25 |
| AMC-48 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-50 | ND | 1.75 | 2.75-1.5 |
| AMC-51 | ND | 2.0 | 2.75-1.75 |
| AMC-61 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-73 | 3.0 | 2.0 | 2.5-1.5 |
| AMC-76 | ND | 2.0 | 2.5-1.5 |
| AMC-78 | 3.0 | 1.75 | 2.5-1.25 |
| AMC-84 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-85 | 2.0 | 2.0 | 1.5-1.5 |
| AMC-96 | 3.0 | 2.0 | 2.75-1.75 |
| AMC-97 | ND | 2.5 | 2.75-1.75 |
| AMC-101 | 3.0 | 2.5 | 2.75-1.75 |
| AMC-107 | 3.0 | 2.0 | 2.5-1.5 |
| AMC-108 | ND | 2.5 | 3.0-2.0 |
| AMC-109 | ND | 2.0 | 2.5-1.5 |
| AVC-1 | 3.0 | 2.5 | 2.5-1.5 |
| AVC-2 | 3.0 | 2.5 | 2.5-1.5 |
| AVC-3 | ND | 2.0 | 2.75-1.75 |
| AVC-5 | ND | 2.0 | 2.75-1.75 |
| AVC-6 | ND | 2.5 | 2.75-1.75 |
| AVC-7 | 3.0 | 2.0 | 2.5-1.5 |
| AVC-9 | 3.0 | 2.0 | 2.75-1.75 |
| AVC-10 | 3.0 | 2.5 | 2.75-1.75 |
| AVC-11 | 3.0 | 2.0 | 2.5-1.5 |
| AVC-12 | 3.0 | 2.0 | 2.75-1.75 |
| AVC-13 | 3.0 | 2.5 | 2.75-1.75 |
| AVC-14 | 3.0 | 2.0 | 2.75-1.75 |
| AVC-16 | 3.0 | 2.5 | 2.75-1.75 |
| AVC-17 | ND | 2.0 | 2.75-1.75 |
| AVC-18 | 3.0 | 2.5 | 2.75-1.75 |
| AVC-24 | 3.0 | 2.5 | 2.75-1.75 |
| ATCC-27543 | 1.75 | 1.5 | 1.5-1.25 |
ND= No determinada a la mayor concentración evaluada en este trabajo (3.0 mg/ml).
Los valores representan la media de tres réplicas.
Efecto bactericida
Se seleccionaron dos aislados multirresistentes (AMC-9 y AMC-23) para determinar el efecto antibacteriano de la nisina y el quitosano solos y en mezcla. En lo que se refiere al aislado AMC-9, la adición de la nisina (3.0 mg/ml) no mostró efecto inhibitorio, ya que, como lo muestra el Cuadro 4, el conteo de UFC/ml fue similar al testigo durante las 72 h que duró el experimento. Por su parte, tanto la adición del quitosano (2.0 mg/ml) como del compósito nisina/quitosano (2.75/1.75 mg/ml), mostró un efecto bactericida, ya que desde las 4 h el conteo de UFC disminuyó a cero en ambos tratamientos, manteniéndose así hasta las 72 h. Con relación al aislado AMC-23, la adición de la nisina (3.0 mg/ml) no mostró efecto inhibitorio, ya que el conteo de UFC/ml también fue similar al testigo, durante el experimento. De la misma manera que en el experimento anterior, tanto la adición del quitosano (2.0 mg/ml), como del compósito nisina/quitosano (2.5/1.25), mostraron un efecto bactericida, ya que desde las 4 h el conteo de UFC/ml disminuyó a cero en ambos tratamientos, manteniéndose así hasta las 72 h.
Cuadro 4 Reducción logarítmica de S. aureus por nisina, quitosano y el compósito nisina/quitosano (Log UFC/ml)
| S. aureus AMC-9 | S. aureus AMC-23 | ||||||
| Tiempo h/ tratamiento | N ϯ | Q ¶ | N/Q γ | Testigo* | N ϯ | Q ¶ | N/Q δ |
| 0 | 7.45±0.13 | 7.45±0.13 | 7.45±0.13 | 7.90±0.57 | 8.50±0.46 | 8.50±0.46 | 8.50±0.46 |
| 4 | 8.21±0.18 | 0 | 0 | 8.61±0.16 | 8.80±0.18 | 0 | 0 |
| 8 | 8.71±0.06 | 0 | 0 | 8.88±0.12 | 8.95±0.03 | 0 | 0 |
| 24 | 9.18±0.20 | 0 | 0 | 9.24±0.28 | 9.08±0.02 | 0 | 0 |
| 32 | 9.40±0.06 | 0 | 0 | 9.31±0.16 | 9.43±0.07 | 0 | 0 |
| 47 | 9.28±0.07 | 0 | 0 | 9.34±0.08 | 9.50±0.03 | 0 | 0 |
| 52 | 9.46±0.09 | 0 | 0 | 9.30±0.20 | 9.30±0.03 | 0 | 0 |
| 72 | 8.20±0.10 | 0 | 0 | 8.71±0.48 | 9.28±0.01 | 0 | 0 |
ϯNisina: 3 mg/ml.
¶Quitosano: 2 mg/ml.
γNisina/quitosano: 2.75/1.75 mg/ml.
δNisina/quitosano: 2.5/1.25 mg/ml.
*Log UFC/ml promedio de AMC-9 y AMC-23.
Los datos representan el promedio de 3 réplicas ± la desviación estándar.
Discusión
En este estudio se detectó una alta frecuencia de aislamientos resistentes a los antibióticos del grupo de los beta-lactámicos, principalmente a penicilina, dicloxacilina y ampicilina, los cuales son los antibióticos más utilizados en la región para el control de la mastitis, lo que sugiere que existe el riesgo de selección positiva de cepas resistentes29. Estos resultados podrían deberse a que no existen programas de monitoreo de la resistencia a antibióticos en la región, lo que permitiría la adopción de medidas para evitar que la resistencia vaya en aumento. De la misma manera, la falta de protocolos de buenas prácticas de higiene durante la ordeña podría contribuir en los resultados observados. Todo lo anterior impacta de manera negativa en la economía del productor y en la salud pública, ya que, además de que la producción de leche disminuye, ésta es de menor calidad, debido a los residuos de antibióticos que contiene30.
Resultados similares han sido reportados en otras regiones del estado y del país. Se ha observado resistencia a penicilina, ceftazidima, dicloxacilina y ampicilina en aislados de S. aureus obtenidos de vacas lecheras mantenidas en traspatio en la región de Morelia, Michoacán20. Asimismo, existen reportes de resistencia a penicilina y ampicilina de S. aureus asociado a mastitis bovina, aislado de granjas lecheras del estado de Guanajuato31.
Los resultados de la determinación de la CMI de la nisina muestran solo una susceptibilidad del 47.1 % de los aislados de S. aureus hacia este péptido antimicrobiano, lo que llama la atención, ya que éste no es utilizado en los hatos de la región como una alternativa terapéutica contra la mastitis bovina. Sin embargo, se ha reportado que S. aureus posee un alto potencial para el desarrollo de resistencia natural a la nisina en condiciones in vitro. Dicho reporte muestra que las bacterias con baja susceptibilidad presentan un fenotipo llamado colonias variantes pequeñas32. Estas variantes se caracterizan por tener una tasa de crecimiento lenta, disminuyen su potencial transmembranal y alteran su metabolismo para resistir la acción del péptido33. Sin embargo, se requiere trabajo adicional para analizar el mecanismo de baja susceptibilidad de aislados de S. aureus a la nisina.
En relación al quitosano adicionado solo, éste mostró un efecto antibacteriano importante, ya que inhibió el crecimiento de todos los aislados de S. aureus (susceptibilidad del 100 %). Este resultado coincide con estudios que muestran que este compuesto tiene la capacidad de unirse a la superficie celular de bacterias Gram positivas, alterar la interacción entre la pared y la membrana celular y provocar un desbalance osmótico, lo que la lleva a muerte celular. Asimismo, este resultado es importante, ya que muestra el potencial de esta biomolécula, la cual ha sido ampliamente estudiada como agente antimicrobiano en diferentes formas (biopelículas, soluciones y compósitos)34.
En este sentido, el compósito nisina/quitosano mostró un efecto antibacteriano importante, ya que inhibió a todos los aislados de S. aureus asociados a mastitis bovina (100 % de susceptibilidad). Adicionalmente, en este resultado se destaca que el efecto del compósito nisina/quitosano fue superior al de ambos compuestos adicionados solos, ya que las CMI del compósito disminuyeron entre 0.25 y 0.5 mg/ml para ambos compuestos. Este efecto podría deberse a que ambos poseen mecanismos de acción distintos, lo que podría haber mejorado la actividad antibacteriana al ser mezclados35,36. Asimismo, la encapsulación del péptido podría haber mejorado su estabilidad y su protección de degradación proteolítica, lo que se reflejó en el efecto antimicrobiano37. Los resultados anteriores son importantes porque muestran el potencial antibacteriano del compósito sobre aislados de S. aureus asociados a mastitis bovina, mismos que podrían ser utilizados en el tratamiento de la enfermedad.
Asimismo, en este trabajo se muestra que el efecto del quitosano y del compósito nisina/quitosano sobre los aislados multirresistentes AMC-9 y AMC-23 es bactericida. Lo anterior, confirma la efectividad del quitosano y del compósito observada durante la determinación de las CMI. Se han reportado datos similares sobre el efecto del quitosano, los cuales muestran un efecto bactericida de la molécula sobre bacterias Gram positivas, lo cual depende de su peso molecular, nivel de desacetilación y concentración37.
Conclusiones e implicaciones
Se identificaron aislados de S. aureus asociados a mastitis bovina de la región de La Ciénega de Chapala, Michoacán, observándose una alta frecuencia de aislamientos resistentes a los antibióticos del grupo de los beta-lactámicos. Los resultados de este estudio sugieren que el quitosano y la formación del compósito nisina/quitosano podrían tener el potencial tecnológico para ser utilizados en terapias de tratamiento contra la mastitis bovina, ya que inhibieron en un 100 % a los aislados de S. aureus; además de que, tanto la nisina como el quitosano son considerados compuestos GRAS (Generalmente Reconocidos como Seguros), por lo que podrían ser utilizados tanto en la formulación de selladores de pezones como de infusiones intramamarias. Sin embargo, es necesario ampliar las investigaciones hacia el posible efecto de los compuestos sobre bacterias Gram negativas asociadas a la enfermedad y realizar investigaciones in vivo, así como estudios de citotoxicidad para considerar a estos compuestos como agentes terapéuticos de la mastitis bovina.











 nova página do texto(beta)
nova página do texto(beta)


