Introducción
La kisspeptina (KISS) o metastina es una familia de péptidos hipotalámicos (KISS-54, -14, -13 y -10), que está involucrada en el control neuroendocrino de la reproducción, y ha sido implicada en la integración del control metabólico de la reproducción en rumiantes1,2. El sistema mencionado ha sido propuesto como un activador de las neuronas productoras de la hormona liberadora de las gonadotropinas (GnRH) durante la maduración puberal3. De hecho, la aplicación i.v. de un solo bolo de KISS-10 estimula en becerras la secreción tanto de la hormona luteinizante (LH) como de la hormona folículo estimulante (FSH)4,5,6. Si bien estos efectos de la KISS en el eje gonadotrópico han sido observados de manera unánime en todas las especies estudiadas, de manera menos contundente se ha informado su influencia en el eje somatotrópico, ya que bajo algunas condiciones experimentales, la administración de KISS-10 estimula la liberación de la hormona de crecimiento (GH) en becerras prepúberes4,6 y vacas lecheras ovariectomizadas7; sin embargo en otros estudios con becerras prepúberes5, cabras en diestro8, borregas ovariectomizadas9 y vacas secas y lactantes10, la KISS-10 administrada por vía endovenosa no ejerció estímulo alguno en la GH.
Durante la maduración puberal, el sistema kisspeptidérgico es sometido a un patrón complejo de activación, que parece incluir al menos dos procesos: un incremento del tono endógeno de KISS11,12, y una mayor sensibilidad de las neuronas GnRH-érgicas a las acciones estimuladoras de la KISS13. Esto fue confirmado en becerras prepúberes, en las que la administración endovenosa de 5 µg de KISS-10/kg de peso cada dos horas durante tres días, -imitando su liberación pulsátil endógena-, fue capaz de inducir incrementos consistentes de LH en todas las becerras. Este formato de aplicación de KISS-10 indujo la ovulación seguida de formación de un cuerpo lúteo, únicamente en las becerras con las mayores concentraciones sanguíneas del factor de crecimiento parecido a la insulina I (IGF-I) y las menores de leptina14. No obstante, se desconoce en becerra prepúberes, si la dosis de KISS-10 y las concentraciones endógenas de IGF-I y leptina influyen en la magnitud de respuesta de LH inducida por KISS-10 y, si esta influencia es extensiva para la FSH y la GH. La hipótesis del presente estudio fue que en becerras prepúberes, la liberación de LH, FSH y GH en respuesta a la KISS-10 exógena es determinada por la dosis y por las concentraciones endógenas de IGF-I y leptina.
Material y métodos
Los procedimientos aplicados en el presente trabajo fueron aprobados por el Subcomité Institucional para el Cuidado de Animales en Experimentación (Programa de Posgrado, Facultad de Medicina Veterinaria y Zootecnia, UNAM). El experimento se efectuó en el Centro Experimental Las Margaritas, ubicado a 19º 51’ 03” N y 97º 12’ 48” O, a 500 msnm.
Tratamientos
Se utilizaron 20 becerras prepúberes, Suizo Pardo por Cebú o Holstein por Cebú, de 100 a 232 kg de peso corporal y de 7 a 11 meses de edad. Las becerras se estratificaron por edad y peso, y con base en esos criterios se asignaron aleatoriamente para recibir un bolo i.v. de 5 (n= 10; 4 Holstein por Cebú y 6 Suizo Pardo por Cebú) o 50 (n= 10; 4 Holstein por Cebú y 6 Suizo Pardo x Cebú) µg de KISS-10 por kilo de peso (3.75 o 37.50 nmol/kg de peso). Para determinar el tamaño de la muestra se utilizó un calculador en línea15 y se consideraron los valores medios, la desviación estándar (DE) y el intervalo de confianza de los datos de LH, FSH, GH, IGF-I y leptina, uno a la vez, publicados previamente en becerras prepúberes6. El tamaño de muestra requerido varió de 6 a 8 animales, dependiendo de la hormona. En el presente trabajo se usó KISS-10 bovina (YNWNSFGLRY-NH2; Proimmune, Oxford, UK) diluida en solución salina fisiológica (1:125) y administrada a través de un catéter (Sonda Kortex calibre 5 FR y longitud 90 cm; K-733, Trokar S.A de C.V) insertado en una de las venas yugulares, como se describió anteriormente14. Este mismo catéter se utilizó para la toma de muestras de sangre de acuerdo al protocolo que se describe posteriormente.
Manejo general y registro de medidas corporales
Las becerras se alojaron individualmente en corrales de 2.5 x 4.5 m, con piso de cemento, área techada (2.5 x 2.7 m), comederos y bebederos. Para la adaptación al manejo, las becerras se enjaquimaron y se introdujeron a los corrales un mes antes del experimento. Durante ese periodo, los animales se sometieron a sujeción con soga al cerco del comedero (2 h/día), de tal manera que pudieron ingerir alimento y agua a libre acceso; además se les sometió a cepillado del pelo con el fin de amansarlos y acostumbrarlos a la presencia de personas. La alimentación diaria consistió en forraje picado a libertad (heno de avena; 95 % MS, 6.5 % de proteína cruda y 2.42 Mcal de EM/kg), 4 kg de concentrado proteínico (93.8 % MS, 16.53 % de proteína cruda y 2.43 Mcal de EM/kg) y sales minerales a libertad. La asignación de alimento se calculó para lograr una ganancia diaria promedio de al menos 0.6 kg/animal/día, objetivo que se cumplió, ya que durante el periodo de adaptación, las vaquillas del grupo de 5 μg de KISS-10 ganaron 0.634 ± 0.081 kg/animal/día y las del grupo de 50 μg registraron 0.631 ± 0.085 kg/animal/día.
El peso corporal (PESO) de los animales se registró a su llegada a los corrales de experimentación y cada siete días hasta la administración de KISS-10; a partir de estos registros se determinó la ganancia diaria de peso promedio (GDP) previa al tratamiento. El día de la administración de KISS-10, además del PESO, tres observadores previamente capacitados evaluaron la condición corporal de las vaquillas y el promedio constituyó la variable analizada (CC; escala de 1 a 9 puntos). Además, se determinó el grosor de la grasa dorsal (GRASA) y la profundidad del músculo Longissimus dorsi (MUS), medidos entre las costillas 12 y 13, en el costado izquierdo del animal mediante ultrasonografía16, utilizando un aparato Kaixin 5000 (Xuzhou Kaixin Electronic Instrument Co. Jiangsu, China) y transductor lineal de 3.5 MHz.
Muestras de sangre y medición de hormonas
Cada tercer día, desde dos semanas antes de iniciar el estudio hasta la aplicación de KISS-10, se obtuvieron muestras de sangre por punción de la vena coxígea y colección en tubos Vacutainer® sin aditivo. Las muestras se procesaron para obtención de suero (refrigeración por 3 h y posterior centrifugación a 1,500 xg por 15 min). El suero se congeló a -20 °C hasta determinar por radioinmunoanálisis (RIA) la concentración de progesterona (P4). La concentración de P4 se utilizó como confirmación del estado prepuberal (P4 < 1 ng/ml en todas las muestras) de las becerras.
Además, se colectaron muestras de sangre cada 15 min, iniciando 6 h antes y finalizando 6 h después de la administración de KISS-10; un muestreo similar de 6 h se realizó 24 h después de la administración de KISS-10. El suero de estas muestras se obtuvo y almacenó como ya se indicó. En estas muestras se determinó LH, FSH y GH por RIA. En las tres muestras previas a la aplicación de KISS-10 (muestras -2, -1 y 0) y en alícuotas de las muestras colectadas cada hora a partir de la aplicación de KISS-10, se determinó leptina e IGF-I mediante RIA.
El RIA para LH se realizó siguiendo el procedimiento descrito17. La hormona utilizada como referencia en la curva patrón fue NIH oLH-S24 y los coeficientes de variación (CV) intra e inter-ensayo fueron 6.22 y 11.53 %, mientras que la cantidad mínima detectable fue 33.22 pg/ml. Para FSH18, la hormona utilizada como referencia en la curva patrón fue la NIH-oFSH S12. Los CV intra e inter-ensayo fueron 7.13 y 14.19 %; y la cantidad mínima detectable fue 35.95 pg/ml. En la cuantificación de GH19, la hormona utilizada como referencia fue la AFP11182B. Los CV intra e inter-ensayo fueron 4.8 y 9.2 % y la cantidad mínima detectable fue 0.14 ng/ml. En todos los casos se incluyó una curva estándar por triplicado y las muestras se analizaron por duplicado. Los RIA para IGF-I y P4 fueron en fase sólida (IGF-I RIACT® y PROG-CTRIA® de CisBio Bioassay, Sorgues, France), y para leptina el RIA fue de fase líquida (XL-85K de Linco Research Inc, St. Charles, MO, USA). La sensibilidad y los CV intra-ensayo para IGF-I, P4 y leptina fueron: 16 ng/ml y 5.1 %, 0.15 ng/ml y 8.8 % y 1.00 ng/ml y 3.8 %, respectivamente.
Variables de respuesta y análisis de datos
Se consideró que ocurrió un incremento de LH, FSH y GH inducido por KISS-10 cuando la concentración hormonal, después de la administración de KISS, superó en dos o más muestras consecutivas al promedio más dos desviaciones estándar de la concentración hormonal registrada en cada animal a las -2, -1 y 0 h de la aplicación de KISS-10 (concentración basal). Para poder conocer las diferencias entre tratamientos a través del tiempo (-0.5 a 6 h con relación a la aplicación de KISS-10), en los datos de LH, FSH y GH se realizó un análisis de varianza (ANDEVA) con mediciones repetidas, usando para ello el procedimiento MIXED de SAS20, en cuyo modelo se incluyó la dosis, el tiempo y su interacción; en este modelo, el animal se anidó en el tratamiento y se usó como un efecto aleatorizado, mismo que fue el objeto de mediciones repetidas en una estructura de covarianza.
Con el fin de evaluar las diferencias en la magnitud de la respuesta hormonal inducida por la dosis de KISS-10, se determinó el promedio, valor máximo (Vmax), amplitud (Amp), área bajo la curva (AUC) y duración de las concentraciones hormonales que superaron el umbral descrito. La Amp fue la diferencia entre Vmax y la concentración basal. Para estimar el AUC se usó la regla del trapecio y esta variable se reportó como unidades arbitrarias. Todas las variables fueron sujetas a un análisis de distribución normal (Shapiro-Wilk y métodos gráficos). Las variables que no se aproximaron a la distribución normal (P<0.1), se transformaron mediante raíz cuadrada (GRASA), logaritmo natural (FSH, GH) o logaritmo base 10 (LH) para asegurar la normalidad en la distribución de los datos. Así mismo, se verificó mediante la prueba de Barttlet la homogeneidad de la varianza en todas las variables. Únicamente los datos de leptina mostraron heteroscedasticidad aún después de su transformación (P<0.05); por lo tanto se analizaron mediante la prueba de Kruskal-Wallis. El análisis de las diferencias de la secreción de LH, FSH y GH en respuesta al tratamiento de KISS-10, fue mediante t de Student.
La relación entre la concentración sérica de IGF-I y leptina con la respuesta de LH, FSH y GH a KISS-10 se analizó mediante regresión lineal. Durante el periodo previo al tratamiento (-6 a 0 h) y un día posterior al mismo (24 a 30 h) se determinó la concentración media y número de pulsos de LH; el criterio para determinar un pulso de LH se definió previamente21. En estos periodos de muestreo se determinó también la concentración media de las hormonas FSH y GH. Con el fin de determinar diferencias entre grupos experimentales y periodos de muestreo se realizó un ANDEVA para diseño en parcelas divididas20.
Resultados
Al inicio del estudio, todas las becerras fueron prepúberes, ya que en ninguna de ellas se registró una concentración sérica de P4 ≥ a 1 ng/ml, y el número de pulsos de LH en las muestras tomadas antes de la aplicación de KISS-10 fue similar (P>0.05) en ambos grupos (Cuadro 1), oscilando entre 0 y 2 eventos cada 6 h. Ambos grupos experimentales fueron homogéneos (P>0.05) en cuanto a los valores registrados (media ± e.e.) para la dosis de 5 μg y de 50 μg, mismas que fueron respectivamente: PESO (170.4 ± 11.1 y 166.2 ± 10.8 kg), CC (6.6 ± 0.34 y 7.0 ± 0.31 puntos), GRASA (2.49 ± 0.22 y 2.67 ± 0.26 mm) y MUS (30.28 ± 2.41 y 28.88 ± 2.22 mm). No se detectaron diferencias (P>0.05) entre tratamientos de las concentraciones séricas previas a KISS-10 tanto de IGF-I (5 μg: 163.06 ± 20.68; 50 μg: 150.41 ± 20.02 ng/ml) como de leptina (5 μg: 2.56 ± 0.24; 50 μg: 3.32 ± 1.11 ng/ml). Tampoco se detectaron diferencias (P>0.05) en las concentraciones de dichas hormonas en las muestras posteriores a KISS-10 (IGF-1, 5 μg: 148.62 ± 21.48; 50 μg: 138.55 ± 18.77 ng/ml. Leptina, 5 μg: 2.73 ± 0.35; 50 μg: 3.28 ± 1.09 ng/ml). No obstante lo anterior, la concentración sérica de IGF-I, pero no la de leptina, estuvo asociada positivamente con el PESO de las becerras (IGF-I: R= 0.80, P=0.032; leptina: R= 0.31, P=0.18).
Cuadro 1 Características del incremento de LH y FSH inducido por una inyección intravenosa de 5 o 50 µg de kisspeptina-10/kg de peso corporal en becerras prepúberes (media ± error estándar)
| LH | FSH | ||||
|---|---|---|---|---|---|
| 5 µg/kg (n=10) | 50 µg/kg (n=10) | 5 µg/kg (n=10) | 50 µg/kg (n=10) | ||
| Basal, ng/ml | 0.45±0.10 | 0.32±0.10 | 0.78±0.06 | 0.77±0.06 | |
| Media, ng/ml | 2.94±0.23 | 2.87±0.23 | 1.41±0.14 | 1.33±0.14 | |
| Valor máximo, ng/ml | 7.22±0.60 | 5.51±0.60 | 1.84±0.33 | 1.75±0.33 | |
| Amplitud, ng/ml | 6.74±0.63 | 5.18±0.63 | 1.59±0.32 | 1.55±0.32 | |
| AUC, u. arbitrarias | 352.5±37.8a | 510.5±37.8b | 116.4±26.8 | 159.2±26.8 | |
| Duración, min | 135.0±20.9 | 178.5±20.9 | 63.0±10.5a | 109.5±10.5b | |
AUC= área bajo la curva.
ab Literales distintas entre dosis difieren (P<0.05).
KISS-10 indujo un aumento de LH y FSH, mas no de GH (Figura 1). El aumento de LH y FSH inducido por KISS-10 (concentración máxima/concentración basal) fue en promedio de 16.6 y 2.29 veces respectivamente. A partir de la primera muestra de sangre, es decir a los 15 min post KISS-10, tanto en LH (5 μg: 5.9 ± 1.1; 50 μg: 3.7 ± 0.3) como en FSH (5 μg: 1.75 ± 0.4; 50 μg: 1.49 ± 0.4) se registró un aumento (P<0.01) con relación a la concentración basal más dos desviaciones estándar (LH: 0.941; FSH: 1.20 ng/ml). En comparación con la dosis de 5 µg, la dosis de 50 µg de KISS-10 indujo una mayor liberación de LH (P<0.05), evidenciada por una AUC mayor (Cuadro 1). Así mismo, la duración del incremento de FSH fue mayor (P<0.05) para la dosis de 50 µg de KISS-10/kg. El resto de las características del incremento de LH y de FSH inducido por KISS-10 fueron similares entre dosis (P>0.05).
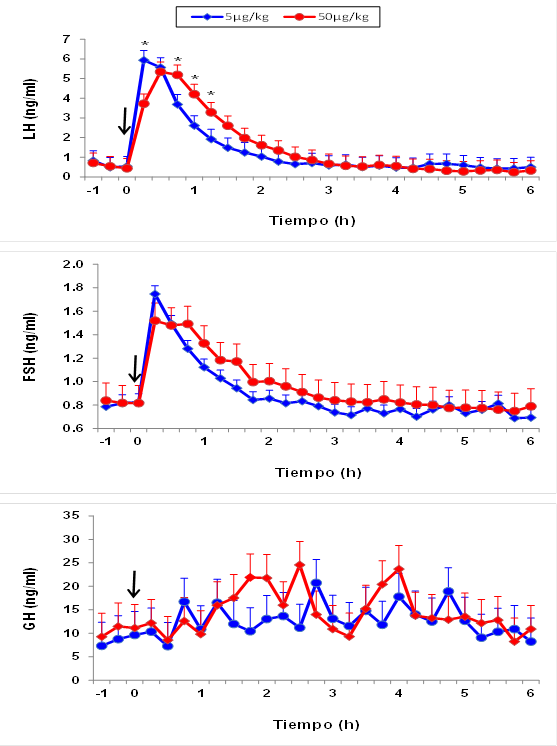
La flecha indica el momento de la aplicación de kisspeptina-10.
*Indica diferencia entre dosis de kisspeptina-10 (P<0.05).
Figura 1 Media ± EEM de las concentraciones séricas de LH, FSH y GH en respuesta a un bolo intravenoso de 5 o 50 µg de kisspeptina-10/kg de peso corporal en becerras prepúberes
La magnitud del aumento de LH inducido por 5 o 50 µg de KISS-10/kg de peso fue modulada por IGF-I, más no por leptina. El IGF-I se relacionó negativamente con el AUC de LH en becerras tratadas con la dosis de 50 µg de KISS-10 (P<0.05; Figura 2); en cambio, el IGF-I no se relacionó en ningún sentido con el AUC del incremento de LH inducido por la dosis de 5 µg de KISS-10/kg de peso (P>0.05). Ninguna otra variable de LH y FSH o las concentraciones de GH posteriores a KISS-10 se asoció (P>0.05) con la concentración de IGF-I o leptina.
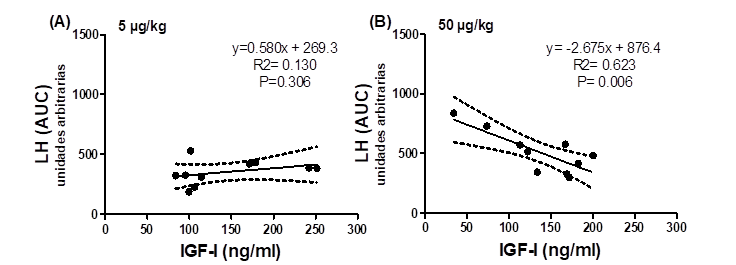
Los puntos representan valores individuales (n=10); la línea continua corresponde a la línea de regresión y las líneas punteadas corresponden al intervalo de confianza al 95 %.
Figura 2 Relación entre la concentración sanguínea del factor de crecimiento similar a la insulina I (IGF-I) y el área bajo la curva (AUC) de LH en respuesta a 5 (A) o 50 (B) µg de kisspeptina-10/kg de peso en becerras prepúberes
Poco antes (-6 a 0 h) y un día después del tratamiento con KISS-10 (24 a 30 h), el número de pulsos de LH y la concentración media de LH, FSH y GH fueron similares (P>0.05), independientemente de la dosis de KISS-10 aplicada (Cuadro 2). En estos periodos de muestreo, no se detectaron diferencias significativas atribuibles a la dosis de KISS-10 o a su interacción con el periodo de muestreo.
Cuadro 2 Media ± EEM de la frecuencia de pulsos de LH y la concentración media de LH, FSH y GH antes y después del tratamiento de kisspeptina-10 (KISS-10) en becerras prepúberes (n=20)
| Variable | Pre KISS-10 (-6 a 0 h) | Pos KISS-10 (24 a 30 h) | P= |
|---|---|---|---|
| LH, pulsos/6 h | 0.68±0.14 | 0.83±0.14 | 0.361 |
| LH, ng/ml | 0.40±0.07 | 0.34±0.07 | 0.297 |
| FSH, ng/ml | 0.77±0.05 | 0.76±0.05 | 0.698 |
| GH, ng/ml | 9.99±1.39 | 12.84±1.39 | 0.112 |
Discusión
Se ha establecido22 que la pubertad es precedida por un incremento progresivo en la frecuencia de la secreción pulsátil de la hormona liberadora de las gonadotropinas (GnRH), siendo este cambio el componente clave de control para iniciar la pubertad23. Existen evidencias que señalan a la KISS como el elemento estimulador preponderante en la actividad de las neuronas productoras de GnRH24. A su vez, las neuronas sintetizadoras de KISS son las principales estructuras que sirven como intermediarias entre las señales de origen somático y ambiental que modulan las funciones de las neuronas productoras de GnRH, determinando tanto la liberación tónica como la secreción fásica de las gonadotropinas hipofisiarias25. En el presente estudio se observó que el eje gonadotrópico de las becerras prepúberes es sensible a KISS-10, ya que después de aplicar dicho péptido por vía endovenosa en dosis de 5 µg/kg de peso corporal, aumentaron el promedio, la Vmax, y la AUC de LH y FSH circulantes. En estudios previos, la KISS-10 administrada como bolo i.v. en la dosis antes indicada indujo un incremento de LH en hembras bovinas prepúberes4,5,6 y adultas ovariectomizadas7 y de FSH en becerras prepúberes5,6. En esos trabajos, el incremento de las gonadotropinas inició a partir de los 30 min pos-tratamiento, mientras que en el aquí presentado, independientemente de la dosis de KISS-10, hubo un aumento a los 15 min post KISS-10 tanto en la LH como en la FSH con relación a su concentración basal, por lo que se confirma el marcado efecto regulador de la KISS en la actividad del eje gonadotrópico de las becerras prepúberes. Al examinar los protocolos de la toma de muestras de sangre en los estudios antes citados y en el presente, es posible afirmar que la respuesta de LH y FSH a una sola aplicación i.v. de KISS-10 no ocurre antes de los 15 min post aplicación, ya que se colectaron muestras cada 57, 105 y 154,6 minutos después de la inyección del péptido, sin haber detectado un aumento de dichas hormonas antes del tiempo arriba señalado; consecuentemente, una implicación derivada de estos datos es que en futuros estudios con similar formato de aplicación de KISS-10, es factible ahorrar recursos al no colectar muestras a intervalos menores de 15 min, sin perder información valiosa con relación a la secreción de LH y FSH.
Otra contribución del presente trabajo es la generación de evidencias de que los mecanismos fisiológicos reguladores de la liberación de LH y FSH son sensibles al aumento de dosis de KISS-10 en becerras prepúberes, y que esta sensibilidad, aparentemente, es afectada por el IGF-I endógeno, ya que en becerras con bajas concentraciones de IGF-I, la dosis de 50 µg de KISS-10 indujo una respuesta de LH mayor que con la dosis de 5 µg, pero esta diferencia no se detectó en becerras con altas concentraciones de IGF-I. Lo anterior indica que: a) la KISS-10 es capaz de activar a edades tempranas el sistema GnRH/LH, y b) el IGF-I, mismo que estuvo asociado positivamente con el peso corporal de los animales, modula la magnitud de la respuesta de LH a diferentes dosis de KISS-10. Considerando la respuesta diferenciada de LH a KISS-10 en becerras con diferentes concentraciones de IGF-I, se sugiere que KISS-10 en dosis de 50 µg podría estar superando factores inhibidores o activando factores estimulantes de la liberación de GnRH, y consecuentemente de las gonadotropinas a nivel hipotalámico o hipofisiario. Dichos factores están presentes y activos en el primer caso, o ausentes/inactivos en el segundo caso, es decir cuando las becerras prepúberes tienen bajas concentraciones de IGF-I. En cuanto a la posibilidad de que IGF-I funja como indicador de un ambiente metabólico favorable para el inicio de la pubertad en becerras; se ha documentado que en dichos animales aumenta el IGF-I circulante unos días antes o al momento de la primera ovulación26,27, mientras que en ratonas la administración de IGF-I adelanta la pubertad28. La acción del IGF-I podría ser la de potenciar el efecto de KISS-10 exógena en la secreción fásica de LH, mas no en la secreción tónica, ya que existen evidencias de ello en primates no humanos28, en roedores (29 y en becerras prepúberes6,14. El IGF-I podría actuar en al menos dos niveles: directamente en las neuronas productoras de GnRH30 y en los gonadotropos31. Los hallazgos de que el IGF-I circulante atraviesa la barrera hematoencefálica en ratas y que se acumula en el núcleo anteroventral-periventricular y la eminencia media32, le da significancia fisiológica a la acción del IGF-I en hipotálamo y adenohipófisis para modular la secreción fásica de LH inducida por KISS-10.
En el estudio que aquí se informa, la variación de la leptina sérica no estuvo asociada con la respuesta de LH, FSH o GH a KISS-10. En cierta manera, dicho fenómeno se esperaba, ya que las evidencias obtenidas en roedores indican que la disminución de leptina circulante o de su capacidad de acción, ya sea por restricción alimenticia, por inmunoneutralización o bien en animales con resistencia a leptina, no altera los efectos de KISS-10 en la liberación de LH33,34. No obstante no se pueden descartar del todo los efectos de la leptina en la regulación del inicio de la pubertad, ya que evidencias producidas en ovinos apoyan una regulación directa de la leptina sobre las neuronas kisspeptidérgicas del núcleo arcuato y área preóptica del hipotálamo, así como interacciones recíprocas de éstas con neuronas productoras tanto del neuropéptido Y como de la proopiomelanocortina, sustancias implicadas en el control metabólico de la reproducción1,2. En general se acepta que si bien hay evidencias del efecto de leptina en las neuronas kisspeptidérgicas, lo más probable es que la mayor parte de sus efectos en el establecimiento de la pubertad sean indirectos con respecto al sistema KISS29.
En el presente trabajo, como en otros efectuados con becerras prepúberes5,6, la administración de 5 µg de KISS-10/kg de peso indujo la liberación de FSH. Sin embargo, la secreción máxima de esta gonadotropina no presentó un aumento adicional al incrementar la dosis de KISS-10, lo cual coincide parcialmente con los resultados obtenidos en cerdas prepúberes35; pero sí indujo una respuesta más duradera, es decir que el incremento de FSH en respuesta a una dosis de 50 µg de KISS-10 se mantuvo elevado por más tiempo, comparado con una dosis de 5 µg (Figura 1-B). La diferencia de respuesta de LH y FSH a KISS-10 puede estar asociada al control que ejercen varios factores además de la GnRH sobre su patrón de liberación36. La información existente indica que tanto E2 como P4, leptina, IGF-I, ghrelina y varios neurotransmisores, entre los que destacan glutamato, ácido γ-aminobutírico y los opioides hipotalámicos, ejercen sus efectos en el patrón de secreción de LH y FSH a través del sistema KISS-GnRH37. No obstante existen evidencias de la mayor dependencia de la LH a las acciones de la GnRH que la de la FSH38. En la regulación de la síntesis y liberación de FSH participan la activina39, la inhibina y la folistatina40, consecuentemente los efectos de una dosis mayor de KISS-10 a la que es capaz de evocar la liberación de GnRH y por ende de las gonadotropinas hipofisiarias, no genera una mayor respuesta de FSH pero sí de LH. No se puede descartar que el efecto de KISS-10 sobre la mayor duración de la respuesta de FSH se pueda deber a su más prolongada vida media (120 a 170 min) que la de LH (40 a 60 min)41.
Con respecto a la respuesta de GH circulante a la KISS-10 en becerras prepúberes, algunos autores determinaron que la aplicación del péptido en dosis de 5 µg/kg indujo un aumento de GH4; por el contrario otros investigadores no detectaron respuesta alguna5, mientras que algunos más, encontraron que unas becerras responden a la KISS-10 pero otras no6. En el presente estudio, la dosis de 5 µg de KISS-10 no evocó una respuesta por parte de GH, consecuentemente los resultados aquí reportados apoyan los hallazgos de Ezzat et al5, sin proporcionar una evidencia que indique el o los mecanismos que pueden interferir o, en su caso, apoyar los efectos de la KISS en el eje somatotrópico, por lo tanto este tópico permanece controversial. En el presente estudio, una dosis diez veces mayor de KISS-10 a la que evocó una respuesta de GH en otros trabajos4,6, no indujo un aumento en la GH circulante, lo que concuerda con Lents et al35, en cuya investigación emplearon cerdas prepúberes y dosis de KISS-10 mayores a las aquí utilizadas. En otros experimentos efectuados con cabras en diestro8, borregas ovariectomizadas9 y vacas secas o lactantes10, tampoco se observó que la KISS-10, administrada en forma de un bolo i.v., indujera la liberación de GH. En oposición a lo anterior y en concordancia con los resultados de un estudio previo4, un incremento de GH en respuesta a KISS-10 se observó cuando el citado neuropéptido se administró a vacas ovariectomizadas presensibilizadas con esteroides ováricos7 y a borregas adultas en anestro estacional y sometidas a un tratamiento prolongado de KISS-1042. Lo anterior sugiere que los niveles circulantes de estradiol podrían determinar o modular los efectos de KISS en la liberación de GH.
En el presente estudio, la baja pulsatilidad de la LH de las becerras y los bajos niveles sanguíneos de progesterona al momento del tratamiento, sugieren una limitada actividad ovárica, y posiblemente reducidos niveles de estradiol en sangre, razón que podría explicar la falta de respuesta del eje somatotrópico. Con relación a la intervención de GH en las funciones del eje gonadotrópico, existen evidencias de que la sobreexpresión de GH en ratonas transgénicas acorta el intervalo del nacimiento a la pubertad43; no obstante, la aplicación de somatotropina bovina recombinante (rbST) a becerras Holstein prepúberes, retrasa la edad a la primera ovulación bajo condiciones de alimentación adecuadas, pero no tiene efecto si las hembras son sobrealimentadas44. De manera similar, la rbST aumenta la tasa de concepción en vacas lecheras después de los 100 días posparto, una vez que están en balance positivo de energía, pero no tiene efecto en vacas lecheras con menos de 100 días en leche, en vacas de razas cárnicas ni en vaquillas lecheras45. Algunas revisiones permiten concluir que la GH ejerce numerosas acciones en la reproducción de las hembras, pero en general sus efectos son pro-gonadales cuando se encuentra en concentraciones fisiológicas; en contraste, en niveles farmacológicos o cuando se presentan concentraciones circulantes excesivas por causas patológicas, la GH es antigonadal46. Si bien hay evidencias del vínculo entre KISS y el eje somatotrópico, hasta el momento no se ha establecido un mecanismo de relevancia fisiológica con respecto a la regulación de la secreción de GH por parte de KISS47. La generalidad de los autores proponen que las acciones positivas de GH en la pubertad y otras funciones reproductivas son efectuadas principalmente a través del IGF-I48; no obstante algunos de sus efectos son ejercidos sin la intervención de dicho factor49. Debido a que en este trabajo no se encontraron efectos de KISS-10 en la secreción de GH, no se profundizará más en ese aspecto; sin embargo, debido a que en algunos trabajos efectuados en bovinos4,6 la KISS-10 incrementó la liberación de GH, sería recomendable determinar las condiciones fisiológicas y de desarrollo en las que KISS evoca un aumento de GH de manera simultánea al de las gonadotropinas hipofisiarias, ya que potencialmente en esas situaciones la KISS exógena podría ser más efectiva en la inducción de la ovulación y el mejoramiento de otras funciones reproductivas.
Finalmente, es adecuado puntualizar que la secreción de LH, FSH y GH antes y 24 h después del tratamiento de KISS-10 fue similar en los animales de ambos tratamientos, lo cual exime a la KISS-10 administrada periféricamente de un efecto residual a nivel del generador de pulsos de GnRH o de los reguladores hipotalámicos de la GH; por lo tanto la KISS-10 exógena podría influir en la liberación de GnRH más que en su síntesis.
Conclusiones e implicaciones
El eje gonadotrópico, mas no el somatotrópico, es altamente sensible a la KISS exógena, puesto que la KISS-10 indujo incrementos de LH y FSH más no de GH. Además, a diferencia de la FSH, la sensibilidad de los mecanismos de liberación de la LH en respuesta a KISS es mayor al aumentar la dosis de KISS-10; dicha sensibilidad está inversamente relacionada con los niveles endógenos de IGF-I. La variación en las concentraciones circulantes de leptina no estuvo asociada con la magnitud de respuesta de LH y FSH inducida por KISS-10 o en la concentración de GH posterior a su aplicación, por lo tanto, otra conclusión es que el IGF-I más no la leptina modula los efectos de KISS-10 en el eje gonadotrópico.




![Uso de retenedores de humedad edáfica en la sobrevivencia y crecimiento de dos especies de pastos Bouteloua curtipendula [Michx.] Torr. y Chloris gayana Kunth](/img/es/prev.gif)






 nueva página del texto (beta)
nueva página del texto (beta)


