Introducción
La leche bovina tiene un elevado valor nutricional, cuya composición general es de 4.6 % lactosa, 3.6 % proteína y 4.2 % grasa; esta última está compuesta por 98 % de triglicéridos en promedio, los cuales están integrados por ácidos grasos (AG) de cadena corta (C4 a C8; 19.0 %), cadena media (C10 a C14; 19.0 %) y cadena larga (> C16; 62.0 %). Los AG de C4:0 a C14:0 y la mitad del C16:0 se sintetizan de novo, mientras que el resto de AG, incluyendo la segunda mitad del C16:0 provienen de la transferencia de AG preformados presentes en la sangre1. La síntesis de AG de novo en glándula mamaria se generan a partir de acético y butírico2, y cuerpos cetónicos como acetoacetato y β-hidroxibutirato3. En tanto que la síntesis por transferencia, los AG son transportados en quilomicrones y lipoproteínas de muy baja densidad, como AG preformados no esterificados, transferidos desde el intestino delgado provenientes de la dieta o por movilización del tejido adiposo3. Por tanto, modificaciones en la producción de ácido acético y butírico en el rumen, así como el tipo de AG presente en la dieta, determinan la composición de AG en leche, y esta situación hace que la grasa láctea sea el componente de la leche más fácilmente modificable4.
Al respecto, la síntesis de grasa es muy sensible al cambio de dieta. Por ejemplo, dietas con menos de 25 % de fibra detergente neutro (FDN), y más de 3.5 % en carga ruminal de AG insaturados, esto es, carga que considera el total de la ingesta de AG insaturados, o la inclusión de ionóforos en la dieta (≥ a 2.7 mg L-1 hr-1)5,6, pueden inducir un síndrome caracterizado por un bajo contenido de grasa en leche, reducción que puede ser hasta en 50 %, fenómeno conocido como síndrome de depresión de grasa láctea (SDGL)7,8,9. Dicho síndrome es también inducido por la adición de ácido linoleico conjugado (ALC) en la dieta, siendo el isómero trans-10, cis-12 del ALC el principal responsable9.
El ALC hace referencia a un conjunto de al menos 26 isómeros geométricos y posicionales del ácido linoleico con enlaces dobles en posición conjugada9, y es producido en el rumen como intermediario en el proceso de biohidrogenación del ácido linoleico, por acción de bacterias10 como Butirivibrio fibrisolvens11) y Megasphaera elsdenii12. El ALC, también puede ser sintetizado de forma endógena en los tejidos de rumiantes a partir de ácido vaccénico (C18: 1 trans-11), por acción de la esteril-CoA desaturasa13. La importancia del ALC radica en su potencial efecto anticancerígeno y su reducción de grasa en tejido adiposo y muscular, atribuido a sus isómeros cis-9, trans-11 y trans-10, cis-1214,15. En particular, el isómero trans-10, cis-12 ALC se asocia con una disminución en la concentración de grasa en leche (SDGL)8. Durante el SDGL hay una reducción de la síntesis de todos los AG presentes en la leche de rumiantes, siendo mayor en la síntesis de novo de AG respecto a la absorción de AG preformados9, por tal motivo son mayormente afectados los AG de cadena corta y cadena media respecto a los de cadena larga7, debido a que los primeros son sintetizados de novo mientras los segundos en su mayoría son absorbidos desde la sangre como AG preformados16.
Para la industria lechera el SDGL no es conveniente debido a un menor rendimiento de subproductos como queso y mantequilla, y para el productor representa menor pago por la leche. Las condiciones de alimentación que causan SDGL están bien establecidas7,9, por lo que se puede predecir el nivel de caída de la grasa en leche con relativa facilidad8. Sin embargo, los mecanismos que causan SDGL no están del todo claros17, por lo que es necesario generar información para proponer estrategias de alimentación que ayuden a contrarrestar este problema. Al respecto, se han propuesto algunas teorías para explicar el SDGL, por lo que el objetivo de esta revisión bibliográfica es discutir dichas teorías y recopilar los avances más relevantes de los mecanismos que causan el síndrome de depresión de grasa láctea para ayudar a generar propuestas de solución a este problema.
Síntesis de grasa en leche
Origen de la grasa láctea
La grasa láctea en rumiantes tiene mayor proporción de AG saturados respecto a la de animales monogástricos1, que depende de modificación de lípidos dietarios durante la fermentación ruminal17, que sigue dos rutas, la lipólisis y biohidrogenación ruminal. La primera consiste en la acción de lipasas presentes en el rumen sobre los enlaces éster que unen los AG y los alcoholes, que al ser hidrolizados liberan los AG al medio17. La segunda consiste en una serie de reacciones enzimáticas secuenciales, que incluyen isomerización e hidrogenación, saturando así los AG insaturados, donde las bacterias Butirivibrio fibrisolvens y Megasphaera elsdenii son las principales responsables del proceso18. Durante la biohidrogenación se forma el ácido esteárico17, por lo que los AG absorbidos en intestino delgado de origen dietario son mayormente AG saturados (70 %), y únicamente del 10 a 15 % de AG insaturados escapa a la biohidrogenación ruminal17. Ello explica la alta proporción de AG saturados en grasa láctea de rumiantes, aunque en leche de vaca, los AG no depende exclusivamente de los AG dietarios, también son sintetizados de novo1. Al respecto, Palmquist y Mattos19 reportan que aproximadamente el 40 % de AG en leche bovina se origina de la síntesis de novo, en tanto el 60 % restante proviene de la absorción y transferencia de AG preformados procedentes en su mayoría de la dieta.
Síntesis de novo de ácidos grasos
En los rumiantes, la síntesis de AG de novo se realiza en las células epiteliales de la glándula mamaria, y utiliza como fuentes de carbono al acetato y butirato derivados de la fermentación ruminal de los carbohidratos2. Estos ácidos grasos volátiles son absorbidos en la circulación portal a través de la pared del rumen, donde el butirato es metabolizado ampliamente a β-hidroxibutirato, mientras que sólo una pequeña cantidad de acetato es metabolizada antes de entrar en la circulación sanguínea20. Es importante mencionar que cantidades considerables de acetato endógeno se producen a partir de acetil-CoA en hígado21 y glándula mamaria22. El β-hidroxibutirato aporta alrededor del 8 % del carbono utilizado para sintetizar la grasa láctea, y aproximadamente dos de los cuatro átomos de carbono en el extremo metilo terminal de los AG sintetizados de novo se derivan del β-hidroxibutirato, y la otra mitad, se derivan del acetato23. El β-hidroxibutirato es oxidado en la mitocondria por la enzima β-hidroxibutirato deshidrogenasa, produciendo acetil-CoA, la cual no puede utilizarse para la lipogénesis que ocurre en el citosol. Por lo tanto, la contribución de butirato a la síntesis de AG está limitada principalmente a la síntesis de los cuatro carbonos iniciales de la cadena carbonada de los AG24. Es preciso señalar que, en rumiantes, la glucosa no es un precursor de la síntesis de AG, debido a que la actividad de las enzimas ATP citrato liasa y NADP malato deshidrogenasa son extremadamente bajas en el tejido mamario25.
La síntesis de AG de novo inicia cuando el acetato es activado a acetil-CoA y, por medio de la enzima acetil-CoA carboxilasa alfa, se forma malonil-CoA26. Una vez sintetizado malonil-CoA, la síntesis de AG se realiza por elongación o alargamiento de la cadena carbonada, mediante el complejo enzimático ácido graso sintasa, a través de reacciones sucesivas de condensación decarboxilativa de moléculas de acetil CoA (o butiril CoA) con malonil CoA, extendiendo así la cadena hidrocarbonada con dos átomos de carbono por cada ciclo, hasta un máximo de 1627. Cada ciclo requiere dos moléculas de equivalentes reductores (NADPH+H+)26, generadas a partir del ciclo de la pentosa fosfato y la oxidación de isocitrato mediante la isocitrato deshidrogenasa24.
Absorción y transferencia de ácidos grasos a grasa en leche
En la glándula mamaria de la vaca, no es posible la condensación sucesiva de acetil CoA con malonil CoA para alargar la cadena de AG a más de 16 carbonos debido a que no existen las enzimas necesarias para la elongación26. Por tanto, los AG C16:0 y C18:0, utilizados para la síntesis de la grasa láctea en glándula mamaria tienen dos orígenes: 1) triglicéridos transportados en quilomicrones y en lipoproteínas de muy baja densidad de origen mayoritariamente intestinal, y 2) ácidos grasos no esterificados, principalmente palmítico C16:0, esteárico C18:0, y oleico C18:1 cis-9, movilizados desde el tejido adiposo28. Los triglicéridos provenientes de la dieta se adhieren a quilomicrones y son hidrolizados por la enzima lipoproteína lipasa, separando a los AG y al glicerol29. Los AG libres y el glicerol son absorbidos en las células alveolares del tejido mamario donde son utilizados para la síntesis de grasa en leche27. Del total de AG absorbidos en el intestino delgado que provienen de triglicéridos de la dieta, entre 50 y 60 % son transferidos a la leche24. En tanto, menos del 10 % de AG movilizados de reservas corporales son transferidos a la leche2,3. Sin embargo, cuando las vacas están en balance energético negativo, la transferencia a partir de AG movilizados del tejido graso aumenta en proporción directa a la magnitud del déficit de energía3.
Ácido linoleico conjugado (ALC)
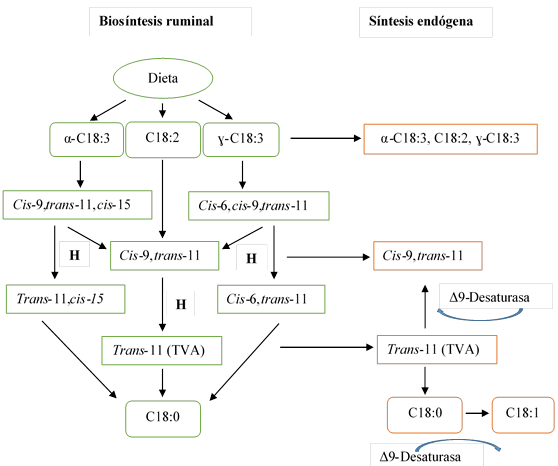
El término ácido linoleico conjugado (ALC) hace referencia a un conjunto de al menos 26 isómeros geométricos y posicionales del ácido linoleico (Cuadro 1), los cuales poseen enlaces dobles en posición conjugada7,9,30. El isómero cis-9, trans-11 denominado ácido ruménico se degrada a ácido vaccénico (C18:1 trans-11), por efecto del proceso de hidrogenación del enlace cis-9, y dada la lentitud de esta fase, se acumula ácido vaccénico, ocasionando que una gran parte de éste escape del rumen y esté disponible para absorción intestinal31 (Figura 1).
Cuadro 1 Isómeros del ácido linoleico conjugado reportados en grasa láctea, queso y carne de bovinos
| Cis/Trans-18:2 | Cis/Cis-18:2 | Trans/Trans-18:2 |
| trans-6,cis-8 | cis-7,cis-9 | trans-6,trans-8 |
| cis-7,trans-9 | cis-8,cis-10 | trans-7,trans-9 |
| trans-7,cis9 | cis-9,cis-11 | trans-8,trans-10 |
| cis-8,trans-10 | cis-10,cis-12 | trans-9,trans-11 |
| trans-8,cis-10 | cis-11,cis-13 | trans-10,trans-12 |
| cis-9,trans-11 | cis-12,cis-14 | trans-11,trans-13 |
| trans-9,cis-11 | trans-12,trans-14 | |
| cis-10,trans-12 | trans-13,trans-15 | |
| trans-10,cis-12 | ||
| cis-11,trans-13 | ||
| cis-12,trans-14 | ||
| trans-11,cis-13 |
El ALC también se sintetiza de forma endógena, a través de la desaturación del ácido vaccénico por acción de la delta (Δ) 9-desaturasa, enzima que se encuentra ampliamente distribuida en bacterias del rumen como Butirivibrio fibrisolvens, glándula mamaria y tejido adiposo13. La síntesis endógena del ALC es la principal vía de producción del isómero cis-9, trans-1113, mientras que la síntesis del isómero trans-10, cis-12 es a través de la biohidrogenación ruminal exclusivamente12.
Síndrome de depresión de grasa láctea (SDGL)
El SDGL se observa en vacas lactantes y se caracteriza por una reducción de hasta 50 % en la concentración de grasa en leche7,9, de igual forma se modifica la composición de AG en leche7, donde se reducen principalmente AG de cadena corta y cadena media32, con poco o nulo cambio en producción de leche ni en concentración de proteína y lactosa en leche7,9. Las condiciones de alimentación que provocan el SDGL son aquellas dietas con niveles bajos de FDN (< 25 %), carga ruminal de AG insaturados ≥ 3.5, inclusión de ionóforos en la dieta a dosis ≥ a 2.7 mg L-1 hr-1(7,9, o la combinación de estos factores de riesgo6. Al respecto, dietas bajas en FDN provocan pH bajos en el rumen, y con ello acumulación excesiva de ácido láctico, que promueve mayor síntesis de ácido propiónico y menor de acético y butírico33, mientras que los AG poliinsaturados y los ionóforos promueven la generación de AG trans a través de cambios en el metabolismo ruminal34, condicionando así el síndrome de depresión de grasa láctea7,9.
Se han desarrollado varias teorías para explicar los cambios metabólicos en las vacas lactantes que condicionan la presentación del SDGL. Al respecto, se ha propuesto que el aumento en la proporción de ácido propiónico y disminución del ácido acético y butírico en rumen resulta en síntesis menor de β-hidroxibutirato, precursor necesario en la síntesis de AG, y ello induce menor concentración de grasa en leche33. También se ha sugerido que el aumento del ácido propiónico estimula mayor secreción pancreática de insulina, y con ello mayor suministro de energía hacia tejido muscular, adiposo y sanguíneo, lo cual representaría una competencia por nutrientes entre glándula mamaria y otros tejidos35. Sin embargo, a la fecha, no existe suficiente evidencia científica que sustente estas teorías7,8,9, excepto la de biohidrogenación propuesta por Bauman y Griinarii30.
Teoría de biohidrogenación
La teoría de biohidrogenación establece que las condiciones alimenticias como baja proporción de fibra detergente neutro (FDN) o alta inclusión de AG insaturados en la dieta de vacas lactantes propician alteraciones en la biohidrogenación ruminal que dan origen a producción mayor de AG trans, los cuales son capaces de inhibir enzimas necesarias para la síntesis de AG en glándula mamaria30. Al respecto, Griinari et al36 establecieron las bases de la teoría de biohidrogenación, al indicar que son necesarias dos condiciones a nivel ruminal para observar el SDGL en vacas lactantes, 1) alta disponibilidad de ácido linoleico o α-linolénico y 2) un cambio en los procesos microbianos en el rumen. Ambas condiciones favorecerán la producción a través de la biohidrogenación ruminal del isómero trans-10, cis-12 ALC, principal responsable del SDGL7,8,9. Los AG linoleico y α-linolénico dan origen a los isómeros trans-10, cis-12 ALC a través de isomerización enzimática, por lo que una disponibilidad alta en el rumen de dichos AG promoverá mayor concentración del isómero trans-10, cis-12 ALC en rumen, lo que a su vez permitirá una mayor tasa de escape de este isómero hacia glándula mamaria12, ocasionado disminución de grasa en leche. En tanto, una dieta baja en FDN genera pH bajo en rumen y cambios en las proporciones de los ácidos grasos volátiles, incrementándose la producción de ácido propiónico, y dichas condiciones favorecen el crecimiento de la población de bacterias Megasphaera elsdenii, bacterias responsables de la producción del isómero trans-10, cis-12 ALC12.
Isómero trans-10, cis-12 ALC en la teoría de biohidrogenación
Durante el SDGL aumentan los isómeros trans de los AG C18:1 y C18:2 en la leche, entre ellos el isómero trans-10, cis-12 ALC. Esta observación permitió obtener los primeros indicios del mecanismo de acción para la presencia del SDGL7,8,9. Con base en ello, se infundieron duodenalmente (para evitar alteraciones por bacterias ruminales) isómeros puros del AG C18:2 con el objetivo de relacionarlos con la caída de grasa en leche7. Al respecto, Baumgard et al32 infundieron los isómeros del ALC trans-10 cis-12 y cis-9 trans-11 y observaron que el primero reducía la concentración de grasa en leche, mientras que cis-9, trans-11 ALC no tuvo ningún efecto (Figura 2). Posteriormente, de Veth et al37 reportaron que la caída de grasa en leche a causa del isómero trans-10, cis-12 ALC se ajusta a una curva de decaimiento exponencial, con reducción de 50 % de grasa en leche a 7.5 g d-1 y un máximo de respuesta medio a 3.5 g d-1 (Figura 3), resultados similares fueron reportados por Shingfield y Griinari38.
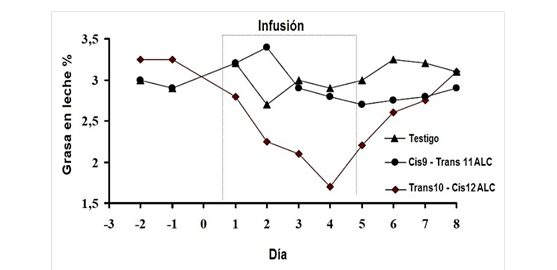
La infusión duró cuatro días y los tratamientos fueron: testigo, cis-9, trans-11 ALC (10 g d-1) y trans-10, cis-12 ALC (10 g d-1). Fuente: Baumgard et al(32).
Figura 2: Concentración de grasa en leche durante la infusión abomasal de isómeros del ácido linoleico conjugado (ALC)
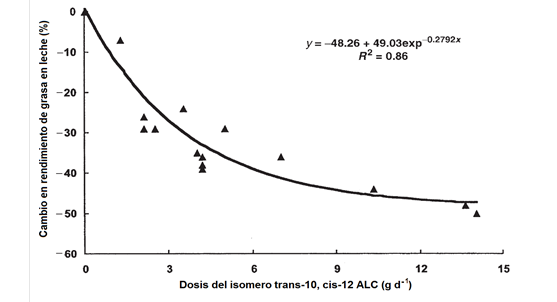
Los valores del modelo para y= tasa de rendimiento de grasa en leche; para x= dosis del isómero isómero trans-10, cis-12 ALC; P <0.001. Fuente Veth et al(37).
Figura 3: Modelo de decaimiento exponencial que establece la relación entre el cambio en rendimiento de grasa en leche de vaca y la dosis del isómero trans-10, cis-12 ALC
Si bien, los estudios donde se infundió duodenalmente a vacas lactantes el isómero trans-10, cis-12 ALC han sido de corta duración (<7 días)37, los resultados son similares a los obtenidos con dietas que inducen SDGL (bajas en FDN o enriquecidas con ácido linoleico y α-linolénico), donde la concentración de grasa en leche ha disminuido hasta 50 %, y se observaron aumentos del isómero trans-10, cis-12 ALC en leche8. Existen suplementos alimenticios que contienen el isómero trans-10 cis-12 ruminal protegido, y han sido usados para estudiar su efecto en vacas lactantes en periodos prolongados, desde 6 a 20 semanas7. En dichos estudios se ha encontrado que la reducción de grasa en leche persiste durante todo el período experimental39,40 y la concentración de grasa en leche vuelve a la normalidad cuando cesa el suministro del tal isómero41. No obstante, las dietas de vacas lactantes donde se han incluido aceites de pescado o en general aceites de origen marino, los cuales son ricos en AG insaturados, causan en la grasa láctea de las vacas poco o ningún aumento del isómero trans-10, cis-12 ALC8, aunque se observa reducción de la concentración de grasa en leche42; lo cual sugiere que otros isómeros producidos por biohidrogenación ruminal intervienen en la inhibición de la síntesis de grasa en leche30. Por ejemplo, incluir los isómeros cis-10, trans-12 ALC43 y trans-9, cis-11 ALC44 de forma abomasal en vacas lactantes, reducen la concentración de grasa en leche. Es importante mencionar que en estos estudios solamente se consideró un solo nivel de tales isómeros, por lo que habrá que tener mucha precaución al extrapolar los resultados. Además, la caída de grasa en leche provocada por dichos isómeros no fue tan pronunciada respecto a la provocada por el trans-10, cis-12 ALC7. Es por ello que los estudios para determinar los mecanismos de acción de los isómeros que llevan a la presencia del SDGL se han enfocado en el isómero trans-10, cis-12 ALC.
Mecanismos de acción del trans-10, cis-12 ALC en el SDGL
Las dos fuentes de AG en la síntesis de grasa en leche (síntesis de novo y absorción y transferencia de AG preformados) requieren la labor coordinada de un complejo enzimático implicado en el transporte de precursores de AG a la glándula mamaria, la síntesis de novo, la desaturación, esterificación y formación de triglicéridos, y finalmente la deposición de AG en leche16, y es precisamente a través de la inhibición de este complejo enzimático que el isómero trans-10, cis-12 ALC causa la presencia de SDGL en vacas lactantes8. Al respecto, se ha demostrado que el trans-10, cis-12 ALC reduce la expresión génica (mRNA) de enzimas lipogénicas, y de factores lipogénicos44.
A pesar de que los mecanismos de acción del isómero trans-10, cis-12 ALC que reducen la grasa en leche no están claros aun17, la evidencia científica apunta a que este proceso está regulado por supresión de fragmentos nucleares en la proteína 1 unida al elemento de respuesta de los esteroles (FREP1)8. El FREP1 es un regulador global de la síntesis de grasa en leche17, implicado en la regulación de genes lipogénicos en el tejido epitelial mamario8, en particular a los asociados con la síntesis de novo45. Al respecto, el grado de supresión de FREP1 es directamente proporcional a la magnitud de la caída en grasa láctea provocada por el isómero trans-10, cis-12 ALC8. Sin embargo, los cambios en la expresión del FREP1 no han podido explicar totalmente el mecanismo de acción para la presencia del síndrome de depresión de grasa láctea17,32, sugiriendo que el isómero trans-10, cis-12 ALC afecta otros factores de transcripción que regulan la síntesis de grasa en leche44. Al respecto, dietas que provocan SDGL e infusiones abomasales con trans-10, cis-12 ALC modifican la expresión de la hormona tiroidea conocido como S1445, así como los receptores activados por proliferadores de peroxisomas (PPARs)46. El isómero trans-10, cis-12 ALC reduce en glándula mamaria la expresión del PPARs, evidenciando el papel central de este factor de transcripción en la regulación de la síntesis de grasa de la leche de vaca45. Sin embargo, la función de los PPARs durante el SDGL es debatible47,48, debido a que el isómero trans-10, cis-12 ALC redujo la grasa corporal en ratones sin actividad del PPARs49. No obstante, los adipocitos responden de manera diferencial a las señales moleculares dependiendo del tejido donde se encuentren50, situación que explicaría la variación en la respuesta del PPARs durante el SDGL51. Hasta el momento la evidencia científica indica que los factores de transcripción afectados por el isómero trans-10, cis-12 ALC, y que explican la reducción de la síntesis de grasa en leche son FREP1, S14 y PPARs. No obstante, es posible existan otras rutas no identificadas52, y gran parte de la investigación respecto al estudio del SDGL está orientada hacia la identificación de dichas rutas53, por lo que sería interesante explorarlas, para un mayor entendimiento de la ocurrencia de dicho síndrome.
Efecto del SDGL en la industria lechera
La industria lechera se ha visto afectada por el efecto que causa el síndrome de grasa láctea, como consecuencia de la implementación de un sistema de fijación de precios a productos lácteos por el departamento de agricultura de Estados Unidos en 200054. Este acontecimiento desencadenó el pago a productores no solo por concepto de volumen de producción, pero por aquella leche con mayor concentración de grasa y proteína. En consecuencia, los productores del sistema lechero estadunidense han encaminado su producción usando estrategias nutricionales para lograr tal objetivo55. En el caso de México, no existe regulación por parte del gobierno en los precios de los productos lácteos56. Sin embargo, algunas empresas lecheras del país pagan incentivos económicos a productores por mayor concentración de grasa y proteína en leche, incrementando de 3 a 8 % el pago por la leche57. La importancia de ofrecer altas concentraciones de grasa y proteína en leche radica en la relación positiva de dichos componentes y el rendimiento de subproductos como el queso58. Al respecto, los factores más importantes que afectan el rendimiento en queso son la concentración de grasa y caseína en leche, que en conjunto representan alrededor del 94 % de la materia seca del queso59, cuyo rendimiento aumenta linealmente con las concentraciones de grasa y caseína en leche. En particular, la concentración de grasa láctea se correlaciona positivamente (r= 0.79) con el rendimiento en queso59. Este comportamiento sugiere, por tanto, que la reducción de la grasa láctea causada por el isómero trans-10, cis-12 ALC, reduce de manera significativa el rendimiento en queso. Al respecto, Schiavon et al60 complementaron la dieta de vacas con 5.5 g d-1 de trans-10, cis-12, reduciendo 13 % la concentración de grasa en leche, y en consecuencia observaron reducción de 11 % del rendimiento en queso. Por su parte, Chen et al61, al complementar la dieta de cabras con 6 g d-1 de trans-10, cis-12, observaron reducción de 23.2 % en la concentración de grasa en leche, y reducción de 10.2 % en rendimiento en queso. Además, la reducción de grasa en leche de vacas por el isómero trans-10, cis-12 aumenta el tiempo de coagulación de la leche, lo cual reduce la firmeza del queso60, aspecto que desfavorece la aceptabilidad del queso por los consumidores59. Con base en estos antecedentes, se asume que el síndrome de depresión de grasa láctea afecta la industria lechera al reducir el rendimiento en queso, por lo que el productor al ofertar leche con bajo contenido de grasa recibe menor pago por la misma. Ante esto, es necesario generar estrategias de alimentación que mitiguen la caída de grasa en leche a causa del SDGL.
Estrategias nutricionales en la mitigación del SDGL
En dietas para vacas lactantes con contenido alto de aceites poliinsaturados (> 5 %), la vitamina E a dosis mayores de 9,000 UI d-1 incrementa la concentración de grasa en leche62 a consecuencia de una mejora en la digestión de la fibra en el rumen62. Además, estabiliza el pH ruminal62, lo cual pudiera ayudar a regular el crecimiento de la población de bacterias Megasphaera elsdenii, responsables de la síntesis del isómero trans-10, cis-12 ALC12. Con base en ello, Ramírez-Mella et al40 propusieron utilizar vitamina E para incrementar la concentración de grasa en leche disminuida a consecuencia del isómero trans-10, cis-12 ALC. Sin embargo, no lograron recuperar la concentración de grasa en leche al incluir vitamina E; aunque, observaron un pequeño incremento del isómero cis-9, trans-11 ALC, aspecto que es interesante seguir estudiando para determinar el papel que juega la vitamina E en la síntesis de este isómero del ALC.
Por otro lado, durante el SDGL se reduce la síntesis de todos los AG en la leche de vaca, aunque esta disminución es mayor en la síntesis de AG de cadena corta y cadena media7,9, lo cual implica que la síntesis de novo es mayormente afectada respecto a la absorción y transferencia de AG preformados7,8,9. Apoyados con este antecedente, Kadegowda et al63 y Vyas et al64 formularon la hipótesis que en vacas lactantes se podría recuperar la concentración de grasa disminuida durante el SDGL a consecuencia del isómero trans-10, cis-12 ALC, al suministrarles en la dieta una mezcla de AG de cadena corta y cadena media, bajo el supuesto que el SDGL es producto de una reducción drástica de la síntesis de AG de novo. Sin embargo, en ambos estudios no se logró la recuperación de la grasa en leche, concluyendo que la dosis usada de la mezcla de AG fue insuficiente. En los citados estudios, la recuperación de la grasa en leche no se logró debido a que la mayoría de los AG suplementados no se transfirió a la leche, excepto el ácido palmítico (C16:0), y en promedio su eficiencia de transferencia a la leche fue de 50 %63,64. Esto implica que inclusiones mayores del C16:0 a vacas lactantes en el SDGL, podrían ayudar a recuperar la concentración de grasa en leche. El C16:0, es un AG importante en la síntesis de triglicéridos en la glándula mamaria, con mayor potencial para incrementar la biosíntesis de lípidos en glándula mamaria65. Al respecto, la síntesis de triglicéridos consiste en la acilación sucesiva del esqueleto de glicerol-3-fosfato en sus tres átomos de carbono (sn 1, sn 2, sn 3), donde en la primera acilación en el sn 1, el sustrato principal de la enzima glicerol-fosfato-acil-transferasa es el C16:0; esta acilación resulta en la formación de ácido lisofosfatídico, el cual es el punto de partida de la síntesis de triglicéridos66. Por lo tanto, el aumento en la disponibilidad de C16:0 en la glándula mamaria, estimula la síntesis de triglicéridos en leche, lo que en consecuencia incrementa la concentración de grasa en leche66. Dada la importancia del C16:0 en la síntesis de triglicéridos en glándula mamaria, se han desarrollado complementos con más del 85.0 % de C16:0, los cuales suministrados a vacas lactantes han incrementado la concentración de grasa en leche65. Por tanto, el C16:0 pudiera ser una opción viable para recuperar la concentración de grasa en leche disminuida por efecto del isómero trans-10, cis-12 ALC.
Conclusiones
El síndrome de depresión de grasa láctea se produce por cambios en la biohidrogenación ruminal, que favorece mayor producción de metabolitos que inhiben enzimas involucradas en la síntesis de ácidos grasos. Uno de estos metabolitos es el isómero trans-10, cis-12 ALC, el cual ha tenido atención mayor, y a partir de su estudio se ha consolidado la teoría de biohidrogenación, teoría que explica con mayor solidez el SDGL. Este síndrome, es un problema vigente que afecta la industria lechera al reducir los rendimientos de subproductos lácteos, por lo que el productor recibe menor pago por la leche, y es por ello que son necesarios estudios encaminados a develar los mecanismos que lo provocan, para así diseñar estrategias alimenticias que mitiguen sus efectos negativos.











 nova página do texto(beta)
nova página do texto(beta)