En los sistemas de producción pecuaria, las infecciones entéricas son una de las principales causas de mortalidad en los neonatos1, su manejo sanitario se realiza con antibióticos, pero el uso inadecuado de estos causa resistencia bacteriana2, así como residuos de los antibióticos en carne y leche3. Ante este problema, el uso de probióticos4 y el de prebióticos como la inulina5 son suplementos alternativos que benefician la salud y la productividad de especies pecuarias. La inulina estimula el desarrollo de bacterias ácido lácticas6 que actúan contra entero patógenos causantes de diarreas, mediante la producción de bacteriocinas7.
Las fuentes de inulina utilizadas en la industria internacional son la achicoria (Cichorium intybus) y la alcachofa (Helianthus tuberosus)8. Sin embargo, en México se cuenta con la especie Agave tequilana Weber var. Azul, reconocida por el contenido alto de inulina9. Se ha documentado en estudios in vitro el uso de inulina de achicoria como sustrato energético para bacterias ácido lácticas (BAL)10; pero las investigaciones con inulina de agave son escasas y se han realizado in vitro11,12,13 e in vivo14,15,16.
Por otra parte, recientemente se documentó el aislamiento de Lactobacilus salivarius y Enterococcus faecium a partir de mucosa oral de becerros y calostro de vacas Holstein, respectivamente, las cuales muestran potencial probiótico para ser administradas en sustitutos lácteos en becerros durante la lactancia17,18. Por lo anterior, el objetivo fue evaluar el efecto prebiótico de la inulina de achicoria y de agave, en el crecimiento in vitro de Lactobacillus salivarius y Enterococcus faecium.
El experimento se realizó en el Laboratorio de Nutrición Animal del Posgrado de Ganadería del Colegio de Postgraduados, Campus Montecillo, ubicado en Montecillo, Estado de México. Las incubaciones in vitro se realizaron a 37 °C, con sustitución de glucosa por inulina de achicoria o agave en el medio Man-Rogosa-Sharpe (MRS)19, para determinar el crecimiento de Lactobacillus salivarius y Enterococcus faecium, y Lactobacillus casei como control positivo.
El grado de pureza (Cuadro 1) de la inulina de agave Inulin Powder® (Bestground, Zapopan, Jalisco, México) y de la de achicoria (Inulin from chicory®, Sigma-Aldrich, USA) se determinó por cromatografía líquida de alta resolución (HPLC) (Knauer, Smartline, Alemania)20,21.
Cuadro 1: Composición (%) de las fuentes de inulina
| Inulin powder ®1 | Inulin from chicory ®2 | |
|---|---|---|
| Inulina | 89.56 | 98.80 |
| Azúcar | 3.17 | 0.93 |
| Sacarosa | 2.83 | 0.27 |
| D-glucosa | 1.17 | - |
| D-fructosa | 3.27 | - |
1Bestground, Zapopan, Jalisco, México; 2Sigma-Aldrich, USA.
Las cepas utilizadas fueron Lactobacillus salivarius y Enterococcus faecium aisladas de calostro de vacas Holstein y mucosa oral de becerros, respectivamente17, e identificadas mediante técnicas moleculares18. El control positivo fue Lactobacillus casei ATCC procedente del Departamento de Investigación y Posgrado de Alimentos de la Facultad de Química, de la Universidad Autónoma de Querétaro. Las cepas se conservaron a -20 °C en tubos Eppendorf (650 µl de inóculo crecido en medio MRS y 650 µl de glicerol como crioprotector).
El diseño experimental fue completamente al azar con siete tratamientos de acuerdo con lo descrito en el Cuadro 2.
Cuadro 2: Tratamientos experimentales
| Tratamiento | Descripción |
|---|---|
| T1 | Lactobacillus casei + MRS - glucosa (Testigo) |
| T2 | Lactobacillus casei + MRS - inulina de achicoria1 |
| T3 | Lactobacillus salivarius + MRS - inulina de achicoria |
| T4 | Enterococcus faecium + MRS - inulina de achicoria |
| T5 | Lactobacillus casei + MRS - inulina de agave2 |
| T6 | Lactobacillus salivarius + MRS - inulina de agave |
| T7 | Enterococcus faecium + MRS - inulina de agave |
1Inulin from chicory®, Sigma-Aldrich, USA; 2Inulin Powder®, Bestground, Zapopan, Jalisco, México.
El medio de cultivo utilizado fue MRS (Fluka Analytical®, Sigma-Aldrich) descrito para bacterias ácido lácticas, en el cual se sustituyó la glucosa (20 g L-1, 2 % p/v) por inulina de achicoria o de agave de acuerdo con su pureza (Cuadro 3). Después se ajustó el pH a 6.2 + 0.2 en los medios y se esterilizaron 15 min a 121 °C.
Cuadro 3: Medios de cultivo MRS con glucosa o inulina
| Componente, g L -1 | MRS-Glucosa †† | MRS - Inulina de achicoria | MRS - Inulina de agave |
|---|---|---|---|
| Peptona | 10 | 10 | 10 |
| Extracto de carne | 8 | 8 | 8 |
| Extracto de levadura | 4 | 4 | 4 |
| Glucosa | 20 | 0 | 0 |
| Inulina† | 0 | 20.24 | 23.52 |
| Fosfato dipotásico | 2 | 2 | 2 |
| Acetato de sodio | 5 | 5 | 5 |
| Citrato de triamonio | 2 | 2 | 2 |
| Sulfato de magnesio | 0.2 | 0.2 | 0.2 |
| Sulfato de manganeso | 0.05 | 0.05 | 0.05 |
| Monoleato de sorbitan, ml | 1 | 1 | 1 |
pH final 6.2 + 0.2; † Ajustado de acuerdo a la pureza de inulina en cada fuente; ††17.
Las cepas de L. salivarius, E. faecium y L. casei identificadas como BAL, se descongelaron gradualmente de -20 °C a 4 °C y después a temperatura ambiente (18 a 20 °C). Luego se inocularon 1.3 ml de cada cultivo en tubos Labcon (15 ml) con 11.7 ml de medio de cultivo (relación 1/10) según el tratamiento (Cuadro 2) y se incubaron 12 h a 37 °C.
Después de la reactivación (12 h) se tomaron alícuotas de 1 ml de cada cepa evaluada y se hicieron diluciones seriadas (10-1 a 10-12) en tubos que contenían 9 ml de agua peptonada (8.5 %); posteriormente se realizó la siembra por estría en cajas Petri con agar MRS de cada dilución elaborada y se incubaron a 37 °C por 24 h; finalmente se estimó la concentración bacteriana mediante el conteo de UFC, y los datos se expresaron con la función log10: 9.55; 9.21; 9.13; 9.15; 9.34; 9.36; 9.31 UFC ml-1 T1, T2, T3, T4, T5, T6 y T7, respectivamente.
Se agregaron 12 ml del cultivo reactivado en matraces Erlenmeyer (125 ml) con 108 ml del medio de cultivo (1/10 v/v) y se incubaron a 37 °C por 60 h. Los tiempos de lectura se establecieron de acuerdo a lo recomendado18 con base al inicio y término de la fase exponencial.
Para determinar la curva de crecimiento se tomaron alícuotas de 3 ml de los cultivos de cada tratamiento (Cuadro 2), y se realizaron lecturas de densidad óptica (630 nm) a las 0, 3, 6, 12, 24, 30, 36, 48, 54 y 60 h, utilizando un espectrofotómetro (Cary 1E UV-Visible, USA); asimismo, se registró el pH (Thermo Scientific Star A121®, USA) en cada horario de muestreo. Se realizaron seis repeticiones por tratamiento.
A partir de lecturas de densidad óptica (DO) en la fase exponencial se calculó: 1) tasa específica de crecimiento (μ, h-1) y 2) tiempo de generación (T, min), obtenido a partir del valor de μ, mediante las siguientes ecuaciones22:
Donde:
Ln N= DO al inicio,
Ln N 0 = DO final de la fase exponencial,
t = tiempo transcurrido entre N 0 y N.
Los datos obtenidos de las variables estudiadas se analizaron mediante un diseño completamente al azar con siete tratamientos y seis repeticiones, procesados en un ANDEVA con PROC GLM23 y las medias de tratamientos se compararon con la prueba de Tukey (P<0.05).
Las Figuras 1a y 1b presentan las curvas de crecimiento de las cepas L. salivarius y E. faecium con las fuentes de inulina evaluadas. El crecimiento bacteriano en los tratamientos T6 y T7 con inulina de agave fue mayor (P<0.05) a las 24 h (DO: 1.80c y 1.70c, respectivamente) respecto a los tratamientos T3 y T4 (DO: 1.19d y 1.19d, respectivamente) con inulina de achicoria. Por su parte, Lactobacillus casei a las 24 h mostró mayor (P<0.05) crecimiento en medio MRS-inulina de achicoria (DO: 2.70a), mientras que en MRS- glucosa y MRS-inulina de agave fue similar (DO: 2.54b y 2.48b, respectivamente). Al final de la incubación L. salivarius en medio con inulina de achicoria mostró el mayor crecimiento (P<0.05) respecto al resto de los tratamientos.

Figura 1: Crecimiento de Lactobacillus casei (Lc), Lactobacillus salivarius (Ls) y Enterococcus faecium (Ef) en inulina de achicoria (IAc) o inulina de agave (IAg)
El mayor crecimiento observado con inulina de agave se relacionó con la estructura tipo mixto de este polímero, compuesto por cadenas lineales de fructosas unidas a enlaces (-[(2→1), (2→6)] con ramificaciones21; en contraste, la inulina de achicoria presenta enlaces (-(2→1), sin ramificaciones implicando menor degradación, no hidrolizables en mamíferos24, pero altamente utilizables por las BAL de los géneros Lactobacillus spp. y Bifidobacterium spp25,26. Además, el grado de polimerización (GP) y las ramificaciones de la molécula afectan la degradación de la inulina, donde el bajo GP de la inulina de agave propicia mayor solubilidad, lo cual favorece su degradación y utilización; por lo anterior, la inulina de agave resulta como una alternativa de energía y mostró capacidad prebiótica para las BAL evaluadas en este estudio.
Adicionalmente, el mayor crecimiento de las cepas L. salivarius y E. faecium con la inulina de agave se asoció al GP según las fuentes de inulina, observándose que el mayor desdoblamiento ocurre con fuentes de bajo GP27. El GP varía según la especie vegetal28, región de producción, nutrientes en el terreno, régimen hídrico29 y tiempo de cosecha20. La inulina de achicoria y alcachofa tienen alto GP < 606, y el agave presenta bajo GP < 3030. Lo anterior explica el mayor desarrollo de la BAL evaluadas cuando el medio contenía inulina de agave. El crecimiento de L. salivarius y E. faecium en MRS con inulina de agave (MRS-IAg) se caracterizó por una fase lag nula, y una fase exponencial eminente entre 0 y 6 h de incubación; sin embargo, para L. salivarius y E. faecium en MRS con inulina de achicoria (MRS-IAc) la fase exponencial fue menos pronunciada (Figuras 1 y 2).
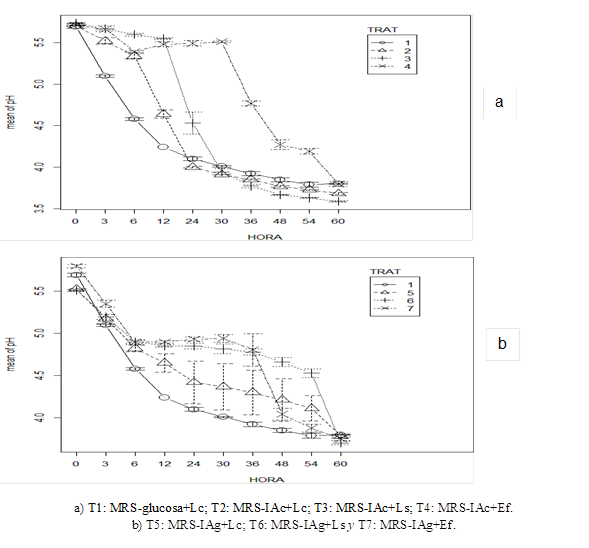
Figura 2: pH de los medios de cultivo con inulina de achicoria (IAc) o inulina de agave (IAg) e inoculados con Lactobacillus salivarius (Ls), Enterococcus faecium (Ef) y Lactobacillus casei (Lc)
La tasa de crecimiento (μ) tuvo un incremento (P<0.05) de 41 % en promedio, en los tratamientos T5, T6, T7 en MRS-IAg y T2 en MRS-IAc, comparados con el grupo testigo (T1) (Cuadro 4). Las cepas probióticas evaluadas en el presente estudio mostraron la capacidad de utilizar ambas fuentes de inulina; sin embargo, el crecimiento varió entre éstas en función del sustrato incluido en el medio como fuente de energía, e implicó una reducción (P<0.05) de 42.6 min en promedio en el tiempo de generación (T) para las cepas cultivadas con inulina de agave, respecto al grupo testigo.
Cuadro 4: Tasa específica de crecimiento (μ) y tiempo de generación (T) en bacterias ácido lácticas en medio MRS con dos fuentes de inulina
| Tratamientos | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| T1 | T2 | T3 | T4 | T5 | T6 | T7 | EE | P | |
| μ (h-1) | 0.34b | 0.48a | 0.33b | 0.39b | 0.51a | 0.50a | 0.50a | 0.01 | 0.0001 |
| T (min) | 125.9a | 85.9c | 126.8a | 106.2b | 83.6c | 82.9c | 83.4c | 3.85 | 0.0001 |
T1= L. casei + MRS; T2= L. casei + IAc; T3= L. salivarius + Inulina de achicoria; T4= E. faecium + Inulina de achicoria; T5= L. casei + Inulina de agave; T6= L. salivarius + Inulina de agave; T7= E. faecium + Inulina de agave. EE= error estándar.
Este crecimiento se explica por la rápida degradación observada en la inulina de agave de bajo GP; por el contario, la inulina de achicoria presenta compuestos remanentes de alto GP, los cuales propiciarán una degradación lenta y un efecto prebiótico prolongado31, lo cual está relacionado también con la longitud de las cadenas en su estructura12,13. Los fructanos de tipo inulina cuando no son ramificados, se dividen en disacáridos o monosacáridos y son degradados extracelularmente, mientras los mixtos como la inulina de agave, son absorbidos intracelularmente, y sólo las bacterias probióticas podrán usarlos12,32,33. En contraste, la baja tasa de crecimiento observada en el grupo testigo se relacionó con el agotamiento de glucosa durante las primeras 30 h de incubación (Figura 1), a diferencia de los tratamientos en los cuales se incluyó inulina donde la fase estacionaria se presentó después de las 48 h5,10.
El tiempo de generación (T) es 61 min para L. salivarius en medio MRS con fructooligosacaridos34 y de 40 min en cepas de E. faecium cultivadas en MRS35. Las diferencias en el valor de T indicado por estos autores con relación a los datos del presente estudio, se explican por la concentración de nutrientes en el medio y la cinética de las reacciones intracelulares, las cuales afectan la trascripción y traducción del ADN y la velocidad de crecimiento bacteriano36. E. faecium posee diferentes rutas para el metabolismo de carbohidratos, permitiéndole utilizar amplia variedad de azúcares37. Chowdhury et al38 hallaron el menor tiempo de generación (T=51 min) de L. casei cuando la concentración de lactosa e inulina en el medio MRS fue de 20 y 0.32 g L-1 , respectivamente. Este patrón de crecimiento se debe a la capacidad del género Lactobacillus de fermentar fructanos de bajo y alto peso molecular39; por el contrario, cepas del género Bifidobacterium tienen alta afinidad por los fructanos de bajo peso molecular40. El tipo de cepa y sustrato utilizado en el medio podría explicar el tiempo de generación obtenido en el presente estudio.
Velázquez-Martínez et al14 y Mueller et al12,13 reportan crecimientos mayores en bacterias prebióticas de los géneros Lactobacillus y Bifidobacterium cuando se utilizó inulina de agave de bajo GP, similar a lo observado en las cepas L. salivarius y E. faecium evaluadas en el presente estudio.
La diferencia en la tasa de crecimiento bacteriano se relaciona con enzimas41 sintetizadas por las BAL, responsables de la fermentación de diferentes carbohidratos; asimismo, de la presencia de códigos génicos definidos42, originando patrones de crecimiento en diferentes sustratos, debido al metabolismo específico en el consumo de inulina43. Lo anterior soporta las diferencias en el metabolismo de las fuentes de inulina evaluadas en este estudio y su relación con el crecimiento bacteriano observado.
El pH al inicio de la incubación fue menor (P<0.05) en T1, seguido de T5 al T7 y T2 al T4 con valores promedio de 5.4c, 5.5b y 5.7c, respectivamente. Los valores de pH en el medio de cultivo fueron disminuyendo gradualmente, independientemente de la fuente de inulina; al final de la incubación también hubo diferencia (P<0.05) entre tratamientos para esta variable (Figuras 2a y 2b).
La disminución del pH en el medio de cultivo es resultado de la fermentación de carbohidratos y la producción de ácido láctico por las BAL44. Pompei et al45 evaluaron cepas de Lactobacillus y Bifidobacterium en medio MRS con dos fuentes de inulina, y reportaron un pH de 3.7, similar a lo observado en el presente estudio. El pH inicial en el medio afecta las tasas de crecimiento; sin embargo, L. casei se adapta a medios ácidos (pH 3); de manera similar L. salivarius resiste pH de 2.6 por un lapso de 6 h46.
La importancia del pH en este tipo de estudios es por su efecto en la actividad enzimática, el metabolismo47 y transporte de nutrientes en la célula48; de tal manera que pHs bajos afectan el crecimiento celular e inhiben las reacciones bioquímicas para la producción de ácido láctico; sin embargo, las cepas evaluadas en el presente estudio mostraron un crecimiento apropiado, aun con valores de pH bajos, y se explica por la capacidad que tienen estas especies bacterianas para regular su pH intracelular a través de la ATPasa, mediante el bombeo de H+ fuera de la célula49.
Se concluye que la inulina de agave es un prebiótico de alternativa nacional para favorecer el crecimiento de bacterias probióticas como Lactobacillus salivarius y Enterococcus faecium.











 nueva página del texto (beta)
nueva página del texto (beta)


